Галина Борисовна,
проф. каф. ФАХ, науч. рук. НИЛ №506
Презентация лекций по курсу: Особенности предварительной подготовки проб объектов окружающей среды и биоматериалов
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Особенности предварительной подготовки проб объектов окружающей среды и биоматериалов Автор : Слепченко Галина Борисовна, проф. каф. ФАХ, науч. рук. НИЛ. презентация
Содержание
- 1. Особенности предварительной подготовки проб объектов окружающей среды и биоматериалов Автор : Слепченко Галина Борисовна, проф. каф. ФАХ, науч. рук. НИЛ.
- 2. Требования к методам анализа для определения загрязнителей
- 3. Присоединимся к мнению ведущих аналитиков: 1.
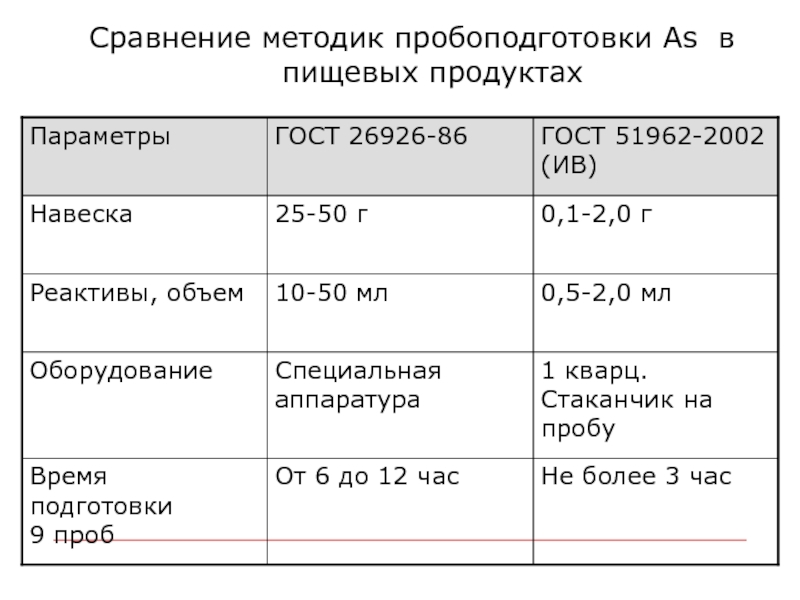
- 4. Сравнение методик пробоподготовки As в пищевых продуктах
- 7. Вольтамперограммы цинка и меди в пробе водопроводной
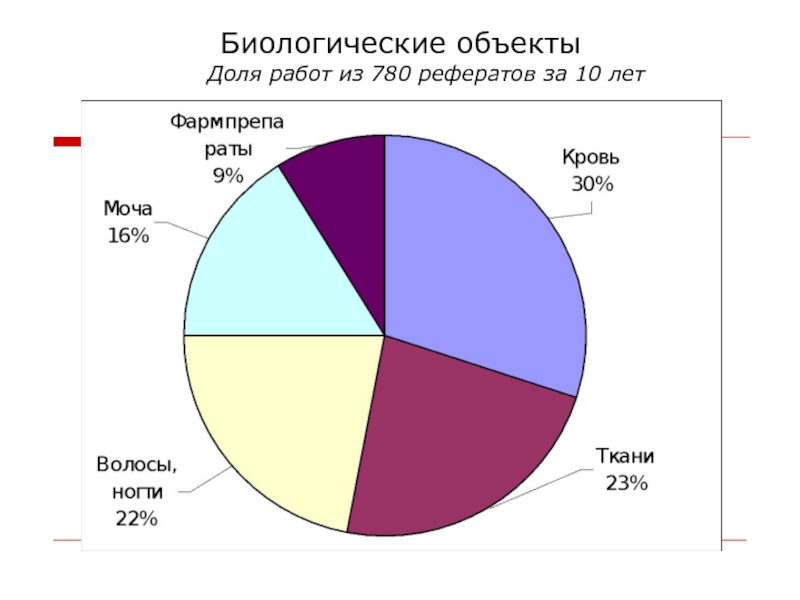
- 8. Биологические объекты Доля работ из 780 рефератов за 10 лет
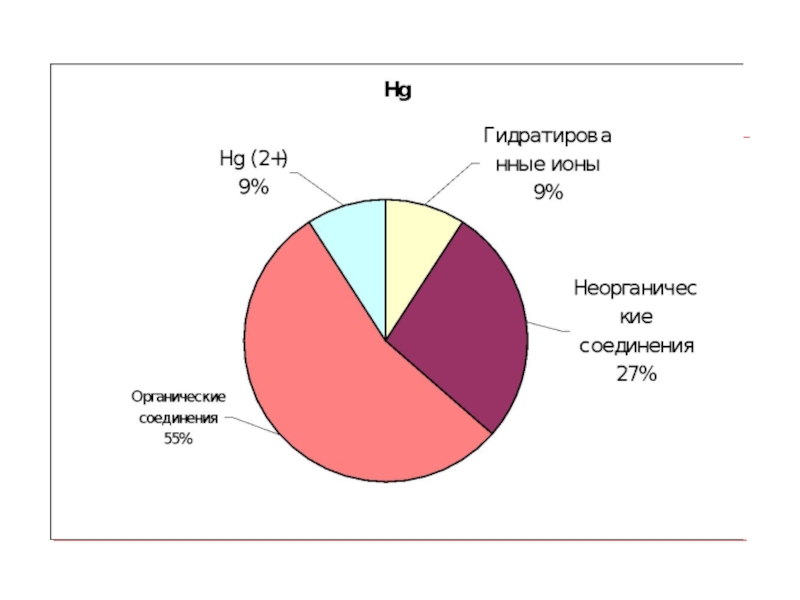
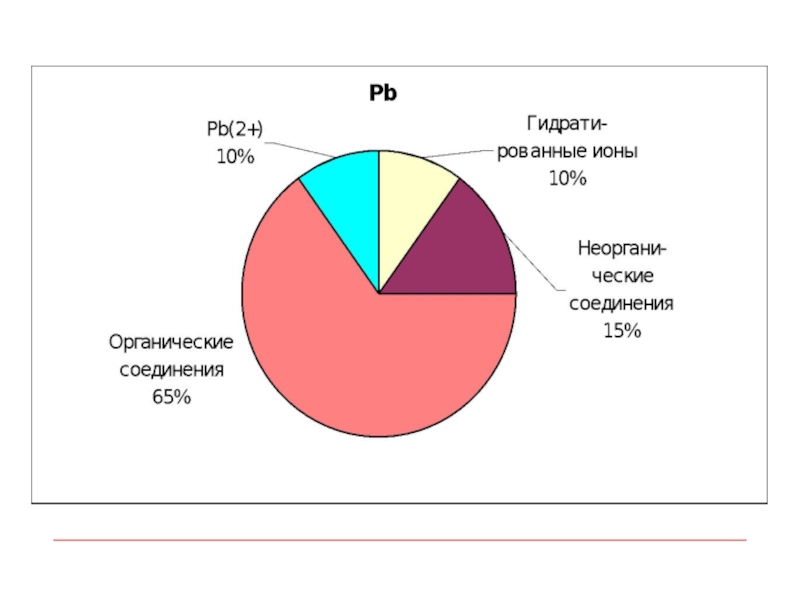
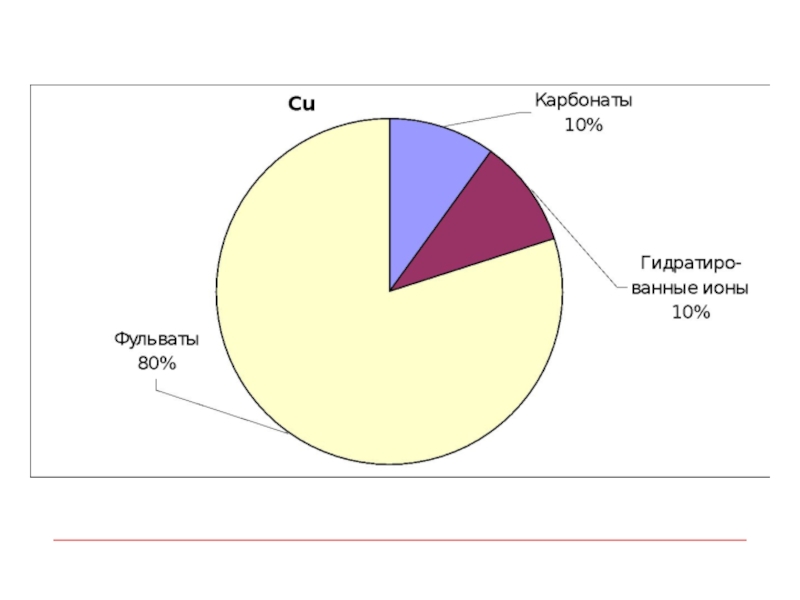
- 9. Химические формы тяжелых металлов в поверхностных водах
- 13. Основные способы пробоподготовки пищевых продуктов к анализу
- 14. Физические воздействия: Возбуждение кислорода (низкотемпературная плазма) Микроволновой нагрев Ультрафиолетовое облучение Ультразвуковая обработка Электрохимическая обработка
- 15. Таблица 2. Распределение публикаций по способам пробоподготовки
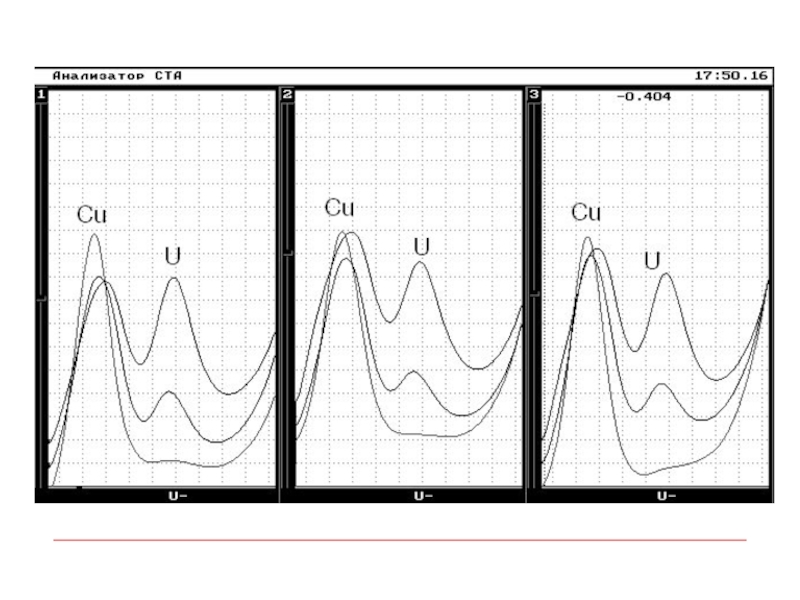
- 16. Пример многоэлементного анализа биологически активных добавок методом ИВ
- 17. УЗ – это акустические волны с частотой
- 18. Кавитация – образование в жидкости пульсирующих пузырьков,
- 19. Кавитация приводит к протеканию хим. реакций ВОЗБУЖДЕННЫХ
- 20. Микроволновое ( МВ) –разложение МВ-излучение – вид
- 21. В закрытых сосудах с азотной кислотой основные
- 22. ФОТОХИМИЧЕСКАЯ ПРОБОПОДГОТОВКА Ультрафиолет – свет с длиной
- 23. Первичные фотохимические р-ции (диссоциации, замещения, окисл./восст….).
- 24. Интенсификация пробоподготовки к ИВ-анализу различных объектов на содержание следов неорганических веществ
- 25. Пробоподготовка к ВА-анализу без минерализации 1. Отделение
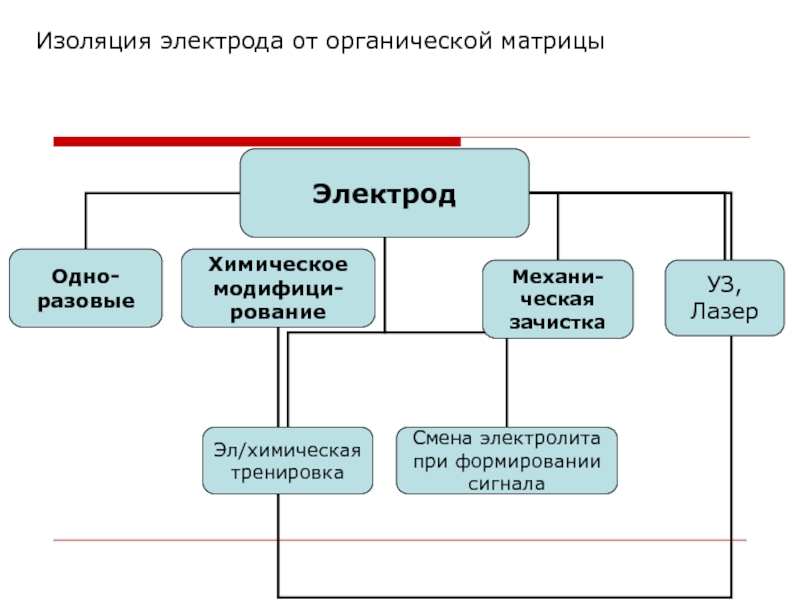
- 26. Изоляция электрода от органической матрицы
- 27. МЕТОДИКА ОПРЕДЕЛЕНИЯ ИОДА В ПИЩЕВЫХ ПРОДУКТАХ Электроактивные формы
- 28. Измерение. Фон – KNO3 + аскорбиновая кислота.
- 29. Рис. Вольтамперограмма определения йода в фоновом электролите
- 30. Методика анализа вод на содержание Se
- 32. Методика анализа пищевых продуктов, биологических объектов на
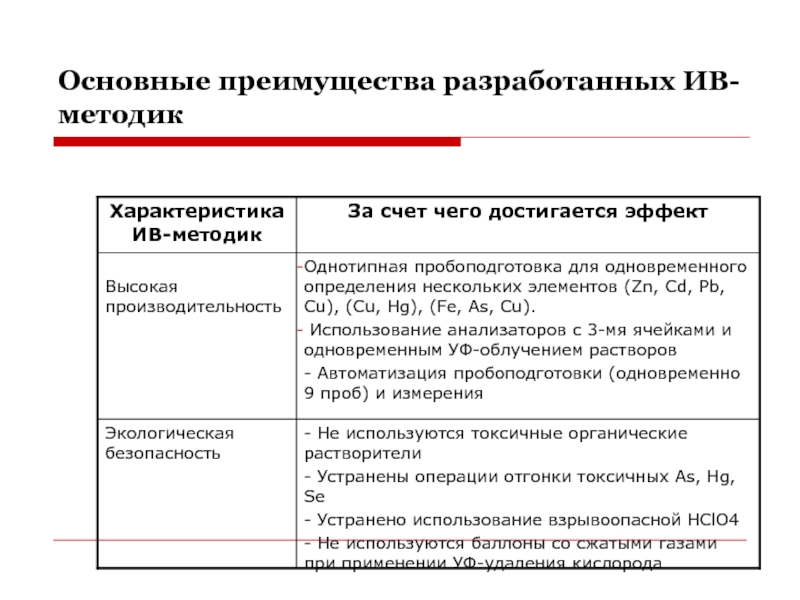
- 34. Основные преимущества разработанных ИВ-методик
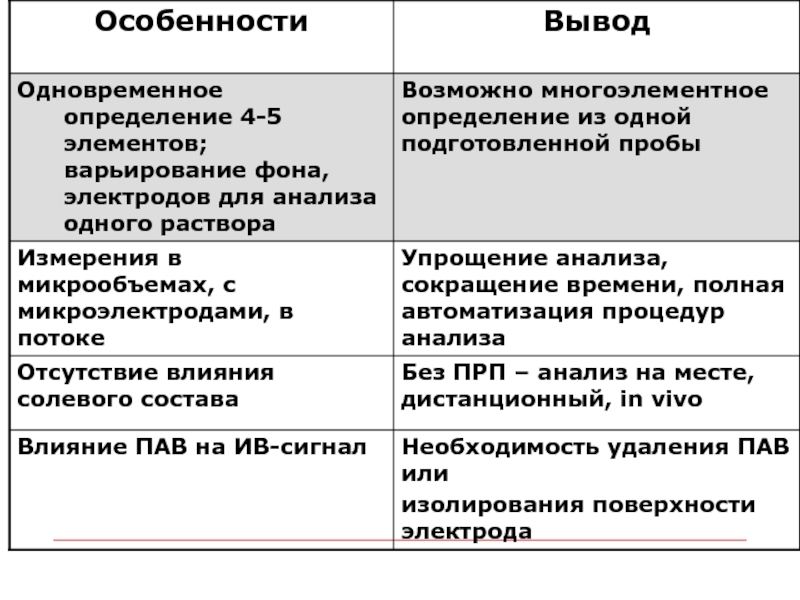
- 35. Особенности метода ИВ, существенные для пробоподготовки (ПРП)
Слайд 1Особенности предварительной подготовки проб объектов окружающей среды и биоматериалов
Автор: Слепченко
Слайд 2Требования к методам анализа для определения загрязнителей
Высокая чувствительность (возможность определения на
уровне хотя бы 0,1 ПДК)
Высокая селективность (возможность определения изомеров, отличающихся по токсичности)
Специфичность (возможность определения отдельных веществ в присутствии других)
Экспрессность
Наличие нормативно-технической документации, регламентирующей отдельные стадии анализа
Метод должен отвечать требованиям по контролю качества измерений и иметь достаточные метрологические характеристики
Высокая селективность (возможность определения изомеров, отличающихся по токсичности)
Специфичность (возможность определения отдельных веществ в присутствии других)
Экспрессность
Наличие нормативно-технической документации, регламентирующей отдельные стадии анализа
Метод должен отвечать требованиям по контролю качества измерений и иметь достаточные метрологические характеристики
Слайд 3Присоединимся к мнению ведущих аналитиков:
1. Цель пробоподготовки - привести пробу и
определяемый элемент в физическую и химическую форму, пригодную для измерения аналитического сигнала с требуемыми метрологическими характеристиками.
2. Выбор способа подготовки проб зависит от:
состава и структуры анализируемого объекта (матрицы),
химических свойств аналита (А),
метода измерения сигнала,
метрологических требований к качеству анализа,
наличия приборов, их стоимости,
традиций, существующих в лаборатории и др.
2. Выбор способа подготовки проб зависит от:
состава и структуры анализируемого объекта (матрицы),
химических свойств аналита (А),
метода измерения сигнала,
метрологических требований к качеству анализа,
наличия приборов, их стоимости,
традиций, существующих в лаборатории и др.
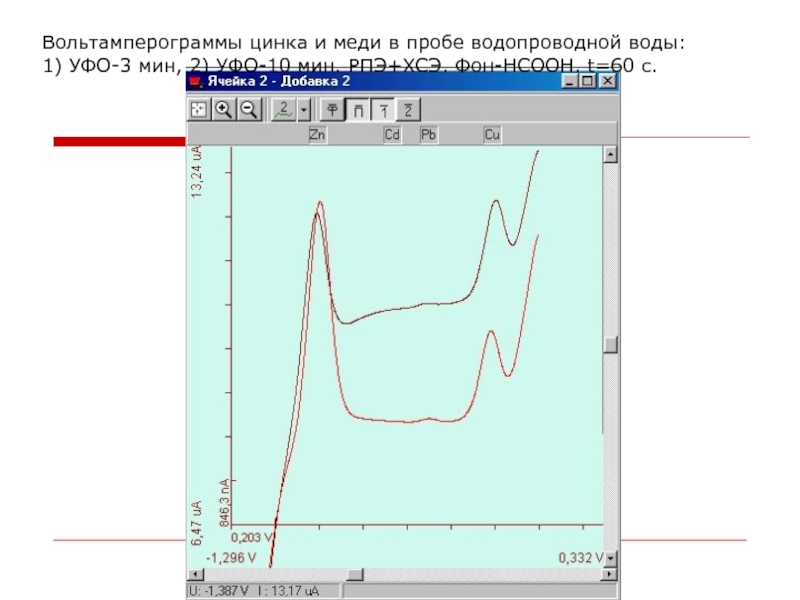
Слайд 7Вольтамперограммы цинка и меди в пробе водопроводной воды: 1) УФО-3 мин,
2) УФО-10 мин. РПЭ+ХСЭ. Фон-HCOOH. t=60 с.
Слайд 13Основные способы пробоподготовки пищевых продуктов к анализу методом ИВ
Химические процессы:
С озолением
матрицы:
Мокрое озоление в открытых и закрытых системах
Сухое озоление, в т.ч. с озоляющими добавками
Без озоления матрицы:
Применение известных методов разделения концентрирования.
Использование вариантов ВА и модифицированных электродов
Мокрое озоление в открытых и закрытых системах
Сухое озоление, в т.ч. с озоляющими добавками
Без озоления матрицы:
Применение известных методов разделения концентрирования.
Использование вариантов ВА и модифицированных электродов
Слайд 14Физические воздействия:
Возбуждение кислорода (низкотемпературная плазма)
Микроволновой нагрев
Ультрафиолетовое облучение
Ультразвуковая обработка
Электрохимическая обработка
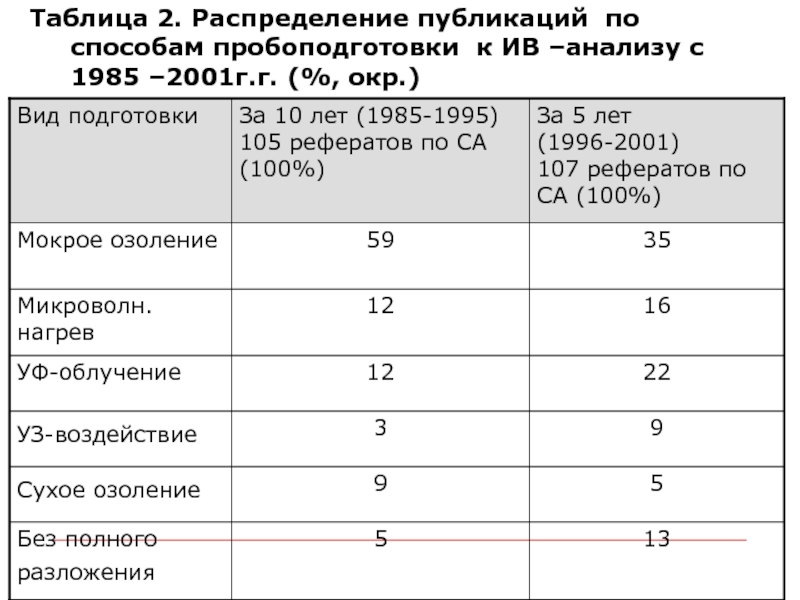
Слайд 15Таблица 2. Распределение публикаций по способам пробоподготовки к ИВ –анализу с
1985 –2001г.г. (%, окр.)
Слайд 17 УЗ – это акустические волны с частотой выше 10 – 20
кГц, подчиняющиеся законам распространения звуковых волн со своими особенностями. При воздействии УЗ с интенсивностью свыше 1 Вт/см2 возникают нелинейные эффекты – акустические течения и кавитации.
Акустические течения – смещения среды вихревого характера . Колебания частиц передаются среде, вызывая ее регулярное движение. Это способствует интенсификации массообменных процессов.
Акустические течения – смещения среды вихревого характера . Колебания частиц передаются среде, вызывая ее регулярное движение. Это способствует интенсификации массообменных процессов.
Слайд 18 Кавитация – образование в жидкости пульсирующих пузырьков, заполненных паром, газом и
их смесью. Когда давление пара в пузырьке становится больше суммарного действия поверхностного натяжения и давления жидкости выросший пузырек схлопывается, при этом давление возрастает до 107 Па, а температура 3000 К. На процессы кавитации влияют свойства жидкости ( ее Т, Р, содержание газов…), а также параметры УЗ – частота и интенсивность.
Слайд 19 Кавитация приводит к протеканию хим. реакций ВОЗБУЖДЕННЫХ ЧАСТИЦ – распад на
радикалы, взаимодействие с молекулами газа и воды, а также сонолюминесценции (свечению).
С помощью УЗ получают высокие интенсивности энергии (на ед. площади перпендикулярной направлению распространения волн), что позволяет интенсифицировать многие химические процессы.
С помощью УЗ получают высокие интенсивности энергии (на ед. площади перпендикулярной направлению распространения волн), что позволяет интенсифицировать многие химические процессы.
Слайд 20 Микроволновое ( МВ) –разложение
МВ-излучение – вид электромагнитного излучения в диапазоне частот
300 – 30000 МГц, вызывающий движение ионов и вращение диполей и приводящий к быстрому разогреву всего объема образца, поглощающего МВ-энергию. Так, при частоте 2400 МГц ориентация молекул и их возвращение в беспорядочное состояние происходит 5.109 раз в секунду. МВ – излучение нагревает весь объем жидкости, не нагревая сосуда проницаемого для МВ (фторопласт, кварц). В результате вместо 1-2 часов для полного разложения проб кислотой требуется 10-15 мин, а Т кип достигается за 2 мин.
Слайд 21 В закрытых сосудах с азотной кислотой основные компоненты пищи разлагаются при
температурах: углеводы – 140 С, белки – при 150 С, жиры – при 160 С.
Недостатки МВ-разложения для ИВ:
Неполное разложение ароматических нитросоединений, которые являются электрохимически активными;
Необходима дополнительная обработка: а) HCLO4 б)УФО;
Необходимо время для охлаждения проб;
Необходимость удаления концентрированных кислот после МВ-разложения.
Недостатки МВ-разложения для ИВ:
Неполное разложение ароматических нитросоединений, которые являются электрохимически активными;
Необходима дополнительная обработка: а) HCLO4 б)УФО;
Необходимо время для охлаждения проб;
Необходимость удаления концентрированных кислот после МВ-разложения.
Слайд 22ФОТОХИМИЧЕСКАЯ ПРОБОПОДГОТОВКА
Ультрафиолет – свет с длиной волны λ короче 400 нм:
Пример
: источник УФ - ртутная лампа низкого давления с наиболее интенсивными линиями λ= 180 и 254 нм
E=hν= hc/λ = 1,2.10-5/λ кДж/моль
Е химической связи ( C- H, C-C, C-OH равна 250 – 500 кДж/моль
Е уфо • Е хим.св.
Под действием энергии УФО происходят первичные, вторичные (в т.ч. каталитические) фотохимические реакции.
E=hν= hc/λ = 1,2.10-5/λ кДж/моль
Е химической связи ( C- H, C-C, C-OH равна 250 – 500 кДж/моль
Е уфо • Е хим.св.
Под действием энергии УФО происходят первичные, вторичные (в т.ч. каталитические) фотохимические реакции.
Слайд 23 Первичные фотохимические р-ции (диссоциации, замещения, окисл./восст….).
Молекулы муравьиной кислоты, перекиси водорода
возбуждаются и распадаются на радикалы :
HCOOH⇒ H.+ .OOH (радикалы R)
H2O2 ⇒ 2 .OH (радикалы R),
Вторичные фотохимические реакции ( с O2 , H2O2, O3 , R. )
R. + O2 ⇒ RO2 . (или R+ + O2-. )
В пределе органические вещества распадаются и минерализуются до CO2 , H2O, нитратов, фосфатов, ионов металлов и др.
HCOOH⇒ H.+ .OOH (радикалы R)
H2O2 ⇒ 2 .OH (радикалы R),
Вторичные фотохимические реакции ( с O2 , H2O2, O3 , R. )
R. + O2 ⇒ RO2 . (или R+ + O2-. )
В пределе органические вещества распадаются и минерализуются до CO2 , H2O, нитратов, фосфатов, ионов металлов и др.
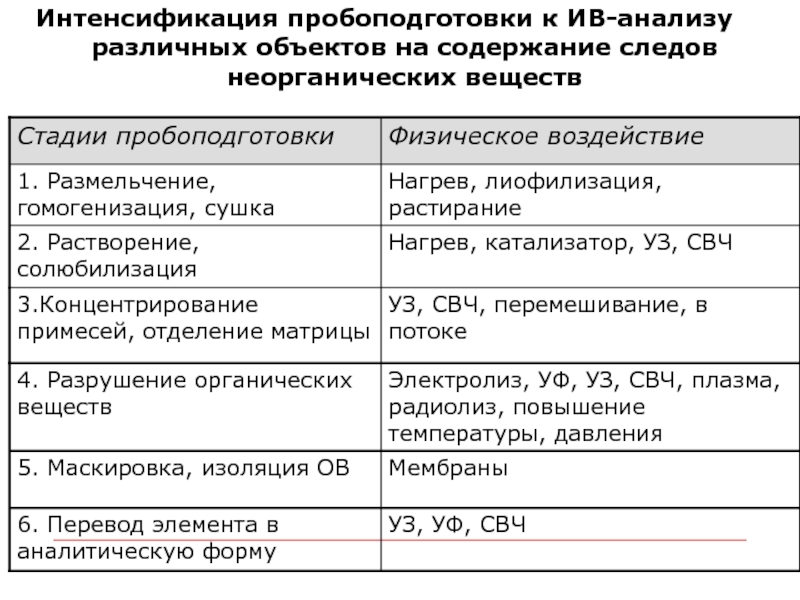
Слайд 24Интенсификация пробоподготовки к ИВ-анализу различных объектов на содержание следов неорганических веществ
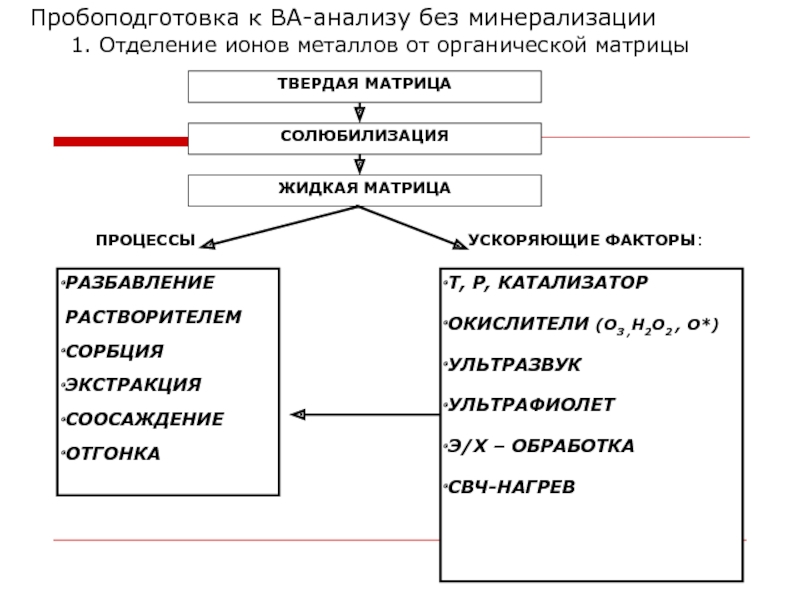
Слайд 25Пробоподготовка к ВА-анализу без минерализации
1. Отделение ионов металлов от органической матрицы
РАЗБАВЛЕНИЕ
РАСТВОРИТЕЛЕМ
СОРБЦИЯ
ЭКСТРАКЦИЯ
СООСАЖДЕНИЕ
ОТГОНКА
Слайд 27 МЕТОДИКА ОПРЕДЕЛЕНИЯ ИОДА В ПИЩЕВЫХ ПРОДУКТАХ
Электроактивные формы – I(1-) – иодид (устойчив
при рН •6) и I(5+)- иодат, IO3 – . В кислой среде: 5I (-1) +IO3(–) + H(+) = 3I2 +3H2O, иод улетучивается. В щелочной среде иодид и иодат устойчивы.
Определение иодида методом катодной ИВ
Пробоподготовка всех объектов: щелочное окислительное плавление (KOH+KNO3 ) при T 480 C для разрушения органической матрицы, последующее подкисление (рН 4-3) и восстановление иодатов до иодида аскорбиновой кислотой.
Определение иодида методом катодной ИВ
Пробоподготовка всех объектов: щелочное окислительное плавление (KOH+KNO3 ) при T 480 C для разрушения органической матрицы, последующее подкисление (рН 4-3) и восстановление иодатов до иодида аскорбиновой кислотой.
Слайд 28 Измерение. Фон – KNO3 + аскорбиновая кислота. Электрод – РПЭ (3-х
электродная ячейка)
Накопление иодида: 2Hg – 2e + I(1-) = Hg2Cl2 (осадок на РПЭ)
Формирование сигнала (катодная развертка потенциала, Еп= -0,24 В):
Hg2Cl2 +2е =2Hg +2СL(-)
Методика аттестована и опубликована //Химия и хим. технология, 2003, Т.46., вып.5, с.74-76. Слепченко Г.Б., Пичугина В.М.
Накопление иодида: 2Hg – 2e + I(1-) = Hg2Cl2 (осадок на РПЭ)
Формирование сигнала (катодная развертка потенциала, Еп= -0,24 В):
Hg2Cl2 +2е =2Hg +2СL(-)
Методика аттестована и опубликована //Химия и хим. технология, 2003, Т.46., вып.5, с.74-76. Слепченко Г.Б., Пичугина В.М.
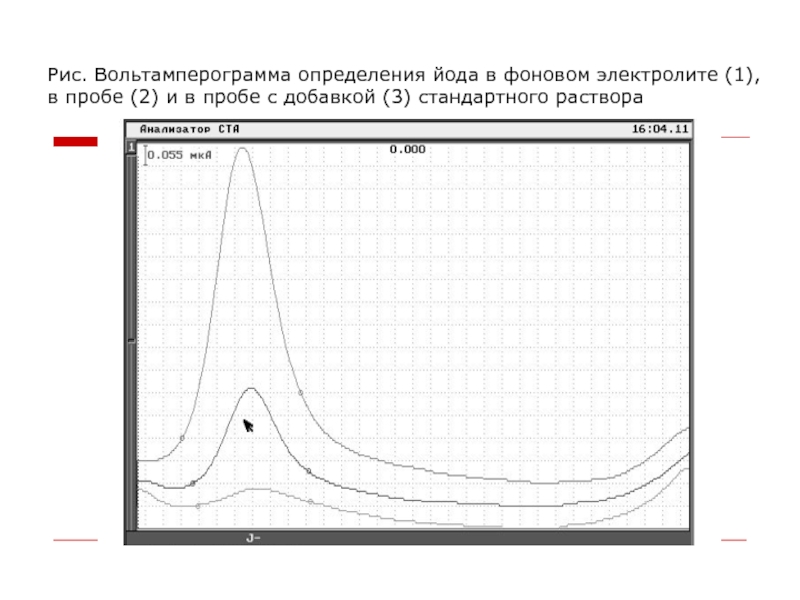
Слайд 29Рис. Вольтамперограмма определения йода в фоновом электролите (1), в пробе (2)
и в пробе с добавкой (3) стандартного раствора
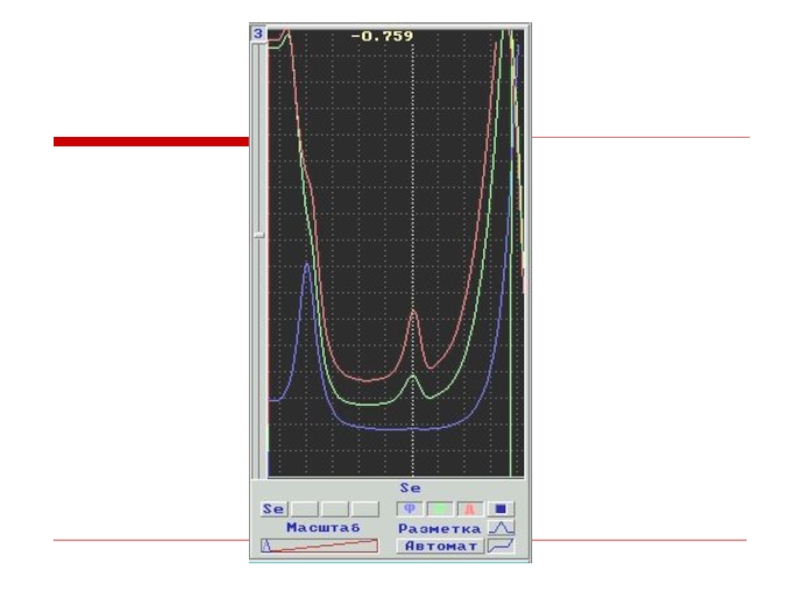
Слайд 30Методика анализа вод на содержание Se
Электроактивной формой является селен (4+), т.е.
селенит,
Подготовка проб вод состоит из двух стадий:
1)фотоокисление всех форм селена до селена (4+, 6+) в присутствии H2O2
2) фотовосстановление Se(6+) до Se (4+) в том же стаканчике, при рН 8-10
Определение методом АНОДНОЙ ИВ на Au-C электроде на фоне– HCLO4:
Накопление:
Анодное растворение:
Для устранения мешающих ионов Cl-, NO2- используется прием смены раствора с пробой на фон в стадии анодного растворения.
Методика аттестована и опубликована в Завод. лабор. 1999, т.65, с.3-6. Захарова Э.А., Филичкина О.Г., Слепченко Г.Б.
Подготовка проб вод состоит из двух стадий:
1)фотоокисление всех форм селена до селена (4+, 6+) в присутствии H2O2
2) фотовосстановление Se(6+) до Se (4+) в том же стаканчике, при рН 8-10
Определение методом АНОДНОЙ ИВ на Au-C электроде на фоне– HCLO4:
Накопление:
Анодное растворение:
Для устранения мешающих ионов Cl-, NO2- используется прием смены раствора с пробой на фон в стадии анодного растворения.
Методика аттестована и опубликована в Завод. лабор. 1999, т.65, с.3-6. Захарова Э.А., Филичкина О.Г., Слепченко Г.Б.
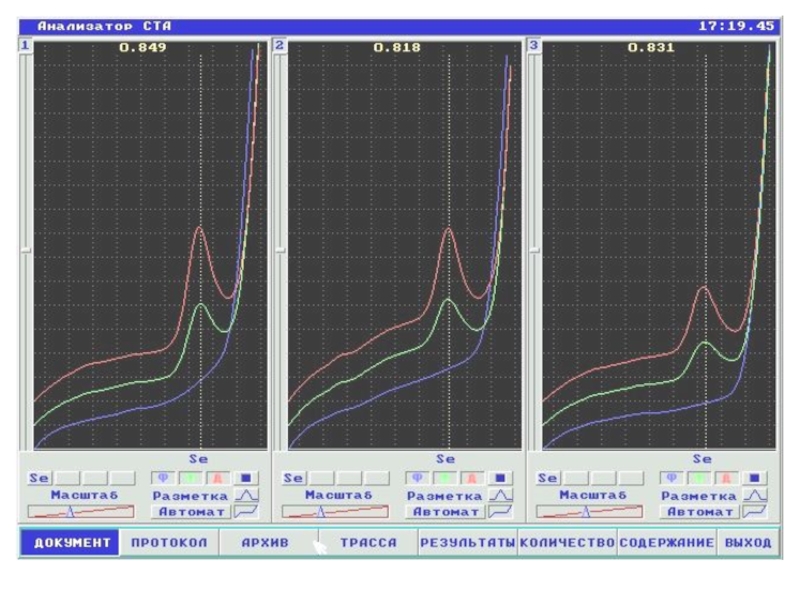
Слайд 32Методика анализа пищевых продуктов, биологических объектов на содержание Se
Электроактивной формой
является селен (4+)
Подготовка проб состоит из 2-х стадий:
Мокрое озоление с добавлением соли магния и прокаливанием при 450 С
Восстановление селена (6+) до (4+) 6 М HCL (90 C)
Определение методом КАТОДНОЙ КВИВ на ртутно-графитовом электроде.
Фон – 0,6 М HCL + ионы ртути (2+) + ионы меди (2+).
Селен накапливается на поверхности РГЭ в виде осадка Cu2Se.
Стадия формирования сигнала селена при катодной развертке потенциала соответствует реакции:
Сu2Se + 2e + 2H (+)→Cu(0)Hg + H2Se
Методика аттестована и будет опубликована в ЖАХ, 2004 г, т.59, №3 с.1-6, Филичкина О.Г., Захарова Э.А., Слепченко Г.Б.
Подготовка проб состоит из 2-х стадий:
Мокрое озоление с добавлением соли магния и прокаливанием при 450 С
Восстановление селена (6+) до (4+) 6 М HCL (90 C)
Определение методом КАТОДНОЙ КВИВ на ртутно-графитовом электроде.
Фон – 0,6 М HCL + ионы ртути (2+) + ионы меди (2+).
Селен накапливается на поверхности РГЭ в виде осадка Cu2Se.
Стадия формирования сигнала селена при катодной развертке потенциала соответствует реакции:
Сu2Se + 2e + 2H (+)→Cu(0)Hg + H2Se
Методика аттестована и будет опубликована в ЖАХ, 2004 г, т.59, №3 с.1-6, Филичкина О.Г., Захарова Э.А., Слепченко Г.Б.