углубленным изучением отдельных предметов
Октябрьского района г. Красноярска
2008 год
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды углерода презентация
Содержание
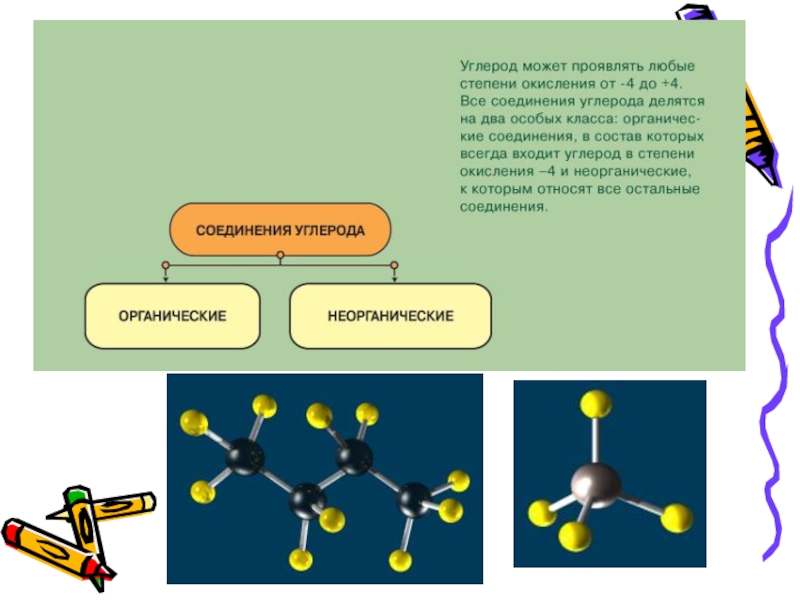
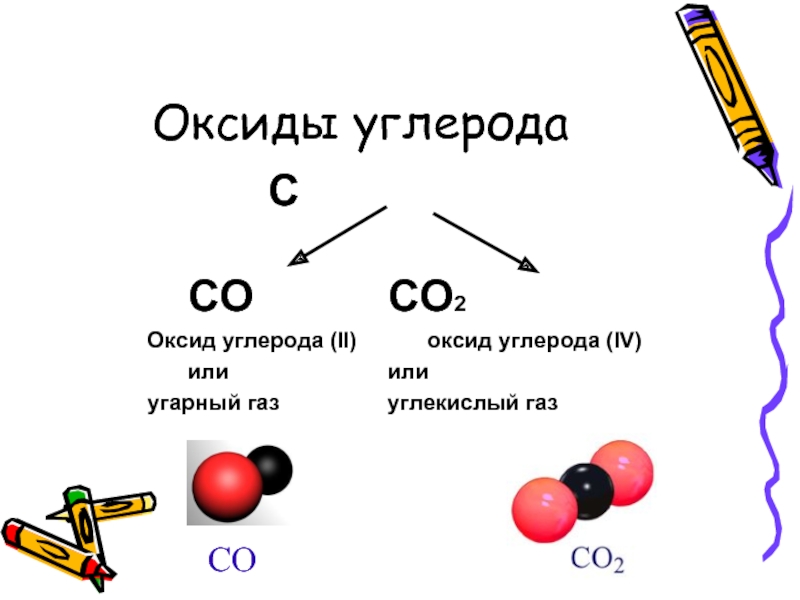
Слайд 3Оксиды углерода
С
СО СО2
Оксид углерода (II) оксид углерода (IV)
или или
угарный газ углекислый газ
СО
Слайд 4Оксид углерода (II)
иначе угарный газ — бесцветный, не имеющий запаха, плохо
растворимый в воде ядовитый газ, относится к несолеобразующим оксидам.
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
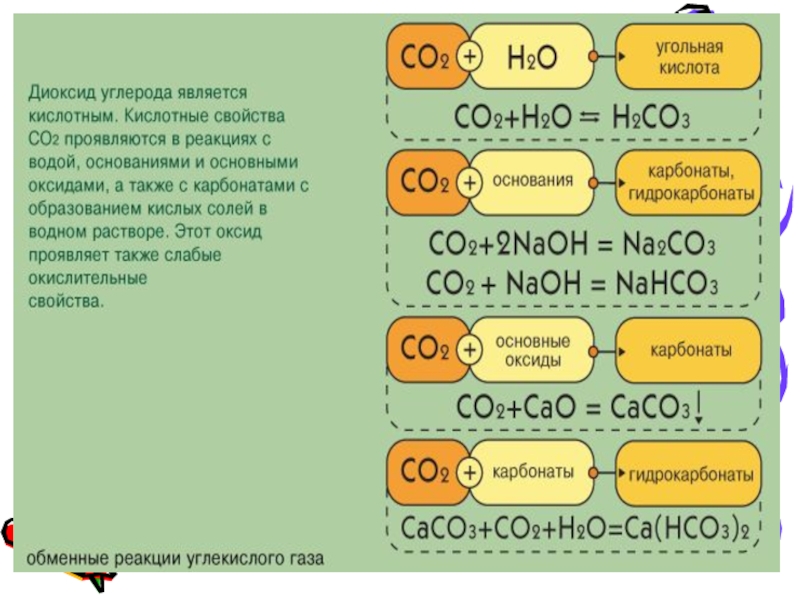
Слайд 5Оксид углерода (IV)
или углекислый газ
– газ без цвета и запаха. Это
кислотный оксид, ему соответствует двухосновная угольная кислота.
Растворение оксида углерода (IV) — обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Растворение оксида углерода (IV) — обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Слайд 8Получение оксида углерода (IV)
В лаборатории оксид углерода (IV) получают взаимодействием
карбоната кальция (мел, мрамор) с соляной кислотой в аппаратах Киппа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
В промышленности этот оксид получают сжиганием угля и при обжиге известняка:
C + O2 = CO2
CaCO3 = CaO + CO2
CaCO3 + 2HCl = CaCl2 + H2O + CO2
В промышленности этот оксид получают сжиганием угля и при обжиге известняка:
C + O2 = CO2
CaCO3 = CaO + CO2
Слайд 9Использованы ЦОР:
СD Уроки химии Кирилла и Мефодия Химия 8-9 класс.
http://school-collection.edu.ru
СD Химия
элементов. Демонстрационное поурочное планирование. Издательство «Учитель»