- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие свойства металлов презентация
Содержание
- 1. Общие свойства металлов
- 2. ИСТОРИЧЕСКАЯ СПРАВКА Древние века и средние века
- 3. НАХОЖДЕНИЕ МЕТАЛЛОВ В ПРИРОДЕ В виде соединений
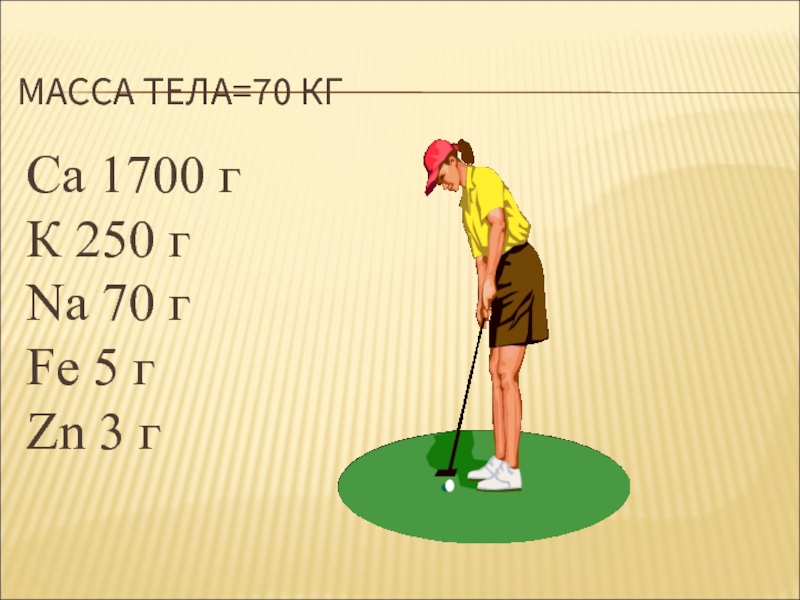
- 5. МАССА ТЕЛА=70 КГ Са 1700 г К
- 6. Влияние металлов на окраску растений.
- 7. КАЛЬЦИЙ
- 8. ПОЛОЖЕНИЕ МЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д. И.МЕНДЕЛЕЕВА
- 9. ЗАГАДОЧНЫЕ СОСЕДИ Щелочно-земельные металлы Переходные металлы Щелочные металлы
- 11. МЕТАЛЛЫ ИМЕЮТ металлическую
- 12. СТРОЕНИЕ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ Имеют свободные валентные электроны
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Твердые вещества, кроме ртути.
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Пластичные
- 16. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Теплопроводность Hg, Cu,
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- 18. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- 19. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Обладают металлическим блеском
- 20. ПРИЧИНЫ, ПРИВОДЯЩИЕ К РАЗЛИЧИЮ ФИЗИЧЕСКИХ СВОЙСТВ Атомы
- 21. Алюминий
- 22. Золото Золото
- 23. ПРИМЕНЕНИЕ МЕТАЛЛОВ Металлургическая промыш-ленность Станкострое-ние медицина Сельское хозяйство Для получения сплавов Домашнее хозяйство
- 24. СТРОНЦИЙ Sr МЕТАЛЛ ФЕЙЕРВЕРКОВ И САЛЮТОВ (КРАСНЫЙ ЦВЕТ)
- 25. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Металлы в химических реакциях
- 26. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Металлы вытесняются из их
- 27. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Запишите уравнения химических реакций:
- 28. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Взаимодействуют с простыми
- 29. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Взаимодействие со сложными веществами
- 30. ПОЛУЧЕНИЕ МЕТАЛЛОВ Пирометаллургический способ- восстановление металла из
Слайд 2ИСТОРИЧЕСКАЯ СПРАВКА
Древние века и средние века – 7 металлов (Au, Ag,
Cu,Pb, Fe, Hg)
М.В. Ломоносов - металлы «светлое тело, которое ковать можно»
А. Лавуазье – 1789 – описал 17 металлов
Д.И. Менделеев – предсказание металлов
ХIХ век – открытие платиновых, щелочных, щелочноземельных металлов.
ХХ – открытие транcурановых элементов.
М.В. Ломоносов - металлы «светлое тело, которое ковать можно»
А. Лавуазье – 1789 – описал 17 металлов
Д.И. Менделеев – предсказание металлов
ХIХ век – открытие платиновых, щелочных, щелочноземельных металлов.
ХХ – открытие транcурановых элементов.
Слайд 3НАХОЖДЕНИЕ МЕТАЛЛОВ В ПРИРОДЕ
В виде соединений
В самородном состоянии (Au, Pt, Ag)
В
виде солей (галогенидов, карбонатов, нитратов, фосфатов)
В виде оксидов и сульфидов
В виде оксидов и сульфидов
Слайд 11
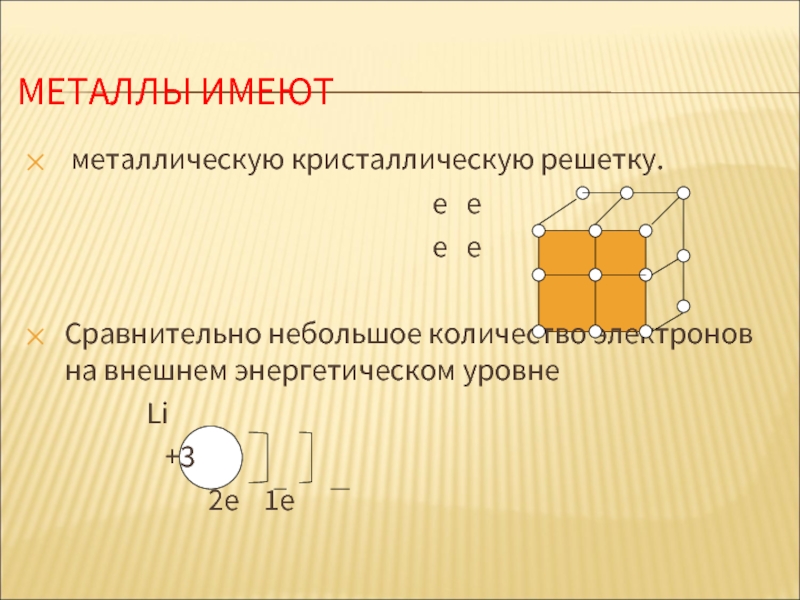
МЕТАЛЛЫ ИМЕЮТ
металлическую кристаллическую решетку.
е е
е е
Сравнительно небольшое количество электронов на внешнем энергетическом уровне
Li
+3
2е 1е
е е
Сравнительно небольшое количество электронов на внешнем энергетическом уровне
Li
+3
2е 1е
Слайд 12СТРОЕНИЕ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Имеют свободные валентные электроны
Металлическая связь не обладает направленностью и
насыщенностью.
Подвижные электроны компенсируют электрическое отталкивание между положительно заряженными ионами и тем самым связывают их в твердые тела
Подвижные электроны компенсируют электрическое отталкивание между положительно заряженными ионами и тем самым связывают их в твердые тела
Слайд 14ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Твердые вещества, кроме ртути.
(самый мягкий – калий,
самый
твердый – хром)
Слайд 16ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Теплопроводность
Hg, Cu, Ag, Al, Fe
уменьшается
Электропроводность
Ag
Mn
уменьшается
уменьшается
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Температура плавления
Легкоплавкие
тугоплавкие
Hg, Ga, Cs, In, Bi W, Mo, V, Cr
Hg, Ga, Cs, In, Bi W, Mo, V, Cr
Слайд 18ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
плотность
легкие тяжелые
(Li–самый легкий, (осмий – самый тяжелый,
K,Na, Mg) Ir, Pb)
легкие тяжелые
(Li–самый легкий, (осмий – самый тяжелый,
K,Na, Mg) Ir, Pb)
Слайд 20ПРИЧИНЫ, ПРИВОДЯЩИЕ К РАЗЛИЧИЮ ФИЗИЧЕСКИХ СВОЙСТВ
Атомы металлов имеют разное число валентных
электронов, участвующих в образовании металлической связи
Атомы (ионы) имеют разные радиусы
Атомы металлов побочных подгрупп могут образовывать и ковалентную связь с помощью неспаренных d-электронов.
Атомы (ионы) имеют разные радиусы
Атомы металлов побочных подгрупп могут образовывать и ковалентную связь с помощью неспаренных d-электронов.
Слайд 23ПРИМЕНЕНИЕ МЕТАЛЛОВ
Металлургическая промыш-ленность
Станкострое-ние
медицина
Сельское хозяйство
Для получения сплавов
Домашнее хозяйство
Слайд 25ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Металлы в химических реакциях являются восстановителями, при этом они
окисляются
Mo – ne =Mn+
Al, Be, Mg, Ca, Li, Na, K, Rb, Cs
Восстановительная способность возрастает
Mo – ne =Mn+
Al, Be, Mg, Ca, Li, Na, K, Rb, Cs
Восстановительная способность возрастает
Слайд 26ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Металлы вытесняются из их соединений другими металлами
Н.Н. Бекетов –
создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов)
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Слайд 27ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Запишите уравнения химических реакций:
Натрий с хлором
Na + CI2 →
Магний с кислородом Mg + O2 →
Кальций с фосфором Ca + P →
Цинк с серной кислотой Zn + H2SO4 →
Цинк с нитратом свинца Zn + Pb(NO3)2 →
Натрий с водой Na + H2O →
Магний с кислородом Mg + O2 →
Кальций с фосфором Ca + P →
Цинк с серной кислотой Zn + H2SO4 →
Цинк с нитратом свинца Zn + Pb(NO3)2 →
Натрий с водой Na + H2O →
Слайд 28ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Взаимодействуют с простыми веществами
С галогенами и кислородом
2Na + Cl2 = 2 Na Cl
Mg + O2 = 2Mg O
C элементами пятой группы (труднее)
3Ca + 2P =Ca3P2
Mg + O2 = 2Mg O
C элементами пятой группы (труднее)
3Ca + 2P =Ca3P2
Слайд 29ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Взаимодействие со сложными веществами
С кислотами
Zn +
H2SO4 = Zn S O4 + H2
C солями
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
C водой (активные)
2Na + 2H2O =2Na OH + H2
C солями
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
C водой (активные)
2Na + 2H2O =2Na OH + H2
Слайд 30ПОЛУЧЕНИЕ МЕТАЛЛОВ
Пирометаллургический способ- восстановление металла из оксида металла углеродом, оксидом углерода
(II), водородом при высокой температуре.
Алюминотермический способ- восстановление металла из оксида металла алюминием при температуре
Гидрометаллургический способ – получение металла из руды, используя более активный металл, из раствора
Электролиз – с помощью электрического тока из расплавов или растворов
Алюминотермический способ- восстановление металла из оксида металла алюминием при температуре
Гидрометаллургический способ – получение металла из руды, используя более активный металл, из раствора
Электролиз – с помощью электрического тока из расплавов или растворов