Максвелла-Больцмана Л8-13.
Явление переноса Л9-10.
Первое начало термодинамики Л10-11.
Изопроцессы. Энтропия Л11-10.
Второе начало термодинамики. Цикл Карно Л12-14.
Модуль 2: лекций 6 (12часов), 68 слайдов.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Модуль 2. презентация
Содержание
- 1. Модуль 2.
- 2. Модуль 2 Лекция 7 Молекулярная физика
- 3. Модуль 2 Лекция 7 Молекулярная физика –
- 4. Модуль 2 Лекция 7 Объектом исследований статистической
- 5. Модуль 2 Лекция 7 Внешние параметры V,
- 6. Модуль 2 Лекция 7 Опытное обоснование молекулярно-кинетической
- 7. Модуль 2 Лекция 7 Абстракции молекулярной физики
- 8. Модуль 2 Лекция 7 Основное уравнение МКТ
- 9. Модуль 2 Лекция 7 Постоянная Больцмана K=1,38∙10-23
- 10. Модуль 2 Лекция 7
- 11. Модуль 2 Лекция 7 P(V)=N0kT
Слайд 1Модуль 2 Лекция 7
Модуль 2.
Молекулярная физика и термодинамика.
Молекулярно-кинетическая теория Л7-10
Распределение
Слайд 2Модуль 2 Лекция 7
Молекулярная физика
(Волькенштейн-1990 г)
МКТ 5.21 5.22
5.26 5.28
Распределение Максвелла
5.50 5.55 5.56 5.93 5.94
Явления переноса
5.139 5.145 5.146 5.141
Распределение Максвелла
5.50 5.55 5.56 5.93 5.94
Явления переноса
5.139 5.145 5.146 5.141
Слайд 3Модуль 2 Лекция 7
Молекулярная физика – это раздел физики, в котором
изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их микроскопического (молекулярного) строения.
Если классическая механика рассматривает лишь внешние взаимодействия макроскопических тел, их движение в целом, то статистическая физика и термодинамика изучают внутренние свойства макроскопических систем и те происходящие в них процессы, которые являются результатом атомных и молекулярных явлений.
Если классическая механика рассматривает лишь внешние взаимодействия макроскопических тел, их движение в целом, то статистическая физика и термодинамика изучают внутренние свойства макроскопических систем и те происходящие в них процессы, которые являются результатом атомных и молекулярных явлений.
Слайд 4Модуль 2 Лекция 7
Объектом исследований статистической физики и термодинамики являются макроскопические
системы, состоящие из очень большого числа частиц.
Статистика исходит из законов механики и теории вероятности, термодинамика – из фундаментальных опытных фактов превращения одних видов энергии в другие.
Статистика исходит из законов механики и теории вероятности, термодинамика – из фундаментальных опытных фактов превращения одних видов энергии в другие.
Слайд 5Модуль 2 Лекция 7
Внешние параметры
V, Sпов., Еэл.поля, Вмагн.поля
зависят от взаимного расположения
окружающих систему тел.
Внутренние параметры
Т, Р, ρ, n
Внутренние параметры
Т, Р, ρ, n
Слайд 6Модуль 2 Лекция 7
Опытное обоснование молекулярно-кинетической теории
Высокая сжимаемость газов свидетельствует о
наличии больших расстояний между молекулами.
Стремление газа занять весь объем говорит о независимости движения молекул.
Диффузия – молекулы движутся в «пустотах».
Смешение жидкостей (вода+спирт) – объем смешения не равен объему компонентов.
Рост давления газа связан с относительным увеличением ударов молекул о стенки.
Броуновское движение – неуравновешенность ударов молекул.
Стремление газа занять весь объем говорит о независимости движения молекул.
Диффузия – молекулы движутся в «пустотах».
Смешение жидкостей (вода+спирт) – объем смешения не равен объему компонентов.
Рост давления газа связан с относительным увеличением ударов молекул о стенки.
Броуновское движение – неуравновешенность ударов молекул.
Слайд 7Модуль 2 Лекция 7
Абстракции молекулярной физики
Идеальный газ – газ, частицы которого
на расстоянии не взаимодействуют, а при столкновениях ведут себя как упругие шары, собственный объем частиц значительно меньше объема, занимаемого газом.
Идеальный газ – собрание большого числа молекул, которые рассматриваются как материальные точки.
Между столкновениями молекулы двигаются равномерно и прямолинейно. Скорости их равновероятны по направлениям.
Давление газа – результат взаимодействия молекул газа со стенками сосуда.
Каждая молекула обладает энергией, которая пропорциональна абсолютной температуре.
Идеальный газ – собрание большого числа молекул, которые рассматриваются как материальные точки.
Между столкновениями молекулы двигаются равномерно и прямолинейно. Скорости их равновероятны по направлениям.
Давление газа – результат взаимодействия молекул газа со стенками сосуда.
Каждая молекула обладает энергией, которая пропорциональна абсолютной температуре.
Слайд 8Модуль 2 Лекция 7
Основное уравнение МКТ для давления
(Уравнение Клаузиуса)
Основное уравнение
МКТ
для температуры
для температуры
Уравнение состояния ид.газа
Объединенный газовый закон
Слайд 9Модуль 2 Лекция 7
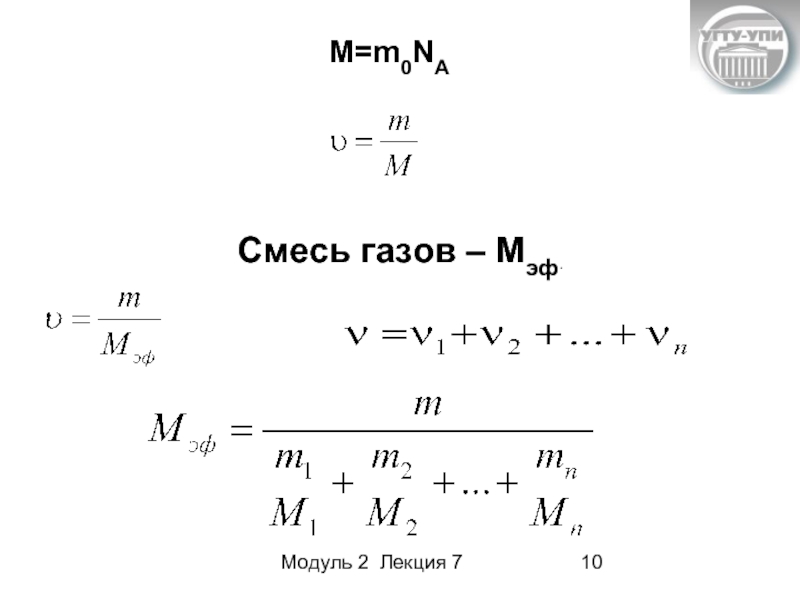
Постоянная Больцмана K=1,38∙10-23 Дж/К
Моль – количество вещества, содержащего
столько же структурных элементов (молекул, атомов), сколько атомов содержится в изотопе углерода 12С массой 0,012 кг.
Молярная масса М, кг/моль–масса 1 моля
Число молей (m – масса газа, кг)
Постоянная Авогадро NA=N0=6,023∙1023 1/моль – число молекул в 1 моле
, где m0 – масса одной молекулы
В 1 моле разных веществ содержится одинаковое NA число молекул.
Молярная масса М, кг/моль–масса 1 моля
Число молей (m – масса газа, кг)
Постоянная Авогадро NA=N0=6,023∙1023 1/моль – число молекул в 1 моле
, где m0 – масса одной молекулы
В 1 моле разных веществ содержится одинаковое NA число молекул.
Слайд 11Модуль 2 Лекция 7
P(V)=N0kT R=N0k R=8.31Дж/моль∙К
R
– универсальная газовая постоянная
P(V)(m/M)=(m/M)RT
PV=(m/M)RT
Уравнение Менделеева-Клапейрона для произвольной массы газа
P(V)(m/M)=(m/M)RT
PV=(m/M)RT
Уравнение Менделеева-Клапейрона для произвольной массы газа