- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Многоатомные спирты презентация
Содержание
- 1. Многоатомные спирты
- 2. Содержание Определение Физические свойства Номенклатура Химические свойства
- 3. Определение К многоатомным спиртам относятся органические
- 4. Физические свойства Этиленгликоль CH2OH – CH2OH
- 5. Номенклатура Наличие в соединениях двух и
- 6. Химические свойства Для многоатомных спиртов характерны
- 7. 1. Взаимодействуют с активными металлами.
- 8. 2. Взаимодействуют с оксидами активных металлов.
- 9. 3. При взаимодействии с галогеноводородами (HCl, HBr)
- 10. 4.При взаимодействии с органическими и неорганическими кислотами
- 11. Аналогично получается и полный уксуснокислый эфир
- 12. 5. Качественная реакция на многоатомные спирты.
- 13. Получение спиртов Этиленгликоль (этандиол-1,2) синтезируют из
- 14. 3. Окисление этилена 3CH2=CH2 + 2KMnO4 +
- 15. Глицерин (пропантриол -1,2,3) получают 1) гидролизом
- 16. б) CH2=CH-CH3 + O2 →
- 17. Применение Этиленгликоль сильно понижает температуру
- 18. Глицерин в больших количествах потребляется в
- 19. Источники информации 1. Петров А.А., Бальян Х.В.,
- 20. 5. Оганесян Э.Т. Руководство по химии поступающим
- 21. 9. Штремплер Г.И. Тесты, вопросы и ответы
Слайд 2Содержание
Определение
Физические свойства
Номенклатура
Химические свойства
с активными металлами, оксидами
активных металловактивных металлов, с галогеноводородами,
с
органическими и неорганическими кислотами,
качественная реакция на многоатомные спирты.
Получение спиртов (этиленгликоль,
глицерин)
Применение (этиленгликольПрименение (этиленгликоль, глицерин)
Источники информации
качественная реакция на многоатомные спирты.
Получение спиртов (этиленгликоль,
глицерин)
Применение (этиленгликольПрименение (этиленгликоль, глицерин)
Источники информации
Слайд 3Определение
К многоатомным спиртам
относятся органические соединения,
в молекулах которых содержится
несколько
гидроксильных групп,
соединенных с углеводородным
радикалом.
В общем виде формулу спиртов
можно записать как R(OH)n.
соединенных с углеводородным
радикалом.
В общем виде формулу спиртов
можно записать как R(OH)n.
Слайд 4Физические свойства
Этиленгликоль CH2OH – CH2OH
бесцветная сиропообразная жидкость с
tкип.
197ºС, имеет сладкий вкус, без
запаха, очень ядовит, смешивается с водой в
любых соотношениях, гигроскопичен.
Глицерин CH2OH – CHOH – CH2OH
бесцветная, вязкая, tкип. 290ºС,
гигроскопичная жидкость, сладкая на вкус, с
водой смешивается в любых соотношениях.
запаха, очень ядовит, смешивается с водой в
любых соотношениях, гигроскопичен.
Глицерин CH2OH – CHOH – CH2OH
бесцветная, вязкая, tкип. 290ºС,
гигроскопичная жидкость, сладкая на вкус, с
водой смешивается в любых соотношениях.
Слайд 5Номенклатура
Наличие в соединениях двух и
более гидроксильных групп
обозначается соответственно
суффиксами –диол–,
–триол– и т.д.
Например
CH3 – CH2 – CH2 – CHOH – CH2OH
пентандиол – 1,2
Например
CH3 – CH2 – CH2 – CHOH – CH2OH
пентандиол – 1,2
Слайд 6Химические свойства
Для многоатомных спиртов
характерны основные реакции
одноатомных спиртов. В отличие
от них,
они могут образовывать производные
по одной или по нескольким
гидроксильным группам, в зависимости
от условий проведения реакций.
они могут образовывать производные
по одной или по нескольким
гидроксильным группам, в зависимости
от условий проведения реакций.
Слайд 71. Взаимодействуют с активными
металлами.
Многоатомные спирты, как и одноатомные,
проявляют
свойства кислот при взаимодействии с
активными металлами, при этом происходит
последовательное замещение атомов водорода в
гидроксильных группах.
2CH2OH-CH2OH + 2Na →
2CH2OH-CH2ONa + H2
неполный гликолят натрия
2CH2OH-CH2ONa + 2Na →
2CH2ONa – CH2ONa + H2
полный гликолят натрия
активными металлами, при этом происходит
последовательное замещение атомов водорода в
гидроксильных группах.
2CH2OH-CH2OH + 2Na →
2CH2OH-CH2ONa + H2
неполный гликолят натрия
2CH2OH-CH2ONa + 2Na →
2CH2ONa – CH2ONa + H2
полный гликолят натрия
Слайд 82. Взаимодействуют с оксидами активных
металлов.
Наличие в молекулах многоатомных спиртов
нескольких гидроксильных групп приводит к
большей поляризации связи O – H, поэтому
кислотные свойства у них выражены сильнее
чем у одноатомных спиртов и воды.
CH2OH-CH2OH +Na2O →
CH2ONa – CH2ONa + H2O
полный гликолят натрия
2CH2OH – CHOH – CH2OH + 3Na2O →
2CH2ONa – CHONa – CH2ONa + 3H2O
глицерат натрия
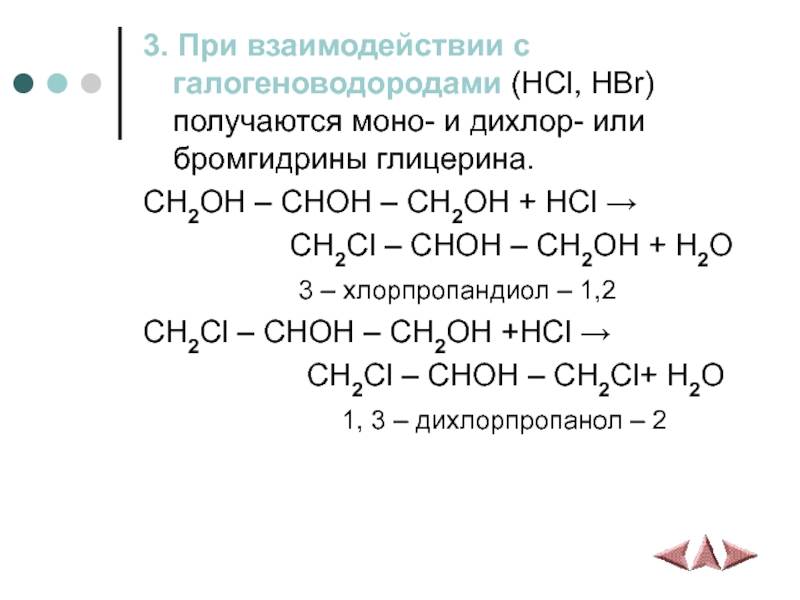
Слайд 93. При взаимодействии с галогеноводородами (HCl, HBr) получаются моно- и дихлор-
или бромгидрины глицерина.
CH2OH – CHOH – CH2OH + HCl →
CH2Cl – CHOH – CH2OH + H2O
3 – хлорпропандиол – 1,2
CH2Cl – CHOH – CH2OH +HCl →
CH2Cl – CHOH – CH2Cl+ H2O
1, 3 – дихлорпропанол – 2
CH2OH – CHOH – CH2OH + HCl →
CH2Cl – CHOH – CH2OH + H2O
3 – хлорпропандиол – 1,2
CH2Cl – CHOH – CH2OH +HCl →
CH2Cl – CHOH – CH2Cl+ H2O
1, 3 – дихлорпропанол – 2
Слайд 104.При взаимодействии с органическими
и неорганическими кислотами
образуются полные и неполные сложные
эфиры.
CH2OH
HO – NO2 CH2ONO2
| H+ |
CHOH + HO – NO2 → CHONO2 + 3H2O
| |
CH2OH HO – NO2 CH2ONO2
глицеринтринитрат
(нитроглицерин)
взрывчатое вещество, применяется при
производстве динамита. При его взрыве
выделяется большое количество газов и тепла:
CH2ONO2-CHONO2-CH2ONO2 →
12CO2 + 6N2 + O2 + 10H2O + Q
| H+ |
CHOH + HO – NO2 → CHONO2 + 3H2O
| |
CH2OH HO – NO2 CH2ONO2
глицеринтринитрат
(нитроглицерин)
взрывчатое вещество, применяется при
производстве динамита. При его взрыве
выделяется большое количество газов и тепла:
CH2ONO2-CHONO2-CH2ONO2 →
12CO2 + 6N2 + O2 + 10H2O + Q
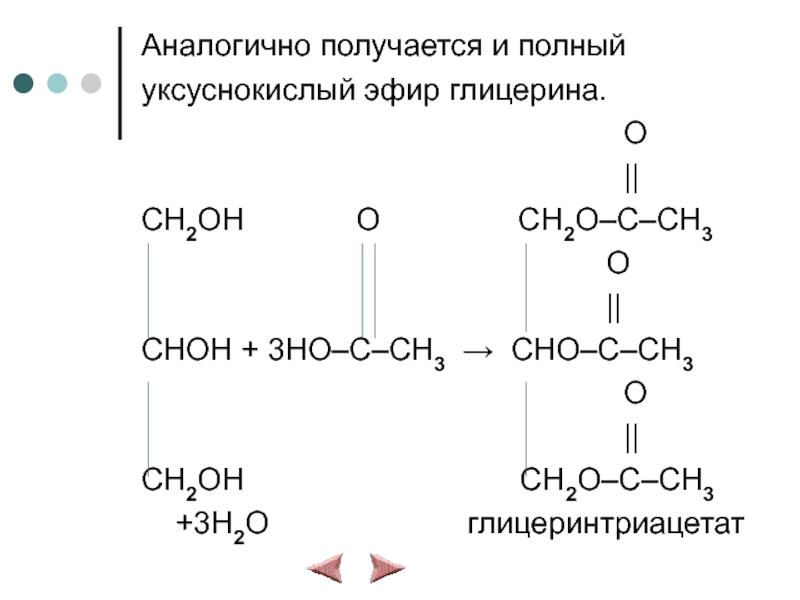
Слайд 11Аналогично получается и полный
уксуснокислый эфир глицерина.
O
||
CH2OH O CH2O–C–CH3
O
||
CHOH + 3HO–C–CH3 → CHO–C–CH3
O
||
CH2OH CH2O–C–CH3
+3H2O глицеринтриацетат
||
CH2OH O CH2O–C–CH3
O
||
CHOH + 3HO–C–CH3 → CHO–C–CH3
O
||
CH2OH CH2O–C–CH3
+3H2O глицеринтриацетат
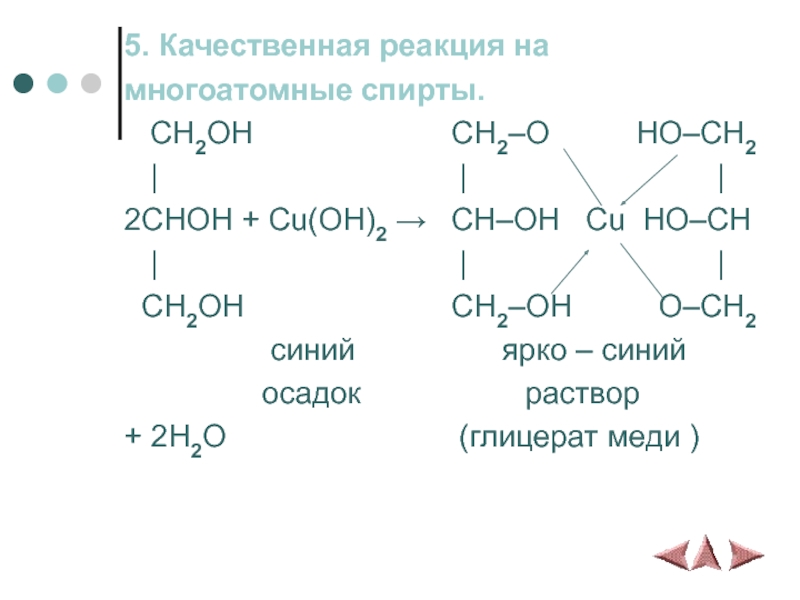
Слайд 125. Качественная реакция на
многоатомные спирты.
CH2OH
CH2–O HO–CH2
| | |
2CHOH + Cu(OH)2 → CH–OH Cu HO–CH
| | |
CH2OH CH2–OH O–CH2
синий ярко – синий
осадок раствор
+ 2H2O (глицерат меди )
| | |
2CHOH + Cu(OH)2 → CH–OH Cu HO–CH
| | |
CH2OH CH2–OH O–CH2
синий ярко – синий
осадок раствор
+ 2H2O (глицерат меди )
Слайд 13Получение спиртов
Этиленгликоль (этандиол-1,2)
синтезируют из этилена различными
способами:
1)CH2=CH2 + Cl2 →
CH2Cl-CH2Cl
Гидролиз дихлорэтана
CH2Cl-CH2Cl + 2H2O ↔ CH2OH-CH2OH
+2HCl KOH
2)CH2=CH2 +HOCl→ CH2OH-CH2Cl
CH2OH-CH2Cl + H2O↔ CH2OH-CH2OH +HCl
KOH
Гидролиз дихлорэтана
CH2Cl-CH2Cl + 2H2O ↔ CH2OH-CH2OH
+2HCl KOH
2)CH2=CH2 +HOCl→ CH2OH-CH2Cl
CH2OH-CH2Cl + H2O↔ CH2OH-CH2OH +HCl
KOH
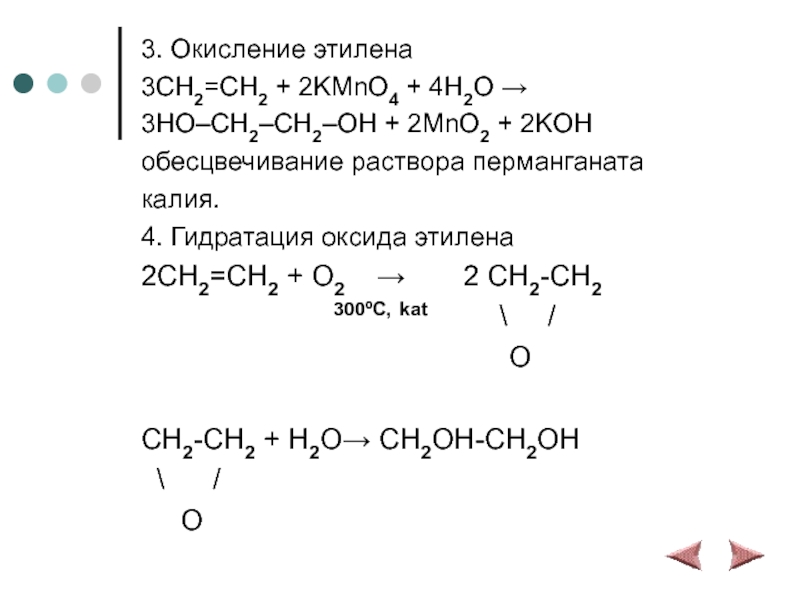
Слайд 143. Окисление этилена
3CH2=CH2 + 2KMnO4 + 4H2O →
3HO–CH2–CH2–OH + 2MnO2 +
2KOH
обесцвечивание раствора перманганата
калия.
4. Гидратация оксида этилена
2CH2=CH2 + O2 → 2 CH2-CH2
300ºC, kat \ /
O
CH2-CH2 + H2O→ CH2OH-CH2OH
\ /
O
обесцвечивание раствора перманганата
калия.
4. Гидратация оксида этилена
2CH2=CH2 + O2 → 2 CH2-CH2
300ºC, kat \ /
O
CH2-CH2 + H2O→ CH2OH-CH2OH
\ /
O
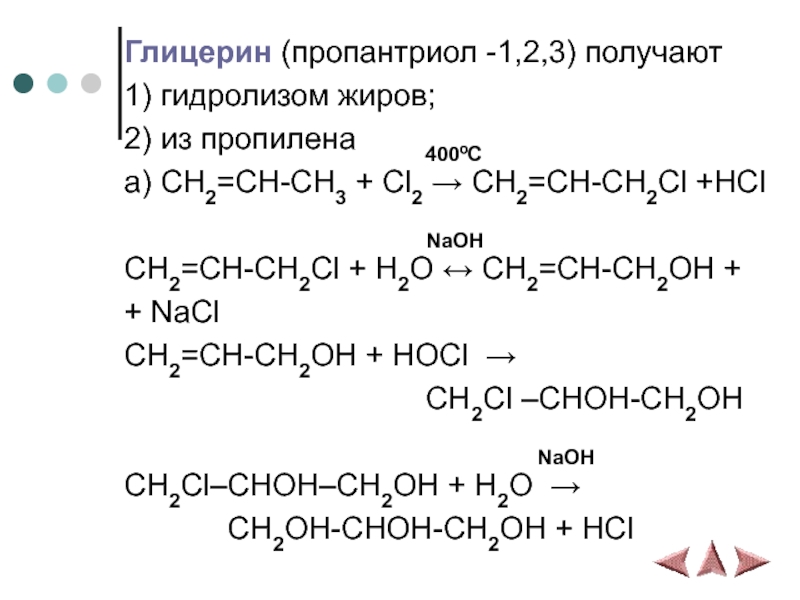
Слайд 15Глицерин (пропантриол -1,2,3) получают
1) гидролизом жиров;
2) из пропилена
400ºС
а) CH2=CH-CH3 + Cl2 → CH2=CH-CH2Cl +HCl
NaOH
CH2=CH-CH2Cl + H2O ↔ CH2=CH-CH2OH +
+ NaCl
CH2=CH-CH2OH + HOCl →
CH2Cl –CHOH-CH2OH
NaOH
CH2Cl–CHOH–CH2OH + H2O →
CH2OH-CHOH-CH2OH + HCl
а) CH2=CH-CH3 + Cl2 → CH2=CH-CH2Cl +HCl
NaOH
CH2=CH-CH2Cl + H2O ↔ CH2=CH-CH2OH +
+ NaCl
CH2=CH-CH2OH + HOCl →
CH2Cl –CHOH-CH2OH
NaOH
CH2Cl–CHOH–CH2OH + H2O →
CH2OH-CHOH-CH2OH + HCl
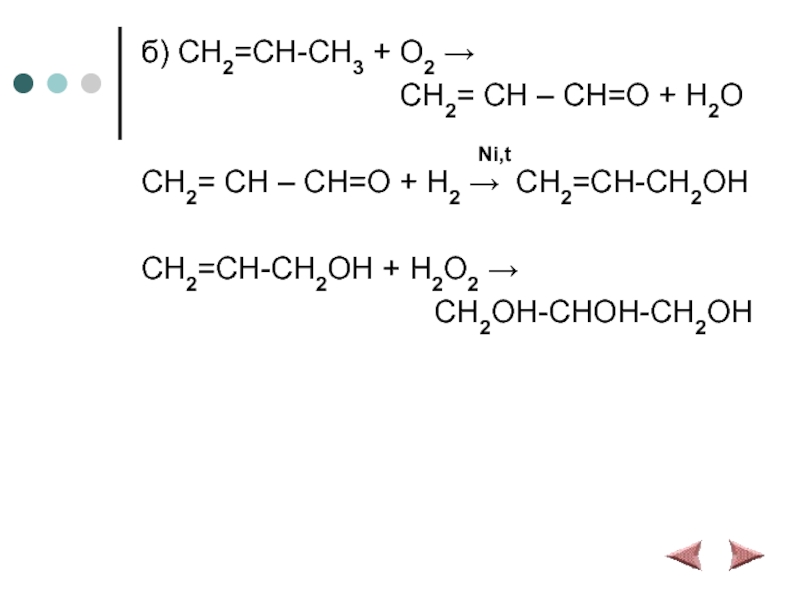
Слайд 16б) CH2=CH-CH3 + O2 →
CH2= CH – CH=O + H2O
Ni,t
CH2= CH – CH=O + H2 → CH2=CH-CH2OH
CH2=CH-CH2OH + H2O2 →
CH2OH-CHOH-CH2OH
Ni,t
CH2= CH – CH=O + H2 → CH2=CH-CH2OH
CH2=CH-CH2OH + H2O2 →
CH2OH-CHOH-CH2OH
Слайд 17 Применение
Этиленгликоль сильно понижает
температуру замерзания воды. 60%-ный
водный раствор гликоля
замерзает при
– 49ºС. Его с успехом применяют для
приготовления антифриза. Он весьма
гигроскопичен, поэтому используется при
изготовлении печатных красок (текстильных,
типографских и штемпельных). Азотнокислый
эфир этиленгликоля – динитроэтиленгликоль –
сильное взрывчатое средство, заменяющее
нитроглицерин.
– 49ºС. Его с успехом применяют для
приготовления антифриза. Он весьма
гигроскопичен, поэтому используется при
изготовлении печатных красок (текстильных,
типографских и штемпельных). Азотнокислый
эфир этиленгликоля – динитроэтиленгликоль –
сильное взрывчатое средство, заменяющее
нитроглицерин.
Слайд 18 Глицерин в больших количествах
потребляется в химической, пищевой
(для изготовления кондитерских
изделий, ликеров, прохладительных
напитков), текстильной и полиграфической
промышленностях (добавляется в печатную
краску для предохранения от высыхания).
Его применяют в производстве пластических
масс и лаков (глифталевые смолы),
взрывчатых веществ и порохов, косметических
и лекарственных препаратов, а также в
качестве антифриза.
Слайд 19Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник
для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
Слайд 205. Оганесян Э.Т. Руководство по химии
поступающим в вузы. Справочное пособие. –
М.: Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.
Слайд 21 9. Штремплер Г.И. Тесты, вопросы и ответы
по химии: Книга для
учащихя 8-11 классов
общеобразовательных учреждений. – М.:
Просвещение, 1999.
10. Малыхин З.В. Тестовые задания для
проверки знаний учащихся по органической
химии. – М.: ТЦ «Сфера», 2001.
11. Городничева И.Н. Контрольные и
проверочные работы по химии. 8-11 класс. –
М.: Аквариум, 1997.
12. Гаврусейко Н.П. Проверочные работы по
органической химии: Дидактический материал:
Пособие для учителя. – М.: Просвещение, 1991.
общеобразовательных учреждений. – М.:
Просвещение, 1999.
10. Малыхин З.В. Тестовые задания для
проверки знаний учащихся по органической
химии. – М.: ТЦ «Сфера», 2001.
11. Городничева И.Н. Контрольные и
проверочные работы по химии. 8-11 класс. –
М.: Аквариум, 1997.
12. Гаврусейко Н.П. Проверочные работы по
органической химии: Дидактический материал:
Пособие для учителя. – М.: Просвещение, 1991.