двигатели. Энтропия. Цикл Карно
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекции по физике. Молекулярная физика и основы термодинамики презентация
Содержание
- 1. Лекции по физике. Молекулярная физика и основы термодинамики
- 2. Обратимые и необратимые процессы Обратимым называют процесс,
- 3. Обратимые и необратимые процессы Пример. Рассмотрим систему
- 4. Обратимые и необратимые процессы Разобьём груз на
- 5. Обратимые и необратимые процессы Пример равновесного необратимого
- 6. Второе начало термодинамики Второе начало термодинамики констатирует
- 7. Второе начало термодинамики Формулировка Томсона. Невозможен круговой
- 8. Второе начало термодинамики Второе начало Т.Д. накладывает
- 9. Тепловые двигатели Тепловой двигатель – это устройство,
- 10. Тепловые двигатели
- 11. Метод циклов В циклическом процессе ΔU=0 →
- 12. Цикл Карно Цикл Карно состоит из двух
- 13. Цикл Карно Первая теорема Карно: Коэффициент полезного
- 14. Цикл Карно Для идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4) η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1) Из уравнения адиабаты: TVγ-1=const
- 15. Цикл Карно T1V1γ-1= T2V4γ-1 и T1V2γ-1= T2V3γ-1
- 16. Цикл Карно Вторая теорема Карно: КПД любого
- 17. Энтропия Рассмотрим произвольный равновесный цикл. Аппроксимируем его
- 18. Энтропия Энтропия – это такая функция состояния,
- 19. Энтропия Найдём энтропию идеального газа Из dU=cVdT
- 20. Энтропия Определение энтропии через теплоту встречает одну
- 21. Постулат Нернста Постулат Нернста сводится к двум
- 22. Статистическая интерпретация энтропии Вероятность состояния пропорциональна его
- 23. Статистическая интерпретация энтропии Т.о. логарифм стат. веса
- 24. Статистическая интерпретация энтропии Т.к. равновесным состоянием является
- 25. Статистическая интерпретация энтропии При протекании обратимых процессов
- 26. Конец лекции
Слайд 1Лекции по физике. Молекулярная физика и основы термодинамики
Второе начало термодинамики. Тепловые
Слайд 2Обратимые и необратимые процессы
Обратимым называют процесс, допускающий возможность возвращения системы в
первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения
Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим
Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим
Слайд 3Обратимые и необратимые процессы
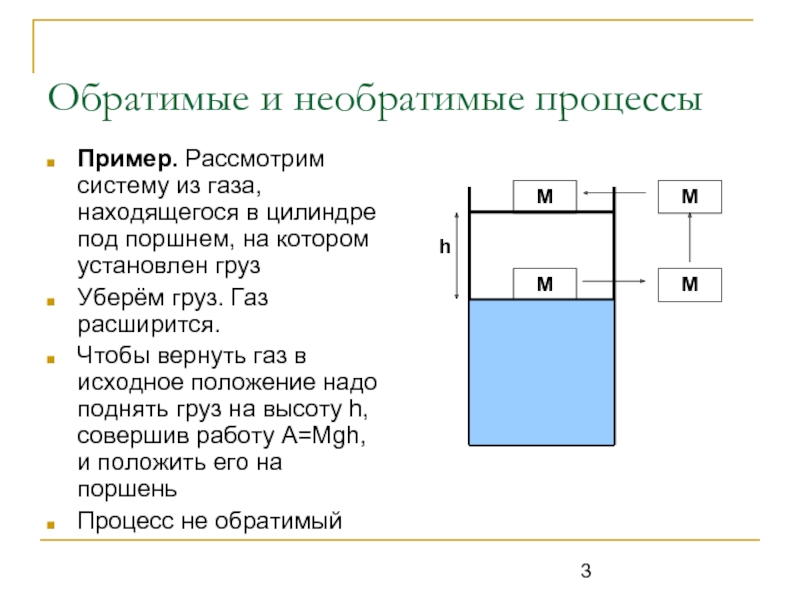
Пример. Рассмотрим систему из газа, находящегося в цилиндре
под поршнем, на котором установлен груз
Уберём груз. Газ расширится.
Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень
Процесс не обратимый
Уберём груз. Газ расширится.
Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень
Процесс не обратимый
Слайд 4Обратимые и необратимые процессы
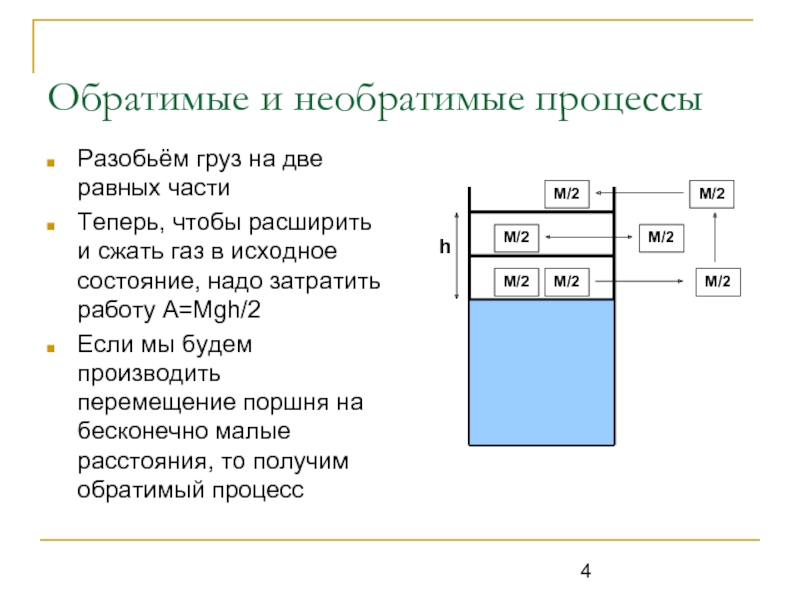
Разобьём груз на две равных части
Теперь, чтобы расширить
и сжать газ в исходное состояние, надо затратить работу A=Mgh/2
Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс
Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс
Слайд 5Обратимые и необратимые процессы
Пример равновесного необратимого процесса – теплообмен
Компенсацией за осуществление
необратимых круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии
Тепловая энергия оказывается менее ценным видом энергии, чем другие
Тепловая энергия оказывается менее ценным видом энергии, чем другие
Слайд 6Второе начало термодинамики
Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно
постулирует направление протекания тепловых процессов
Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому
Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому
Слайд 7Второе начало термодинамики
Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было
бы совершение работы за счёт охлаждения теплового резервуара
Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода
Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода
Слайд 8Второе начало термодинамики
Второе начало Т.Д. накладывает запрет на вечный двигатель второго
рода
Из второго начала Т.Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций
Из второго начала Т.Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций
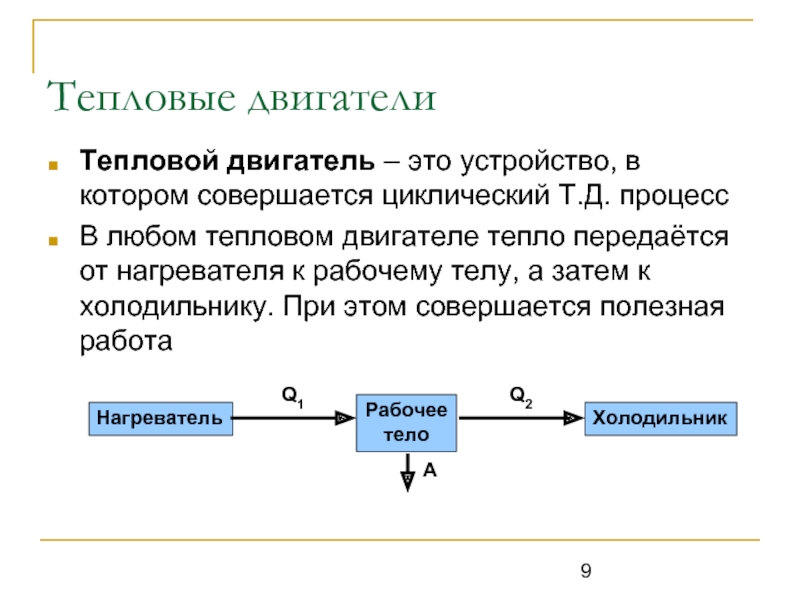
Слайд 9Тепловые двигатели
Тепловой двигатель – это устройство, в котором совершается циклический Т.Д.
процесс
В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа
В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа
Слайд 11Метод циклов
В циклическом процессе ΔU=0 → Q=A=Q1-Q2
При переходе 1→2 работа совершается
системой, а при переходе 2→1 над системой
При переходе 1'→2‘ тепло передаётся системе, а при переходе 2'→1' от системы
КПД теплового двигателя η=A/Q1=(Q1-Q2)/Q1
При переходе 1'→2‘ тепло передаётся системе, а при переходе 2'→1' от системы
КПД теплового двигателя η=A/Q1=(Q1-Q2)/Q1
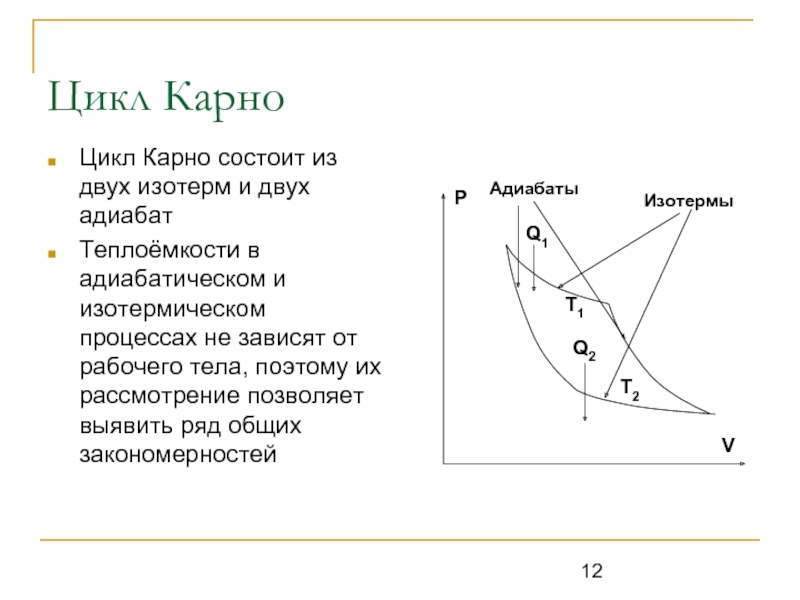
Слайд 12Цикл Карно
Цикл Карно состоит из двух изотерм и двух адиабат
Теплоёмкости в
адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей
Слайд 13Цикл Карно
Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по
циклу Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела
Слайд 14Цикл Карно
Для идеального газа:
Q1=RT1ln(V2/V1)
Q2=RT2ln(V4/V3)
A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4)
η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1)
Из уравнения адиабаты:
TVγ-1=const
Слайд 15Цикл Карно
T1V1γ-1= T2V4γ-1 и T1V2γ-1= T2V3γ-1 →
V2/V1=V3/V4 →
η=(T1-T2)/T1=1-T2/T1
Для повышения КПД
надо повышать температуру нагревателя и понижать температуру холодильника
η=(Q1-Q2)Q1=(T1-T2)/T1 →
Q1/T1=Q2/T2
Величина Q/T называется приведённой теплотой
η=(Q1-Q2)Q1=(T1-T2)/T1 →
Q1/T1=Q2/T2
Величина Q/T называется приведённой теплотой
Слайд 16Цикл Карно
Вторая теорема Карно: КПД любого цикла не может быть больше,
чем КПД цикла Карно - η=1-Т2/Т1, где под Т1 понимается максимальная, а под Т2 минимальная температура
Слайд 17Энтропия
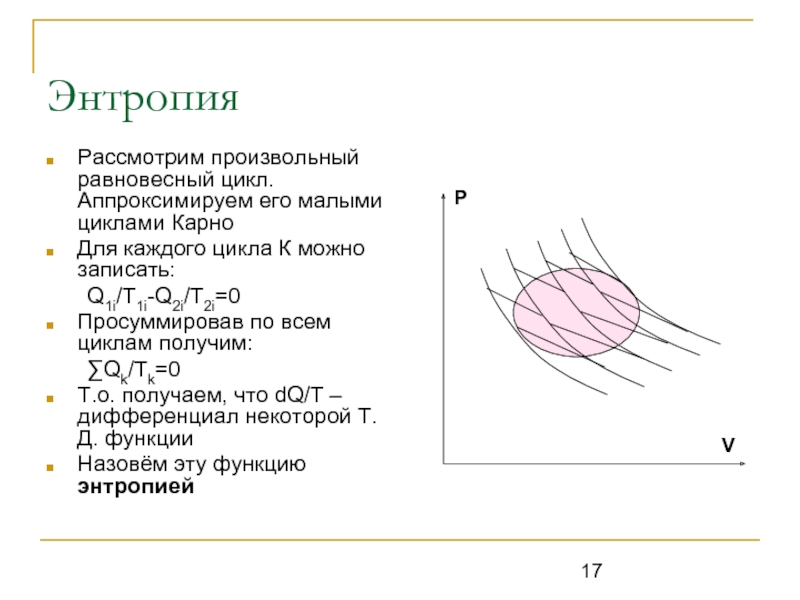
Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно
Для каждого цикла
К можно записать:
Q1i/T1i-Q2i/T2i=0
Просуммировав по всем циклам получим:
∑Qk/Tk=0
Т.о. получаем, что dQ/T – дифференциал некоторой Т.Д. функции
Назовём эту функцию энтропией
Q1i/T1i-Q2i/T2i=0
Просуммировав по всем циклам получим:
∑Qk/Tk=0
Т.о. получаем, что dQ/T – дифференциал некоторой Т.Д. функции
Назовём эту функцию энтропией
Слайд 18Энтропия
Энтропия – это такая функция состояния, дифференциал которой связан с элементарным
тепловым эффектом в обратимом процессе соотношением:
dQ=TdS (∗)
Энтропия S имеет размерность теплоёмкости
С учётом (∗) первое начало Т.Д. можно выразить как:
TdS=dU+PdV
Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т.Д. параметров
dQ=TdS (∗)
Энтропия S имеет размерность теплоёмкости
С учётом (∗) первое начало Т.Д. можно выразить как:
TdS=dU+PdV
Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т.Д. параметров
Слайд 19Энтропия
Найдём энтропию идеального газа
Из dU=cVdT и P/T=R/V следует что:
dS=cVdT/T+RdV/V → S(T,V)=cVlnT+RlnV
при
cV=const
Можно S выразить через T и P:
S(T,P)=cPlnT-RlnP
Можно S выразить через T и P:
S(T,P)=cPlnT-RlnP
Слайд 20Энтропия
Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл
∫dQ/T может расходиться
Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики
Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики
Слайд 21Постулат Нернста
Постулат Нернста сводится к двум утверждениям:
При приближении к абсолютному нулю
энтропия стремится к определённому конечному пределу. Можно положить S(Т=0)=0
Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма
Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма
Слайд 22Статистическая интерпретация энтропии
Вероятность состояния пропорциональна его статистическому весу Ω, т.е. числу
микроскопических способов, которым может быть осуществлено данное макросостояние
Разобьём некоторую Т.Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω1 и Ω2
Число способов, которыми может реализоваться данное состояние системы:
Ω=Ω1⋅Ω2
Разобьём некоторую Т.Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω1 и Ω2
Число способов, которыми может реализоваться данное состояние системы:
Ω=Ω1⋅Ω2
Слайд 23Статистическая интерпретация энтропии
Т.о. логарифм стат. веса является аддитивной функцией состояния системы:
lnΩ=lnΩ1+lnΩ2
Энтропия
системы:
S=k⋅lnΩ (∗∗)
где k – постоянная Больцмана
Формула (∗∗) называется формулой Больцмана
S=k⋅lnΩ (∗∗)
где k – постоянная Больцмана
Формула (∗∗) называется формулой Больцмана
Слайд 24Статистическая интерпретация энтропии
Т.к. равновесным состоянием является состояние с наибольшим стат. весом
(и наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает
Энтропия системы, находящейся в равновесном состоянии, максимальна
Энтропия системы, находящейся в равновесном состоянии, максимальна
Слайд 25Статистическая интерпретация энтропии
При протекании обратимых процессов энтропия изолированной системы остаётся постоянной
Энтропия
равновесной системы не остаётся строго постоянной она претерпевает флуктуации
Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной:
ΔS≥0
Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной:
ΔS≥0









![Цикл КарноДля идеального газа: Q1=RT1ln(V2/V1) Q2=RT2ln(V4/V3) A=Q1-Q2=RT1ln(V2/V1)-RT2ln(V3/V4) η=A/Q1=[RT1ln(V2/V1)-RT2ln(V3/V4)]/RT1ln(V2/V1)Из уравнения адиабаты: TVγ-1=const](/img/tmb/1/19627/7be966bfb2b92dee4bb9e3249562d704-800x.jpg)