- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Көлденең - жолақты бұлшықеттердің ультрақұрылымы презентация
Содержание
- 1. Көлденең - жолақты бұлшықеттердің ультрақұрылымы
- 2. 11 желтоқсан, 2015 жыл Оқыту мақсаты:
- 3. 11 желтоқсан, 2015 жыл ЖЕТІСТІК
- 4. 11 желтоқсан, 2015 жыл Жиырылғыштық қасиетiне
- 5. 11 желтоқсан, 2015 жыл
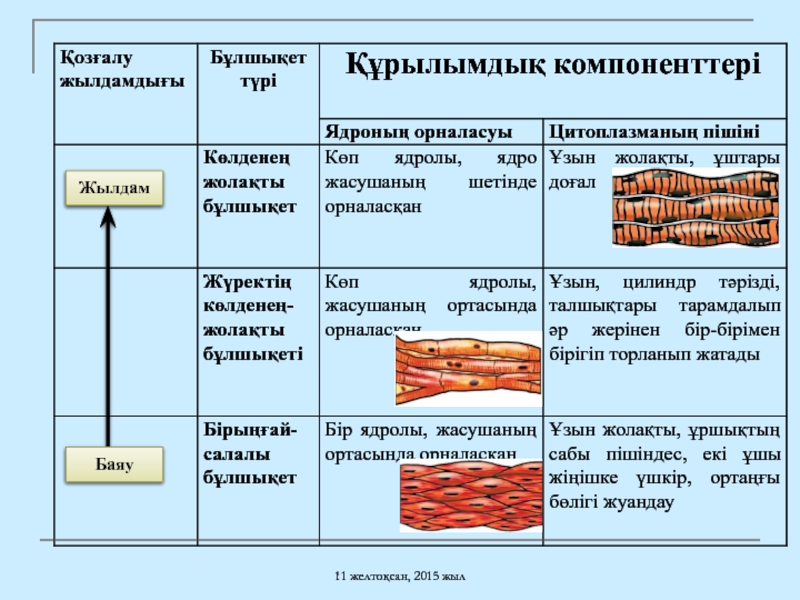
- 6. 11 желтоқсан, 2015 жыл Жылдам Баяу
- 7. 11 желтоқсан, 2015 жыл Көлденең жолақты бұлшықет
- 8. 11 желтоқсан, 2015 жыл Бұлшықет талшығы
- 9. 11 желтоқсан, 2015 жыл Микроскопиялық құрылымы
- 10. Саркомера Миофибрилланың негізгі құрылымдық бірлігі 11 желтоқсан,
- 11. 11 желтоқсан, 2015 жыл H зонасы Саркомердің
- 12. 11 желтоқсан, 2015 жыл Титин – миозинді
- 13. 11 желтоқсан, 2015 жыл МИОЗИН - бұлшықет
- 14. 11 желтоқсан, 2015 жыл АТФ (АҮФ) БАРЛЫҚ
- 15. 11 желтоқсан, 2015 жыл Қаңқа бұлшықетінің жиырылуы
- 16. 11 желтоқсан, 2015 жыл Уақыт, мс 1
- 17. 11 желтоқсан, 2015 жыл 2. Т –
- 18. 11 желтоқсан, 2015 жыл В. Хемомеханикалық өзгеріс:
- 19. 11 желтоқсан, 2015 жыл
- 20. 11 желтоқсан, 2015 жыл Жиырылу айналымы 4
- 21. 11 желтоқсан, 2015 жыл Актин мен миозиннің
- 22. 11 желтоқсан, 2015 жыл Кальций иондарымен қосылу
- 23. 11 желтоқсан, 2015 жыл Жиырылу үрдісі аяқталысымен
- 24. 11 желтоқсан, 2015 жыл
- 25. 11 желтоқсан, 2015 жыл
- 26. Қалыптастырушы бағалау 11 желтоқсан, 2015 жыл Саркомердің
- 27. 11 желтоқсан, 2015 жыл
- 28. 11 желтоқсан, 2015 жыл Тез жиырылатын бұлшықеттер
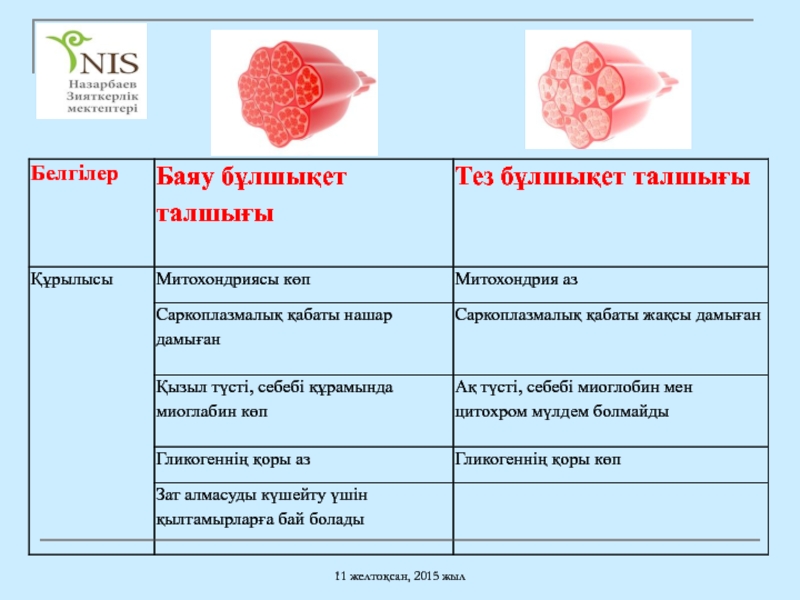
- 29. 11 желтоқсан, 2015 жыл Бұлшықет талшықтарының құрылысы
- 30. 11 желтоқсан, 2015 жыл
- 31. 11 желтоқсан, 2015 жыл
- 32. 11 желтоқсан, 2015 жыл
- 33. 11 желтоқсан, 2015 жыл Динамикалық жұмыстар
- 34. 11 желтоқсан, 2015 жыл Баяу бұлшықет талшығының қызметі
- 35. 11 желтоқсан, 2015 жыл Тез бұлшықет талшығының қызметі
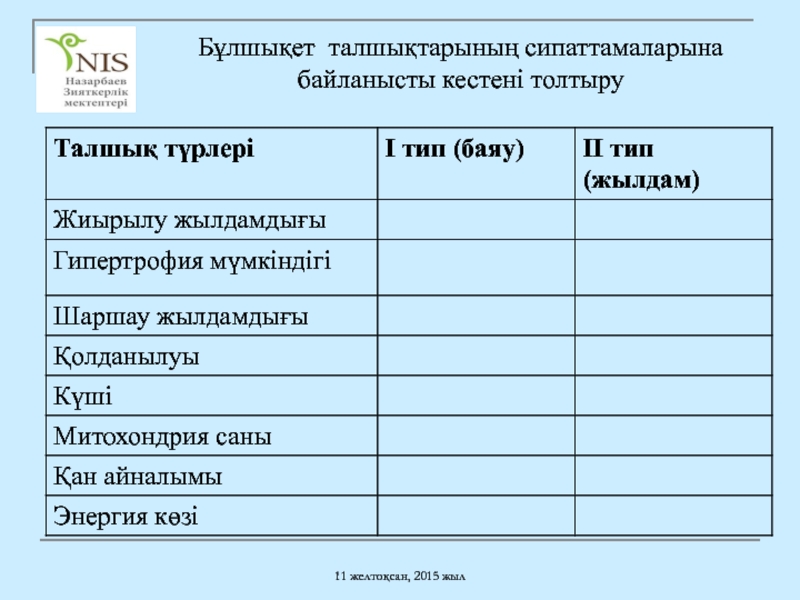
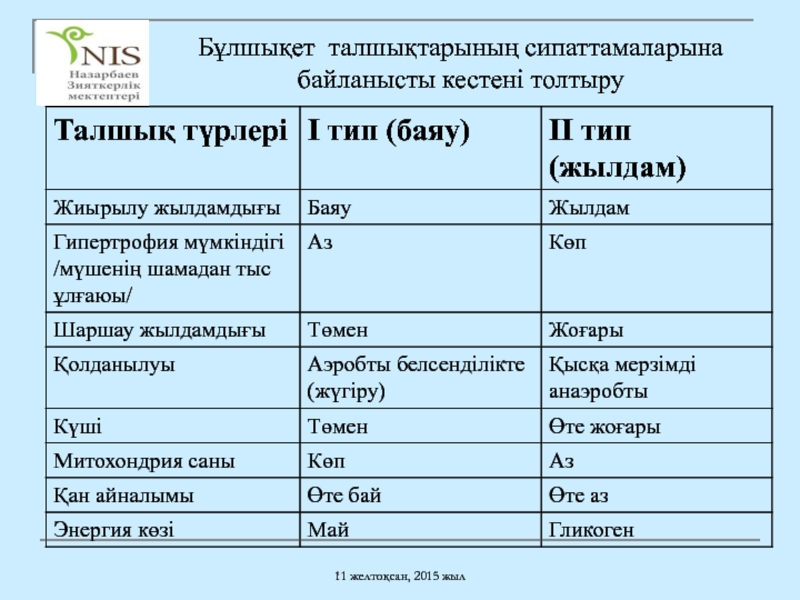
- 36. 11 желтоқсан, 2015 жыл Бұлшықет талшықтарының сипаттамаларына байланысты кестені толтыру
- 37. 11 желтоқсан, 2015 жыл Бұлшықет талшықтарының сипаттамаларына байланысты кестені толтыру
- 38. Рефлексия Нысана 5 – өте жоғары
- 39. 11 желтоқсан, 2015 жыл Пайдаланылған әдебиеттер тізімі
Слайд 111 желтоқсан, 2015 жыл
11.2С. Өсу, даму және қозғалыс
Көлденең жолақты бұлшықеттердің ультрақұрылымы
Жылдам
Слайд 211 желтоқсан, 2015 жыл
Оқыту мақсаты:
Көлденең -жолақты бұлшықеттердің ультрақұрылымын зерттеу;
Жылдам және баяу
Слайд 3
11 желтоқсан, 2015 жыл
ЖЕТІСТІК КРИТЕРИЙІ
Тез және баяу жиырылатын бұлшықеттерді бұлшықет
Көлденең жолақты бұлшықеттің ультрақұрылымын диаграммада сызып көрсетеді және құрылымдық бөліктерін жазып береді.
Слайд 4
11 желтоқсан, 2015 жыл
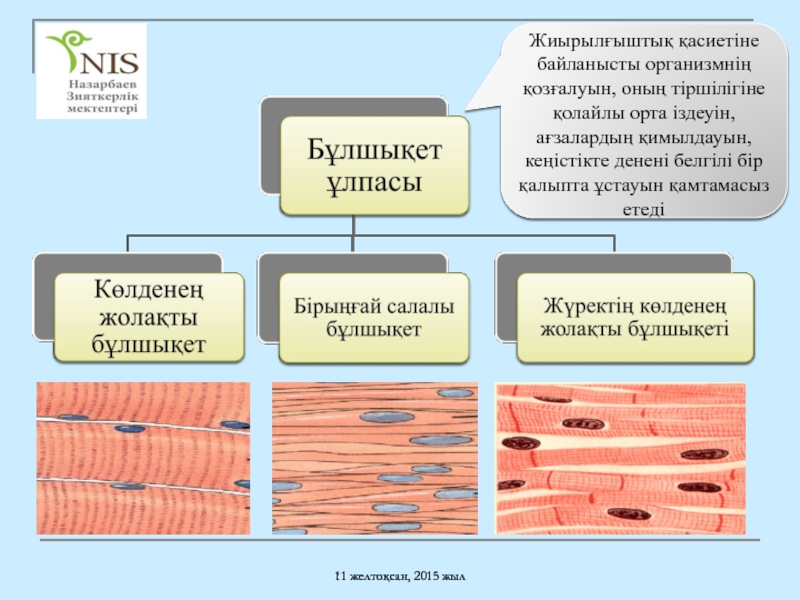
Жиырылғыштық қасиетiне байланысты организмнiң қозғалуын, оның тiршiлiгіне қолайлы
Слайд 5
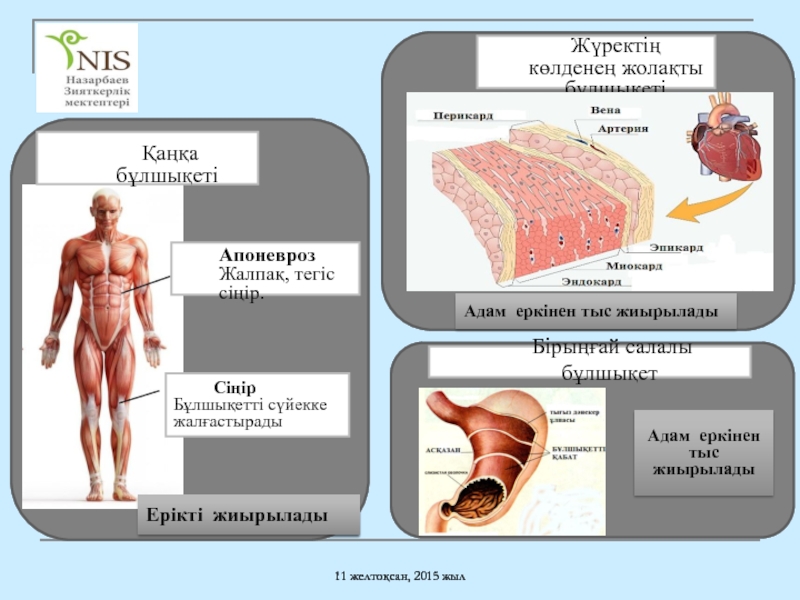
11 желтоқсан, 2015 жыл
Апоневроз
Жалпақ, тегіс сіңір.
Сіңір
Бұлшықетті сүйекке жалғастырады
Жүректің көлденең жолақты бұлшықеті
Бірыңғай салалы бұлшықет
Ерікті жиырылады
Адам еркінен тыс жиырылады
Адам еркінен тыс жиырылады
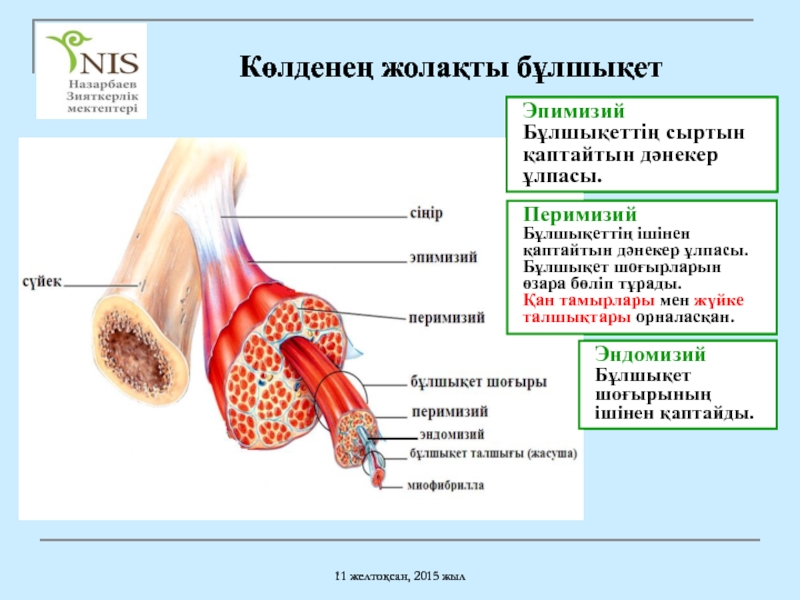
Слайд 711 желтоқсан, 2015 жыл
Көлденең жолақты бұлшықет
Эпимизий
Бұлшықеттің сыртын қаптайтын дәнекер
Перимизий
Бұлшықеттің ішінен қаптайтын дәнекер ұлпасы. Бұлшықет шоғырларын өзара бөліп тұрады.
Қан тамырлары мен жүйке талшықтары орналасқан.
Эндомизий
Бұлшықет шоғырының ішінен қаптайды.
Слайд 811 желтоқсан, 2015 жыл
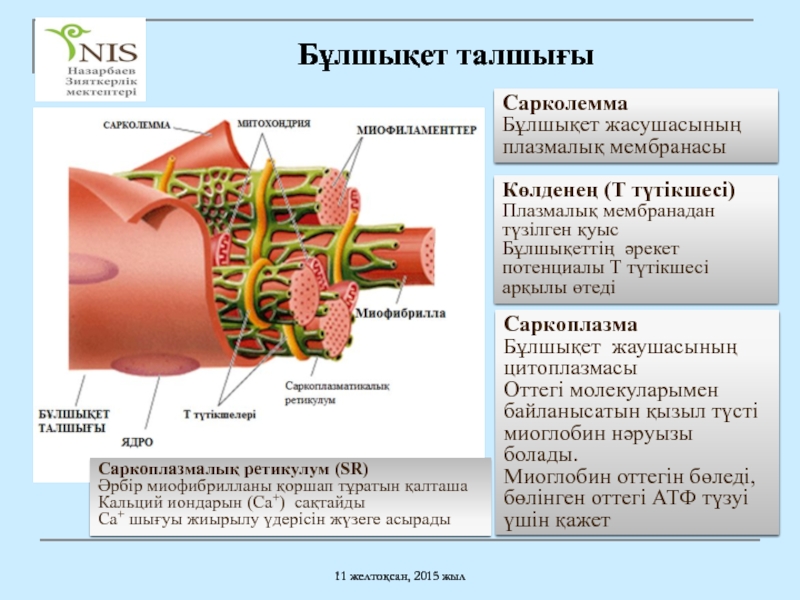
Бұлшықет талшығы
Сарколемма
Бұлшықет жасушасының плазмалық мембранасы
Көлденең (T
Плазмалық мембранадан түзілген қуыс
Бұлшықеттің әрекет потенциалы Т түтікшесі арқылы өтеді
Саркоплазма
Бұлшықет жаушасының цитоплазмасы
Оттегі молекуларымен байланысатын қызыл түсті миоглобин нәруызы болады.
Миоглобин оттегін бөледі, бөлінген оттегі АТФ түзуі үшін қажет
Саркоплазмалық ретикулум (SR)
Әрбір миофибрилланы қоршап тұратын қалташа
Кальций иондарын (Ca+) сақтайды
Ca+ шығуы жиырылу үдерісін жүзеге асырады
Слайд 911 желтоқсан, 2015 жыл
Микроскопиялық құрылымы
Адам дүниеге келмей тұрып бұлшықет талшықтарының
Өмірдің соңына дейін олардың саны сақталады
Бұлшықеттің өсуі қарқынды жүреді
Бұлшықет талшықтарының ауқымы үлкейеді
Тестостерон және өсу гормондары басқарды
Зақымдалған бұлшықет талшықтарын серіктес жасушаларының регенерациялану қабілетін сақтайды
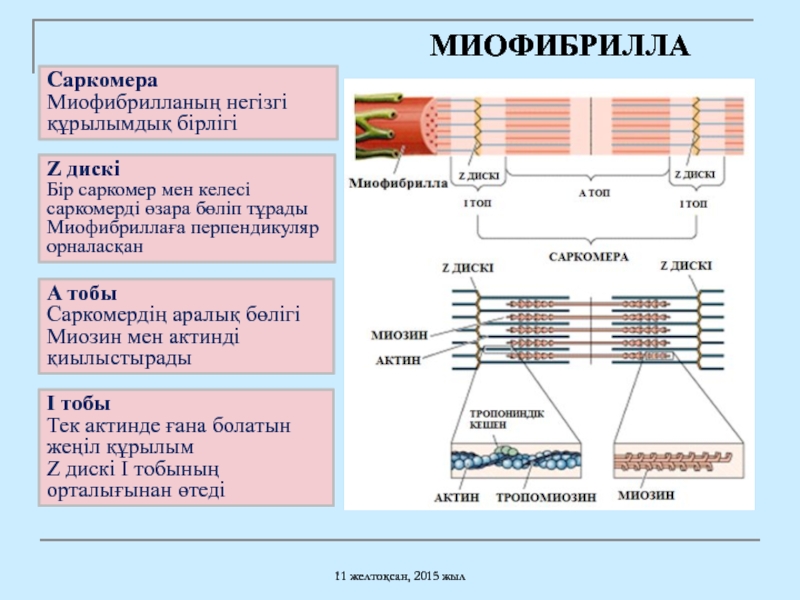
Слайд 10Саркомера
Миофибрилланың негізгі құрылымдық бірлігі
11 желтоқсан, 2015 жыл
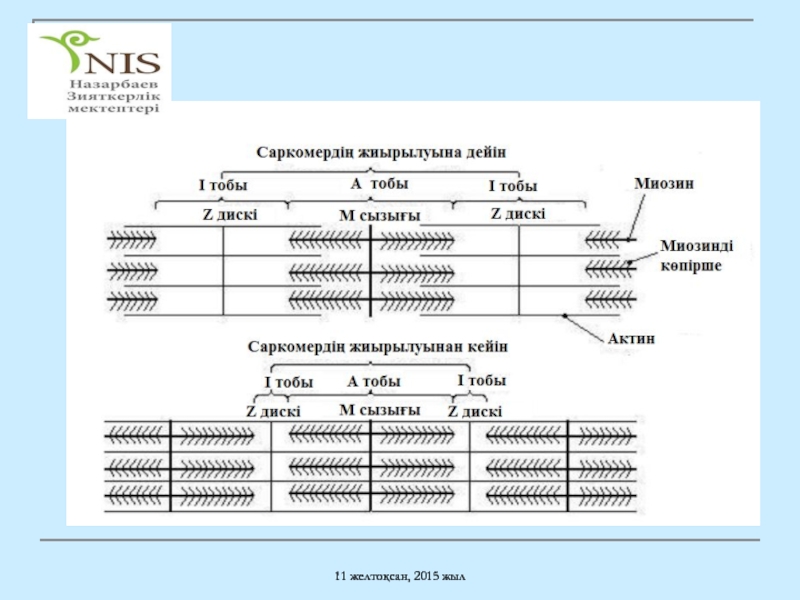
Z дискі
Бір саркомер мен келесі
Миофибриллаға перпендикуляр орналасқан
МИОФИБРИЛЛА
A тобы
Саркомердің аралық бөлігі
Миозин мен актинді қиылыстырады
I тобы
Тек актинде ғана болатын жеңіл құрылым
Z дискі І тобының орталығынан өтеді
Слайд 1111 желтоқсан, 2015 жыл
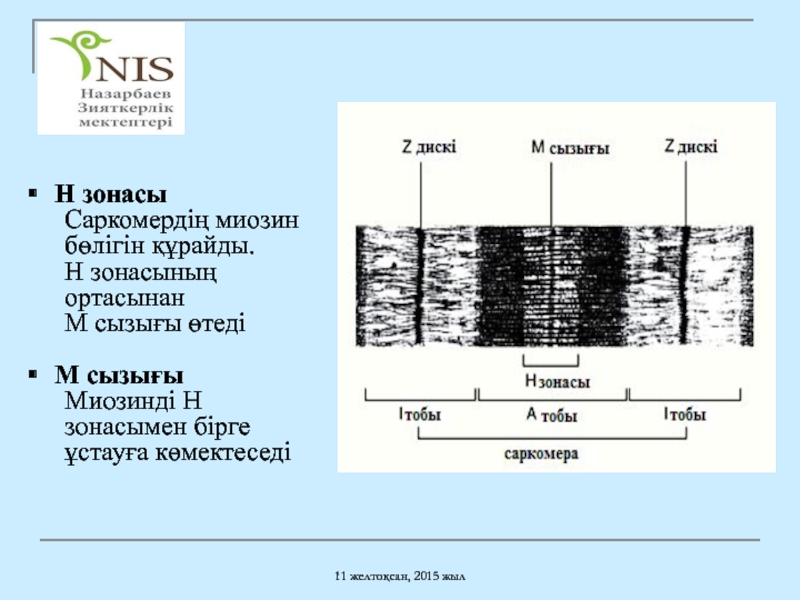
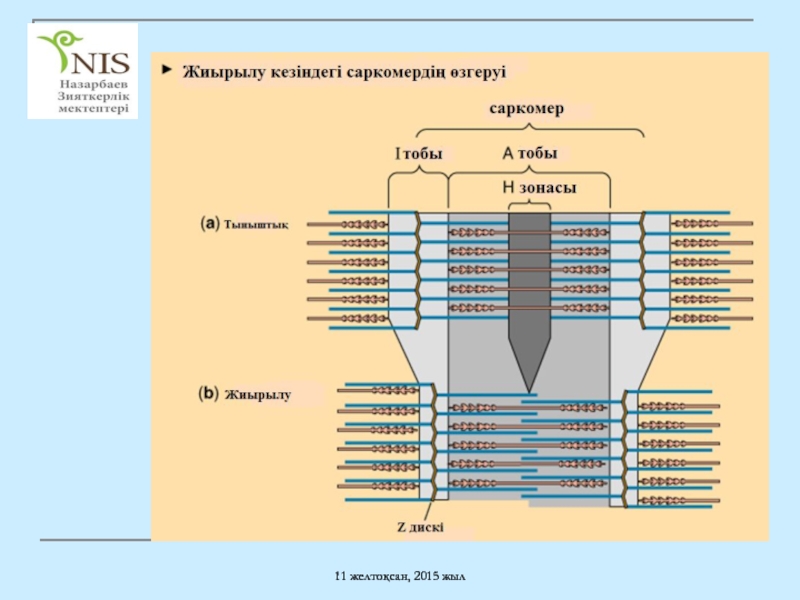
H зонасы
Саркомердің миозин бөлігін құрайды.
Н зонасының ортасынан
М сызығы өтеді
M сызығы
Миозинді Н зонасымен бірге ұстауға көмектеседі
Слайд 1211 желтоқсан, 2015 жыл
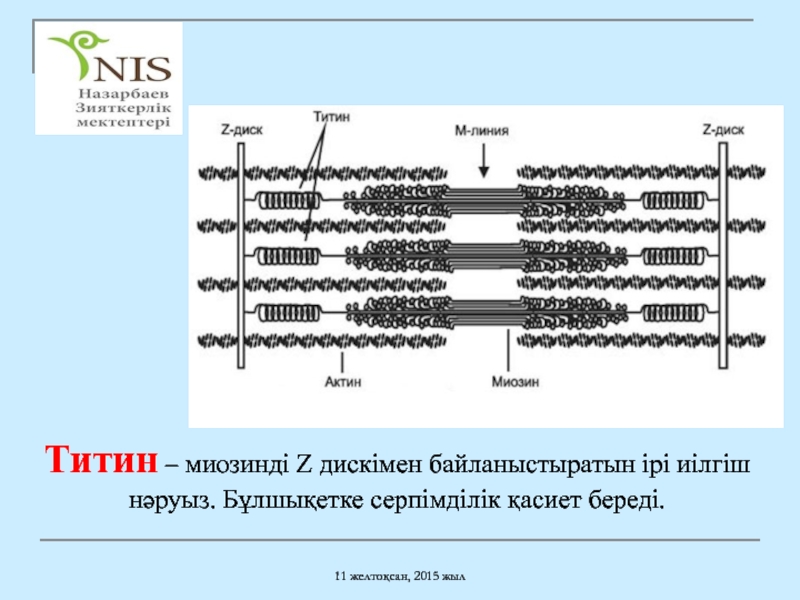
Титин – миозинді Z дискімен байланыстыратын ірі иілгіш
Слайд 1311 желтоқсан, 2015 жыл
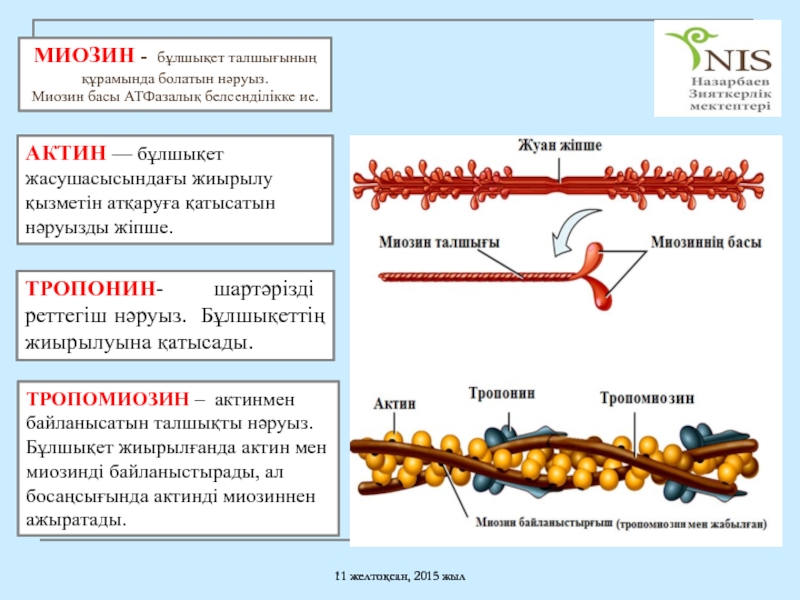
МИОЗИН - бұлшықет талшығының құрамында болатын нәруыз.
Миозин
АКТИН — бұлшықет жасушасысындағы жиырылу қызметін атқаруға қатысатын нәруызды жіпше.
ТРОПОНИН- шартәрізді реттегіш нәруыз. Бұлшықеттің жиырылуына қатысады.
ТРОПОМИОЗИН – актинмен байланысатын талшықты нәруыз. Бұлшықет жиырылғанда актин мен миозинді байланыстырады, ал босаңсығында актинді миозиннен ажыратады.
Слайд 1411 желтоқсан, 2015 жыл
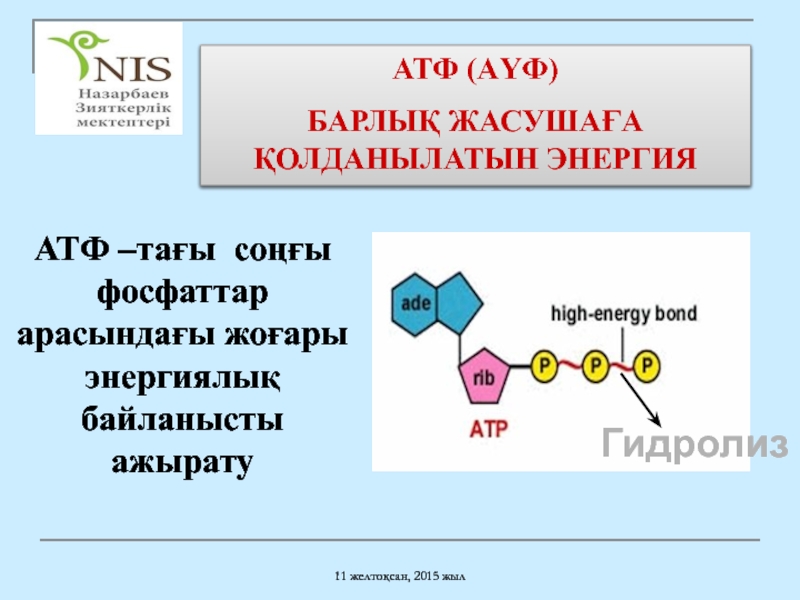
АТФ (АҮФ)
БАРЛЫҚ ЖАСУШАҒА ҚОЛДАНЫЛАТЫН ЭНЕРГИЯ
АТФ –тағы соңғы фосфаттар
Гидролиз
Слайд 1511 желтоқсан, 2015 жыл
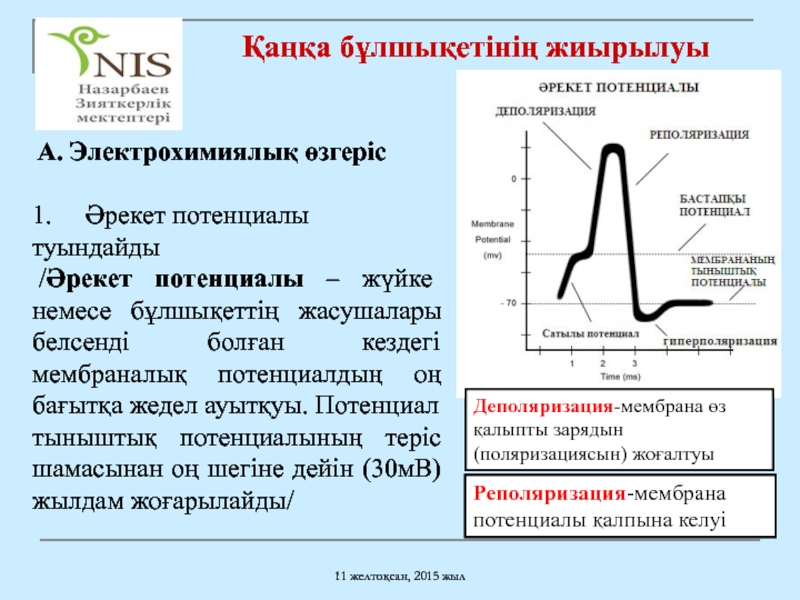
Қаңқа бұлшықетінің жиырылуы
А. Электрохимиялық өзгеріс
1. Әрекет потенциалы туындайды
/Әрекет потенциалы – жүйке немесе бұлшықеттің жасушалары белсенді болған кездегі мембраналық потенциалдың оң бағытқа жедел ауытқуы. Потенциал тыныштық потенциалының теріс шамасынан оң шегіне дейін (30мВ) жылдам жоғарылайды/
Деполяризация-мембрана өз қалыпты зарядын (поляризациясын) жоғалтуы
Реполяризация-мембрана потенциалы қалпына келуі
Слайд 1611 желтоқсан, 2015 жыл
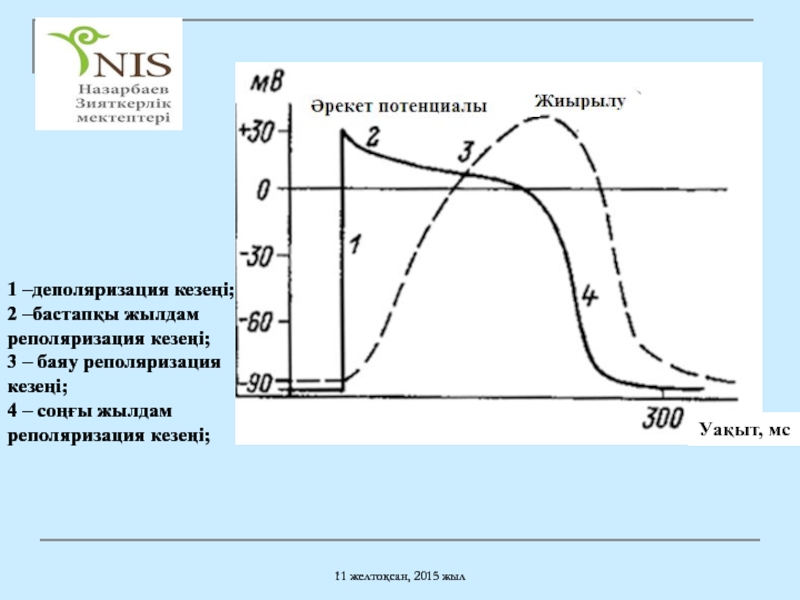
Уақыт, мс
1 –деполяризация кезеңі;
2 –бастапқы жылдам реполяризация
3 – баяу реполяризация кезеңі; 4 – соңғы жылдам реполяризация кезеңі;
Слайд 1711 желтоқсан, 2015 жыл
2. Т – түтікшесі арқылы әрекет потенциалы таралады
3. Т –түтікшесі мен саркоплазмалық тордың байланыс аймағы электрлі реттеледі,
ферменттер белсендіріледі,
Са2+ иондарының жасушаішілік концентрациясы артады.
Слайд 1811 желтоқсан, 2015 жыл
В. Хемомеханикалық өзгеріс:
4. Са2+ иондарының тропонинмен әрекеттесіп, актин
5. Актинмен миозин өскіндерінің басы байланысады, өскін басы айналады және серпімді күш тудырады
6. Актин мен миозин жіпшелері біршама өзара сырғанауынан саркомердің көлемі кемиді. Бұлшықет талшықтары қысқарады.
Слайд 1911 желтоқсан, 2015 жыл
Бұлшық ет қозған кезде актин
Слайд 2011 желтоқсан, 2015 жыл
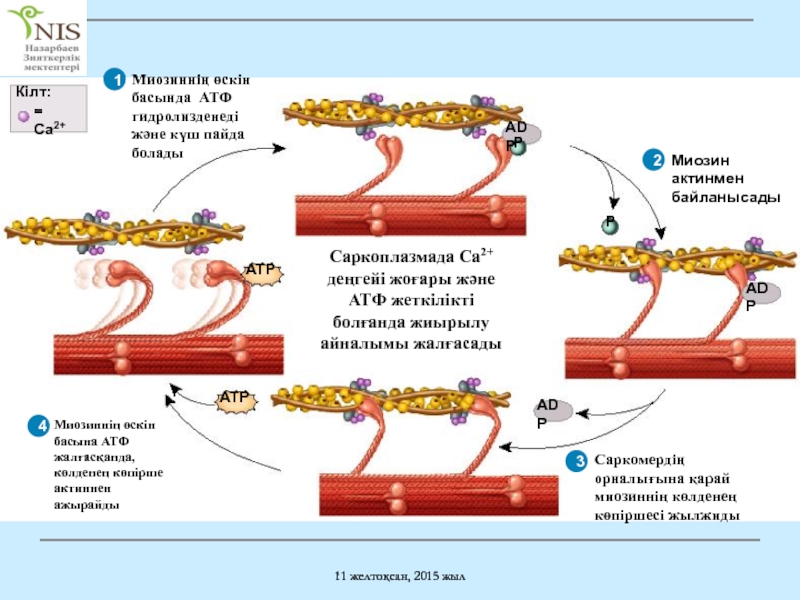
Жиырылу айналымы 4 сатыдан құралады
1) АТФ гидролизі
Миозин басында
2) Көлденең көпіршенің қалыптасуы
Актиннің миозин байланыстырғыш сайтына миозиннің басы жалғасады
3) Қоректену жолы
Жұмыс уақытында сырғанақ жіпке айналады
4) Миозиннен актиннің алшақтауы
АТФ миозиннің келесі басымен байланысқа түскенде актин миозиннен ажыратылады
Айналым кальций иондарының жеткілікті болғанына дейін қайталанады
Айналым қайталануы кезінде саркомер жиырылады
Слайд 2111 желтоқсан, 2015 жыл
Актин мен миозиннің өзара әрекеттесуі саркоплазмалық торда сақталатын
Кальций иондарының актин мен миозиннің өзара әрекеттесуіне әсері актин жіпшелерінің құрамына енетін ТРОПОМИОЗИН мен ТРОПОНИНДІК КЕШЕН арқылы жүреді. Алдымен әрекет потенциалы ықпалымен саркоплазмалық тордан кальций иондары шығып, олар тропонин нәруызымен қосылады да, тропониндік кешен пайда болады.
Слайд 2211 желтоқсан, 2015 жыл
Кальций иондарымен қосылу нәтижесінде тропониннің пішіні өзгеріп, тропомиозинді
Миозиннің көлденең өскіндерінің БАСЫНДА АТФ-АЗА ФЕРМЕНТІНІҢ катализдік белсенді орталығы орналасады. Өскін басы актин жіпшелеріне бекіген кезде магний иондарының қатысуымен АТФ-аза активтеніп, АТФ-ті ыдыратады. Бұл үрдістерде бөлінген энергия бұлшықет талшықтарын жиырылту үшін пайдаланылады.
Слайд 2311 желтоқсан, 2015 жыл
Жиырылу үрдісі аяқталысымен АТФ энергиясы арқылы кальций иондары
Слайд 26Қалыптастырушы бағалау
11 желтоқсан, 2015 жыл
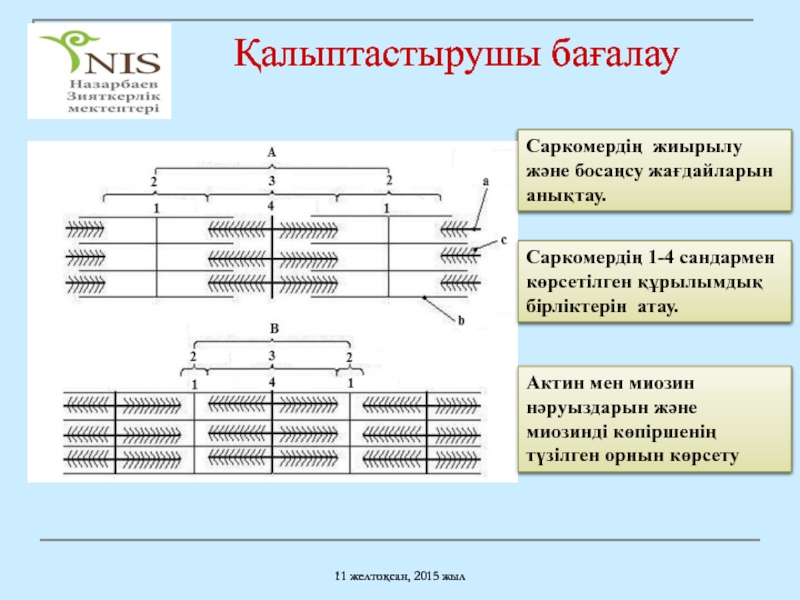
Саркомердің жиырылу және босаңсу жағдайларын анықтау.
Саркомердің
Актин мен миозин нәруыздарын және миозинді көпіршенің түзілген орнын көрсету
Слайд 2811 желтоқсан, 2015 жыл
Тез жиырылатын бұлшықеттер
Баяу жиырылатын бұлшықеттер
Қаңқа бұлшықеті
Слайд 2911 желтоқсан, 2015 жыл
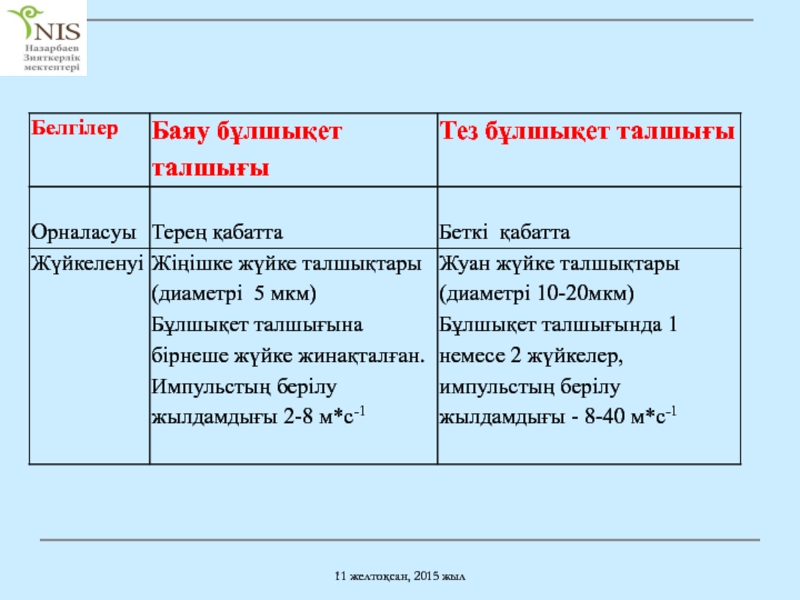
Бұлшықет талшықтарының құрылысы
Орналасуы
Жүйкеленуі
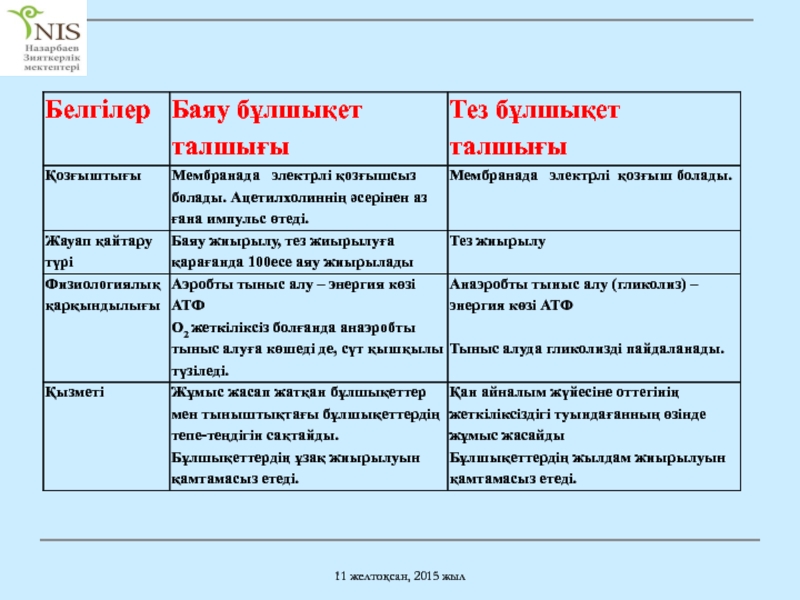
Қозғыштығы
Жауап қайтару түрі
Физиологиялық қарқындылығы
Қызметі
Тез және
Слайд 3311 желтоқсан, 2015 жыл
Динамикалық жұмыстар немесе аэробика
Ұзақ уақытта жүгіру, жүзу,
Жеңіл атлетика
Дене тұрысын ұстап тұру /арқа бұлшықеттері/
Жылуды түзеді
Миоглобин нәруызы көп болғандықтан глюкозаның оттегімен тотығуы кезінде энергия пайда болады
Баяу бұлшықет талшығының қызметі
Слайд 3911 желтоқсан, 2015 жыл
Пайдаланылған әдебиеттер тізімі
https://www.youtube.com/watch?v=jBJ-M4vBxkE
Биология. Тейлор Д., Грин Н.,
http://www.sportmassag.ru/1/page6174.html
http://anfiz.ru/ekzamen/item/f00/s00/z0000000/st005.shtml
http://www.bbc.co.uk/learningzone/clips/why-can-t-i-run-fast/13435.html
http://www.bbc.co.uk/science/humanbody/body/factfiles/fastandslowtwitch/soleus.shtml