- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов презентация
Содержание
- 1. Коррозия металлов
- 2. 1. Коррозия – это процесс самопроизвольного разрушения
- 3. Ущерб, наносимый коррозией Мировая потеря 20 млн.
- 4. Делийская железная колонна Эйфелева башня
- 5. Виды коррозии
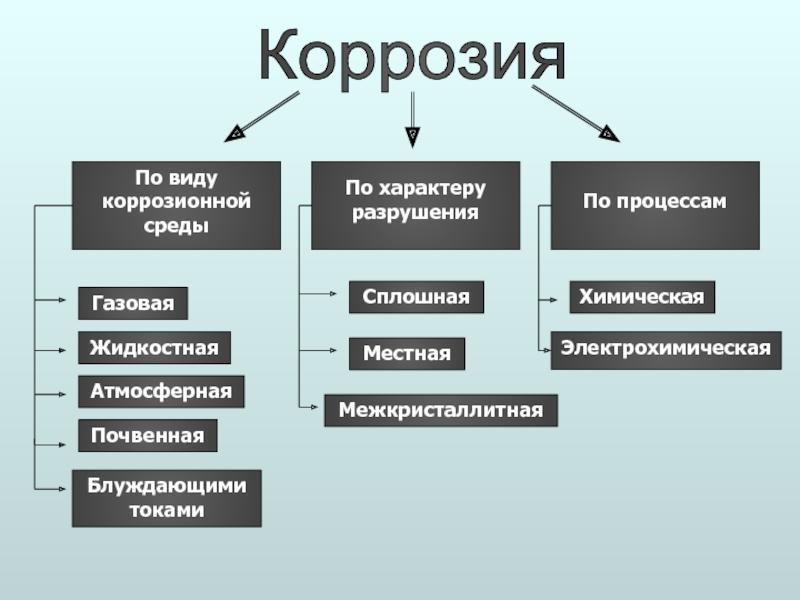
- 6. Коррозия По виду коррозионной среды
- 7. По виду коррозионной среды
- 8. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 9. По характеру разрушений
- 10. Сплошная коррозия Равномерная Неравномерная
- 11. Местная коррозия
- 12. Причины возникновения местной коррозии Соль на дорогах
- 13. По процессам
- 14. Химическая коррозия Химическая коррозия – самопроизвольное разрушение
- 15. Электрохимическая коррозия Электрохимическая коррозия металлов – самопроизвольный
- 16. Защита металлов от коррозии
- 17. Применение ингибиторов Ингибиторы - это вещества,
- 18. Нанесение защитных покрытий Пластмасса Краска Лак Грунтовка Смола Эмаль Масло
- 19. Покрытие антикоррозионным металлом Хромирование Никелирование Оцинковка
- 20. Позолота Покрытие антикоррозионным металлом Лужение Покрытие алюминием
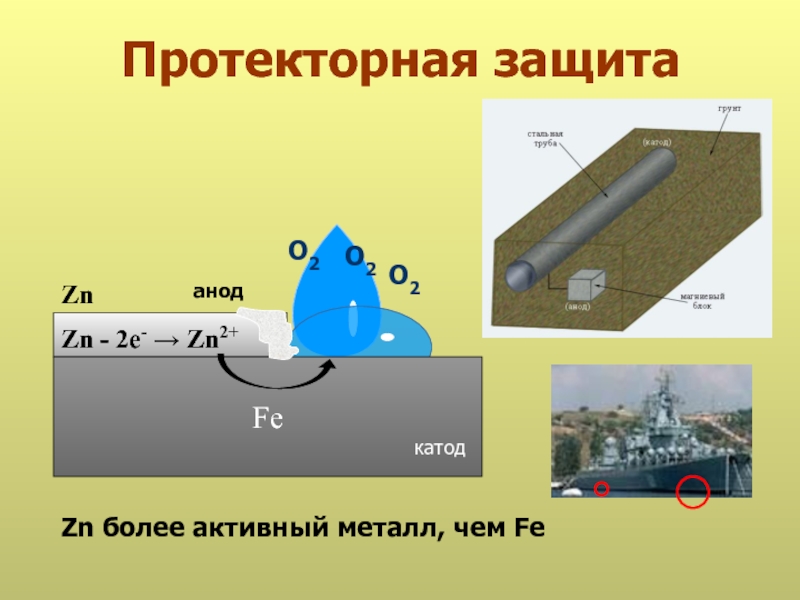
- 21. Протекторная защита анод Fe О2
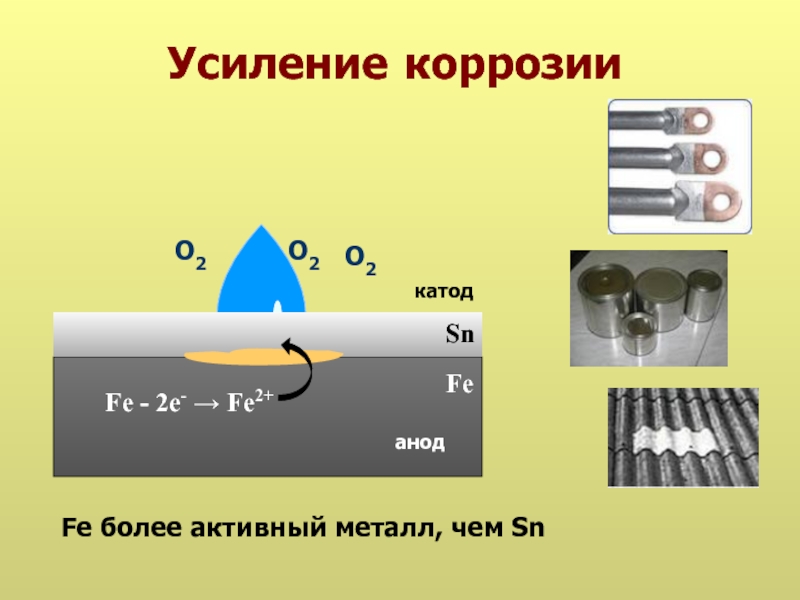
- 22. Усиление коррозии
- 23. Задача 1 Сантехника попросили поставить водопроводный кран,
- 24. Задача 2 Человек поставил на зуб золотую
Слайд 21. Коррозия – это процесс самопроизвольного разрушения металла под действием окружающей
2. Коррозия– это процесс перехода металла в то природное, естественное состояние, в котором
мы встречаем его в земной коре.
Слайд 3Ущерб, наносимый коррозией
Мировая потеря 20 млн. тонн металла в год
Еще более
Слайд 4Делийская
железная колонна
Эйфелева башня
Высота 7, 2 м, вес около
Возраст 1600 лет
Красили 18 раз,
отчего ее масса 9000 т
каждый раз увеличивалась
на 70 т (в сумме - 1260 т)
Слайд 6Коррозия
По виду
коррозионной среды
По характеру
разрушения
По процессам
Газовая
Жидкостная
Атмосферная
Почвенная
Сплошная
Местная
Химическая
Электрохимическая
Межкристаллитная
Блуждающими токами
Слайд 14Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металлов
в среде окислительного газа
повышенных температурах или в жидких не электролитах.
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
Газовая
В жидких
не электролитах
В нефти
В сере
В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
Слайд 15Электрохимическая коррозия
Электрохимическая коррозия металлов – самопроизвольный
процесс разрушения металлов в среде
2Fe + O2 + 2H2O = 2Fe(OH)2
Me – ne = Me +n
Fe - 2е- → Fe2+
О2
О2
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
О2
Слайд 17Применение ингибиторов
Ингибиторы - это вещества,
способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
Слайд 23Задача 1
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии
Слайд 24Задача 2
Человек поставил на зуб золотую коронку, по истечении
некоторого времени
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?