«Химия идет к своей цели, к своему совершенствованию. Мы не знаем каков будет предел ее успехов. Мы не можем утверждать, что то, что сегодня признается простым, действительно простое.»
Антуан Лоран Лавуазье. 1787г.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные соединения презентация
Содержание
- 1. Комплексные соединения
- 2. Комплексы – жизнь в
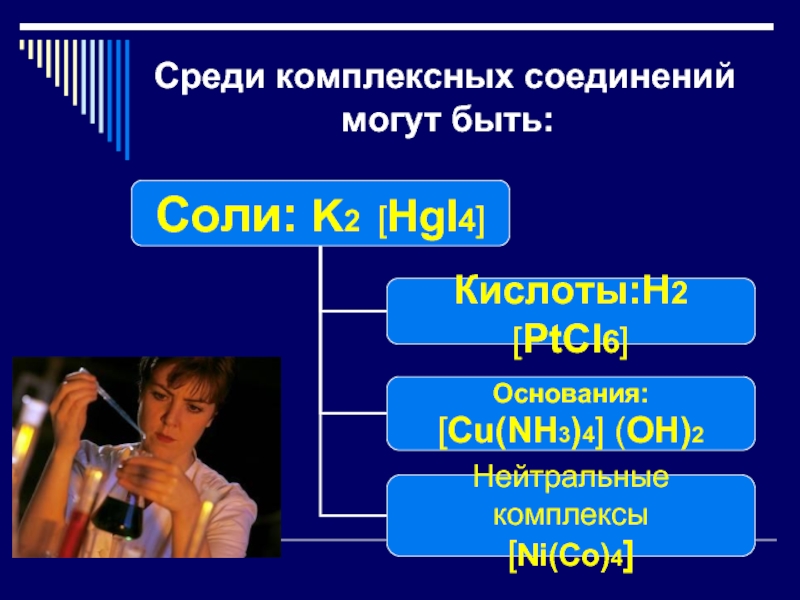
- 3. Среди комплексных соединений
- 4. Комплексные соединения
- 5. Комплексы часто имеют
- 6. Строение комплексов
- 7. Составление формул
- 8. Комплексо-
- 9. Составьте формулы веществ: Комплексообразователь -
- 10. Номенклатура [Cu(NH3)4] SO4
- 11. Назовите вещества K2
- 12. Качественные реакции на
- 14. Получение комплексных
- 15. Явление необычное,
- 16. Секрет Якоба Вайца.
- 17. Делаем выводы: Комплексное соединение – сложное вещество,
- 18. Упражнения
- 19. Спасибо за работу!
Слайд 1 Комплексные соединения
Слайд 2 Комплексы – жизнь в
квадратных скобках
Ваша
Понять, что это за вещества и как они образуются.
Зачем изучать комплексные соединения?
Эти сложные вещества чрезвычайно распространены в природе и часто встречаются в химической практике. Их значительно больше, чем всех остальных неорганических веществ.
Слайд 4Комплексные соединения
используются:
в качестве катализаторов при
для связывания атмосферного азота;
при производстве синтетических моющих средств;
для борьбы с коррозией металлов;
для получения лаков, красок.
Слайд 5Комплексы часто имеют
яркую окраску
хлорофилл в зеленых растениях – это тоже комплексные соединения.
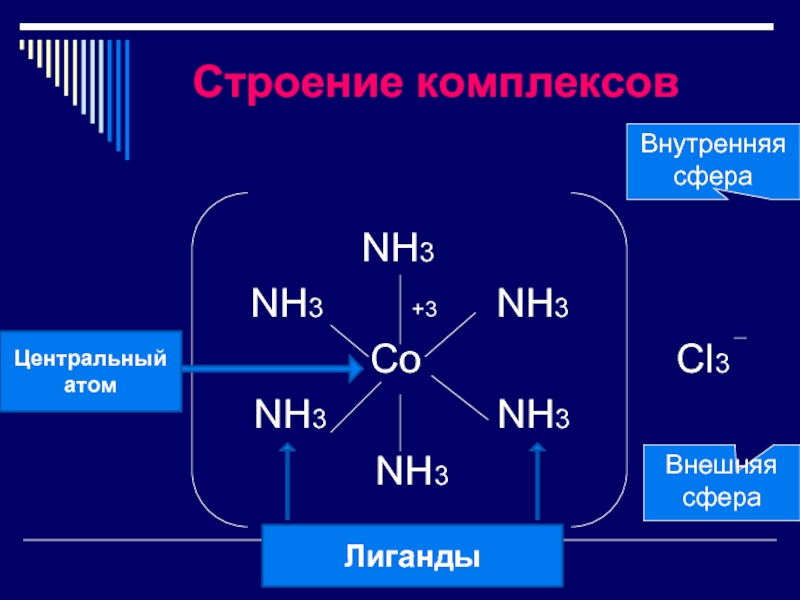
Слайд 6 Строение комплексов
NH3 +3 NH3
Co Cl3
NH3 NH3
NH3
Внутренняя сфера
Внешняя сфера
Лиганды
Центральный
атом
Слайд 7 Составление формул
Центральный атом - комплексообразователь
Лиганды – молекулы или ионы соединенные с комплексообразователем.
Координационное число – общее число лигандов, соединенных с комплексообразователем
Слайд 8 Комплексо-
Ag+1 Cu+1 к.ч. – 2
Cu+2 Zn+2 к.ч. - 4
Fe+2 Fe+3 Al+3
Co+3 к.ч. - 6
Лиганды
Н2О - аква
NH3 - амино
Cl - хлоро
CN - циано
OH - гидроксо
Слайд 9Составьте формулы веществ:
Комплексообразователь - Fe
Его заряд - +2 +3
Координационное число - 6 6 (4+2)
Лиганд - CN (-) NH3,
Cl (-)
внешняя сфера - К (+) Cl (-)
Определите заряд внутренней сферы.
Слайд 10 Номенклатура
[Cu(NH3)4] SO4
Сульфат тетраамин
меди
Анион
Лиганд
Комплексо-образователь
Валентность
K4 [Fe(CN)6]
Гексацианоферрат (II)
калия
Лиганд
Комплексо-образователь
Валентность
Катион
Слайд 12 Качественные реакции на
катионы железа
3FeCl2 + 2K3 Fe(CN)6 = Fe3 Fe(CN)6 2 + 6KCl
красная кровяная турнбуллева синь
соль
Слайд 13
4FeCl3 + 3K4 Fe(CN)6 = Fe4 Fe(CN)6 3↓ + 12KCl
желтая кровяная берлинская лазурь
соль голубой
FeCl3 + NH4SCN = Fe(SCN)3↓ + 3NH4Cl
кроваво-красный
Дайте названия комплексным соединениям
Слайд 14 Получение комплексных
соединений
CuCl2 + 2NH3 + 2H2O = Cu(OH)2↓ + 2NH4Cl
[Cu(NH3)4] (OH)2
Назовите полученное соединение.
Слайд 15 Явление необычное,
Может ли слабая кислота способствовать образованию сильного основания? Что за абсурдный вопрос! Однако это происходит при добавлении к раствору фторида калия борной кислоты.
В соответствии с уравнением реакции:
B(OH)3 + 4KF = K [BF4]↓ + 3KOH
Образуется очень устойчивый комплекс, малорастворимый в воде. Одновременно в растворе появляется гидроксид калия – сильное основание.
Назовите комплексное соединение.
Слайд 16 Секрет Якоба Вайца.
В 1704 г., во время
«Симпатические чернила» изобрел шведский аптекарь Якоб Вайц. Хлорид гексааквакобальта бледно-розового цвета. Если его подогреть, комплекс меняет состав и превращается в синий дихлородиаквако-бальт.
Напишите формулы названных комплексов.
Слайд 17Делаем выводы:
Комплексное соединение – сложное вещество, в состав которого входит комплексный
Комплексный ион – это ион, состоящий из d-металла и лигандов.
Лиганд – молекула или ион, входящий в состав комплексного иона, связанный с d-металлом донорно-акцепторной связью.
Координационное число – количество лигандов, входящих в состав комплексного иона.
Слайд 18 Упражнения
1. Определите внутреннюю и внешнюю
H4 [PtCl 6] [Cu(NH3)2] SO4 [Cr(H2O)6 ]Cl2
2. Составьте формулу соединения, если известно, что его молекула содержит ионы Ni (+2), 3Cl (-), а также три молекулы NH3.







![Номенклатура[Cu(NH3)4] SO4Сульфат тетраамин меди (II)АнионЛигандКомплексо-образовательВалентность K4 [Fe(CN)6]Гексацианоферрат (II) калияЛигандКомплексо-образовательВалентностьКатион](/img/tmb/2/199417/c1c2128eefd89c9ae00532ec4491134d-800x.jpg)
![Назовите вещества K2 [PtCl6] [Co(NH3)4Cl2] Cl Na2 [Zn(OH)4] [Cu(NH3)4] (OH)2](/img/tmb/2/199417/63147b52b8ef47c2c152c074a216f0f9-800x.jpg)













