- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты органические и неорганические презентация
Содержание
- 1. Кислоты органические и неорганические
- 2. Определение Кисло́ты — сложные вещества, которые состоят
- 3. В свете ТЭД: Кислоты – это
- 4. Определение Льюиса По электронной теории, предложенной в 1923 г.
- 5. Протолитическая теория Брёнстеда -Лоури По протонной теории кислот
- 6. Протолитическая теория Брёнстеда -Лоури HCl +
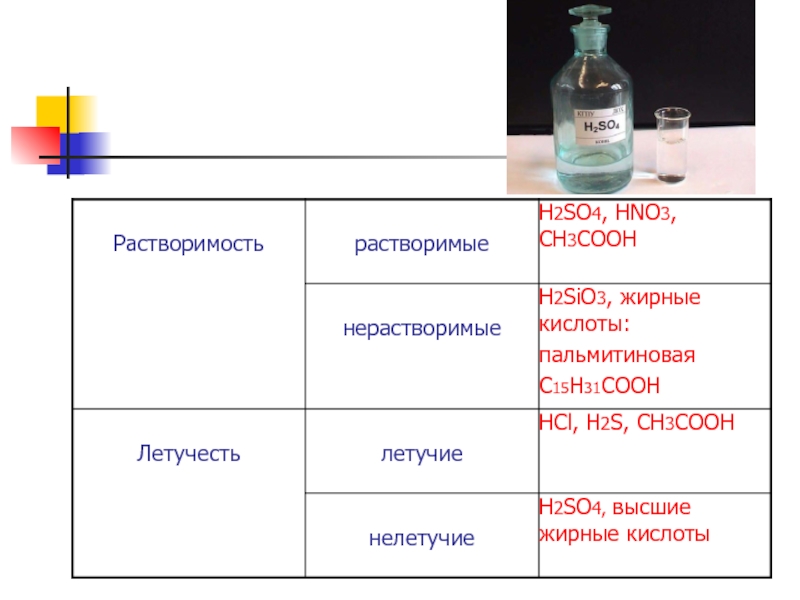
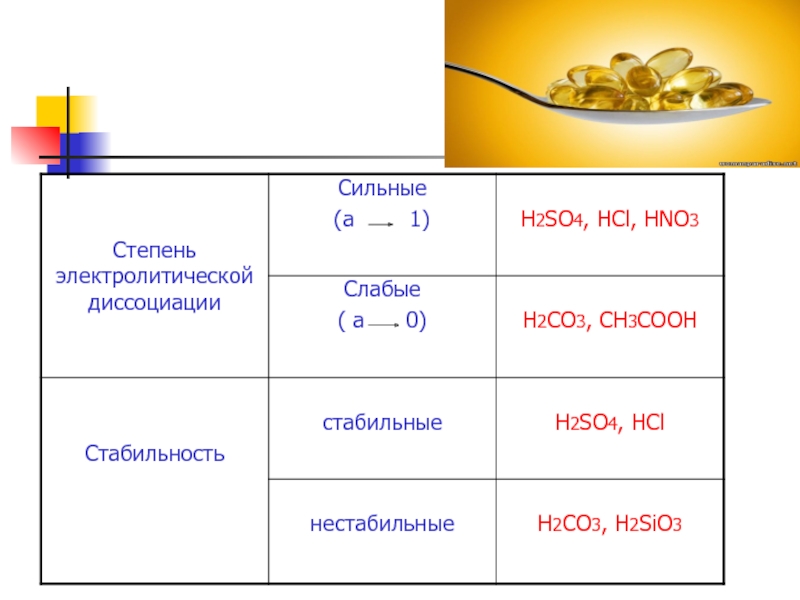
- 7. Классификация кислот
- 10. Свойства кислот Кислый вкус, действие на индикаторы
- 11. HCl = H+ + Cl- HNO3 =
- 12. Химические свойства Взаимодействие с металлами Металлы, стоящие
- 13. H2SO4 (конц) и HNO3 любой концентрации
- 14. Химические свойства Взаимодействие с металлами Неметаллы и
- 15. Химические свойства Взаимодействие с основными и амфотерными
- 16. Химические свойства Взаимодействие с основаниями: щелочами и
- 17. Химические свойства Взаимодействие с солями Взаимодействие с
- 18. Химические свойства Взаимодействие с солями Взаимодействие с
- 19. Для органических кислот характерна реакция этерификации
- 20. Образование сложного эфира между этиленгликолем и азотистой кислотой Химические свойства Взаимодействие со спиртами
- 21. Особенности строения уксусной кислоты C-3H3COOH+1 Восстановительные
- 22. Особенности строения уксусной кислоты C-3H3COOH+1 Окислительные 2CH3COOH+1 + Mg0 → (СН3COO)2Mg+2 + H20↑
- 23. Особенности строения муравьиной кислоты HC+2OOH+1 Восстановительные
- 24. Особые свойства кислот в зависимости от кислотного
- 25. Особые свойства кислот в зависимости от кислотного
- 26. Оксиды и гидроксиды Кислотные свойства усиливаются, окислительные свойства ослабевают
- 27. Применение кислот
- 28. Домашнее задание: П.20, № 5,8,9
- 29. Спасибо за работу!
Слайд 1Кислоты органические и неорганические
Составитель: И.Н. Пиялкина, учитель химии МБОУ СОШ №
Слайд 2Определение
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться
Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
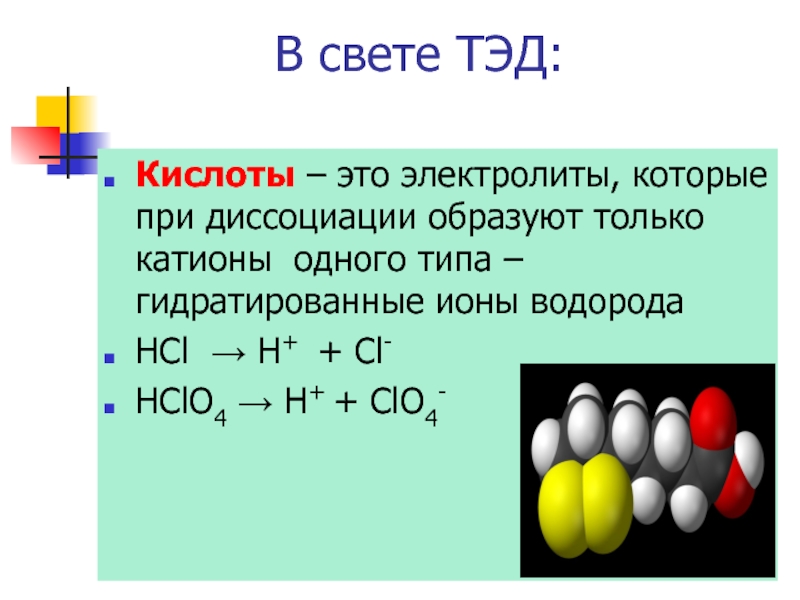
Слайд 3В свете ТЭД:
Кислоты – это электролиты, которые при диссоциации образуют
HCl → H+ + Cl-
HClO4 → H+ + ClO4-
Слайд 4Определение Льюиса
По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее
Слайд 5Протолитическая теория Брёнстеда -Лоури
По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо
Кислоты — водородсодержащие вещества, отдают при реакциях положительные ионы водорода — протоны, т.е являются донорами.
Основания – принимают катионы H+ , т.е. являются акцепторами H+
Так как атом водорода состоит только из протона и электрона, то катион H+ представляет собой протон, поэтому кислоту называют донором ( с лат. дарить) протонов, а основание – акцептором (с лат. получать) протонов
Название теории – протолитическая (синтез терминов «протон» и «электролит»
Слайд 6Протолитическая теория Брёнстеда -Лоури
HCl + H2O = H3O+
кислота основание кислота основание
вода протон ион оксония
В этой реакции Н2О ведет себя как как основание – присоединяет протон Н+ и образует ион оксония по донорно-акцепторному механизму. Ион оксония Н3О+ и сам может играть роль кислоты – отдавать Н+ и превращаться в молекулу Н2О.
Слайд 10Свойства кислот
Кислый вкус, действие на индикаторы
(лакмус – красный, метилоранж
Слайд 11HCl = H+ + Cl-
HNO3 = H+ + NO3-
H2SO4 = H+
HSO4- ↔ 2H+ + SO42-
CH3COOH ↔ CH3COO- + H+
Химические свойства
Диссоциация
Слайд 12Химические свойства
Взаимодействие с металлами
Металлы, стоящие в электрохимическом ряду напряжений до водорода,
Условия: а)образование в результате реакции растворимой соли; б)реакция протекает в растворах кислот H2SiO3 + Zn →
2HCl + Mg = MgCl2 + H2
2H+ + Mg0 = Mg2+ + H20 ↑
2CH3COOH + Mg = (CH3COO)2Mg + H2
2CH3COOH + Mg = 2CH3COO- + Mg2++ H20↑
Слайд 13 H2SO4 (конц) и HNO3 любой концентрации
Реагируют с металлами
Химические свойства
Взаимодействие с металлами
Слайд 14Химические свойства
Взаимодействие с металлами
Неметаллы и малоактивные металлы восстанавливают H2SO4 (конц) до
Активные металлы до H2S или S
На холоде H2SO4 (конц) пассивирует
Al, Fe, Cr
HNO3 в реакциях с металлами и неметаллами восстанавливается до
N2O, NO, NO2, N2, NH3, NH4NO3
Слайд 15Химические свойства
Взаимодействие с основными и амфотерными оксидами
Взаимодействие с оксидами металлов с
CaO + 2HCl = CaCl2 + H2O
CaO + 2H+ = Ca2+ + H2O
ZnO + HCl = ZnCl2 + H2O
ZnO + 2H+ = Zn2+ + H2O
2СН3СООН + СаО = (СН3СОО)2Са + Н2О
2СН3СООН + СаО = 2СН3СОО- + Са2+ + Н2О
Слайд 16Химические свойства
Взаимодействие с основаниями: щелочами и амфотерными гидроксидами
Взаимодействие со щелочамиВзаимодействие со
HCl + NaOH = NaCl + H2O
H++ OH- = H2O
2СН3СООН + Mg(ОH)2= (СН3СОО)2Mg + 2Н2О
2СН3СООН+Mg(ОH)2=2СН3СОО- + Mg2+2Н2О
Многоосновные кислоты могут образовывать как средние так и кислые соли
H2SO4 + NaOH = NaHSO4 + H2O
Слайд 17Химические свойства
Взаимодействие с солями
Взаимодействие с солямиВзаимодействие с солями, если выделяется газ:
2H+ + CaCO3 = Ca2++ CO2↑ + Н2О
2CH3COOH+Na2CO3=2CH3COONa +CO2↑+ Н2О
2CH3COOH +CO32- =2CH3COO-+ CO2↑ + Н2О
Слайд 18Химические свойства
Взаимодействие с солями
Взаимодействие с солямиВзаимодействие с солями, если выпадает осадок
Ba2+ + SO42-= BaSO4 ↓
CH3COOH + Na2SiO3=2CH3COONa + Н2SiО3 ↓
2CH3COOH + SiO32- = 2CH3COO-+ Н2SiО3 ↓
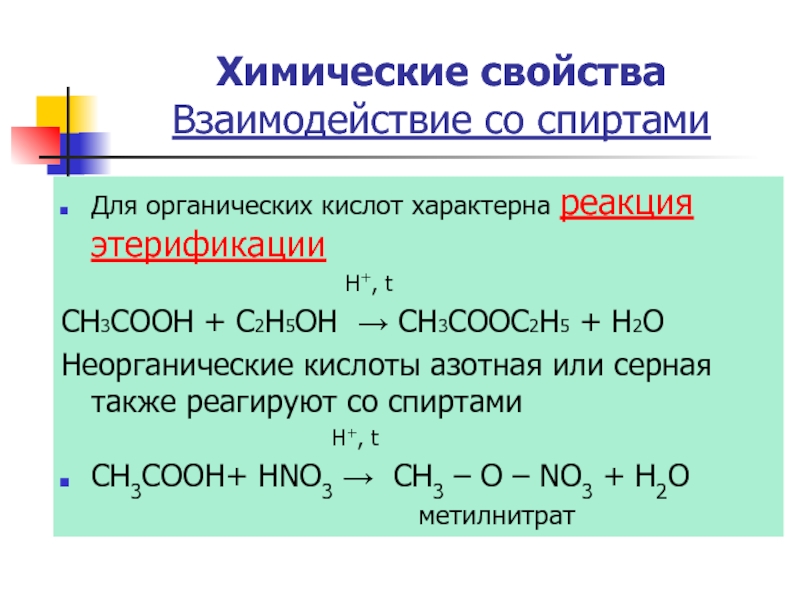
Слайд 19Для органических кислот характерна реакция этерификации
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Неорганические кислоты азотная или серная также реагируют со спиртами
H+, t
CH3COOH+ HNO3 → CH3 – O – NO3 + Н2О
метилнитрат
Химические свойства
Взаимодействие со спиртами
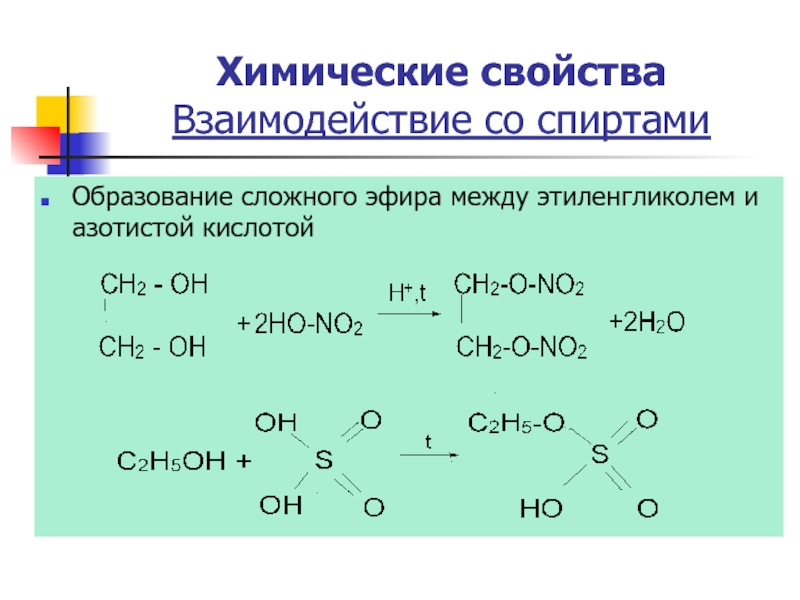
Слайд 20Образование сложного эфира между этиленгликолем и азотистой кислотой
Химические свойства
Взаимодействие со спиртами
Слайд 21Особенности строения уксусной кислоты
C-3H3COOH+1
Восстановительные
C-3H3COOH + Cl20 → С-1Н2Cl-COOH + HCl-1
Реакция замещения водорода в радикале на галоген протекает за счет восстановительных свойств атома углерода радикала метила. Под влиянием атомов галогена степень диссоциации увеличивается почти в 100 раз у хлоруксусной кислоты
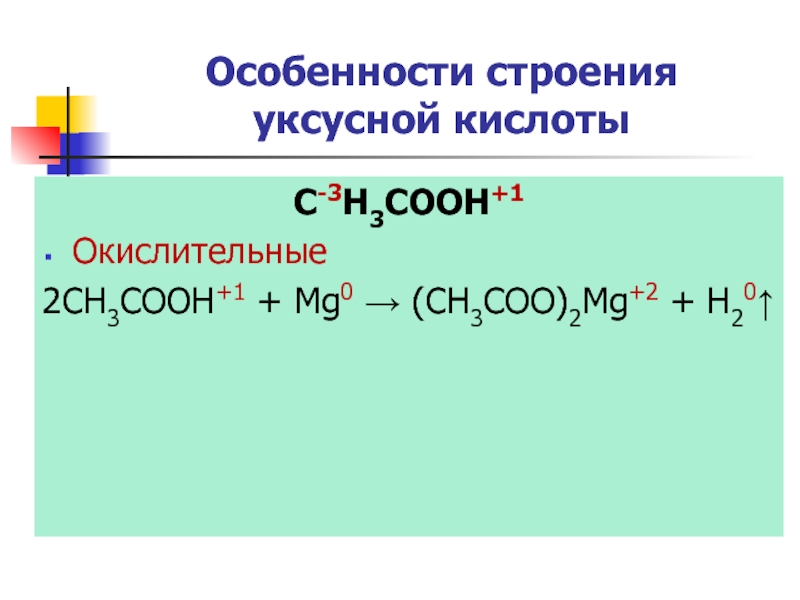
Слайд 22Особенности строения уксусной кислоты
C-3H3COOH+1
Окислительные
2CH3COOH+1 + Mg0 → (СН3COO)2Mg+2 + H20↑
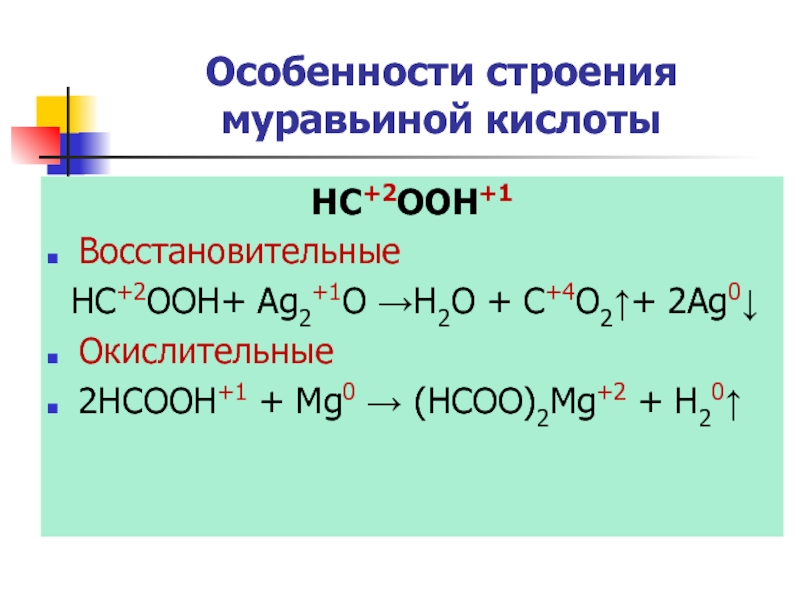
Слайд 23Особенности строения муравьиной кислоты
HC+2OOH+1
Восстановительные
HC+2OOH+ Ag2+1O →H2O + C+4O2↑+ 2Ag0↓
Окислительные
2HCOOH+1 +
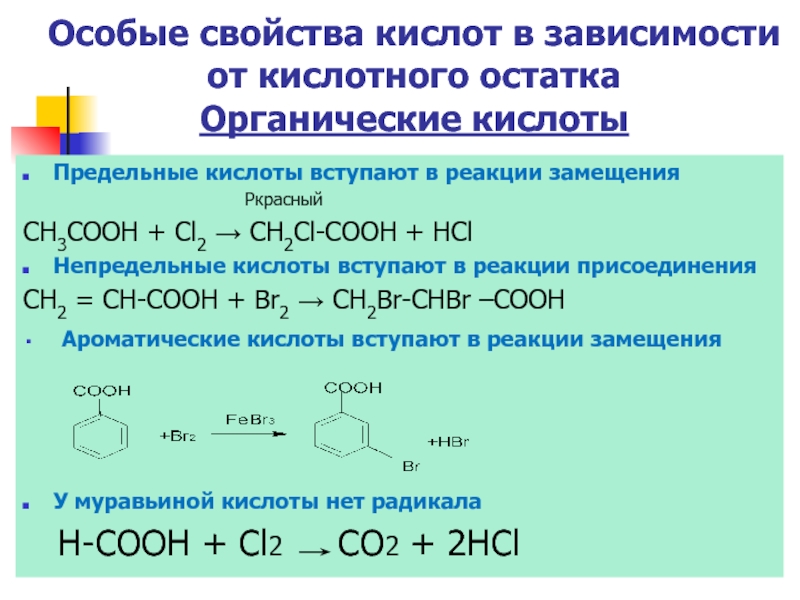
Слайд 24Особые свойства кислот в зависимости от кислотного остатка
Органические кислоты
Предельные кислоты вступают
Pкрасный
CH3COOH + Cl2 → СН2Cl-COOH + HCl
Непредельные кислоты вступают в реакции присоединения
CH2 = CH-COOH + Br2 → СН2Br-CHBr –COOH
Ароматические кислоты вступают в реакции замещения
У муравьиной кислоты нет радикала
Н-СООН + Сl2 CO2 + 2HCl
Слайд 25Особые свойства кислот в зависимости от кислотного остатка
Неорганические кислоты
Качественные реакции на
Ba2+ + SO42-= BaSO4 ↓
Окислительные свойства аниона
Cu + 4HN+5O3 = Cu(NO3)2 + 2N+4O2↑ + 2H2O
Восстановительные свойства
4HCl-1 + MnO2 = MnCl2 + Cl20 + 2H2O
Если центральный атом находится в промежуточной с.о., кислота проявляет окислительно-восстановительную двойственность
H2S+4O3 + H2O2 = H2S+6O4 + H2O
H2S+4O3 + 2H2S = 3S0 + 3H2O