Кукес В.Г.
Раменская Г.В.
Насонов А.С.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ИССЛЕДОВАНИЕ БИОЭКВИВАЛЕНТНОСТИ ГЕНЕРИЧЕСКИХ ЛС - ОСНОВНОЙ ЭТАП ИХ ЭКСПЕРТИЗЫ Кукес В.Г. Раменская Г.В. Насонов А.С. презентация
Содержание
- 1. ИССЛЕДОВАНИЕ БИОЭКВИВАЛЕНТНОСТИ ГЕНЕРИЧЕСКИХ ЛС - ОСНОВНОЙ ЭТАП ИХ ЭКСПЕРТИЗЫ Кукес В.Г. Раменская Г.В. Насонов А.С.
- 2. Известно, что оценка биоэквивалентности генерических ЛС является
- 3. Нужны ли генерики?
- 4. По литературным данным объем продаж воспроизведенных ЛС
- 5. В настоящее время в России зарегистрировано свыше 10000 генериков
- 6. ГЕНЕРИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ЗАРЕГИСТРИРОВАННЫЕ В США, ГЕРМАНИИ И КАНАДЕ НА ОСНОВАНИИ ДАННЫХ ИХ БИОЭКВИВАЛЕНТНОСТИ
- 7. В России регистрация ЛС проводится на основе:
- 9. С целью гармонизации требований к
- 10. 1. “In vivo bioequivalence guidances” – USP
- 11. Исследования биоэквивалентности в РФ выполняются только после
- 12. Исследования биоэквивалентности ЛС
- 14. Фармакокинетика этацизина N=12 N=18
- 15. Аналитический метод должен обеспечивать избирательное, точное
- 16. В ряде случаев происходит очень быстрый метаболизм
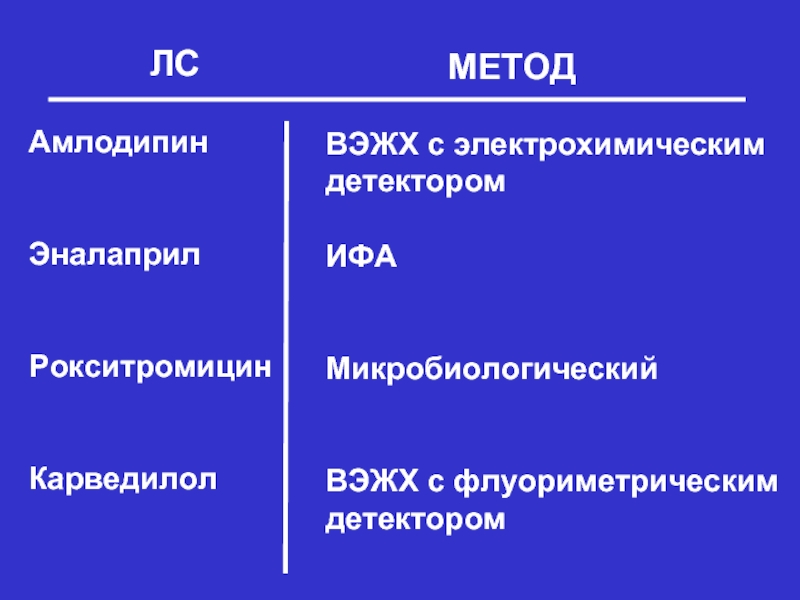
- 17. ЛС МЕТОД Амлодипин Эналаприл
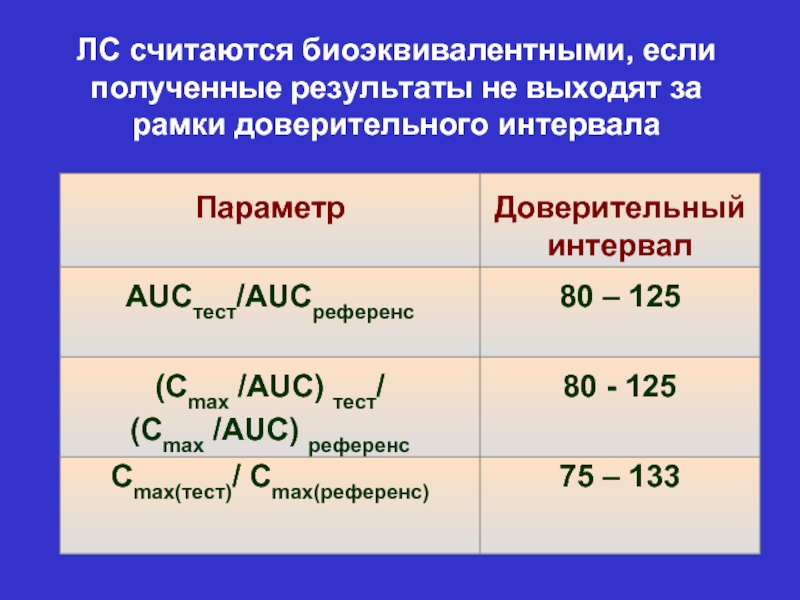
- 18. ЛС считаются биоэквивалентными, если полученные результаты не выходят за рамки доверительного интервала
- 19. Существуют ситуации когда ЛС метаболизируются в организме
- 20. CYP3A4,1A2 Верапамил Норверапамил
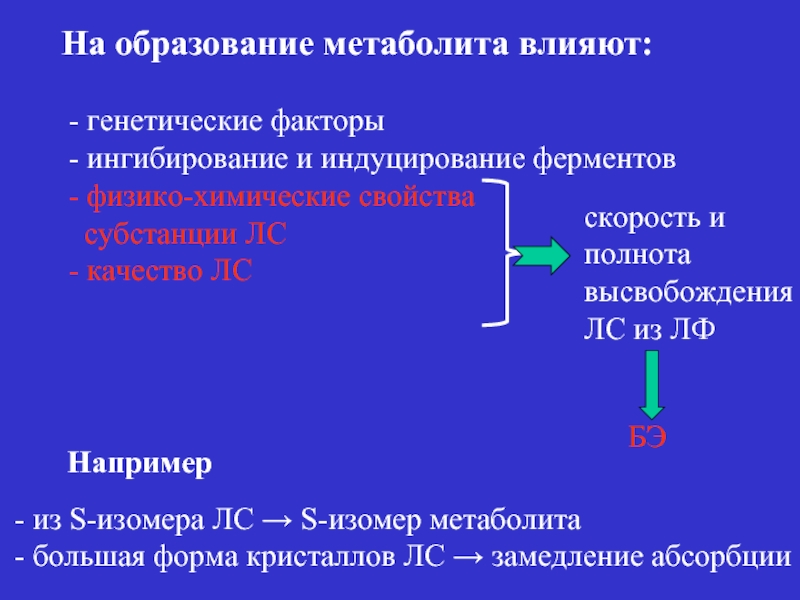
- 21. На образование метаболита влияют: -
- 22. С целью усовершенствования проведений исследований по биоэквивалентности
- 23. Ответ на 1 вопрос: Если AUCтест/AUCреференс и
- 24. Учитывая специфичность действия этих ЛС мы рекомендуем
- 25. АМИТРИПТИЛИН По данным Немецкой национальной программы по
- 26. ГЛИБЕНКЛАМИД Частота гипогликемий при
- 27. Что мы предлагаем: 1. Изучать БЭ
- 28. Не будет ли более достоверным, если оценивать
- 29. Насколько достоверны и воспроизводимы результаты ККИ?
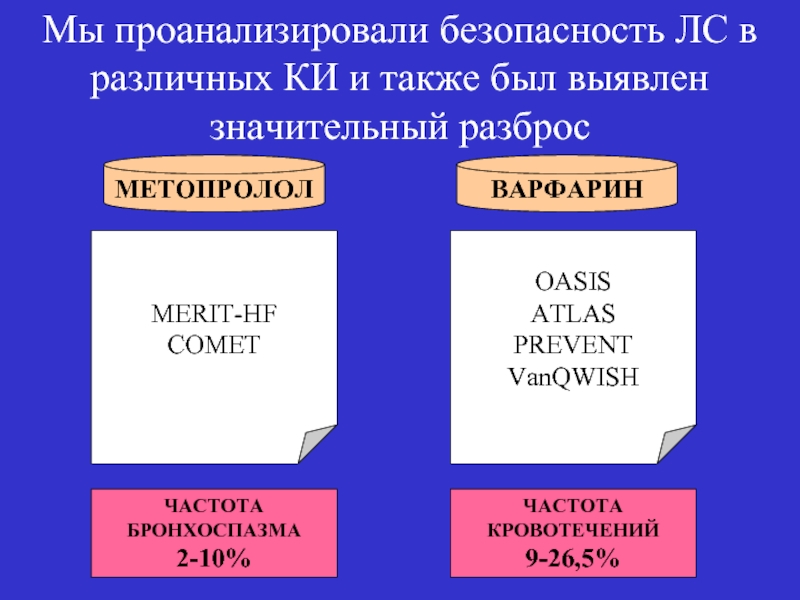
- 30. Мы проанализировали эффективность ЛС в различных КИ
- 31. МЕТОПРОЛОЛ ВАРФАРИН MERIT-HF COMET OASIS ATLAS PREVENT
- 32. Разброс величины удлинения интервала QT при применении спарфлоксацина в 5 РКИ
- 33. Разброс в эффективности карведилола при ХСН в четырех РКИ Снижение смертности, %
- 34. Ответ на назначение иГКС в одинаковой дозе
- 35. Т.о. представленные данные показывают, что имеются большой
- 36. Причины возможного снижения качества генериков по сравнению
- 37. Например амлодипин L- изомер – фармакологически
- 38. Зависимость растворения фуросемида от морфологии и
- 39. Взаимосвязь размеров кристаллов субстанции тамоксифена и
- 40. Прежде чем регистрировать ЛС надо зарегистрировать субстанцию,
- 41. Также при регистрации субстанции необходимо представлять данные
- 42. BASF Aktiengesellschaft В состав кишечно-растворимых таблеток
- 43. Но при этом меняется кинетика растворения таблеток
- 44. Спасибо за внимание и терпение!
Слайд 1ИССЛЕДОВАНИЕ БИОЭКВИВАЛЕНТНОСТИ
ГЕНЕРИЧЕСКИХ ЛС - ОСНОВНОЙ
ЭТАП ИХ ЭКСПЕРТИЗЫ
Слайд 2 Известно, что оценка биоэквивалентности генерических ЛС является основным видом медико-биологического контроля
В качестве препарата сравнения следует использовать соответствующий оригинальный препарат, если он официально зарегистрирован в Российской Федерации, или его аналог, нашедший в Российской Федерации наиболее широкое медицинское применение.
Слайд 4По литературным данным объем продаж воспроизведенных ЛС на фармацевтическом рынке составляет:
Слайд 6ГЕНЕРИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ЗАРЕГИСТРИРОВАННЫЕ В США, ГЕРМАНИИ И КАНАДЕ НА ОСНОВАНИИ ДАННЫХ
Слайд 7В России регистрация ЛС проводится на основе:
Федерального закона от
Слайд 9 С целью гармонизации требований к регистрации ЛС в РФ
Слайд 101. “In vivo bioequivalence guidances” – USP
2. EMEA, The rules
3. Руководство для органов по регулированию оборота лекарственных средств (серия пособий по вопросам регулирования №5) Всемирная организация здравоохранения
При разработке
Методических указаний по
биоэквивалентности в РФ использовались:
Слайд 11Исследования биоэквивалентности в РФ выполняются только после одобрения Национального Комитета по
Слайд 12
Исследования биоэквивалентности ЛС проводятся по открытой, pандомизиpованной и
Слайд 15 Аналитический метод должен обеспечивать избирательное, точное и воспроизводимое определение концентрации
Слайд 16В ряде случаев происходит очень быстрый метаболизм ЛС. Не всегда удается
Слайд 17ЛС
МЕТОД
Амлодипин
Эналаприл
Рокситромицин
Карведилол
ВЭЖХ с электрохимическим
детектором
ИФА
Микробиологический
ВЭЖХ с флуориметрическим
детектором
Слайд 18ЛС считаются биоэквивалентными, если полученные результаты не выходят за рамки доверительного
Слайд 19Существуют ситуации когда ЛС метаболизируются в организме с образованием активных метаболитов.
Слайд 20
CYP3A4,1A2
Верапамил
Норверапамил
Нифедипин
CYP3A4
неактивен
20% активности верапамила
В результате биотрансформации из ЛС может образовываться активные или
Слайд 21На образование метаболита влияют:
- генетические факторы
- ингибирование и индуцирование
- физико-химические свойства
субстанции ЛС
- качество ЛС
БЭ
Например
- из S-изомера ЛС → S-изомер метаболита
- большая форма кристаллов ЛС → замедление абсорбции
скорость и
полнота
высвобождения
ЛС из ЛФ
Слайд 22С целью усовершенствования проведений исследований по биоэквивалентности необходимо ответить на следующие
Слайд 23Ответ на 1 вопрос: Если AUCтест/AUCреференс и (Cmax/AUC)тест/(Cmax /AUC)референс находятся на уровне верхней
Слайд 24Учитывая специфичность действия этих ЛС мы рекомендуем проводить пострегистрационные клинические исследования
Слайд 25АМИТРИПТИЛИН По данным Немецкой национальной программы по безопасности лекарственных средств в психиатрии
Слайд 26 ГЛИБЕНКЛАМИД Частота гипогликемий при применении глибенкламида составляет 17%! Источник: Glibenclamide vs gliclazide in
Слайд 27Что мы предлагаем: 1. Изучать БЭ на крупных видах животных (собаки,
Слайд 28Не будет ли более достоверным, если оценивать генерический препарат по их
Для ответа на этот вопрос, приведем данные по результатам мультицентровых исследований некоторых ЛС. И по итогам полученных результатов - ответить на вопрос.
Слайд 30Мы проанализировали эффективность ЛС в различных КИ и был выявлен значительный
ЛОВАСТАТИН
ФЛУОКСЕТИН
MARS
FATS
CLAPT
LRT
EXCEL
РКИ из базы
CENTRAL
Достижение «целевых»
уровней ЛНП у 30-75%
пациентов
Эффективность
при депрессии-
20-40%
Слайд 31МЕТОПРОЛОЛ
ВАРФАРИН
MERIT-HF
COMET
OASIS
ATLAS
PREVENT
VanQWISH
ЧАСТОТА
БРОНХОСПАЗМА
2-10%
ЧАСТОТА
КРОВОТЕЧЕНИЙ
9-26,5%
Мы проанализировали безопасность ЛС в различных КИ и также
Слайд 34Ответ на назначение иГКС в одинаковой дозе у 895 больных БА
Malmstrom, K et al. Ann Intern Med 1999;130,487-495
~25% больных БА
не отвечают на лечение!
Слайд 35Т.о. представленные данные показывают, что имеются большой разброс в оценке эффективности
Слайд 36Причины возможного снижения качества генериков по сравнению с инновационными препаратами:
Изменение метода
Характер производства, а так же изменение вспомогательных веществ.
Изменение технологии производства.
Слайд 37Например амлодипин
L- изомер – фармакологически активен
D- изомер – фармакологически неактивен
До 80%
Менее 50% L отсутствие эффекта
95% L побочные эффекты
Слайд 38
Зависимость растворения фуросемида от морфологии и размеров кристаллов
Myriam Hassoun
Myriam Hassoun
M Hassoun, 2003
Слайд 39
Взаимосвязь размеров кристаллов субстанции тамоксифена и его фармакокинетики
В.В. Чистяков, 2004
A Adjei,
Взаимосвязь размеров кристаллов субстанции лаурила ацетата и его фармакокинетики
Мелкие кристаллы
Крупные кристаллы
Мелкие кристаллы
Крупные кристаллы
Слайд 40Прежде чем регистрировать ЛС надо зарегистрировать субстанцию, требования к качеству которой
При разработке новой технологии получения субстанции необходимо разработать и прменять новый аналитический контроль полупродуктов и самой субстанции. Если применяется старый аналитический контроль, то он не может оценить качество сусбанции и выявить примеси.
Поэтому при регистрации новой субстанции необходимы
сведения о путях ее синтеза, для прогнозирования наличия возможных примесей
Так например: одна субстанция диклофенака вызывала побочные эффекты. При анализе путей ее синтеза было выявлено, что она содержит бром, что было подтверждено в дальнейшем. С ним и были связаны побочные эффекты
Академик РАМН Глушков Р.Г.
Слайд 41Также при регистрации субстанции необходимо представлять данные о соотношении оптических и
Это касается и оригинальных препаратов. На сегодня известно, что ряд препаратов зарегистрированные как рацематы являются более активными если применяются в виде активного оптического изомера.
Пример: амлодипин, клопидогрель, омепразол, верапамил и др.
Слайд 42BASF Aktiengesellschaft
В состав кишечно-растворимых таблеток омепразола добавили гидрофосфат натрия (Na2HPO3),
Слайд 43Но при этом меняется кинетика растворения таблеток
при рН 6,8.
Например, через
не содержащих Na2HPO3 и 50% таблеток, содержащих Na2HPO3.
Но при этом меняется кинетика растворения таблеток
при рН 6,8.
Например, через 15 минут растворяется около 20% таблеток,
не содержащих Na2HPO3 и 50% таблеток, содержащих Na2HPO3.