- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Использование информационных технологий при обучении химии презентация
Содержание
- 1. Использование информационных технологий при обучении химии
- 2. Термин «информационные технологии» подразумевает использование компьютеров как
- 3. Применение компьютера при обучении химии в школе
- 4. Медиа- лекции: «Углерод. Аллотропия.» (9 класс) «Природные
- 5. Уроки комбинированного типа: «Алюминий и его соединения»(9
- 6. Результаты ЕГЭ: 2003-2004 учебный год Оценка
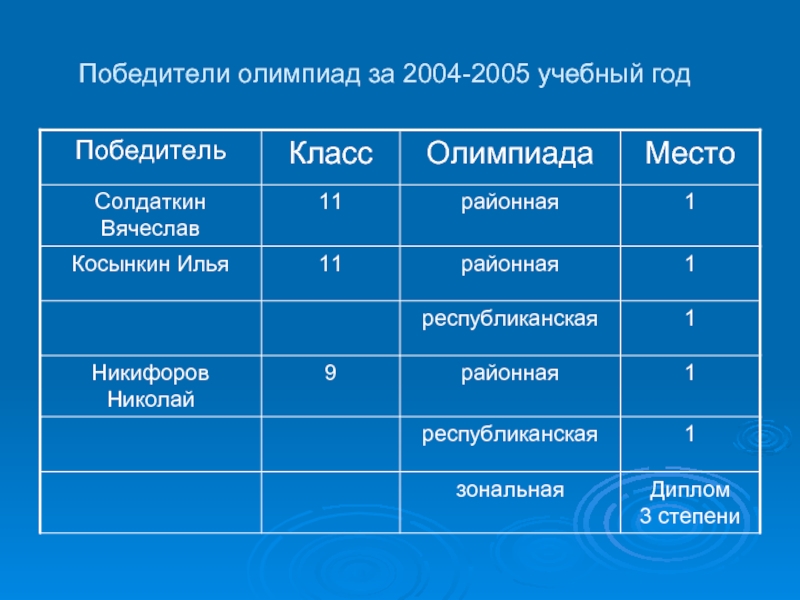
- 7. Победители олимпиад за 2004-2005 учебный год
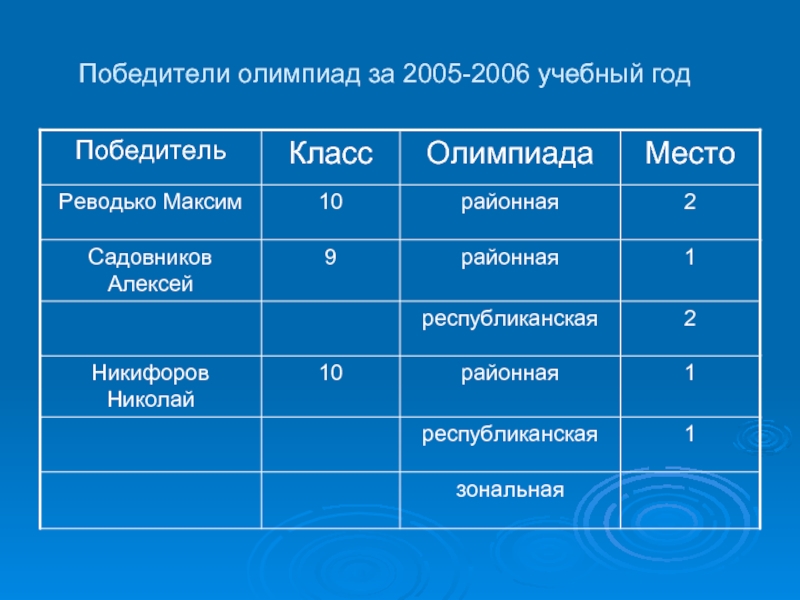
- 8. Победители олимпиад за 2005-2006 учебный год
- 9. NH3 + H2O = NH4+ + OH
- 10. 1. Катион – это: а) ион меди;
- 11. 1. Катион – это: а) ион меди;
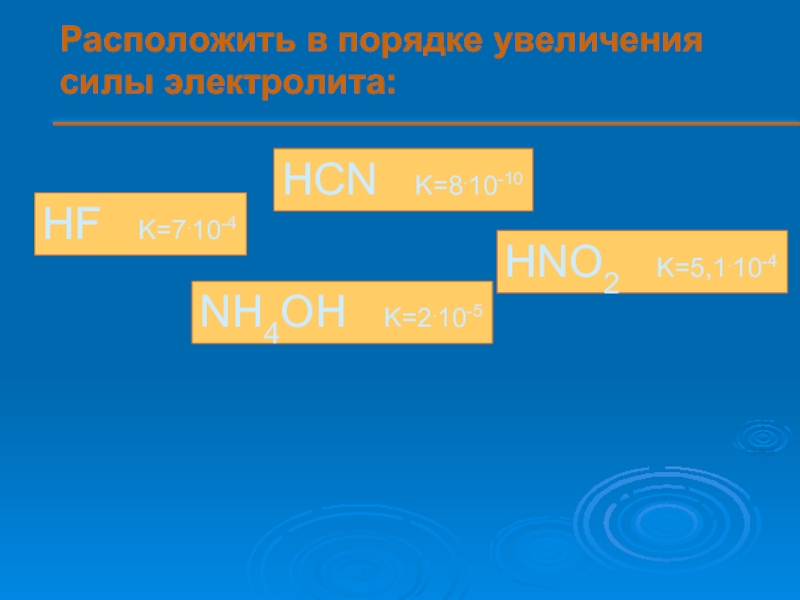
- 12. Расположить в порядке увеличения силы электролита:
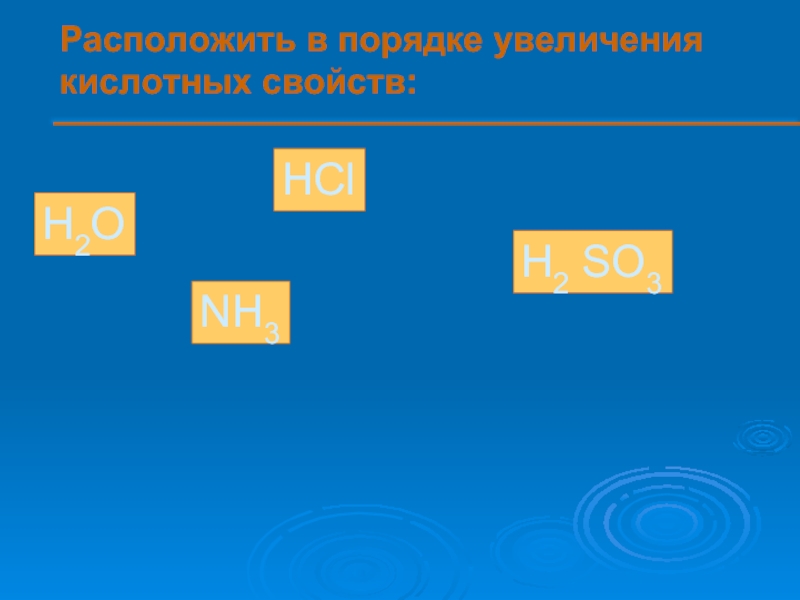
- 13. Расположить в порядке увеличения кислотных свойств: H2O HCl H2 SO3 NH3
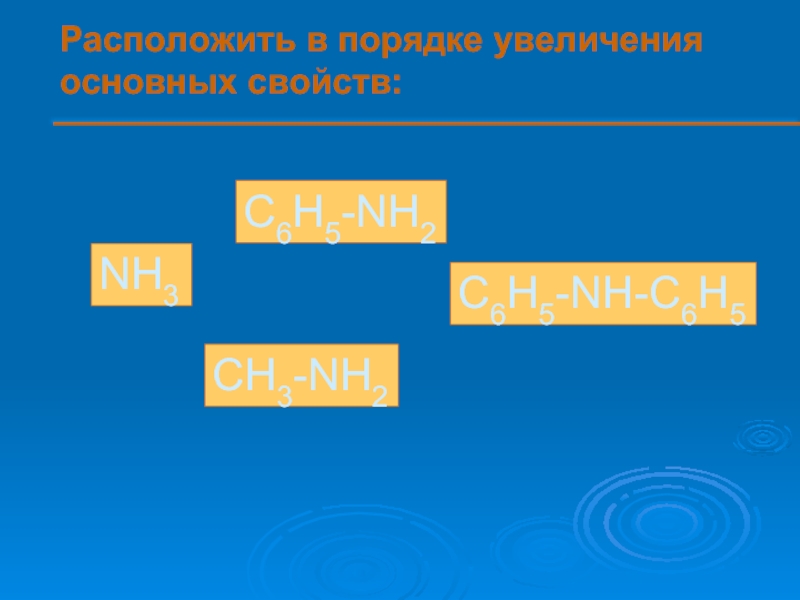
- 14. Расположить в порядке увеличения основных свойств: NH3 C6H5-NH2 C6H5-NH-C6H5 CH3-NH2
- 15. Укажи, допущены ли ошибки в тексте:
- 16. Укажи, допущены ли ошибки в тексте:
- 17. Эффект применения компьютерных технологий зависит в наибольшей
Слайд 1Использование информационных технологий при обучении химии
учитель химии естественно-технического лицея №43 города
Слайд 2Термин «информационные технологии» подразумевает использование компьютеров как новых средств подготовки, диагностики,
делать по-новому то, что делали всегда;
делать то, что без компьютера делать очень сложно;
делать то, что не делали раньше.
Слайд 3Применение компьютера при обучении химии в школе целесообразно в тех случаях,
Проведение медиа-уроков с использованием компьютерных дисков.
Создание презентаций к урокам и исследовательским работам учащихся.
Использование дисков для подготовки к ЕГЭ и олимпиадам школьников.
Слайд 4Медиа- лекции:
«Углерод. Аллотропия.» (9 класс)
«Природные источники углеводородов» (10 класс)
«Белки, их строение
«Основные понятия химии ВМС» (11 класс)
«Типы химических реакций» (11 класс)
Слайд 5Уроки комбинированного типа:
«Алюминий и его соединения»(9 класс)
«Многоатомные спирты» (10 класс)
«Качественные реакции
«Теория электролитической диссоциации» (11 класс)
Слайд 6Результаты ЕГЭ:
2003-2004 учебный год
Оценка «5» - 2 ученика
Оценка «4» - 6
2004-2005 учебный год
Оценка «5» - 6 учеников
Оценка «3» - 1 ученик
Слайд 101. Катион – это: а) ион меди; б) атом серы;
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
Выберите правильные ответы:
Слайд 111. Катион – это: а) ион меди; б) атом серы;
2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода.
3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой: а) синяя; б) малиновая; в) желтая; г) бесцветная.
4. Формула вещества, образующего при диссоциации сульфат-ионы: а) Na2S; б) SO3; в) Na2SO4; г) BaSO4.
5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода: а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
Выберите правильные ответы:
Слайд 12
Расположить в порядке увеличения силы электролита:
HF K=7.10-4
HCN K=8.10-10
HNO2
NH4OH K=2.10-5
Слайд 15
Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации вещества по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
Слайд 16
Укажи, допущены ли ошибки в тексте:
1. На процесс диссоциации влияет растворение
2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду.
3. Основность кислоты не всегда совпадает с числом атомов водорода в ней.
4. Все щелочи – сильные электролиты.
5. Константа диссоциации слабой кислоты по первой ступени всегда больше, чем по второй.
6. Степень диссоциации зависит от температуры и концентрации электролита.
7. Диссоциация электролитов – обратимый процесс.
8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O.
9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O.
10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.
Слайд 17Эффект применения компьютерных технологий зависит в наибольшей мере от умения использовать
Очевидно, что в самом ближайшем будущем умение учителя-практика пользоваться компьютером в учебном процессе станет обязательным элементом его профессиональной компетенции.