- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь и строение молекул презентация
Содержание
- 1. Химическая связь и строение молекул
- 2. Молекула – это… …минимумом полной энергии системы
- 3. Термодинамика процесса образования ХС.
- 4. ∆ G < 0 только если
- 5. 2. Межэлектронные взаимодействия двух типов: а)
- 6. В 1927 В. Гайтлер и Ф. Лондон
- 7. r,нм Изменение потенциальной энергии в системе из
- 8. Химическая связь – это совокупность электронно –
- 9. Теории химической связи Метод валентных связей
- 10. Основные положения метода ВС 1. Х. с.
- 11. 5. В пространстве х. с. располагается в
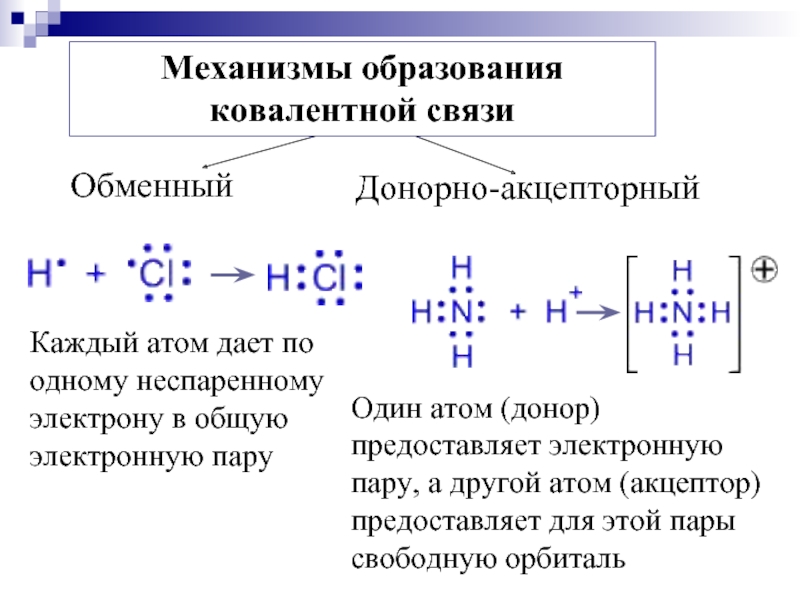
- 12. ٭Ковалентность элемента или его спинвалентность определяется числом
- 13. Каждый атом дает по одному неспаренному
- 14. Свойства ковалентной химической связи 1. Энергия связи
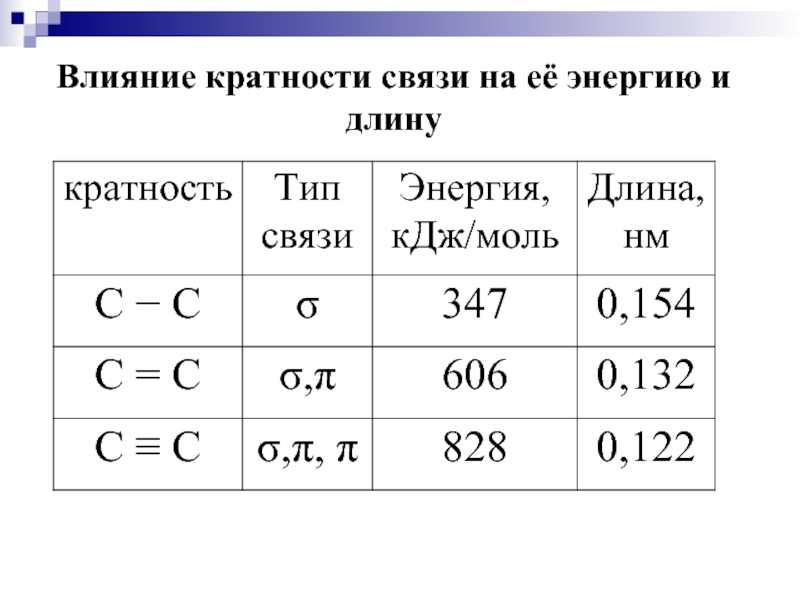
- 15. Влияние кратности связи на её энергию и длину
- 16. Насыщаемость связи -… II период –
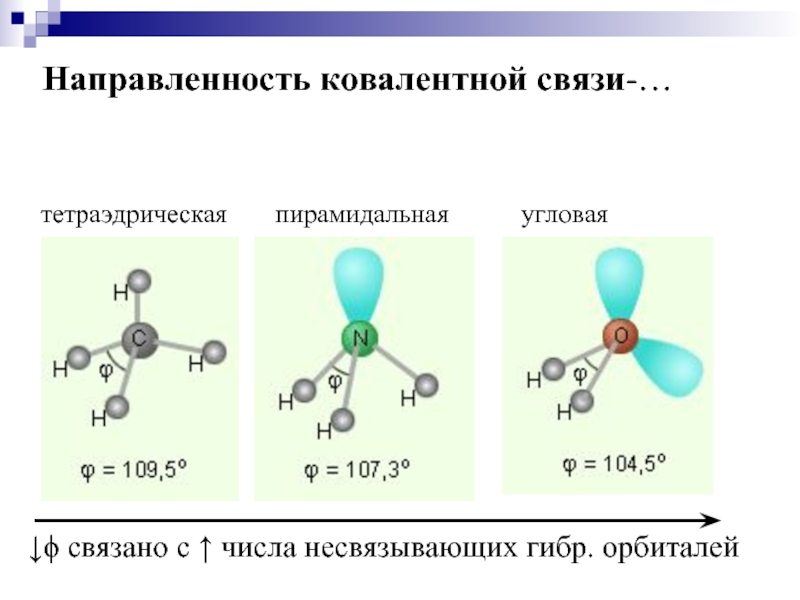
- 17. Направленность ковалентной связи-…
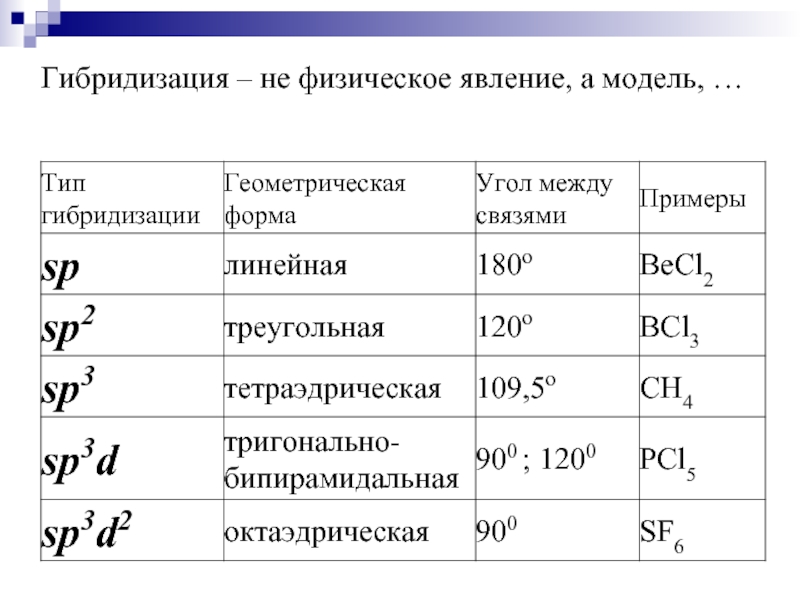
- 18. Гибридизация – не физическое явление, а модель, …
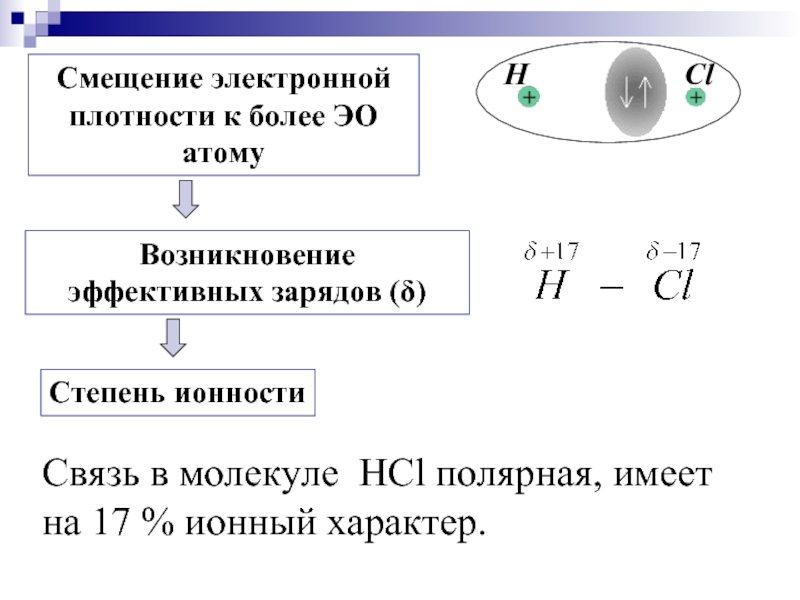
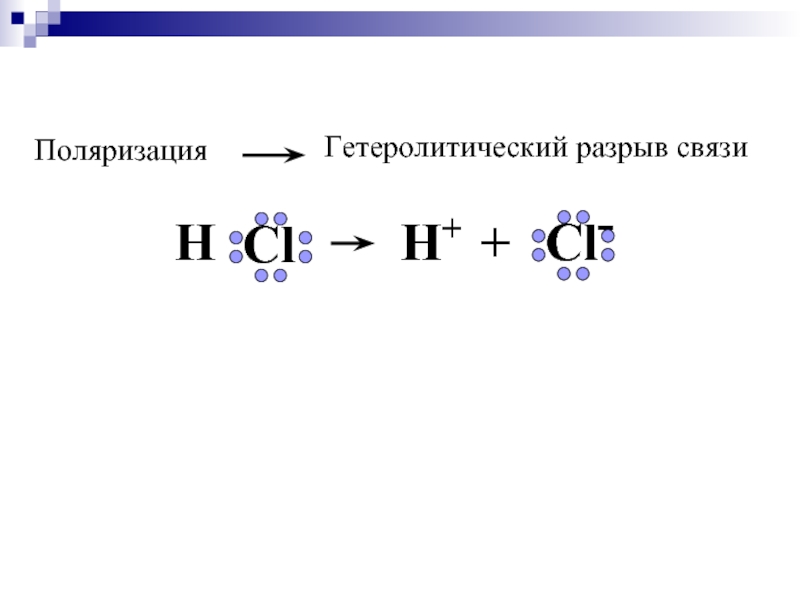
- 19. Полярность связи-… Чем ↑Δ ОЭО, тем ↑
- 20. Cвязь в молекуле HCl полярная, имеет на 17 % ионный характер.
- 21. т.е. степень ионности равна 83%.
- 22. Дипольный момент связи (μ) Эффективный заряд Длина связи
- 23. Неполярные молекулы Молекула неполярна, если суммарный μ всех связей = 0.
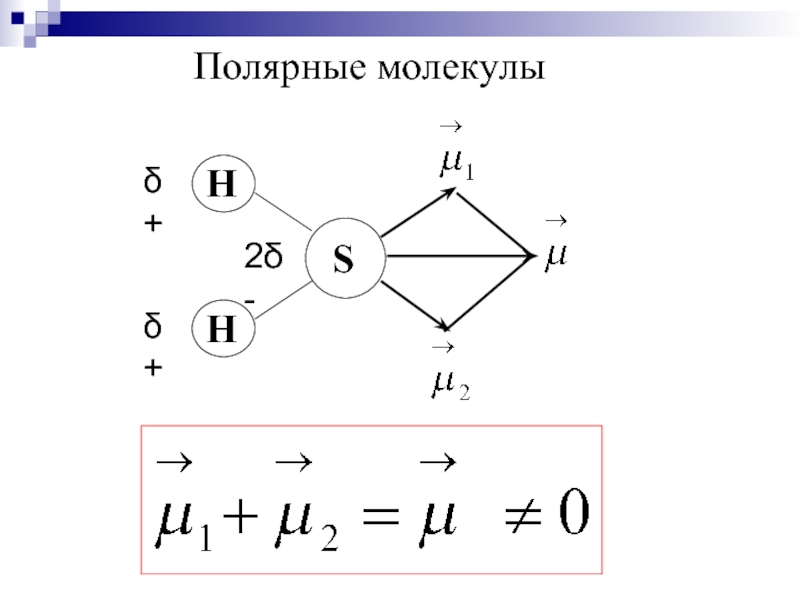
- 24. Полярные молекулы
- 25. Дипольный момент молекулы зависит: ∙от полярности
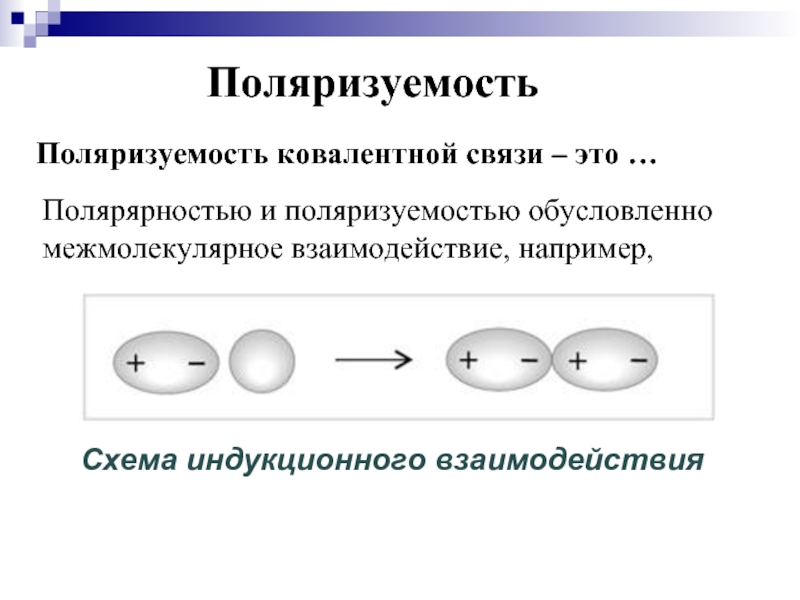
- 26. Поляризуемость Поляризуемость ковалентной связи – это …
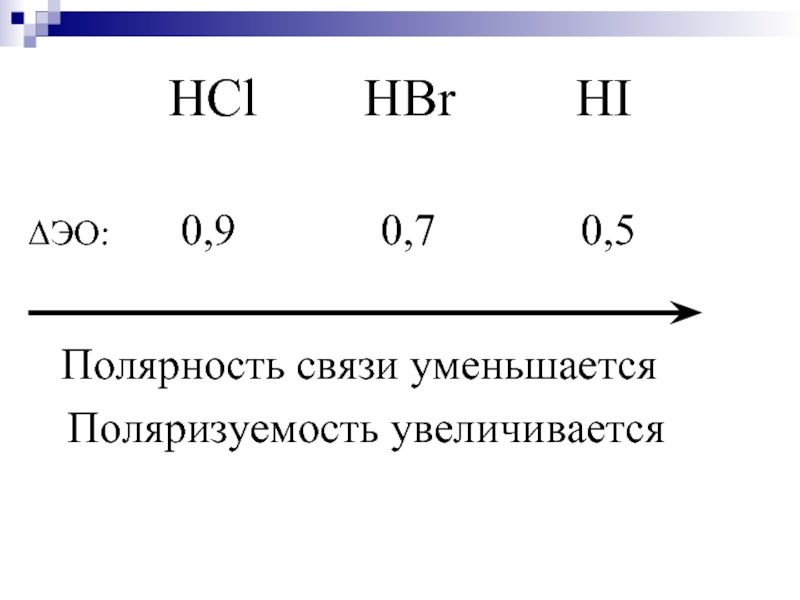
- 27. HCl HBr
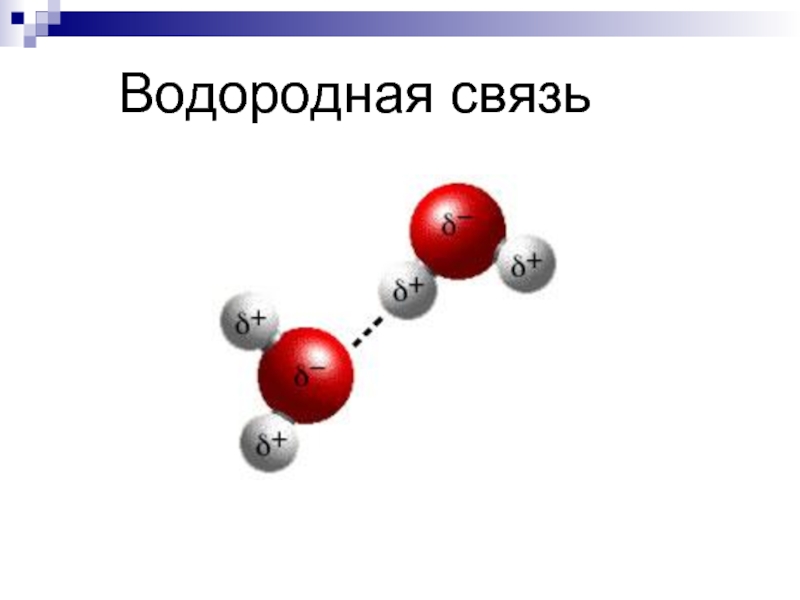
- 29. Водородная связь
- 30. Взаимодействие между молекулами НХ: сильно ЭО элемент: F, O, N, (Cl, S )
- 31. Механизм образования Н-связи: - Электростатическое взаимодействие (диполь-дипольное) -Донорно-акцепторное взаимодействие: -направленность -насыщаемость
- 32. Есвязи, кДж/моль ковалентная 100-400 водородная 4-50 межмолекулярная 0,1 -5 Энергия Н-связи
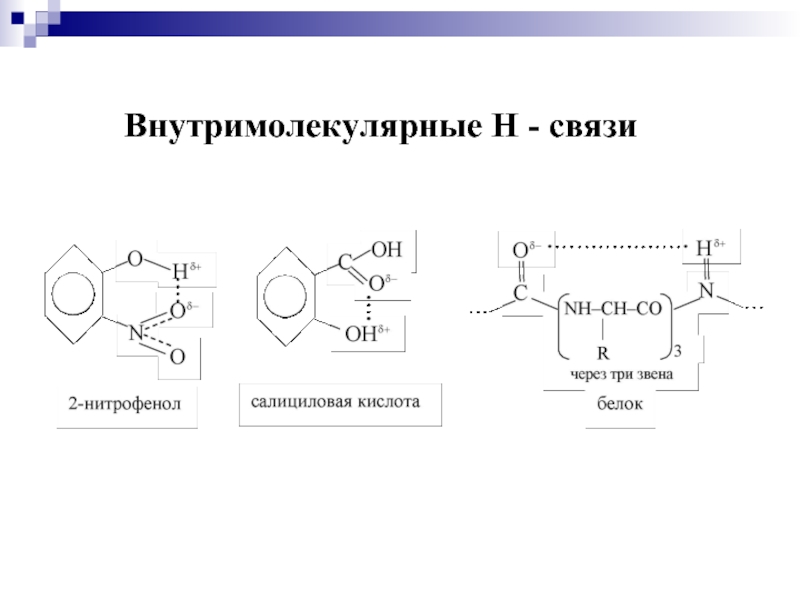
- 33. Внутримолекулярные Н - связи
- 34. Основные положения метода молекулярных орбиталей (ММО) 1.
- 35. 3.Для получения МО используют метод линейной комбинации
- 36. 6. Химическая связь в ММО характеризуется энергией
- 37. σсвяз. МО σразр. Энергетическая диаграмма МО молекулы Н2
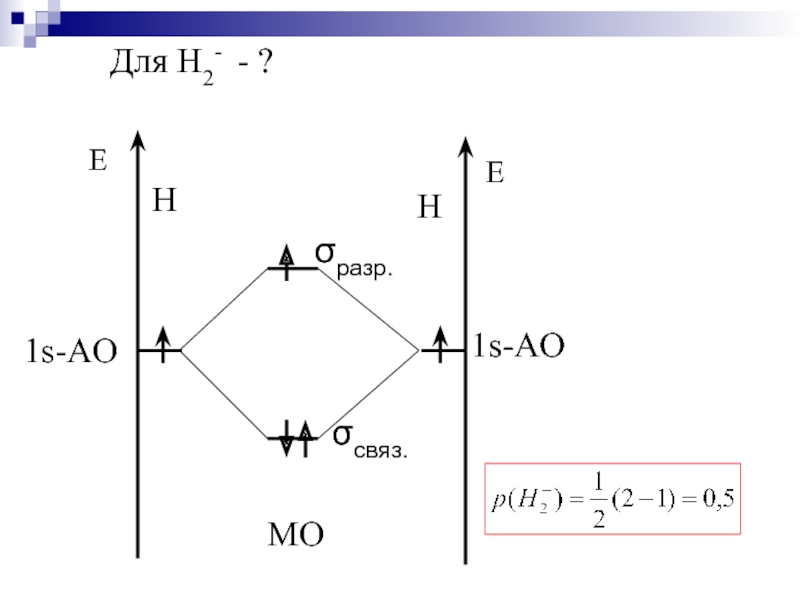
- 38. Для Н2- - ?
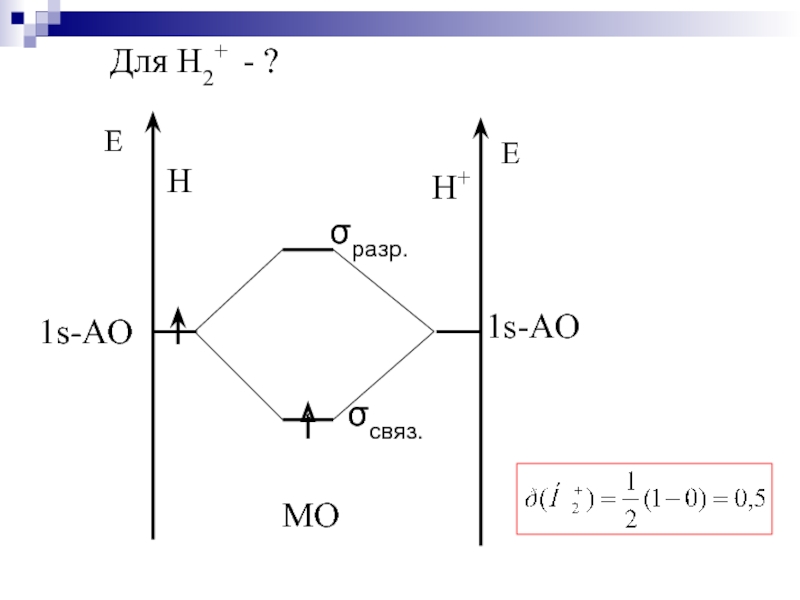
- 39. Для Н2+ - ?
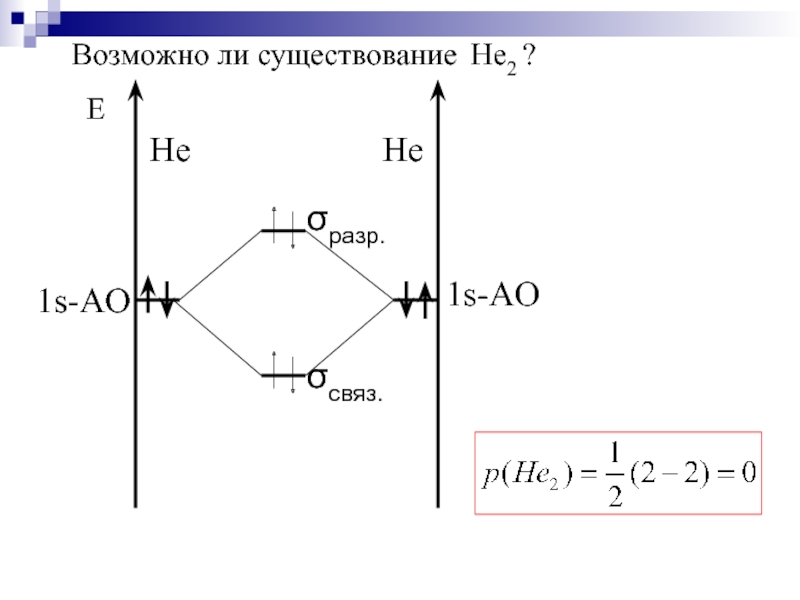
- 40. Возможно ли существование Не2 ?
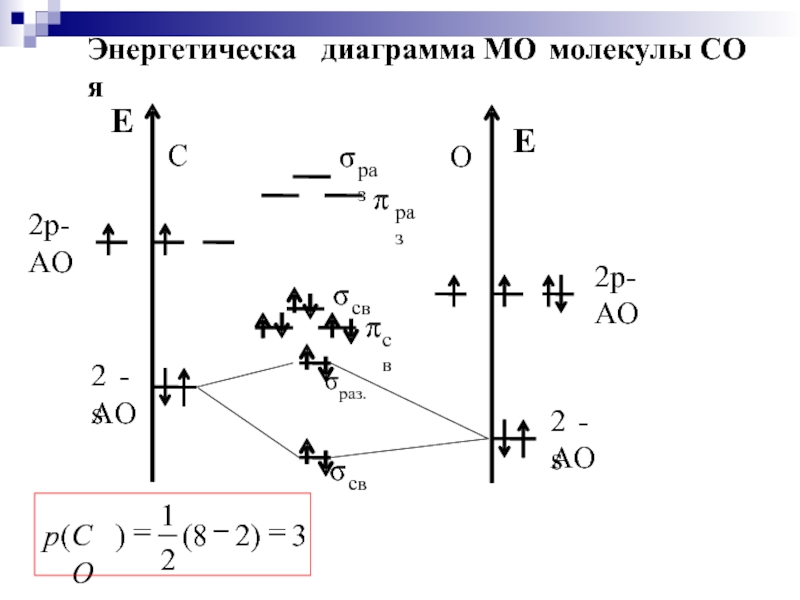
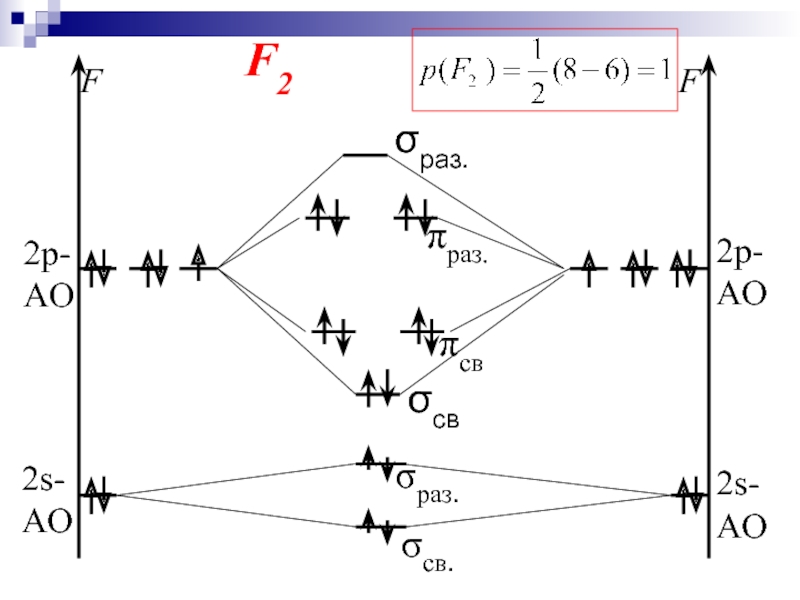
- 42. F2
- 43. σcв σcв σраз Энергетическая диаграмма, иллюстрирующая с
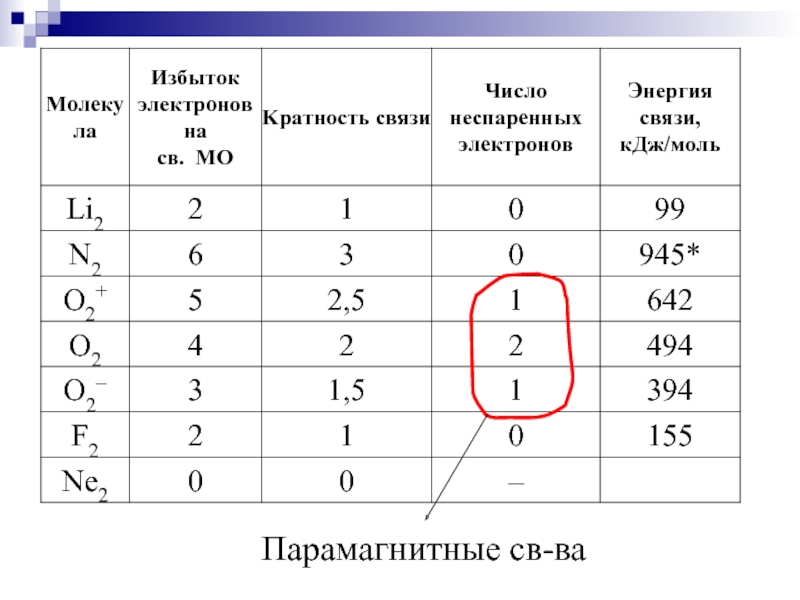
- 44. Наличие спаренных или неспаренных электронов в атомах,
- 45. Парамагнитные св-ва
- 46. Сравнительная характеристика методов: ВС и
- 47. МО достоинства: ∙общий подход при описании
Слайд 3Термодинамика процесса образования ХС.
Энтальпийный
фактор
Энтропийный
фактор
Процесс самопроизвольный, т.е. ∆ G
А + В → АВ
S1
S2
S1 > S2 ⇒ ∆S < 0
Т∆S < 0, а это не способствует образованию х.с.
Слайд 4
∆ G < 0 только если ∆Н < 0
Основной причиной образования
Слайд 5
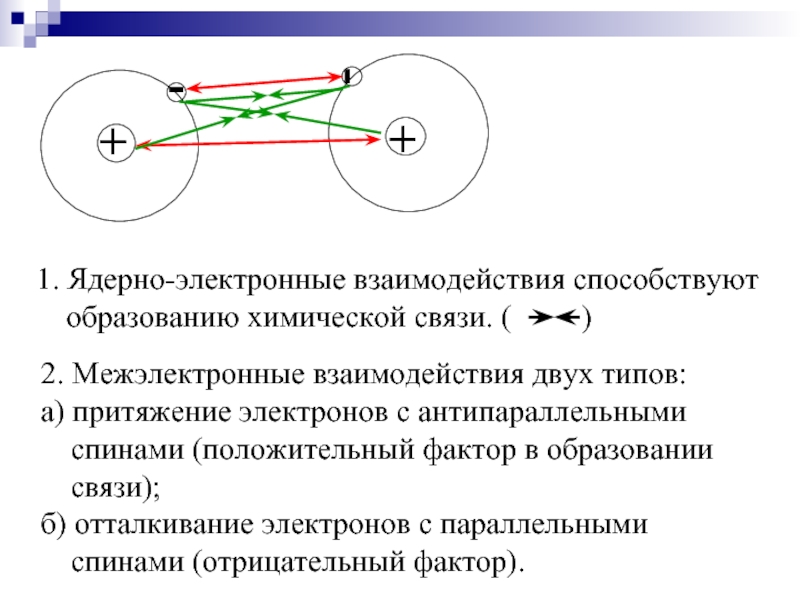
2. Межэлектронные взаимодействия двух типов:
а) притяжение электронов с антипараллельными спинами (положительный
б) отталкивание электронов с параллельными спинами (отрицательный фактор).
Слайд 6В 1927 В. Гайтлер и Ф. Лондон
Исследовали зависимость потенциальной энергии
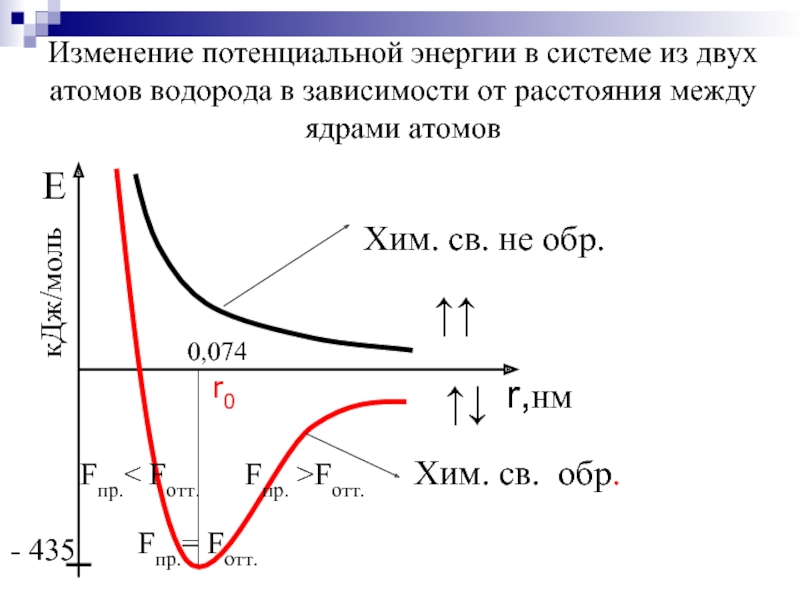
Слайд 7r,нм
Изменение потенциальной энергии в системе из двух атомов водорода в зависимости
0,074
Fпр.= Fотт.
Fпр. >Fотт.
Fпр.< Fотт.
Слайд 8Химическая связь – это совокупность электронно – ядерных взаимодействий, приводящих к
Энергия связи – это…
Длина связи – это…
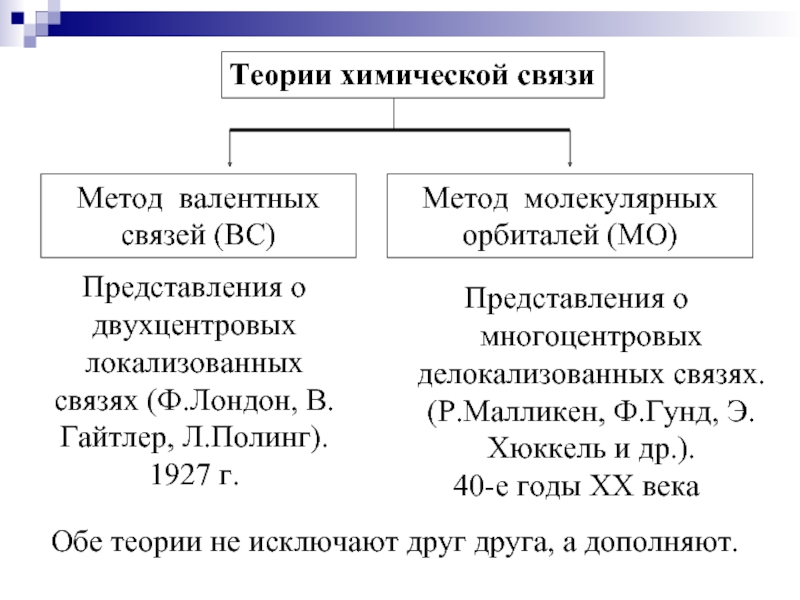
Слайд 9Теории химической связи
Метод валентных
связей (ВС)
Метод молекулярных
орбиталей (МО)
Представления о двухцентровых
1927 г.
Представления о многоцентровых делокализованных связях. (Р.Малликен, Ф.Гунд, Э.Хюккель и др.).
40-е годы ХХ века
Обе теории не исключают друг друга, а дополняют.
Слайд 10Основные положения метода ВС
1. Х. с. между атомами образуется в результате
2. Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами.
3. При обр. х. с. происходит частичное перекрывание АО, что приводит к увеличению электронной плотности в межъядерном пространстве.
4. Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие АО.
Слайд 115. В пространстве х. с. располагается в том направлении, в котором
6. Связь, образованная перекрыванием АО по линии, соединяющей центры атомов, называется – σ- связью, а по обе стороны от линии - π-связью.
Еσ > Еπ
7. Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи.
8.Общая электронная пара соответствует единице химической связи.
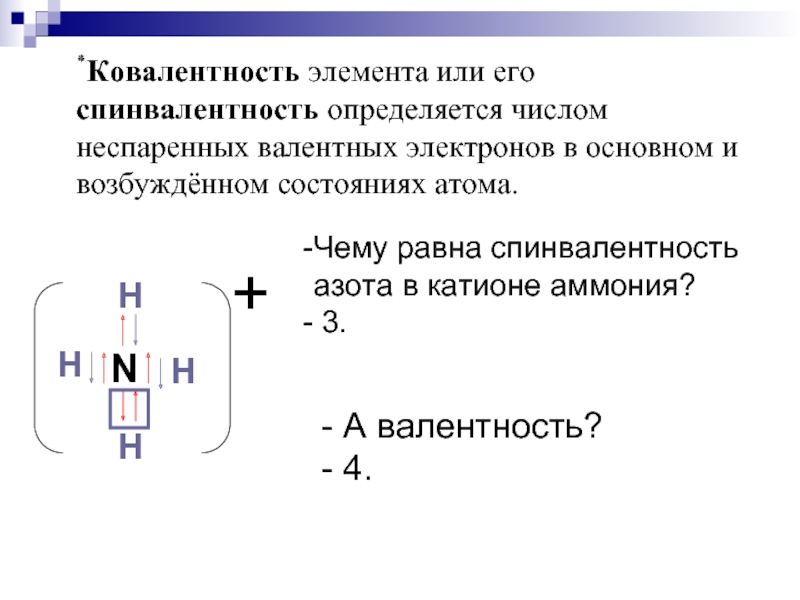
Слайд 12٭Ковалентность элемента или его спинвалентность определяется числом неспаренных валентных электронов в
Чему равна спинвалентность азота в катионе аммония?
3.
- А валентность?
- 4.
Слайд 13
Каждый атом дает по одному неспаренному электрону в общую электронную пару
Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь
Слайд 14Свойства ковалентной химической связи
1. Энергия связи
2. Длина связи
3. Кратность связи
4. Насыщаемость
5.
6. Полярность
7. Поляризуемость
Слайд 16Насыщаемость связи -…
II период – макс. валентность не более IV
III
( не всегда реализуется)
Макс. валентность атома зависит от положения элемента в ПС.
Слайд 19Полярность связи-…
Чем ↑Δ ОЭО, тем ↑ полярность х.с
Если ΔОЭО = 0
Если ΔОЭО ≈ 2,5-3,2 связь условно считают ионной и рассматривают как предельный случай ковалентной полярной связи.
Слайд 21т.е. степень ионности равна 83%.
Полного перетягивания связующих пар электронов от
Слайд 25Дипольный момент молекулы зависит:
∙от полярности связей;
∙от геометрии молекулы;
∙от
Слайд 26Поляризуемость
Поляризуемость ковалентной связи – это …
Полярярностью и поляризуемостью обусловленно межмолекулярное взаимодействие,
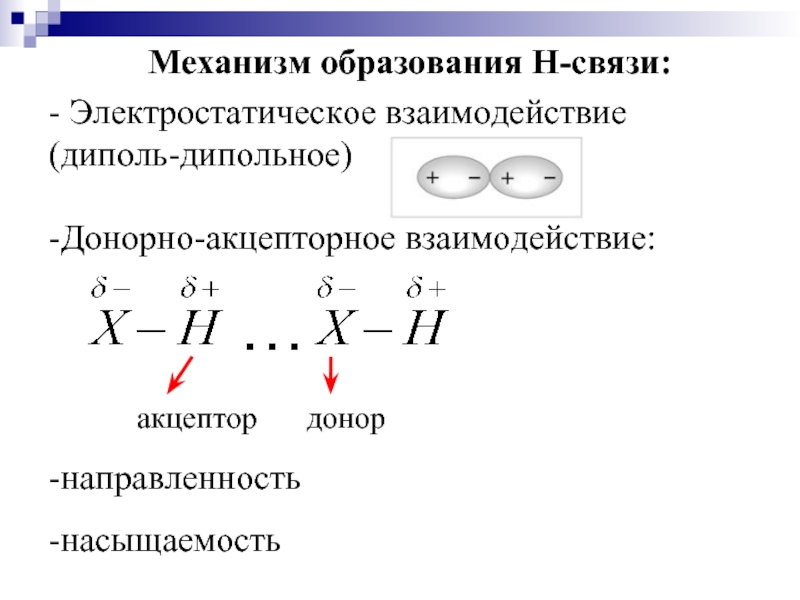
Слайд 31Механизм образования Н-связи:
- Электростатическое взаимодействие (диполь-дипольное)
-Донорно-акцепторное взаимодействие:
-направленность
-насыщаемость
Слайд 34Основные положения метода
молекулярных орбиталей (ММО)
1. При образовании молекулы по ММО изменяют
2. МО – это объём пространства в поле нескольких ядер, где вероятность нахождения электронов составляет 90-95%
Слайд 353.Для получения МО используют метод линейной комбинации атомных орбиталей МЛКАО. Из
а) связывающая, которая характеризуется меньшим запасом энергии по сравнению с запасом энергии АО;
б) разрыхляющая – с большим запасом энергии.
4. Число МО равно сумме АО соединяемых атомов.
Например, для молекулы Н2О:
2АО(Н) + 8АО(О) = 10МО.
5. Распределение электронов на МО молекулы подчиняется тем же правилам, что и по АО в атоме (принцип мин. полной энергии молекулы, запрет Паули, правило Гунда).
Слайд 366. Химическая связь в ММО характеризуется энергией связи и кратностью. Кратность
Если р > 0, то химическая связь реализуется, тем больше энергия и прочность связи.
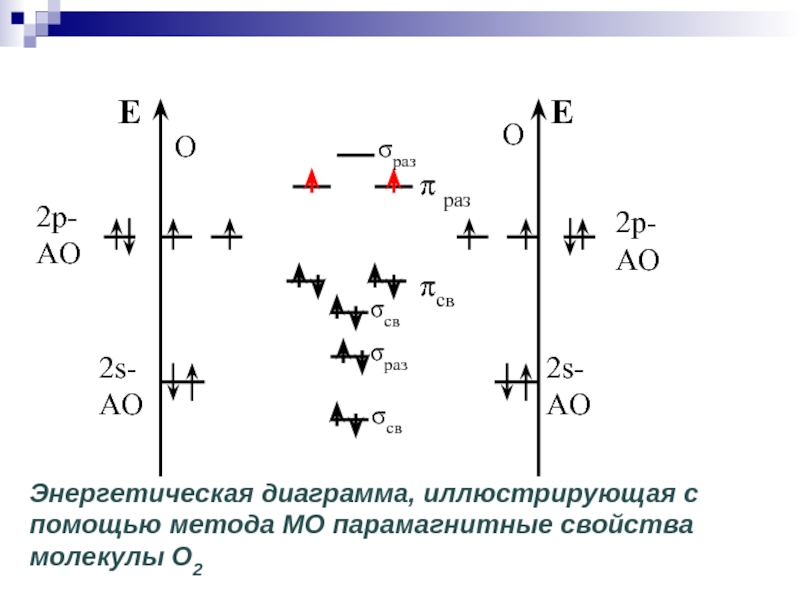
Слайд 43σcв
σcв
σраз
Энергетическая диаграмма, иллюстрирующая с помощью метода МО парамагнитные свойства молекулы O2
π
πсв
σраз
Слайд 44Наличие спаренных или неспаренных электронов в атомах, молекулах и кристаллах устанавливается
Слайд 46
Сравнительная характеристика
методов: ВС и МО
ВС
достоинства:
нагляден; описывает геометрию молекул
недостатки:
∙не рассматривает вклад неспаренных электронов в образовании связи (природу связи в частице Н2+);
∙не может объяснить магнитные свойства вещества (например парамагнитные свойства О2)
Слайд 47МО
достоинства:
∙общий подход при описании всех хим. соед.;
Выбор метода определяется
недостатки:
∙ненагляден;
∙не объясняет геометрии молекул