- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фенолы презентация
Содержание
- 1. Фенолы
- 2. Фено́лы — органические соединения ароматического ряда, в
- 3. Физические свойства Фенол — токсичное вещество, вызывает
- 4. Получение фенолов Мировое производство фенола - более
- 5. Получение фенолов Гидролиз солей диазония Из растительного сырья
- 6. Реакции фенолов 1. Реакции по гидроксильной группе
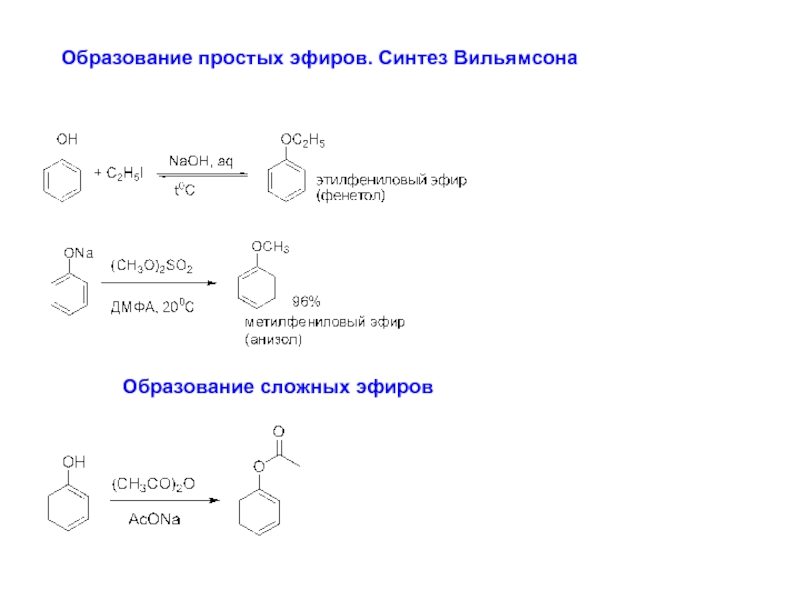
- 7. Образование простых эфиров. Синтез Вильямсона Образование сложных эфиров
- 8. Реакции фенолов 2. Реакции с участием бензольного
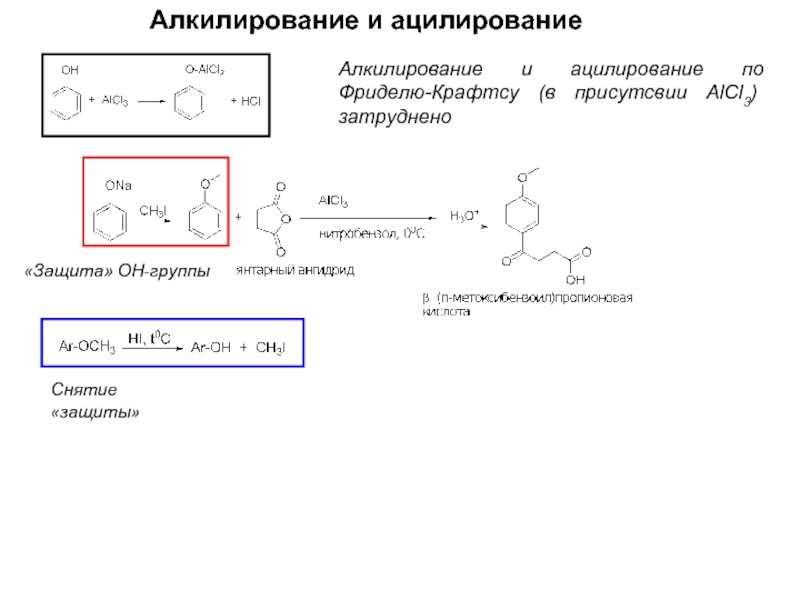
- 9. Реакции фенолов. Алкилирование и ацилирование О-алкилирование
- 10. Алкилирование и ацилирование Алкилирование и ацилирование по
- 11. Алкилирование и ацилирование Перегруппировка Кляйзена Перегруппировка Фриса
- 12. Карбоксилирование. Реакция Кольбе Адольф Вильгельм Герман
- 13. Формилирование фенола. Реакция Раймера-Тимана 1. Генерирование карбена: 2. Присоединение дихлоркарбена и гидролиз
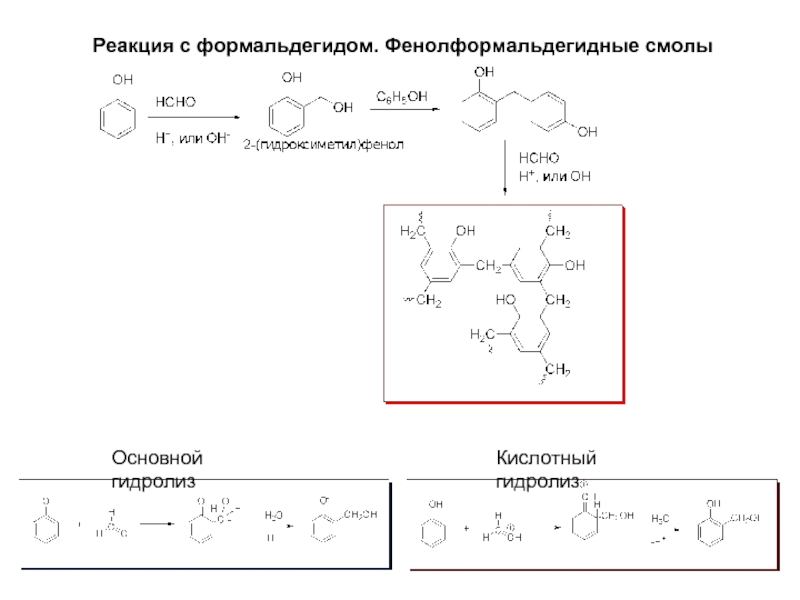
- 14. Реакция с формальдегидом. Фенолформальдегидные смолы Основной гидролиз Кислотный гидролиз
- 15. Применение Мировое потребление фенола (2006 г.):
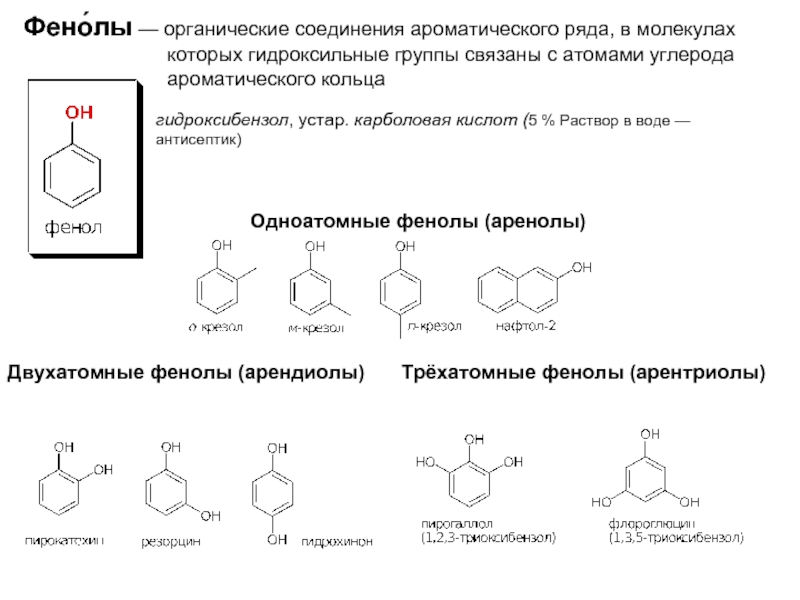
Слайд 2Фено́лы — органические соединения ароматического ряда, в молекулах
гидроксибензол, устар. карболовая кислот (5 % Раствор в воде — антисептик)
Одноатомные фенолы (аренолы)
Двухатомные фенолы (арендиолы)
Трёхатомные фенолы (арентриолы)
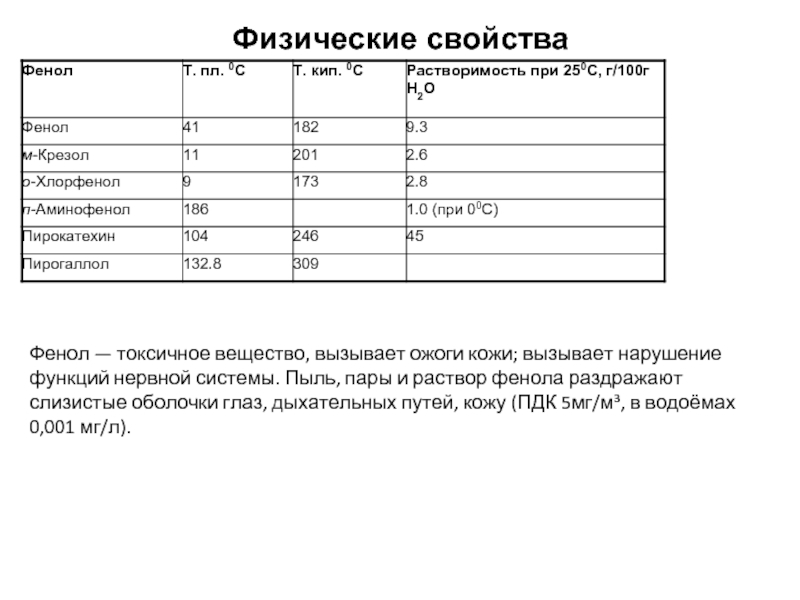
Слайд 3Физические свойства
Фенол — токсичное вещество, вызывает ожоги кожи; вызывает нарушение функций
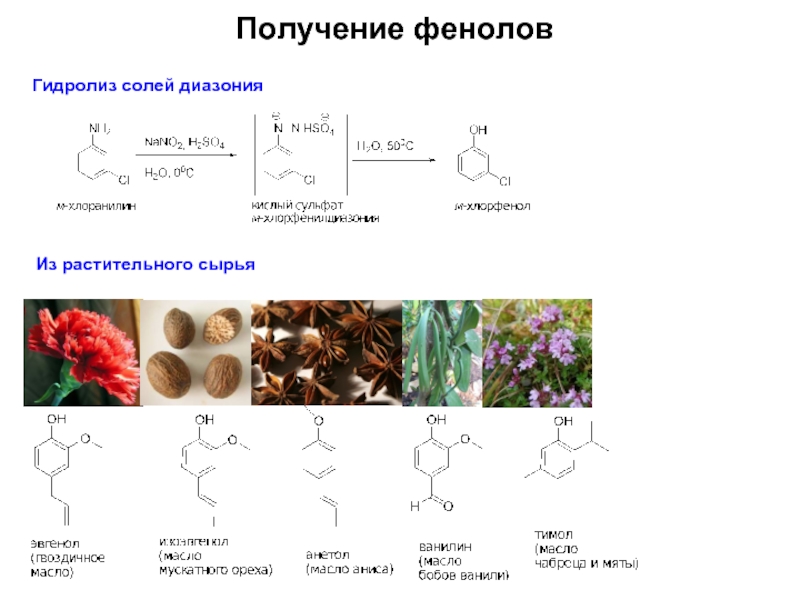
Слайд 4Получение фенолов
Мировое производство фенола - более 8,3 млн тонн/год (2006г.)
Кумольный метод (более
«Dow»-процесс
Около 2% фенола и крезолы получают из каменноугольной смолы
Сплавление сульфонатов со щелочью
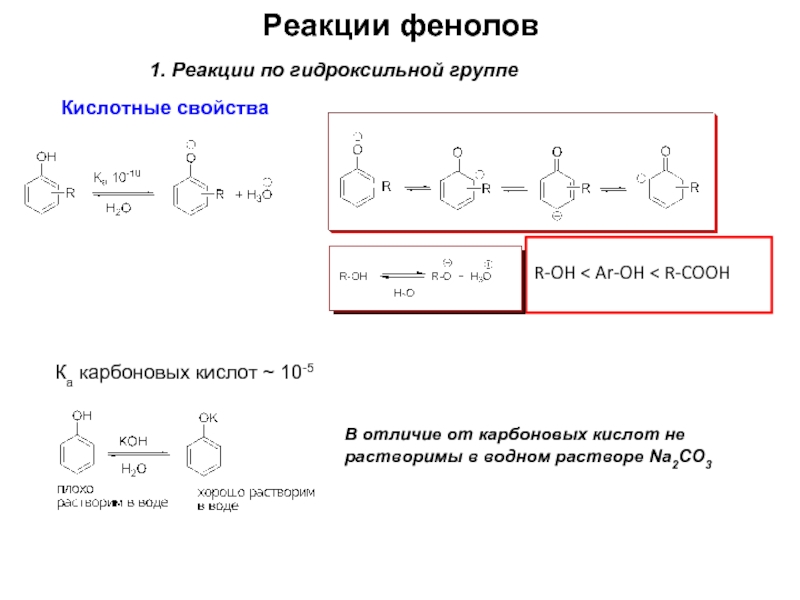
Слайд 6Реакции фенолов
1. Реакции по гидроксильной группе
Ка карбоновых кислот ~ 10-5
В отличие
R-OH < Ar-OH < R-COOH
Кислотные свойства
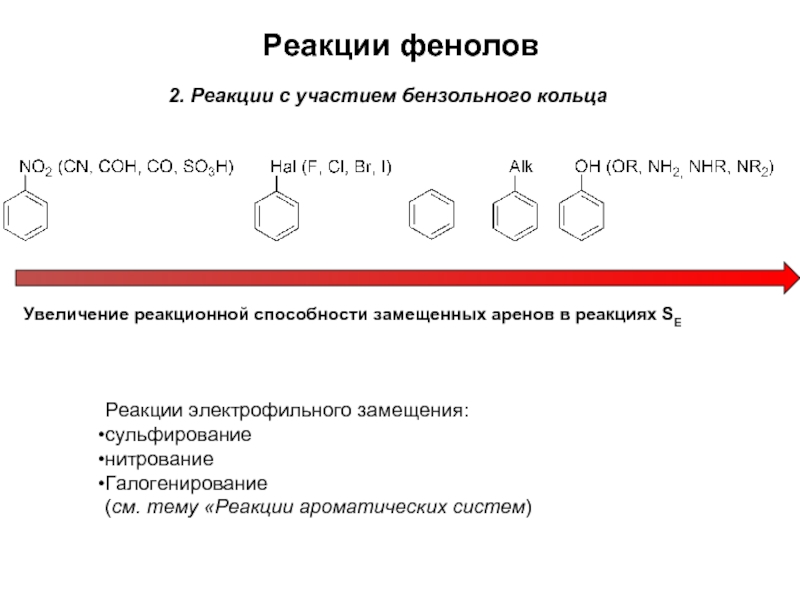
Слайд 8Реакции фенолов
2. Реакции с участием бензольного кольца
Увеличение реакционной способности замещенных аренов
Реакции электрофильного замещения:
сульфирование
нитрование
Галогенирование
(см. тему «Реакции ароматических систем)
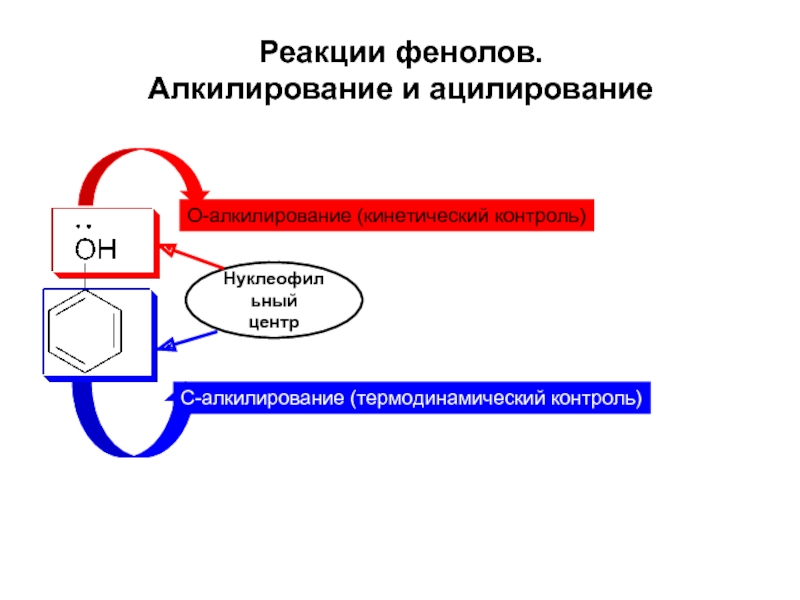
Слайд 9Реакции фенолов.
Алкилирование и ацилирование
О-алкилирование (кинетический контроль)
С-алкилирование (термодинамический контроль)
Нуклеофильный
центр
Слайд 10Алкилирование и ацилирование
Алкилирование и ацилирование по Фриделю-Крафтсу (в присутсвии AlCl3) затруднено
«Защита»
Снятие «защиты»
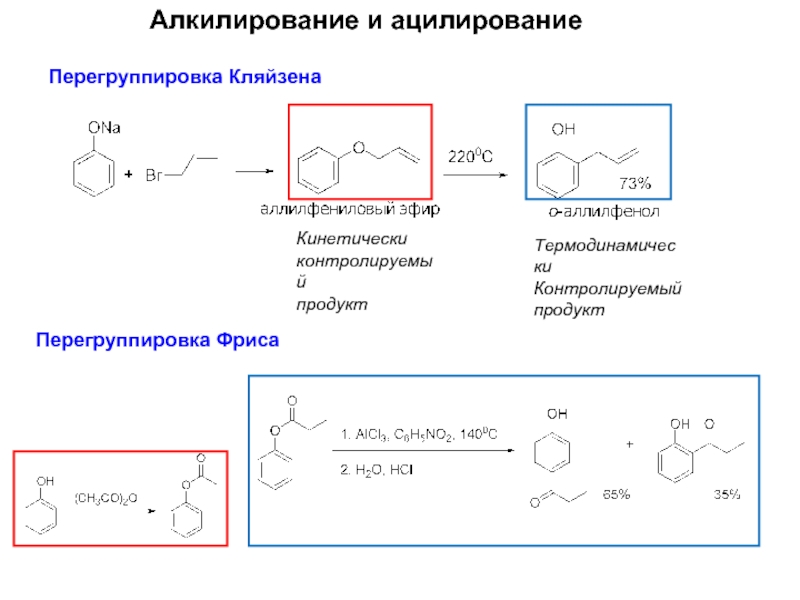
Слайд 11Алкилирование и ацилирование
Перегруппировка Кляйзена
Перегруппировка Фриса
Кинетически
контролируемый
продукт
Термодинамически
Контролируемый
продукт
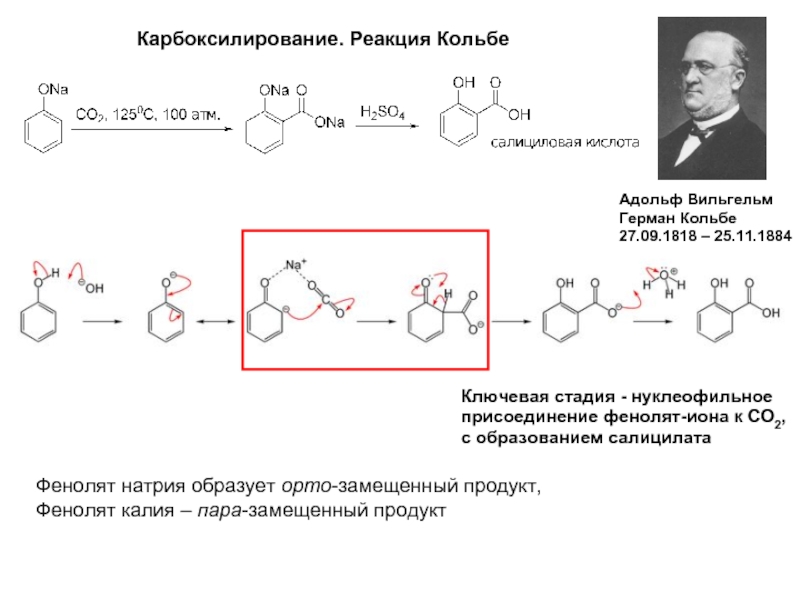
Слайд 12Карбоксилирование. Реакция Кольбе
Адольф Вильгельм
Герман Кольбе
27.09.1818 – 25.11.1884
Ключевая стадия - нуклеофильное
присоединение фенолят-иона к СО2,
с образованием салицилата
Фенолят натрия образует орто-замещенный продукт,
Фенолят калия – пара-замещенный продукт
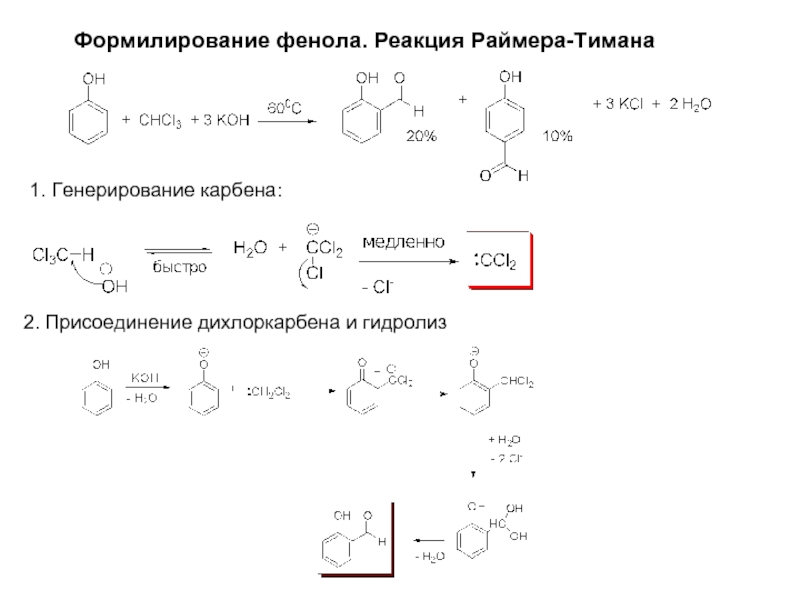
Слайд 13Формилирование фенола. Реакция Раймера-Тимана
1. Генерирование карбена:
2. Присоединение дихлоркарбена и гидролиз
Слайд 15Применение
Мировое потребление фенола (2006 г.):
44 % - на производство бисфенола А, который,
30 % - производство фенолформальдегидных смол
12 % фенола гидрированием превращается в циклогексанол (используемый для получения нейлона и капрона)
14 % - на другие нужды, в том числе на производство антиоксидпнтов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов.
Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство.
Фенол и его производные обуславливают консервирующие свойства коптильного дыма.Также фенол используют в качестве консерванта в вакцинах.