- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах. презентация
Содержание
- 1. Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах.
- 2. 1) Знать: понятия «электролиты», «неэлектролиты», «электролитическая диссоциация»,
- 3. Выполните задания 1. Из приведенного списка веществ
- 4. Проверка задания 1. Кислоты: H2SO4, HCl.
- 5. Вещества с ионной связью.
- 6. Вещества с ковалентной связью. Йод
- 7. Проблемный вопрос «Дождливый день.
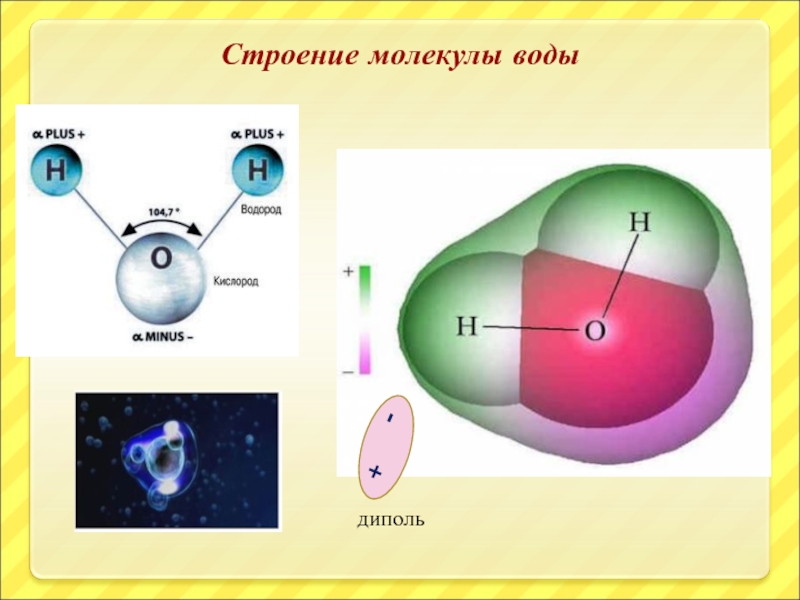
- 8. Строение молекулы воды диполь
- 10. Опыт. Испытание веществ электрическим током. Проверка электропроводности:
- 11. Опыт. Испытание веществ электрическим током. Проверка электропроводности:
- 12. Опыт. Испытание веществ электрическим током. Проверка электропроводности:
- 14. Электролиты Неэлектролиты
- 15. Электролиты в водном растворе или расплаве распадаются
- 16. +
- 18. «Честь науке- ей дано уменье, выводить нас
- 19. + + - - + + -
- 20. Раствор
- 21. Катионы – это положительно заряженные ионы АНОД
- 22. Тепловые явления при растворении. Кристаллогидраты http://edu.kubannet.ru/dlrstore/617fb4d9-8cff-11db-b606-0800200c9a66/ch08_34_03.swf CuSO4
- 23. Сванте Август Аррениус (1859-1927) Один из основоположников
- 24. Иван Алексеевич Каблуков (1857-1942).
- 25. Кистяковский Владимир Александрович
- 26. Дмитрий Иванович Менделеев Д. И.
- 27. Основные положения ТЭД 1. Электролиты в водной
- 28. О значении электролитов для
- 29. Каким образом ток добрался до пассажира?
- 30. Ошибка Молодец Молодец Ошибка
- 31. Крестики-нолики Выигрышный путь – электролиты. Выигрышный путь – неэлектролиты.
- 32. Вставьте недостающие слова: 1. Все
- 33. Электролитическая диссоциация Проверка знаний А Атомы Протоны Ионы Молекулы
- 34. Электролитическая диссоциация Проверка знаний А
- 35. Соотнесите А. Электролиты 1) Кислоты Б. Неэлектролиты 2)
- 36. Домашнее задание §1, упр. 5,6, с. 13
Слайд 1
Тема урока:
Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах.
9
Слайд 21) Знать: понятия «электролиты», «неэлектролиты», «электролитическая диссоциация», основные положения теории электролитической
Цели урока:
Слайд 3Выполните задания
1. Из приведенного списка веществ выберите:
а) кислоты; б) щелочи;
Na2O, KOH, H2SO4, Mg, C6H12O6, BaCl2, NaNO3, HCl, P2O5, NaOH.
2. Определите в выбранных веществах тип химической связи.
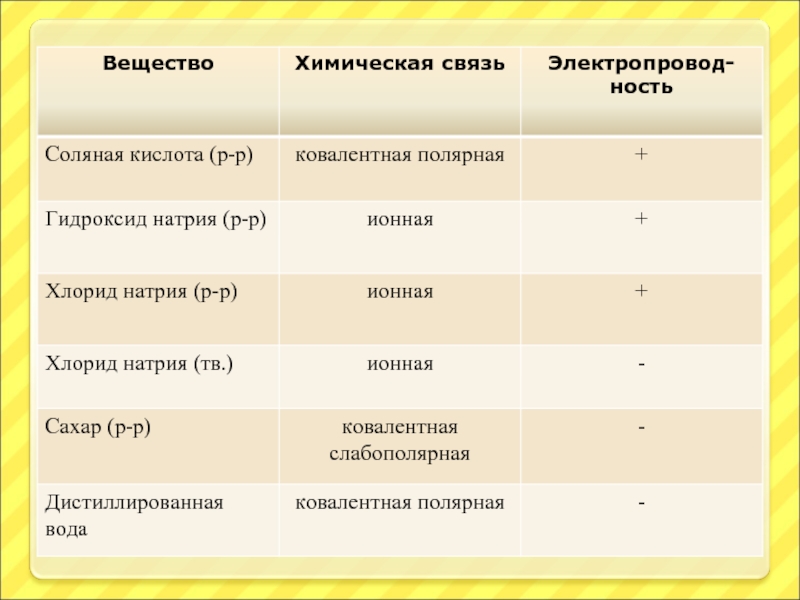
Слайд 4Проверка задания
1. Кислоты: H2SO4, HCl.
Щелочи:KOH, NaOH.
Соли:BaCl2, NaNO3.
2.
HCl – ковалентная полярная связь.
KOH – ионная и ковалентная полярная связь.
NaOH – ионная и ковалентная полярная связь.
BaCl2 – ионная связь.
NaNO3 – ионная и ковалентная полярная связь.
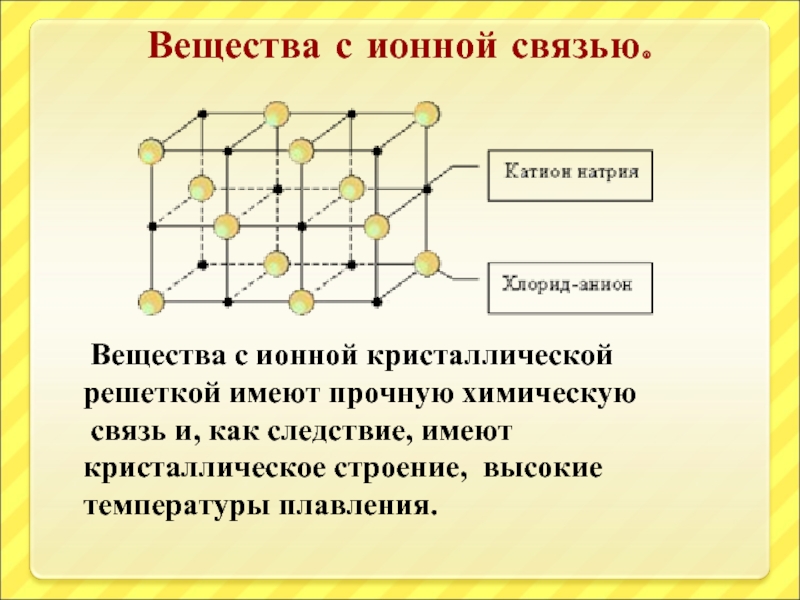
Слайд 5Вещества с ионной связью.
Вещества с ионной кристаллической решеткой имеют
связь и, как следствие, имеют кристаллическое строение, высокие температуры плавления.
Слайд 6Вещества с ковалентной связью.
Йод
Их толочь не надо в ступке -
Так кристаллы эти хрупки.
Чуть-чуть нагреваются,
И тотчас испаряются.
Слайд 7Проблемный вопрос
«Дождливый день. На остановке троллейбуса люди складывают зонтики
Как же ток добрался до пассажира?
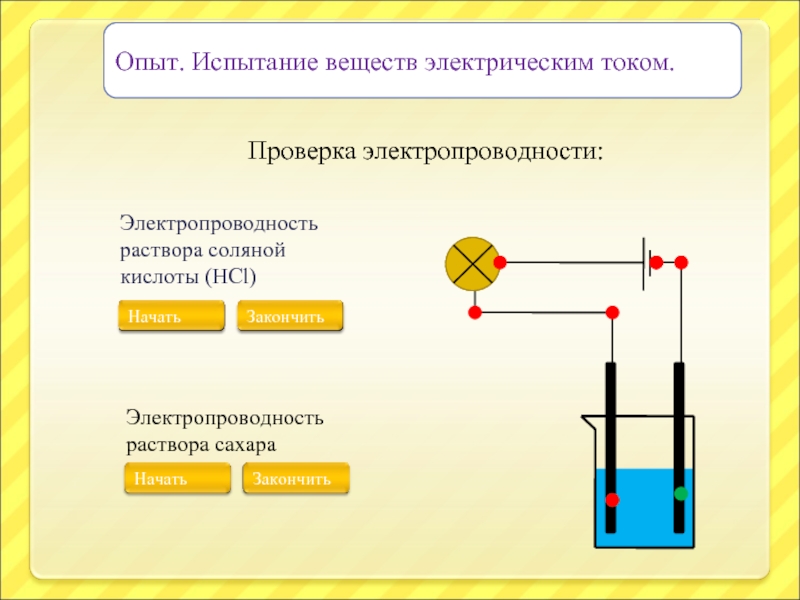
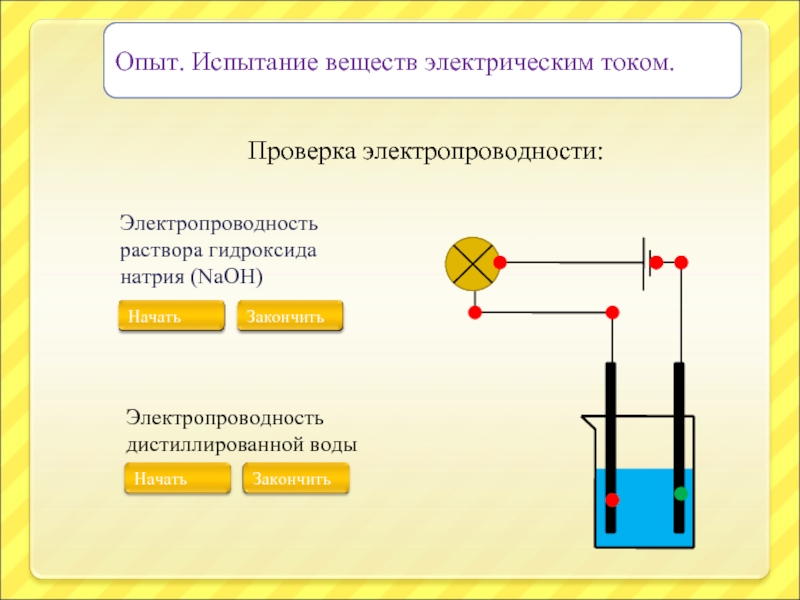
Слайд 10Опыт. Испытание веществ электрическим током.
Проверка электропроводности:
Электропроводность раствора соляной кислоты (HCl)
Электропроводность
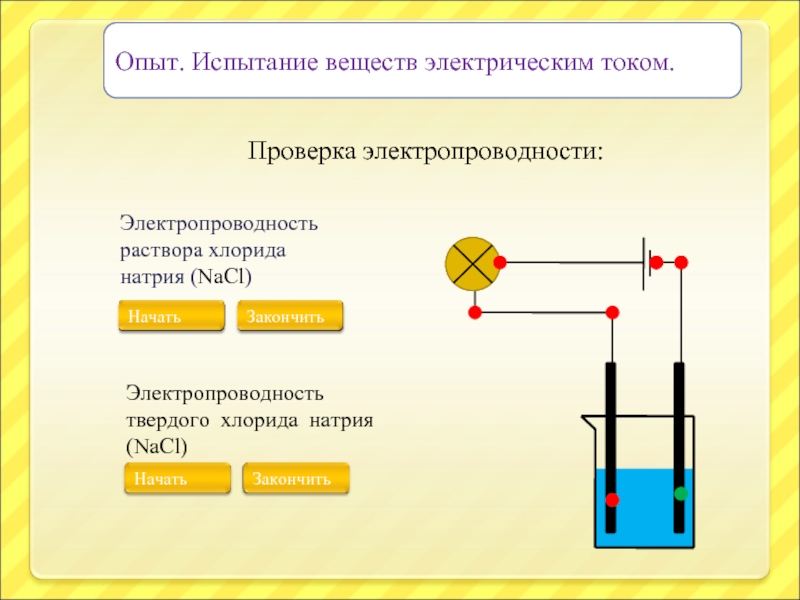
Слайд 11Опыт. Испытание веществ электрическим током.
Проверка электропроводности:
Электропроводность раствора хлорида натрия (NaCl)
Электропроводность
Слайд 12Опыт. Испытание веществ электрическим током.
Проверка электропроводности:
Электропроводность раствора гидроксида натрия (NaOH)
Электропроводность
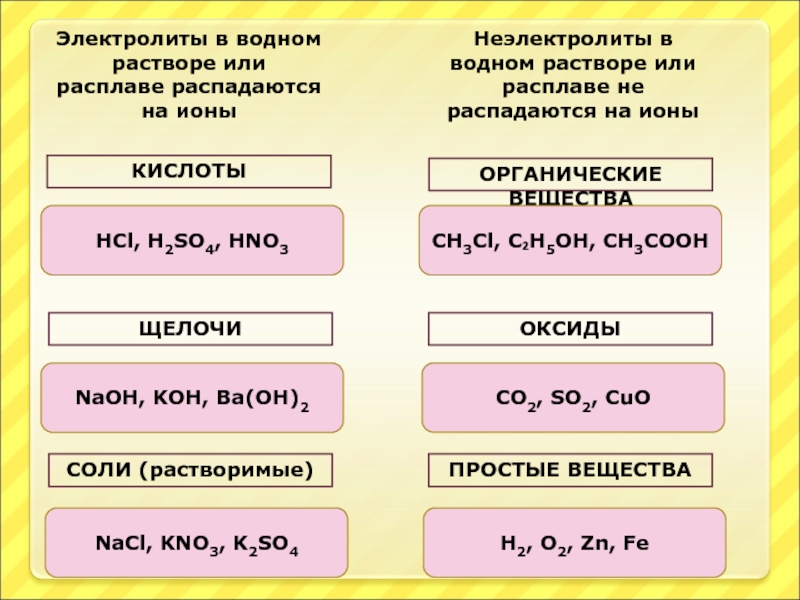
Слайд 15Электролиты в водном растворе или расплаве распадаются на ионы
Неэлектролиты в водном
КИСЛОТЫ
ЩЕЛОЧИ
СОЛИ (растворимые)
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
ОКСИДЫ
ПРОСТЫЕ ВЕЩЕСТВА
HCl, H2SO4, HNO3
NaOH, KOH, Ba(OH)2
NaCl, KNO3, K2SO4
CH3Cl, C₂H5OH, CH3COOH
H2, O2, Zn, Fe
CO2, SO2, CuO
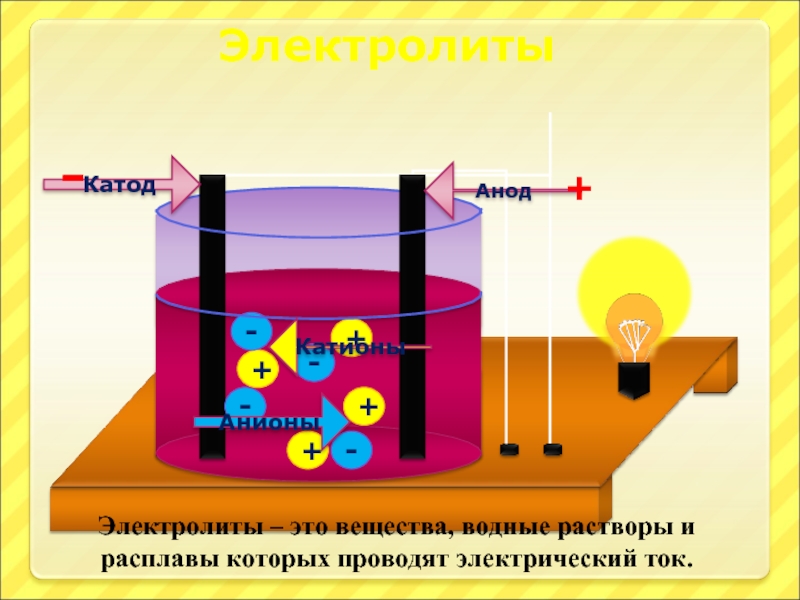
Слайд 16
+
+
+
+
-
-
-
-
Анионы
Катионы
Анод
Катод
-
+
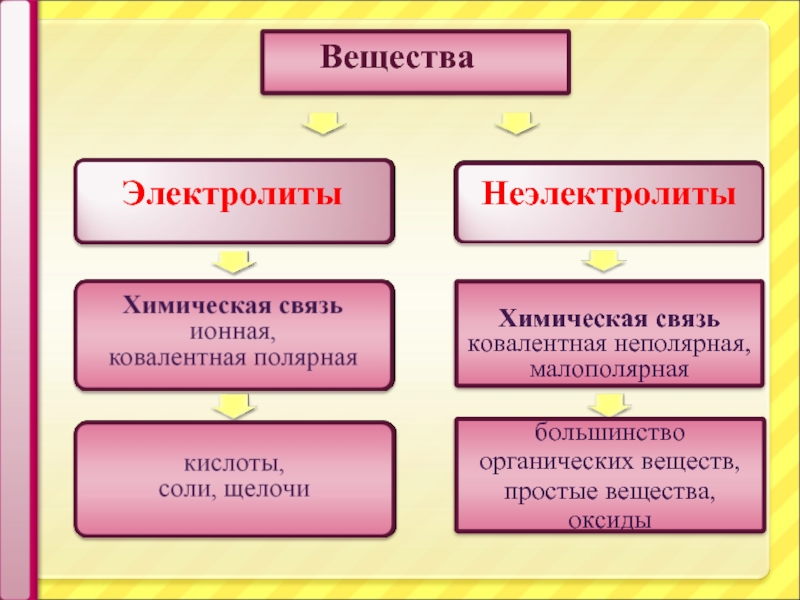
Электролиты – это вещества, водные растворы и расплавы которых проводят электрический
Электролиты
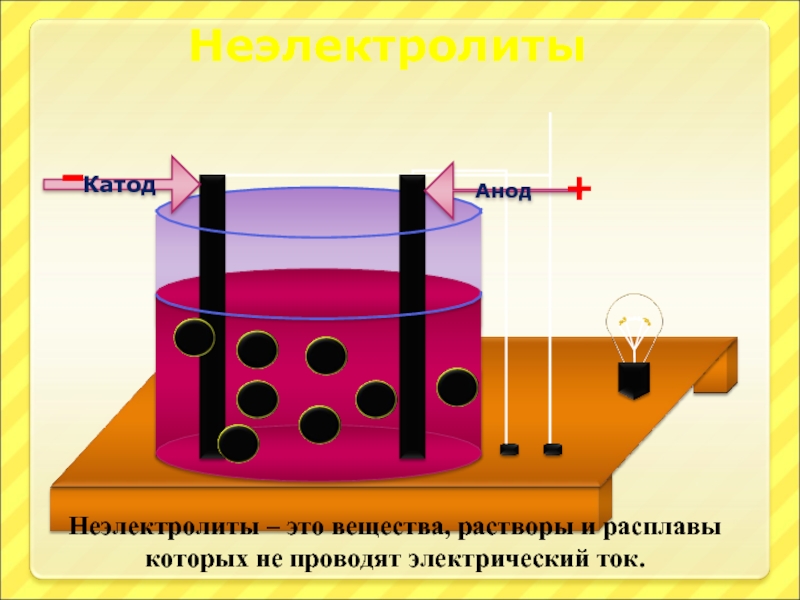
Слайд 17
Анод
Катод
-
+
Неэлектролиты – это вещества, растворы и расплавы которых не проводят электрический
Неэлектролиты
Слайд 18«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов
процесс распада
С.Аррениус
Электролитическая диссоциация -
Теория электролитической диссоциации. 1887 г.
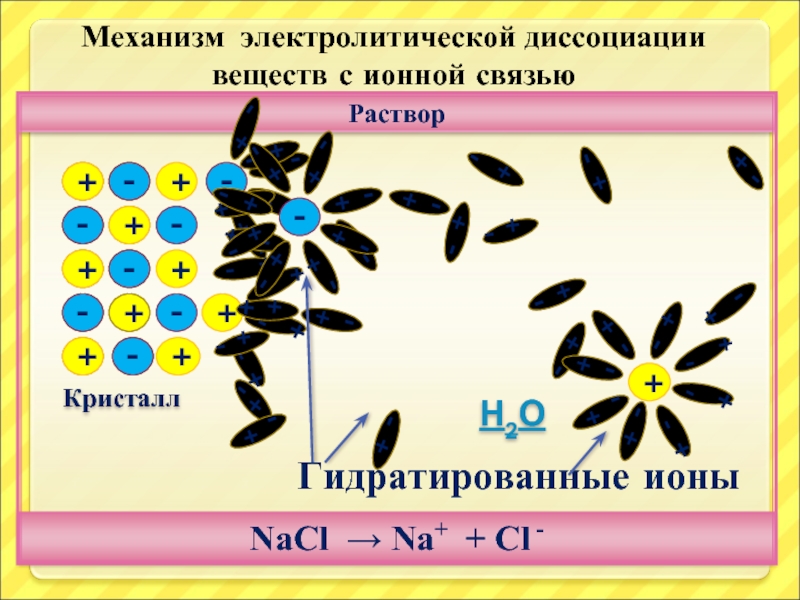
Слайд 19+
+
-
-
+
+
-
-
Раствор
Кристалл
-
+
+
+
-
-
+
+
-
-
-
+
NaCl → Na+ + Cl -
Механизм электролитической диссоциации
веществ с
Гидратированные ионы
Н2О
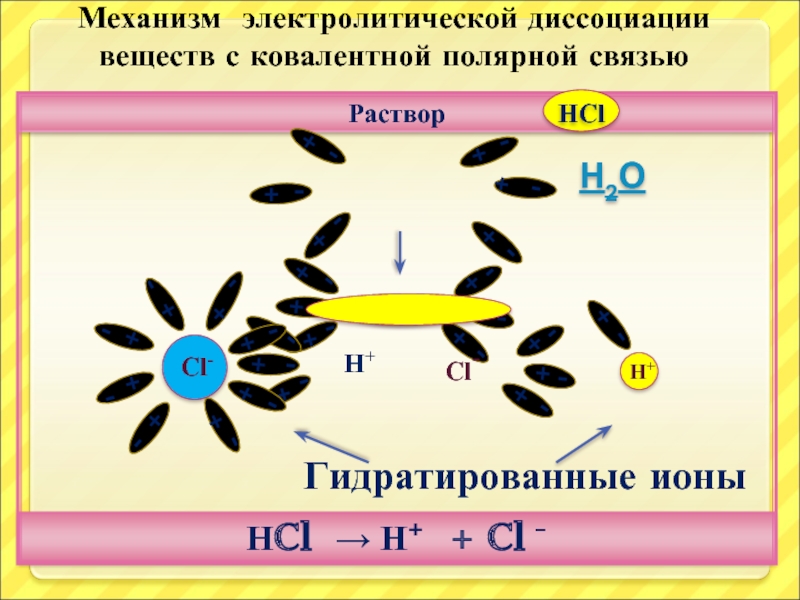
Слайд 20
Раствор
НCl → Н+ + Cl -
Механизм электролитической диссоциации
веществ с
Н2О
Гидратированные ионы
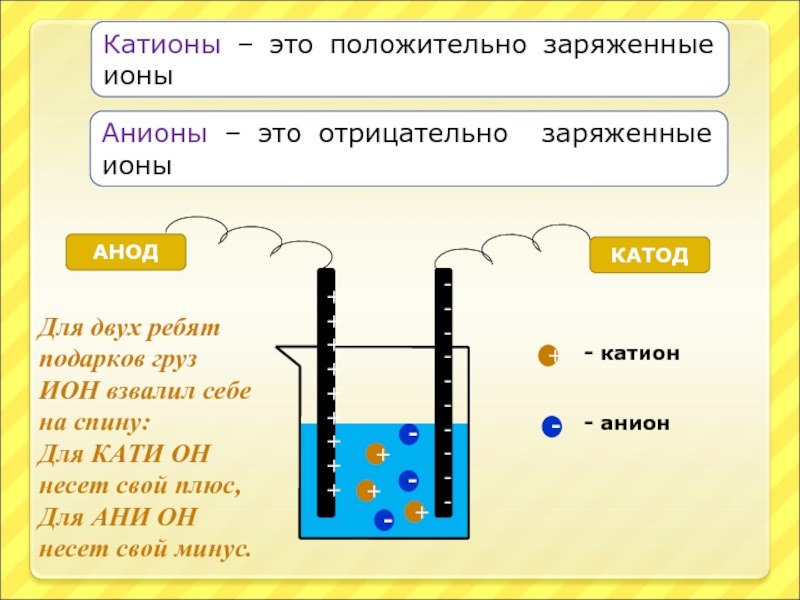
Слайд 21Катионы – это положительно заряженные ионы
АНОД
КАТОД
+
+
+
-
-
-
+
-
- катион
- анион
Анионы – это отрицательно
Для двух ребят подарков груз
ИОН взвалил себе на спину:
Для КАТИ ОН несет свой плюс,
Для АНИ ОН несет свой минус.
Слайд 22Тепловые явления при растворении. Кристаллогидраты
http://edu.kubannet.ru/dlrstore/617fb4d9-8cff-11db-b606-0800200c9a66/ch08_34_03.swf
CuSO4 + 5H2O = CuSO4 ∙ 5H2O
Сульфат
кристаллогидрат (пентагидрат) сульфата меди (II)
белый
синий
(медный купорос)
Слайд 23Сванте Август Аррениус (1859-1927)
Один из основоположников физической химии. Основные научные работы
Слайд 24Иван Алексеевич Каблуков (1857-1942).
Ввёл в науку представление о сольватации (гидратации) ионов, послужившее основой для объединения химических и физических теорий растворов.
Слайд 26Дмитрий Иванович Менделеев
Д. И. Менделеев разработал химическую теорию растворов,
Слайд 27Основные положения ТЭД
1. Электролиты в водной среде (и в расплавленном состоянии)
2. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
3. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
Слайд 28
О значении электролитов для живых организмов
Электролиты –
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; имеют большое значение для физиологических и биохимических процессов:
ионы H+; OH- играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0,85% раствор NaCl;
ионы I - влияют на работу щитовидной железы.
НCO3-
Слайд 30Ошибка
Молодец
Молодец
Ошибка
Молодец
Молодец
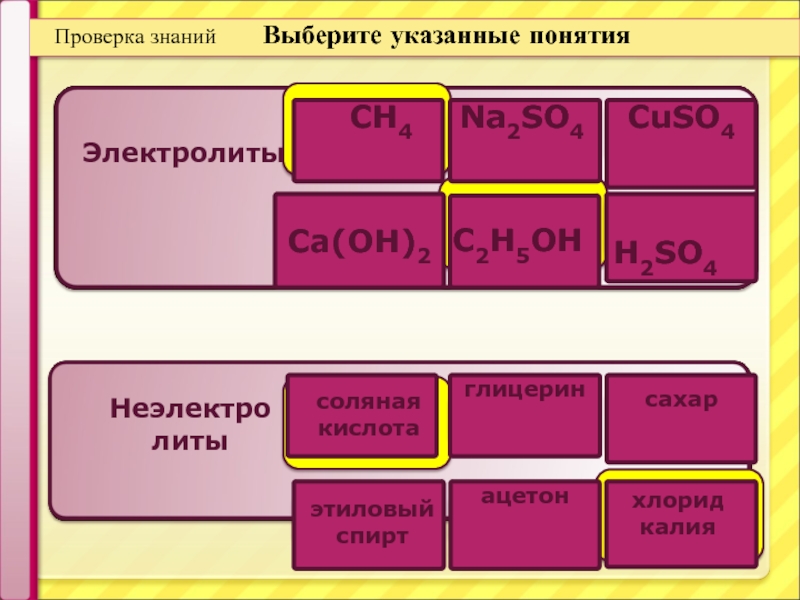
Ca(OH)2
Электролиты
Неэлектро
литы
Проверка знаний
Выберите указанные понятия
Слайд 32Вставьте недостающие слова:
1. Все вещества по их способности проводить электрический
2. Процесс распада электролита на ионы называется _____________ _____________.
3. В растворах электролиты диссоциируют на _____________ и _____________ ионы.
4. Положительно заряженные ионы называют _________ .
5. Отрицательно заряженные ионы называют __________.
Слайд 34
Электролитическая диссоциация
Проверка знаний
А
Д.И. Менделеев
М. В. Ломоносов
М. Фарадей
С. Аррениус
Слайд 35Соотнесите
А. Электролиты 1) Кислоты
Б. Неэлектролиты 2) Оксиды
4) Соли
5) Основания
Электролиты Ионы в растворе электролита
1) Cl¯
2) H +
А. NaCl 3) OH ¯
Б. KOH 4) Na
В. HNO3 5) NO3¯
6) K¯