- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрический ток в различных средах презентация
Содержание
- 1. Электрический ток в различных средах
- 2. Электрический ток в металлах
- 3. Электрический ток в металлах представляет собой упорядоченное движение свободных электронов
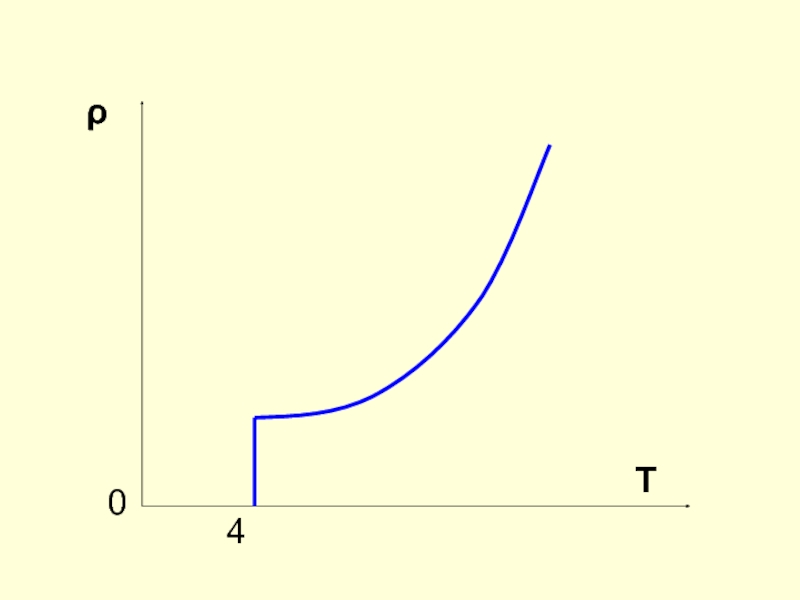
- 4. Зависимость сопротивления проводника от температуры ρ = ρ0 (1 + άΔТ)
- 5. СВЕРХПРОВОДИМОСТЬ 1911 г. – Камерлинг-Оннес При охлаждении
- 7. Применение сверхпроводников: Мощные электромагниты, работающие без затрат
- 8. 1986 г. – открыта высокотемпературная сверхпроводимость (Т ~ 100К) Электротехника Радиотехника Компьютерные технологии
- 9. Электрический ток в жидкостях
- 10. Жидкости: проводники (растворы кислот, щелочей и солей);
- 11. Электролитическая диссоциация Образование заряженных частиц в растворах и расплавах кислот, щелочей и солей.
- 12. Степень диссоциации (доля молекул, распавшихся на ионы)
- 13. Электрический ток в жидкостях Направленное движение положительных
- 14. Электролиз Процесс выделения на электродах вещества, связанный с окислительно – восстановительными реакциями.
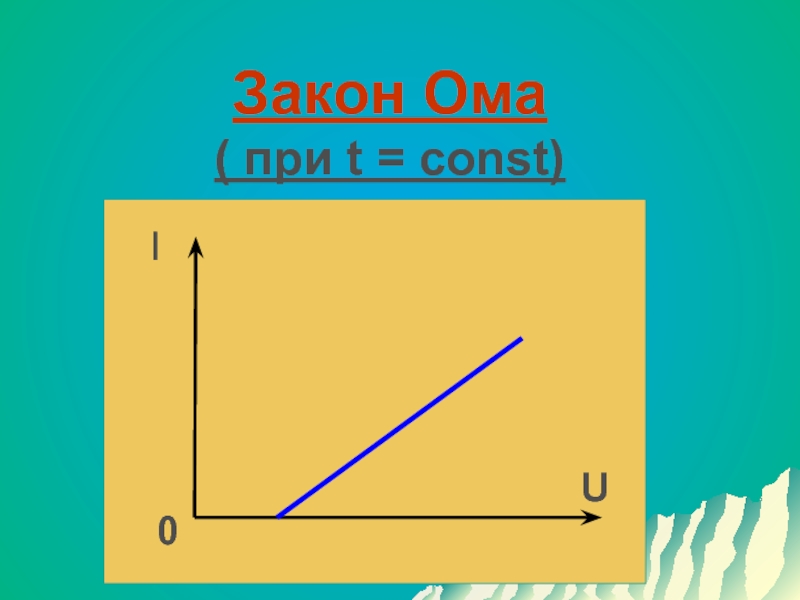
- 15. Закон Ома ( при t = const)
- 16. Масса вещества, выделяющегося на электродах за время
- 17. Масса вещества, выделившегося на
- 18. Постоянная
- 19. F = 9,65*104 Кл/моль
- 20. Применение электролиза Гальваностегия (нанесение покрытий). Гальванопластика (изготовление
- 21. Домашнее задание: Теория (по конспекту) Подготовить ответы на вопросы
Слайд 5СВЕРХПРОВОДИМОСТЬ
1911 г. – Камерлинг-Оннес
При охлаждении ртути в жидком гелии ее сопротивление
постепенно уменьшается, а при температуре 4,1 К резко падает до нуля.
Слайд 7Применение сверхпроводников:
Мощные электромагниты, работающие без затрат энергии. (Ускорители элементарных частиц.)
Если бы
удалось создать сверхпроводящие материалы при температурах, близких к комнатным – стала бы возможна передача электроэнергии без потерь.
Слайд 81986 г. – открыта высокотемпературная сверхпроводимость (Т ~ 100К)
Электротехника
Радиотехника
Компьютерные технологии
Слайд 10Жидкости:
проводники (растворы кислот, щелочей и солей);
диэлектрики (дистиллированная вода, керосин …)
полупроводники (расплавы
сульфидов, расплавленный селен).
Слайд 11Электролитическая диссоциация
Образование заряженных частиц в растворах и расплавах кислот, щелочей и
солей.
Слайд 12Степень диссоциации (доля молекул, распавшихся на ионы)
Зависит от:
концентрации раствора;
диэлектрической проницаемости раствора;
температуры
(с увеличением температуры – возрастает).
Слайд 13Электрический ток в жидкостях
Направленное движение положительных ионов к катоду и отрицательных
ионов к аноду
В жидких металлах – движение положительных ионов к катоду и электронов к аноду.
В жидких металлах – движение положительных ионов к катоду и электронов к аноду.
Слайд 14Электролиз
Процесс выделения на электродах вещества, связанный с окислительно – восстановительными реакциями.
Слайд 16Масса вещества, выделяющегося на электродах за время Δt
М. Фарадей 1836 г.
k
– электрохимический эквивалент вещества.
Слайд 17
Масса вещества, выделившегося на электроде при переносе через раствор заряда 1
Кл.
Отношение массы иона вещества к его заряду.
Слайд 18
Постоянная Фарадея
Заряд, который надо пропустить через раствор 1-валентного в-ва, чтобы
на электроде выделилось 1 моль вещества.
Слайд 19
F = 9,65*104 Кл/моль
- для одновалентного вещества
Для выделения на
электроде 1 моля n – валентного вещества, необходимо пропустить заряд, численно равный произведению nF.
Слайд 20Применение электролиза
Гальваностегия (нанесение покрытий).
Гальванопластика (изготовление копий с рельефных предметов).
Рафинирование (очистка) металлов.
Получение
чистых металлов из расплавов природных соединений.