- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЧТО ТАКОЕ ОКСИДЫ? презентация
Содержание
- 1. ЧТО ТАКОЕ ОКСИДЫ?
- 2. Внимательно посмотрите на формулы приведенных оксидов: CaO,
- 3. 1. Оксиды – это вещества простые или
- 4. Попробуем составить определение класса оксидов Оксиды
- 5. Оксиды – это СЛОЖНЫЕ вещества, состоящие из
- 6. Из предложенного перечня веществ выпишите только оксиды:
- 7. Проверяем: оксидами являются SnO, NaOH, HCl,
- 8. Оксидами не являются: NaOH, Na2CO3, CrSO4, KOH,
- 9. Попробуем назвать оксиды СаО – оксид
- 10. Однако, случается так, что один и
- 11. А теперь потренируйтесь и назовите следующие оксиды: FeO Fe2O3 P2O3 P2O5 K2O SO2 SO3
- 12. Проверяем: FeO – оксид железа (II) Fe2O3
- 13. Наверное, вам хочется самим научиться составлять формулы
- 14. Наверное, вам хочется самим научиться составлять формулы
- 15. Наверное, вам хочется самим научиться составлять формулы
- 16. Попробуйте составить формулы оксидов: Оксид цинка –
- 17. Проверяем: Оксид цинка – ZnO Оксид азота
- 18. Все оксиды можно разделить на две группы
- 19. Солеобразующие оксиды делятся на три группы: основные
- 20. Выполни тест для закрепления темы 1.
- 21. Выполни тест для закрепления темы 3.
- 22. Выполни тест для закрепления темы 5.
- 23. Проверь себя:
Слайд 2Внимательно посмотрите на формулы приведенных оксидов:
CaO, CO2, Al2O3, Mn2O7, N2O, P2O5,
И постарайтесь ответить
на вопросы:
Слайд 31. Оксиды – это вещества простые или сложные?
2. Какой элемент обязательно
в состав оксидов?
3. Сколько всего элементов входит в состав оксида?
CaO, CO2, Al2O3, Mn2O7, N2O, P2O5, MgO, CO, SO2, SO3, Na2O, CuO, Fe2O3
Слайд 4Попробуем составить определение класса оксидов
Оксиды – это _____________ вещества,
состоящие из _______
один из которых __________________.
Проверим…
Слайд 5Оксиды – это СЛОЖНЫЕ вещества,
состоящие из ДВУХ элементов,
один из которых КИСЛОРОД.
Запомните
Слайд 6Из предложенного перечня веществ выпишите только оксиды:
SnO, NaOH, HCl, N2O5, Na2CO3,
Слайд 7Проверяем:
оксидами являются
SnO, NaOH, HCl, N2O5, Na2CO3, CO2, Cr2O3, CrSO4, Cu2O,
Эти вещества состоят из двух элементов, один из которых – кислород. Поэтому они принадлежат к классу оксидов
Слайд 8Оксидами не являются:
NaOH, Na2CO3, CrSO4, KOH, K3PO4, HNO3
так как состоят
HCl, KCl, CH4
так как не содержат кислород
Слайд 9Попробуем назвать оксиды
СаО – оксид кальция
Al2O3 – оксид алюминия
Na2O – оксид
MgO – оксид магния
BaO – оксид бария
Слайд 10Однако, случается так, что один и тот же элемент образует несколько оксидов,
Тогда в скобках после наименования элемента указывают численное значение его степени окисления в данном оксиде
+2
CO – оксид углерода (II)
+4
CO2 – оксид углерода (IV)
Слайд 12Проверяем:
FeO – оксид железа (II)
Fe2O3 – оксид железа (III)
P2O3 – оксид
P2O5 – оксид фосфора (V)
K2O – оксид калия
SO2 – оксид серя (IV)
SO3 - оксид серы (VI)
Слайд 13Наверное, вам хочется самим научиться составлять формулы оксидов.
Для этого:
1. Запишите
Оксид свинца (IV)
+4 -2
Pb O
Слайд 14Наверное, вам хочется самим научиться составлять формулы оксидов.
2. Определите наименьшее общее
Слайд 15Наверное, вам хочется самим научиться составлять формулы оксидов.
3. Разделив наименьшее общее
4
+4 -2
Pb O2
Слайд 16Попробуйте составить формулы оксидов:
Оксид цинка –
Оксид азота (V) -
Оксид
Оксид кремния (IV) –
Оксид меди (I) –
Оксид вольфрама (VI) –
Оксид марганца (VII) -
Слайд 17Проверяем:
Оксид цинка – ZnO
Оксид азота (V) – N2O5
Оксид хрома (III) –
Оксид кремния (IV) – SiO2
Оксид меди (I) – Cu2O
Оксид вольфрама (VI) – WO3
Оксид марганца (VII) – Mn2O7
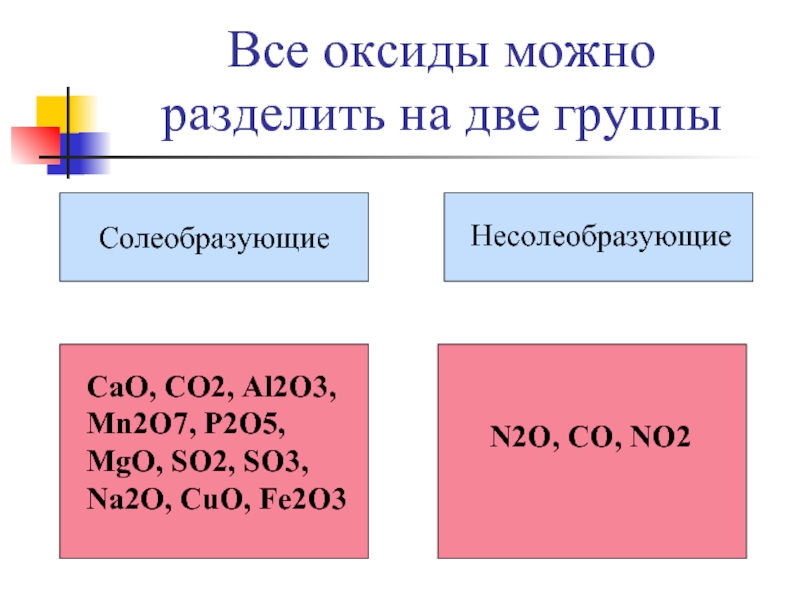
Слайд 18Все оксиды можно разделить на две группы
Солеобразующие
Hесолеобразующие
CaO, CO2, Al2O3, Mn2O7,
N2O, CO, NO2
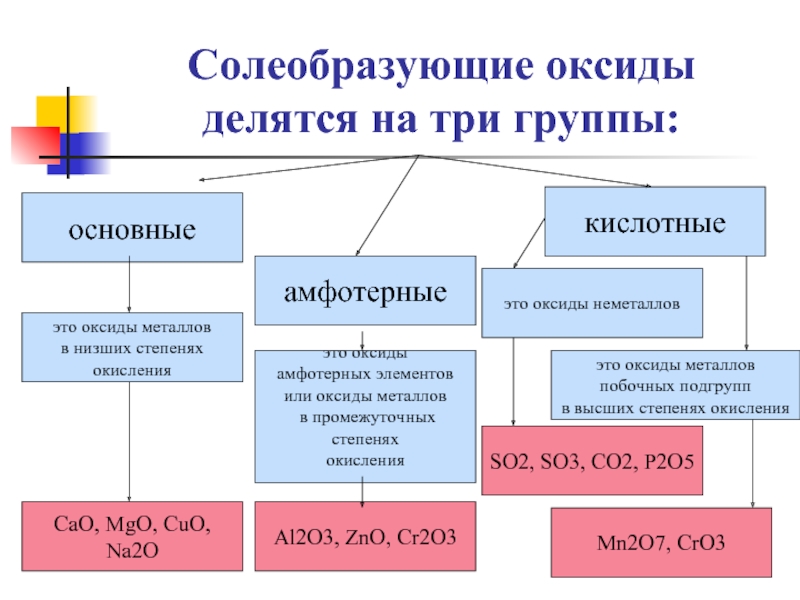
Слайд 19Солеобразующие оксиды делятся на три группы:
основные
амфотерные
кислотные
это оксиды металлов
в низших степенях
окисления
это
амфотерных элементов
или оксиды металлов
в промежуточных степенях
окисления
это оксиды неметаллов
CaO, MgO, CuO, Na2O
Al2O3, ZnO, Cr2O3
SO2, SO3, CO2, P2O5
это оксиды металлов
побочных подгрупп
в высших степенях окисления
Mn2O7, CrO3
Слайд 20Выполни тест
для закрепления темы
1. Оксидом является вещество:
1. MnCl2 3. MnO2
2. Mn(OH)2 4.
2. К оксидам не относится:
1. СaO 3. BaO
2. NO2 4. HNO2
Слайд 21Выполни тест
для закрепления темы
3. В ряду веществ, формулы которых K2O,
1. кислотные оксиды
2. амфотерные оксиды
3. основные оксиды
4. кислотные и основные оксиды
4. Формулы кислотных оксидов:
1. CO2, CaO 3. CO2, SO3
2. Al2O3, ZnO 4. SO2, ZnO
Слайд 22Выполни тест
для закрепления темы
5. Формулы кислотного и основного оксидов соответственно:
1.
2. P2O5, CO2 4. SO3, CaO
6.Формулы кислотного, основного, амфотерного оксидов, соответственно:
1.MnO2, CO2, Al2O3 3. CaO, SO2, BeO
2. Mn2O7, CaO, ZnO 4. MnO, CuO, CO2