Сыгай Н.А.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АО Национальный центр нейрохирургии презентация
Содержание
- 1. АО Национальный центр нейрохирургии
- 2. Актуальность: Тема преоперативной эмболизации менингиом в широкой
- 3. Менингиомы наиболее общная группа доброкачественных интракраниальных новообразований
- 4. Методы 117 пациентов в период между 2001-2010г.
- 5. Расположение менингиом в случаях, подвергшихся эмболизации (в
- 6. Нет общей согласованности в вопросе продолжительности, технической
- 7. Осложнения Доля осложнений составила 3,7%. 4 пациента
- 8. Эмболизирующие агенты были разделены на 3 категории:
- 9. Эмболизация Все эмболизации выполнялись опытными интервенционными нейрорадиологами
- 10. Использованные агенты: маленькие акриловые частицы, смешанные с
- 11. Результаты Использование мелких частиц в качестве эмболизирующего
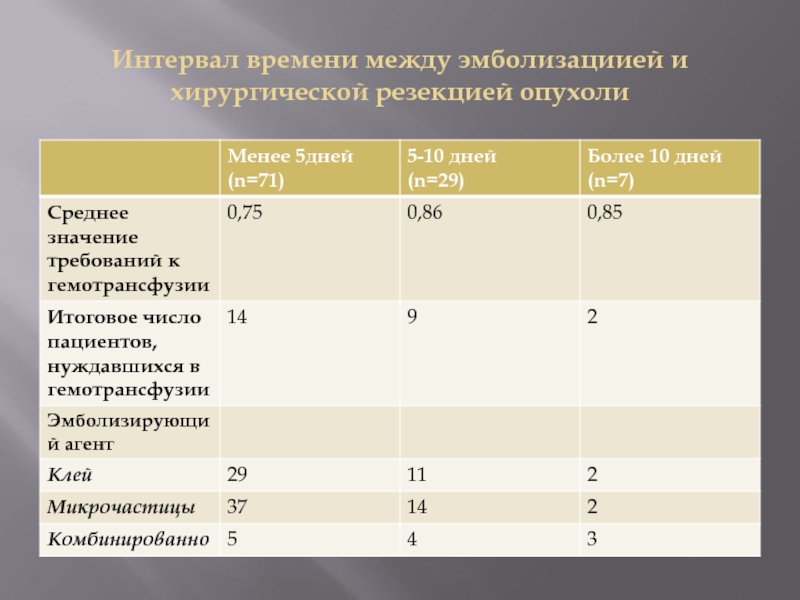
- 12. Интервал времени между эмболизациией и хирургической резекцией опухоли
- 13. ЗАКЛЮЧЕНИЕ Не было замечено взаимосвязи между видом
Слайд 1АО «НАЦИОНАЛЬНЫЙ ЦЕНТР НЕЙРОХИРУРГИИ»
Преоперативная эмболизация менингиом: Анализ 117 случаев
Докладчики: Кульмирзаев М.А.
Слайд 2Актуальность:
Тема преоперативной эмболизации менингиом в широкой научной среде остается спорной и
дискутабельной, с элементами нерешительности в вопросах безопасности и эффективности. Преимущества постэмболического снижения риска интраоперационной кровопотери должны быть учтены в контексте рисков данного метода. Целью данного исследования было оценить безопасность преоперативной эмболизации менингиом и ее влияние на последующие требования к переливанию крови.
Слайд 3Менингиомы наиболее общная группа доброкачественных интракраниальных новообразований с распространением в среднем
13-26% у взрослых. Иссечение остается опорой лечения в настоящее время. Они преимущественно доброкачественные опухоли (92% в сравнении с 6,26% атипичных и 1,7% злокачественных форм), часто высоковаскуляризованные, основное кровоснабжение происходит из дурального и смежного пиального кровотока. Современная микрохирургическая техника ассоциирована с низким безрецидивным периодом и высокой безболезненной выживаемостью.
Преоперативная эмболизация ставит целью снижение кровоснабжения через афференты. Это может приводить к обмягчению опухоли, способствуя более быстрому и скорому иссечению со снижением кровопотери и требований к переливанию. С момента первых процедур, описанных впервые в 1973г. Манельфом, произошел значительный скачок в эволюции техник в виде усовершенствования конструкций микрокатетеров и микропроводников, методов визуализации, а также эмболизирующих агентов.
Преоперативная эмболизация ставит целью снижение кровоснабжения через афференты. Это может приводить к обмягчению опухоли, способствуя более быстрому и скорому иссечению со снижением кровопотери и требований к переливанию. С момента первых процедур, описанных впервые в 1973г. Манельфом, произошел значительный скачок в эволюции техник в виде усовершенствования конструкций микрокатетеров и микропроводников, методов визуализации, а также эмболизирующих агентов.
Слайд 4Методы
117 пациентов в период между 2001-2010г. С, предположительно, интракраниальными менингиомами перед
удалением были отобраны на эмболизацию опухоли. Анализированы степень и природа эмболизация-ассоциированных осложнений, уровень ангиографической деваскуляризации, а также требования к интраоперативному переливанию крови. Жидкие и/или микрочастицы использовались для 107 пациентов. 10 пациентов были исключены от манипуляции ввиду грубого микрокатетер-индуцированного вазоспазма (3 случая) и комбинации из неблагоприятного варианта анатомии с отсутствием (либо минимальности) визуализации опухоли.
Слайд 5Расположение менингиом в случаях, подвергшихся эмболизации (в скобках-отмененные)
Парасагиттально/фалькса
43(4)
Конвекситально 33(2)
Крыло клинов. 20
ЗЧЯ 10(1)
Ольфакт.ямка 4(2)
Интравентрикул. 5(1)
Основание черепа 1
Супраселлярно 1
Конвекситально 33(2)
Крыло клинов. 20
ЗЧЯ 10(1)
Ольфакт.ямка 4(2)
Интравентрикул. 5(1)
Основание черепа 1
Супраселлярно 1
Слайд 6Нет общей согласованности в вопросе продолжительности, технической стратегии. Несмотря на то,
что главной целью являются ветви НСА как основных снабженцев, имеется возможность относительно безопасно эмболизировать дуральные ветви, идущих из ВСА и ПА, несмотря на риск ишемического инсульта. Ишемические осложнения происходят при непреднамеренном пассаже эмболизата в ветви, кровоснабжающие паренхиму мозга или краниальные нервы, кожу лица и скальпа. Постэмболическое внутриопухолевое кровоизлияние также оценивается как осложнение, предположительно, связанное с чрезмерным внутриочаговым ишемическим некрозом.
Согласно литературным данным, показатели всех осложнений находятся в пределах 2,5-6,4%.
!!! Проксимальные ветви a.meningea media посредством артериальных анастомозов связаны с краниальными нервами основания черепа. Сфеноидальная ветвь кровоснабжает III, IV пару ЧМН, кавернозная ветвь – V, каменистая ветвь - VII и VIII пары.
Согласно литературным данным, показатели всех осложнений находятся в пределах 2,5-6,4%.
!!! Проксимальные ветви a.meningea media посредством артериальных анастомозов связаны с краниальными нервами основания черепа. Сфеноидальная ветвь кровоснабжает III, IV пару ЧМН, кавернозная ветвь – V, каменистая ветвь - VII и VIII пары.
Слайд 7Осложнения
Доля осложнений составила 3,7%. 4 пациента имели осложнения непосредственно по причине
процедуры. Туда входит: в 2 случаях- внутритуморозное кровоизлияние, в 1 случае - паралич отводящего нерва и еще в 1-м - некроз скальпа, потребовавшего реконструктивную операцию
Слайд 8Эмболизирующие агенты были разделены на 3 категории: 1) микрочастицы (поливинил-спирт и
целлюлозно-порозные шарики)
2) жидкие агенты, такие как: гистоакрил и глюбран (цианоакрилатные клеи); Оникс (этиленвинил спирт кополимер, диметил сульфоксид) и Тантал
3) отделяемые спирали для достижения проксимальной окклюзии.
Слайд 9Эмболизация
Все эмболизации выполнялись опытными интервенционными нейрорадиологами на цифровом субтракционном ангиографическом биплан-аппарате
с высоким разрешением. Манипуляции проводились под общим наркозом, с установкой интрадьюсера 5F в правую бедренную артерию и использованием контраста Омнипак 240, предварительным в/в введением Гепарина для удваивания АЧТВ в сравнении с базисным уровнем, а также введением вначале 8мг Дексаметазона, затем по 4мг каждые 6часов до хирургии и продолжением в течение 5 дней для предупреждения перитуморозного отека.
Слайд 10Использованные агенты: маленькие акриловые частицы, смешанные с Йогексолом (Омнипак 300) и
разбавленные до 50% физиологическим раствором. Либо цианокрилатный клей Гистоакрил или Глюбран 2, разбавленный Липиодолом. Линейка микрокатетеров была использования исхода из оптимальной позиции в соответствующих питающих опухоль артериях: 1,9F при использовании частиц и 1,2-1,8F для клея. Выбор эмболизата определялся исходя из совокупности факторов, таких как артериальная анатомия, риск коллатеральной эмболизации витальных нейроструктур, конечное стояние микрокатетера, клинические показания и запланированная дата оперативного вмешательства.
До недавнего времени эмболизация микрочастицами была ограничена при использовании маленьких катетеров (меньше 1,9F) ввиду их преждевременной закупорки.
Манипуляция выполнялась до тех пор, пока все доступные дуральные афференты опухоли были выключены. Контрольная ипсилатеральная каротидная ангиография выполнялась в каждом случае для оценки степени деваскуляризации. Эмболизация считалась тотальной, если на ангиограммах отсутствовала характерная опухолевая сеть и частичной - если оставалась.
До недавнего времени эмболизация микрочастицами была ограничена при использовании маленьких катетеров (меньше 1,9F) ввиду их преждевременной закупорки.
Манипуляция выполнялась до тех пор, пока все доступные дуральные афференты опухоли были выключены. Контрольная ипсилатеральная каротидная ангиография выполнялась в каждом случае для оценки степени деваскуляризации. Эмболизация считалась тотальной, если на ангиограммах отсутствовала характерная опухолевая сеть и частичной - если оставалась.
Слайд 11Результаты
Использование мелких частиц в качестве эмболизирующего агента производилось в 53случаях, цианокрилатного
клея – в 42, комбинированно – в 12. Эмболизация проводилась через дуральные ветки во всех случаях, за исключением 5 случаев интравентрикулярных менингиом, где хороидальные ветви были доступны. Использование бассейна НСА было преимущественным –у 91 пациента, 10 – через ветви ВСА, 6-ПА. В 11 случаях встречался комбинированный доступ через два васкулярных бассейна. Средний срок между эмболизацией и микрохирургической операцией составил 4,4 дня, средняя длительность операции – 4,3часа. Патогистологически в 95 случаях выявлена первичная менингиома (68-G=1 WHO, 26-G=II WHO, 1-неуточненная), в 7 – гемангиоперицитома, 1 случай – MTS рака груди.
Средняя потребность в трансфузии во время хирургии составила 0,8 единиц на случай. Переливание крови производилось меньше у пациентов с ангиографически полноценной (завершенной) деваскуляризацией опухоли (Р=.035).
Средняя потребность в трансфузии во время хирургии составила 0,8 единиц на случай. Переливание крови производилось меньше у пациентов с ангиографически полноценной (завершенной) деваскуляризацией опухоли (Р=.035).
Слайд 13ЗАКЛЮЧЕНИЕ
Не было замечено взаимосвязи между видом эмболизирующего агента и степенью деваскуляризации.
Достижение полной эмболизации привело к меньшему требованию к переливанию крови. Эти серии показывают безопасность данного метода и способность снижать операционную кровопотерю. Применение жидких эмболов для дистальной интратуморозной инъекции представляется безопасной и эффективной альтернативой признанным техникам эмболизации частицами