- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амфотерные соединения презентация
Содержание
- 1. Амфотерные соединения
- 2. 9 класс
- 3. Амфотерными называются вещества, которые в зависимости от
- 5. Прильем к взвеси гидроксида цинка (основанию) раствор
- 6. Гидроксид цинка
- 7. А теперь прильем к взвеси гидроксида цинка
- 8. Гидроксид цинка
- 9. вывод: Гидроксид цинка ведет себя двояко: с
- 10. формула Основная кислотная Zn(OH)2 H2ZnO2 Гидроксид цинка Цинковая кислота
- 11. Амфотерные соединения образуют металлы. Те Ме, которым
- 12. Алюминий (главная подгруппа 3 группы) гидроксид Al(ОН)3
- 13. Химические свойства амфотерных оксидов С кислотами
- 14. Со щелочами с образованием соли и воды
- 15. С кислотами с образованием соли и
- 16. Со щелочами с образованием соли и
- 17. Генетический ряд переходного металла Ме
- 18. 11 класс
- 19. Диссоциация амфотерных соединений Согласно теории С.Аррениуса
- 20. Н2О Н++ОН- Протолитическая теория
- 21. Н2SO4→2H++SO42- Это доноры протонов⇒ это кислоты(серная и
- 22. Рассмотрим поведение в растворе аминоуксусной кислоты(глицина) H2N-CH2-COOH
- 23. Вывод формул амфотерных гидроксидов по соответствующим
- 24. ЭО2(GeO2, VO2, TiO2) Кислотная форма Основная форма
- 25. Вот они какие , амфотерные вещества. Они двуличные, но симпатичные. конец
Слайд 3Амфотерными называются вещества, которые в зависимости от условий проявляют кислотно-основную двойственность.
Рассмотрим
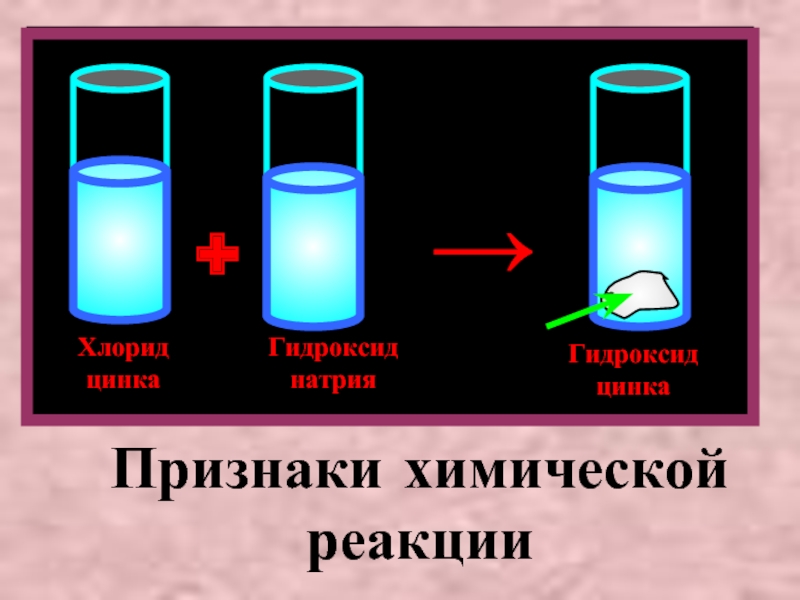
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Раств.
Раств.
Раств.
Осадок
Zn2++2Cl - +2Na+ + 2OH- = Zn(OH)2 + 2Na++2Cl -
Zn2++ 2OH- = Zn(OH)2 ↓
Слайд 5Прильем к взвеси гидроксида цинка (основанию) раствор серной кислоты.Произойдет реакция нейтрализации.Чтобы
Zn(OH)2 + Н2SO4 = ZnSO4 + 2H2O
Раств.
Раств.
Осадок
Слабый
эл-т
Zn(OH)2 + 2H+ +SO42- = Zn2+ +SO42- +2H2O
Zn(OH)2↓ + 2H+ = Zn2+ +2H2O
Слайд 6
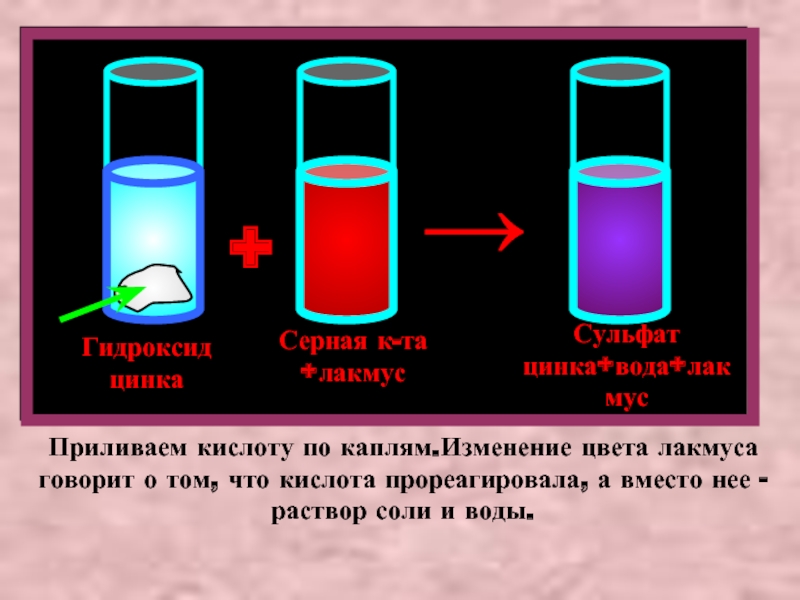
Гидроксид цинка
Серная к-та +лакмус
+
Сульфат цинка+вода+лакмус
→
Приливаем кислоту по каплям.Изменение цвета лакмуса говорит
Слайд 7А теперь прильем к взвеси гидроксида цинка избыток раствора щелочи, также
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Осадок
Раств.
Раств.
Слабый
эл-т
Zn(OH)2+2Na++2OH- =2Na++ZnO22- +2H2O
Zn(OH)2↓+2OH- =ZnO22- +2H2O
Слайд 8
Гидроксид цинка
Гидроксид натрия+лакмус
+
Цинкат натрия+вода+лакмус
→
Приливаем щелочь тоже по каплям.Изменение цвета лакмуса говорит
Слайд 9вывод:
Гидроксид цинка ведет себя двояко: с кислотой- как основание, а со
Слайд 11Амфотерные соединения образуют металлы. Те Ме, которым соответствуют амфотерные гидроксиды, называются
примеры
Бериллий (главная подгруппа 2 группы)
гидроксид
Ве(ОН)2
Н2ВеО2 (соль - бериллат)
Слайд 12Алюминий (главная подгруппа 3 группы)
гидроксид
Al(ОН)3
Н3AlО3(соль - алюминат)
Хром (побочная подгруппа 6 группы)
гидроксид
Cr
Н3СrО3(соль - хромит)
+3
+3
При записи кислотной формы этих гидроксидов просто «раскрываются скобки» и водороды переносятся в начало формулы.
Слайд 13Химические свойства
амфотерных оксидов
С кислотами с образованием соли и воды
Cr2O3 +2H3PO4
Оксид
хрома (III)
Ортофосфорная
кислота
Фосфат
хрома (III)
Слайд 14Со щелочами с образованием соли и воды
Cr2O3 +6NaOH = 2Na3CrO3 +3H2O
Оксид
Хромит
натрия
Химические свойства
амфотерных гидроксидов
Слайд 15С кислотами с образованием
соли и воды
Ве(ОН)2 + 2НСl = ВеСl2
Гидроксид
бериллия
Хлорид
бериллия
Внимание: переходный металл в составе катиона
Слайд 16Со щелочами с образованием
соли и воды
Ве(ОН)2 + 2NaOH =
Гидроксид
бериллия
Бериллат
натрия
Внимание: переходный металл в составе аниона
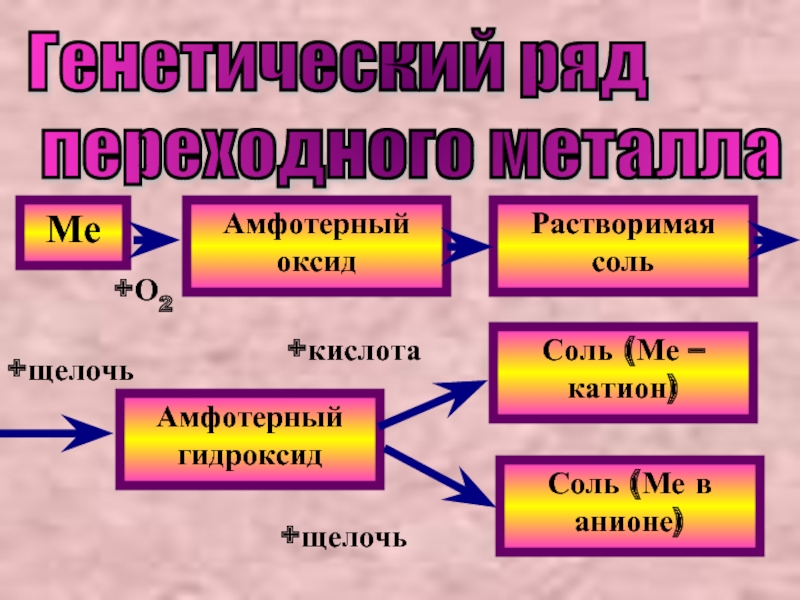
Слайд 17Генетический ряд
переходного металла
Ме
Амфотерный оксид
Растворимая соль
Амфотерный гидроксид
Соль (Ме – катион)
Соль
+О2
+щелочь
+щелочь
+кислота
Слайд 19Диссоциация амфотерных
соединений
Согласно теории С.Аррениуса , амфотерное соединение при диссоциации образует
Вода - слабый электролит амфотерного характера
Слайд 20Н2О
Н++ОН-
Протолитическая
теория
Бренстед
Согласно протолитической теории Бренстеда - Лоури, кислота – донор протона,
Слайд 21Н2SO4→2H++SO42-
Это доноры протонов⇒ это кислоты(серная и уксусная)
СН3СOОН→H++СН3СОО-
NН3+H+→[NH4]+
CH3NН2+H+→[ CH3NН3]+
Аммиак и метиламин акцепторы
Слайд 22Рассмотрим поведение в растворе аминоуксусной кислоты(глицина)
H2N-CH2-COOH
В этом веществе имеется и донор
H3N+-CH2-COO-
Диполь(цвиттер-ион)
Слайд 23Вывод формул амфотерных
гидроксидов по соответствующим
оксидам
Напоминаем, что многие амфотерные соединения
ЭО(BeO, ZnO, GeO, SnO, PbO)
Кислотная форма
Основная форма
Н2ЭО2
Э(ОН)2
Слайд 24ЭО2(GeO2, VO2, TiO2)
Кислотная форма
Основная форма
Э2О3(Al2O3, Ga2O3, In2O3Cr2O3)
Кислотная форма
Основная форма
Н3ЭО3(орто-форма) НЭО2 (мета-форма)
Э(ОН)3
Э2О3*nH2O
Н4ЭО4(орто-форма)
Э(ОН)4
ЭО2*nH2O

















![Н2SO4→2H++SO42-Это доноры протонов⇒ это кислоты(серная и уксусная)СН3СOОН→H++СН3СОО-NН3+H+→[NH4]+CH3NН2+H+→[ CH3NН3]+Аммиак и метиламин акцепторы протонов⇒ это основания(образуются катионы](/img/tmb/1/97884/08b17e31544d96b3d37b7d5de514c306-800x.jpg)









