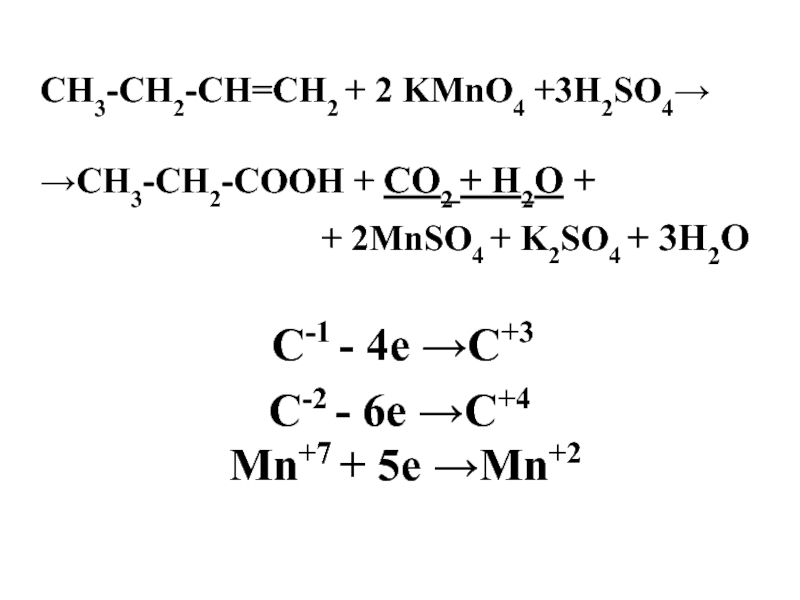- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛКЕНЫ презентация
Содержание
- 1. АЛКЕНЫ
- 2. ПЛАН ЗАНЯТИЯ 1. Определение понятия «алкены» 2.
- 3. АЛКЕНЫ это нециклические УВ, молекулы которых содержат
- 4. Общая формула СnH2n Отличаются от циклоалканов наличием открытой цепи
- 5. СТРОЕНИЕ АЛКЕНОВ В алкенах оба атома
- 7. ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ С2Н2 ЭТИЛЕН (ЭТЕН)
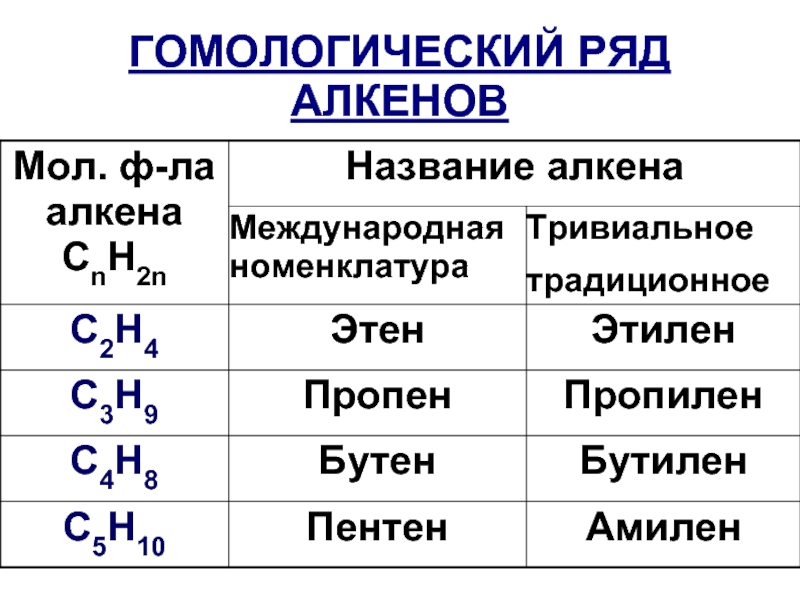
- 8. ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ
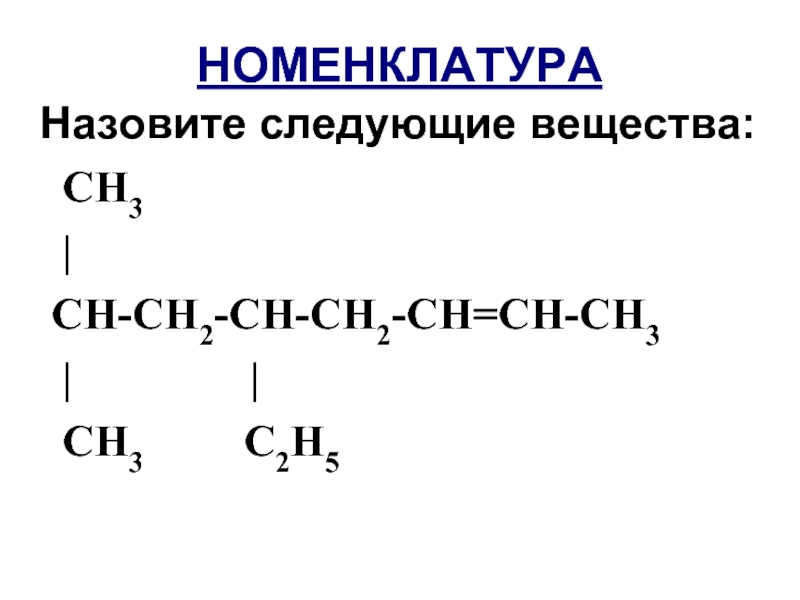
- 9. НОМЕНКЛАТУРА Назовите следующие вещества: СН3
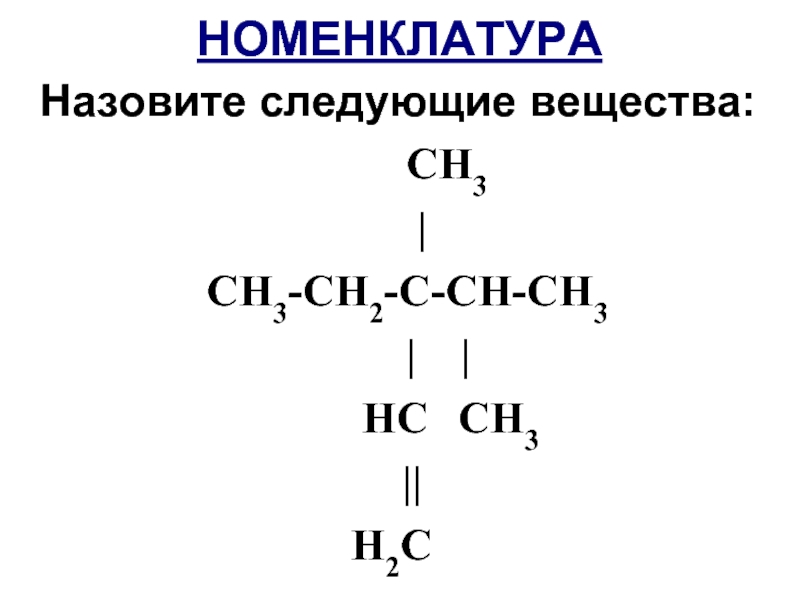
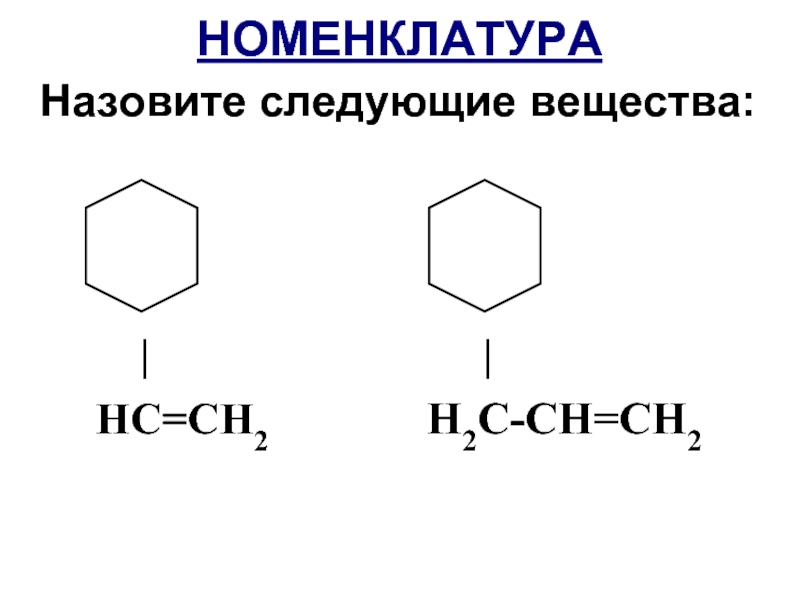
- 10. НОМЕНКЛАТУРА Назовите следующие вещества:
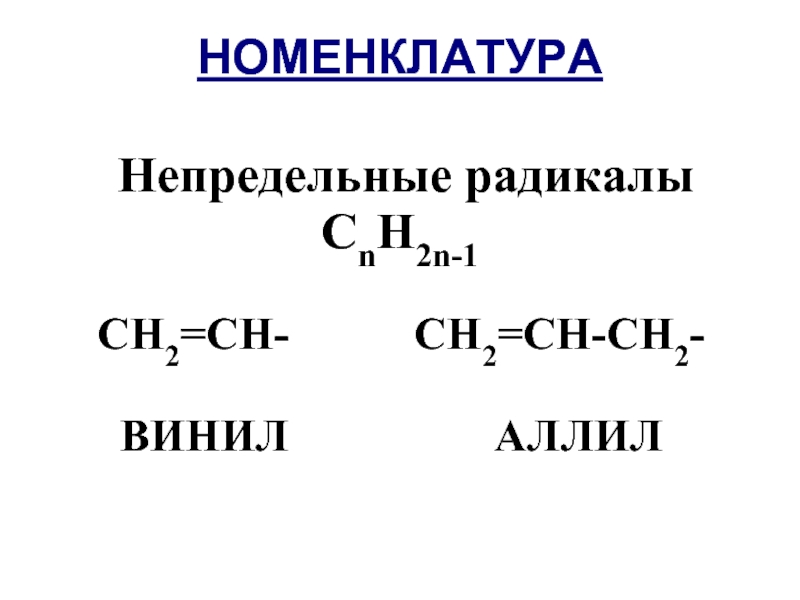
- 11. НОМЕНКЛАТУРА Непредельные радикалы СnH2n-1
- 12. НОМЕНКЛАТУРА Назовите следующие вещества:
- 13. ИЗОМЕРИЯ Первые два члена ряда алкенов
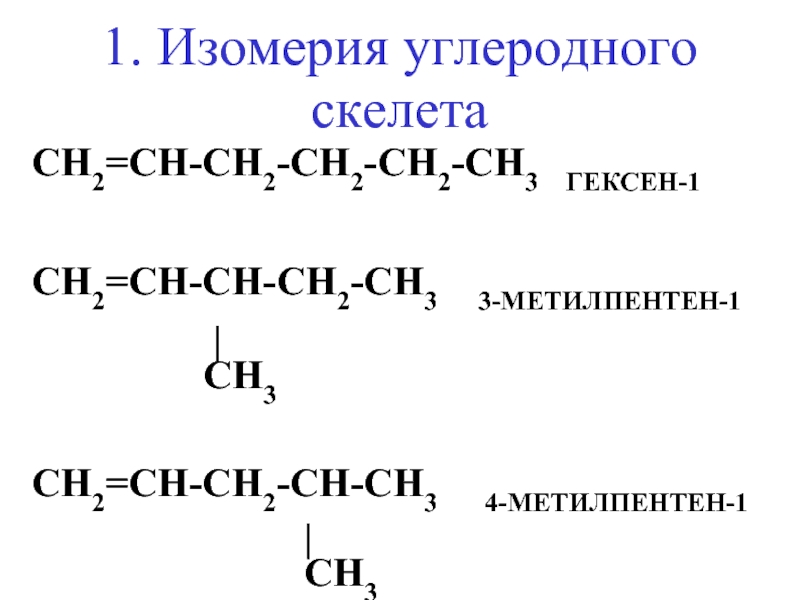
- 14. 1. Изомерия углеродного скелета CH2=CH-CH2-СH2-СH2-CH3 ГЕКСЕН-1
- 15. 2. Изомерия положения «=» CH2=CH-CH2-СH2-СH2-CH3
- 16. Геометрическая изомерия Правила существования цис-транс изомеров
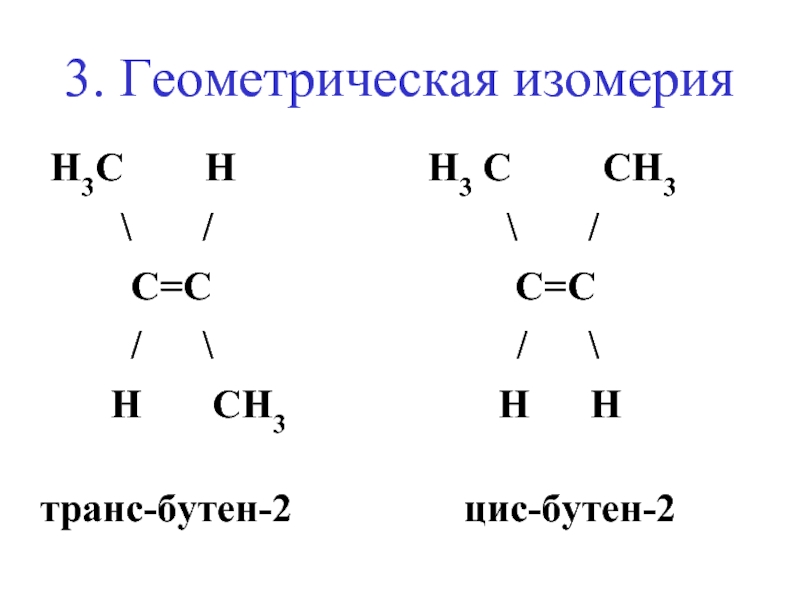
- 17. 3. Геометрическая изомерия H3C
- 18. Составить цис-транс изомеры CH3-CH=СH-СH2-CH3 3-МЕТИЛПЕНТЕН-2
- 19. Составить цис-тран изомеры, если они возможны 2,3-диметилпентен-2 3-метил-4-этилгептен-3 3-метил-4-этилгексен-3
- 20. 4. Межклассовая изомерия Алкены изомерны циклоалканам Гексен-1
- 21. Для вещества 3-метилгексен-3 составить все возможные изомеры и назвать их
- 22. ФИЗИЧЕСКИЕ СВОЙСТВА С2...С4 - газы без
- 23. Ткип, Тпл, плотность возрастают с увелием
- 24. При равном количестве атомов “С“ в
- 25. ХИМИЧЕСКИЕ СВОЙСТВА Характерны реакции электрофильного ПРИСОЕДИНЕНИЯ
- 26. РЕАКЦИИ ПРИСОЕДИНЕНИЯ 1. ГИДРИРОВАНИЕ
- 27. 2. ГАЛОГЕНИРОВАНИЕ R-СH=СН2 + Br2(водн) →
- 28. 3. ГИДРОГАЛОГЕНИРОВАНИЕ СH2=СН2 + НСl →
- 29. Правило Марковникова При присоединении веществ типа
- 30. При наличии в молекуле
- 31. 4. РЕАКЦИЯ ГИДРАТАЦИИ
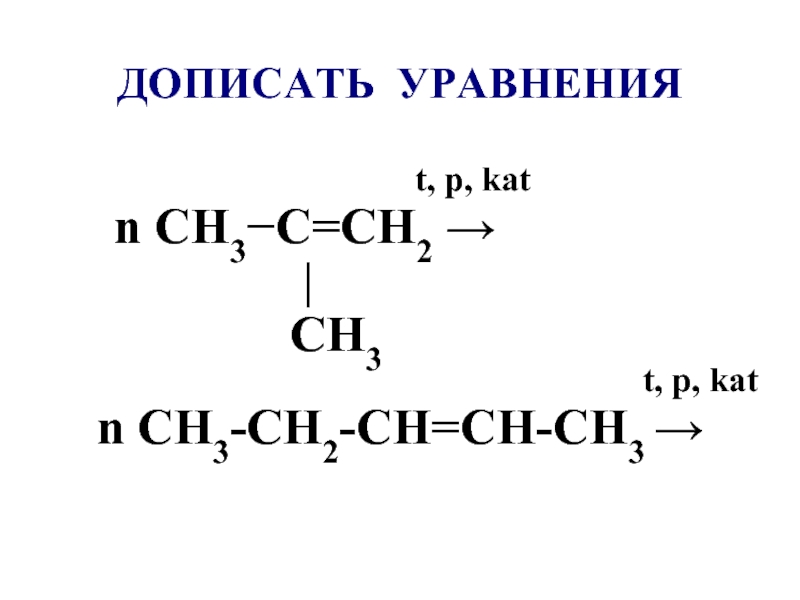
- 32. ДОПИСАТЬ УРАВНЕНИЯ
- 33. РЕАКЦИИ ПОЛИМЕРИЗАЦИИ Процесс полимеризации алкенов открыт А.М.
- 35. Где n-степень полимеризации (число молекул мономера)
- 36. Мономер – низкомолекулярное в-во, из
- 37. ДОПИСАТЬ УРАВНЕНИЯ
- 38. Д/З § 14, 15, 16
- 39. РЕАКЦИИ ОКИСЛЕНИЯ 1. р. ГОРЕНИЯ Полное окисление
- 40. Неполное окисление (недостаток О2)
- 41. 2. Каталитическое
- 42. 3. Взаимодействие с О2 в присутствии
- 43. 4. р. Вагнера Р-ция неполного,
- 44. При действии водного КMnO4 (р)
- 45. р. Вагнера (упрощенное уравнение) СН2=СН2 +
- 46. р. Вагнера (полное уравнение) 3СН2=СН2 +
- 47. Если р. Вагнера проводить в жестких условиях:
- 48. 5 СН3-CH=СН-СН3 +8 KMnO4+12H2SO4 →
- 49. р. глубокого окисления (жёсткое окисление)
- 50. 5СН3-С=СН-СН3 + 6KMnO4
- 51. р. глубокого окисления
- 52. СН3-CH2-СН=СН2 + 2 KMnO4 +3H2SO4→ →СН3-CH2-СООН
- 53. р.Вагнера используют для установления
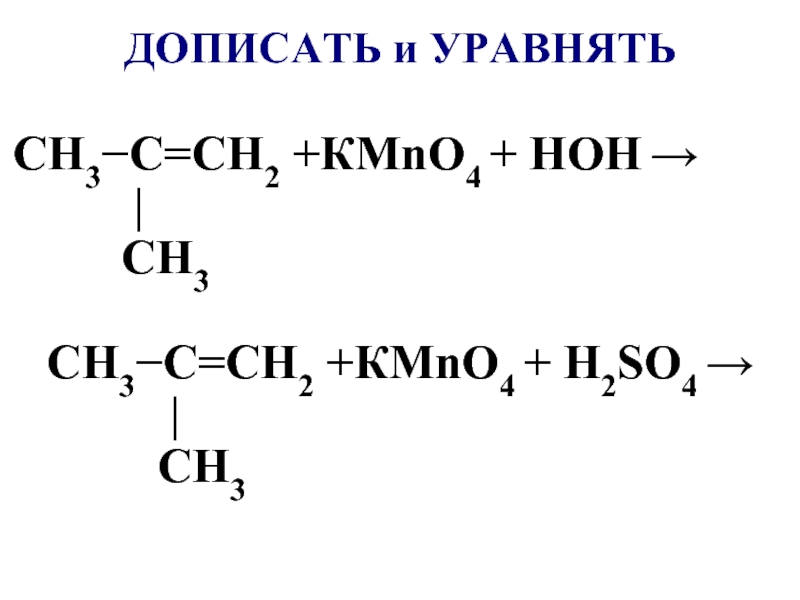
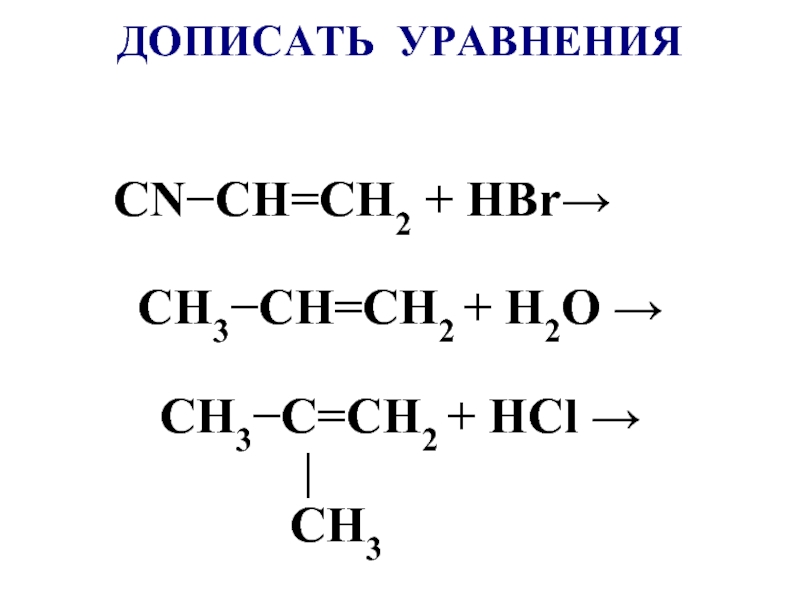
- 54. ДОПИСАТЬ и УРАВНЯТЬ CH3−C=CH2 +КMnO4
- 55. Д/З § 14, 15, 16
- 56. ПРИМЕНЕНИЕ АЛКЕНОВ Благодаря высокой
- 57. Этилен ускоряет созревание плодов и фруктов
- 58. Из пропена получают глицерин, ацетон, изопропанол, растворители, полипропилен
- 59. На основе полученных полимеров (полиэтилен) производят волокна
- 60. СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ 1. ПРОМЫШЛЕННЫЕ Крекинг алканов
- 61. I. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ 1.
- 62. 2. ДЕГИДРИРОВАНИЕ АЛКАНОВ
- 63. 3. ГИДРИРОВАНИЕ АЛКИНОВ Ni, Pt,
- 64. 1. ДЕГИДРОГАЛОГЕНИРОВАНИЕ моногалогеналканов действием твердой щёлочи или
- 66. Согласно правилу Зайцева: В реакциях отщепления
- 67. по правилу Зайцева
- 68. 2. ДЕГИДРАТАЦИЯ СПИРТОВ
- 69. 3. ДЕГАЛОГЕНИРОВАНИЕ дигалогеналканов с атомами галогена у
- 70. ПРЕДЛОЖИТЕ СПОСОБЫ ПОЛУЧЕНИЯ: ПРОПЕНА 2-МЕТИЛБУТЕНА-2
- 71. Д/З § 14, 15, 16
Слайд 2ПЛАН ЗАНЯТИЯ
1. Определение понятия «алкены»
2. Строение молекулы алкена
3. Гомологический ряд
4. Изомерия
5.
Номенклатура
6. Физические свойства алкенов
7. Применение алкенов
8. Химические свойства алкенов
9. Способы получение алкенов
6. Физические свойства алкенов
7. Применение алкенов
8. Химические свойства алкенов
9. Способы получение алкенов
Слайд 3АЛКЕНЫ
это нециклические УВ, молекулы которых содержат
в своем составе, помимо одинарных связей,
одну
двойную
углерод-углеродную связь
углерод-углеродную связь
Слайд 5СТРОЕНИЕ АЛКЕНОВ
В алкенах оба атома углерода,
связанные двойной связью,
находятся в состоянии
sp2-гибридизации
sp2-гибридизации
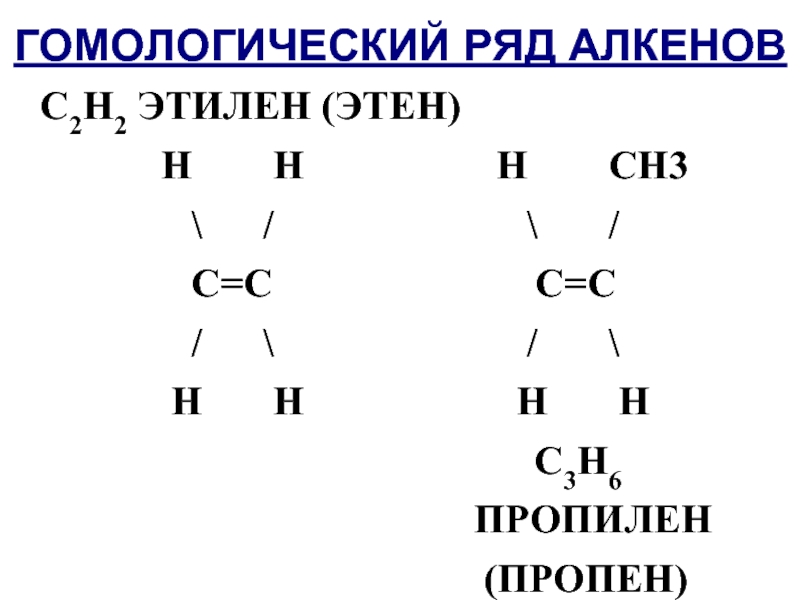
Слайд 7ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ
С2Н2 ЭТИЛЕН (ЭТЕН)
Н
Н Н СН3
\ / \ /
С=С С=С
/ \ / \
Н Н Н Н
С3Н6
ПРОПИЛЕН
(ПРОПЕН)
\ / \ /
С=С С=С
/ \ / \
Н Н Н Н
С3Н6
ПРОПИЛЕН
(ПРОПЕН)
Слайд 13ИЗОМЕРИЯ
Первые два члена ряда алкенов изомеров не имеют
Для остальных:
Структурная изомерия
(углеродного скелета с С4)
2. Изомерия положения «=» (с С4)
3. Геометрическая (цис-транс-)
4. Межклассовая изомерия
2. Изомерия положения «=» (с С4)
3. Геометрическая (цис-транс-)
4. Межклассовая изомерия
Слайд 141. Изомерия углеродного скелета
CH2=CH-CH2-СH2-СH2-CH3 ГЕКСЕН-1
CH2=CH-СH-СH2-CH3 3-МЕТИЛПЕНТЕН-1
|
CH3
CH2=CH-СH2-СH-CH3 4-МЕТИЛПЕНТЕН-1
|
CH3
CH3
CH2=CH-СH2-СH-CH3 4-МЕТИЛПЕНТЕН-1
|
CH3
Слайд 152. Изомерия
положения «=»
CH2=CH-CH2-СH2-СH2-CH3 ГЕКСЕН-1
CH3-CH=CH-СH2-СH2-CH3 ГЕКСЕН-2
CH3-CH2-CH=СH-СH2-CH3
ГЕКСЕН-3
Слайд 16Геометрическая изомерия
Правила существования цис-транс изомеров
Кратная связь не может быть вначале цепи
(после первого атома углерода)
2. У обоих атомов углерода при двойной связи должны быть два различных заместителя
2. У обоих атомов углерода при двойной связи должны быть два различных заместителя
Слайд 173. Геометрическая изомерия
H3C H
H3 C CH3
\ / \ /
С=C С=C
/ \ / \
H CH3 H H
транс-бутен-2 цис-бутен-2
\ / \ /
С=C С=C
/ \ / \
H CH3 H H
транс-бутен-2 цис-бутен-2
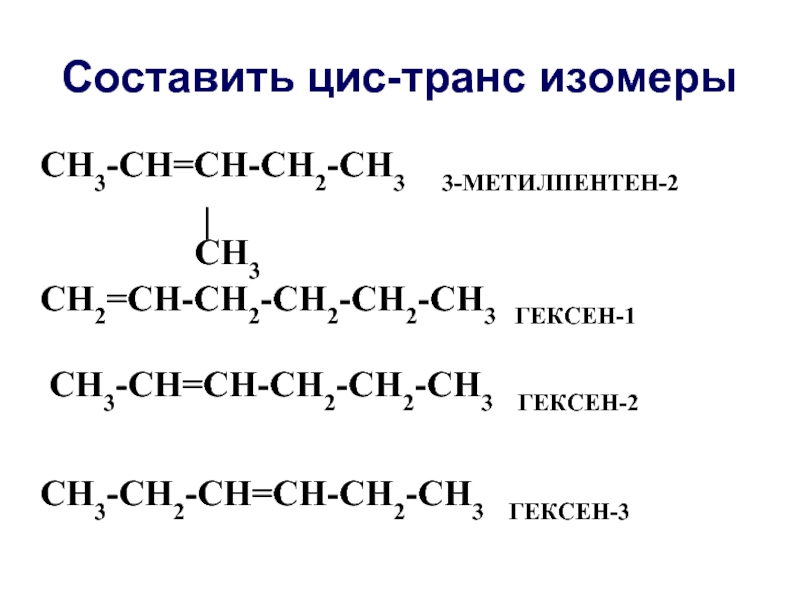
Слайд 18Составить цис-транс изомеры
CH3-CH=СH-СH2-CH3 3-МЕТИЛПЕНТЕН-2
|
CH3
CH2=CH-CH2-СH2-СH2-CH3 ГЕКСЕН-1
CH3-CH=CH-СH2-СH2-CH3 ГЕКСЕН-2
CH3-CH2-CH=СH-СH2-CH3 ГЕКСЕН-3
CH3
CH2=CH-CH2-СH2-СH2-CH3 ГЕКСЕН-1
CH3-CH=CH-СH2-СH2-CH3 ГЕКСЕН-2
CH3-CH2-CH=СH-СH2-CH3 ГЕКСЕН-3
Слайд 19Составить цис-тран изомеры, если они возможны
2,3-диметилпентен-2
3-метил-4-этилгептен-3
3-метил-4-этилгексен-3
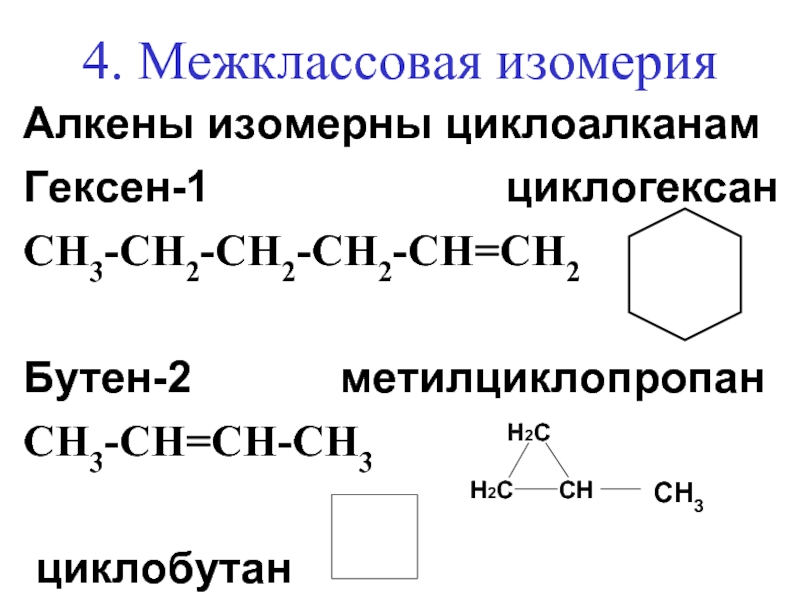
Слайд 204. Межклассовая изомерия
Алкены изомерны циклоалканам
Гексен-1
циклогексан
СН3-СН2-СН2-СН2-СН=СН2
Бутен-2 метилциклопропан
СН3-СН=СН-СН3
циклобутан
СН3-СН2-СН2-СН2-СН=СН2
Бутен-2 метилциклопропан
СН3-СН=СН-СН3
циклобутан
CH3
Слайд 22ФИЗИЧЕСКИЕ СВОЙСТВА
С2...С4 - газы без цвета и запаха
С5...С15 - бесцветные
жидкости
С16... - твердые вещества белого цвета, жирные на ощупь
С16... - твердые вещества белого цвета, жирные на ощупь
Слайд 23Ткип, Тпл, плотность возрастают с увелием
числа атомов “С“ в цепи
АЛКЕНЫ
не растворяются
в воде, но растворяются
в органических растворителях
в воде, но растворяются
в органических растворителях
Слайд 24
При равном количестве атомов “С“ в цепи
алкены плавятся и кипят
при более низких температурах, чем алканы
Слайд 25ХИМИЧЕСКИЕ СВОЙСТВА
Характерны
реакции электрофильного ПРИСОЕДИНЕНИЯ
за счет разрыва π-связи С=С
При особых
условиях – реакции ОКИСЛЕНИЯ, ПОЛИМЕРИЗАЦИИ
Слайд 26РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. ГИДРИРОВАНИЕ
p, Ni
R-СH=СН2 + Н2
→ R-СН2-СH3
kat – платина, палладий, никель.
Протекает при атмосферном и повышенном давлении и не требует высокой температуры (р.экзотермическая)
При повышении температуры-
р. дегидрирования
kat – платина, палладий, никель.
Протекает при атмосферном и повышенном давлении и не требует высокой температуры (р.экзотермическая)
При повышении температуры-
р. дегидрирования
Слайд 272. ГАЛОГЕНИРОВАНИЕ
R-СH=СН2 + Br2(водн) → R-СНBr-СH2Br
Р. бромирования
(с бромной водой)
является
качественной реакцией на все непредельные УВ
Признак: обесцвечивание бромной воды
Признак: обесцвечивание бромной воды
Слайд 283. ГИДРОГАЛОГЕНИРОВАНИЕ
СH2=СН2 + НСl → СН2Cl-СH3
Присоединение галогеноводородов
к несимметричным алкенам происходит
по правилу Марковникова
Слайд 29Правило Марковникова
При присоединении веществ типа НХ (где Х = Г,
ОН и т.п.)
к несимметричным алкенам
атом водорода присоединяется
к атому углерода у кратной связи, связанному с большим числом атомов водорода (более гидрированный)
СН3-СН=СН2 + НBr → СН3-СН-СН3
|
Br
к несимметричным алкенам
атом водорода присоединяется
к атому углерода у кратной связи, связанному с большим числом атомов водорода (более гидрированный)
СН3-СН=СН2 + НBr → СН3-СН-СН3
|
Br
Слайд 30 При наличии в молекуле непредельных УВ заместителей,
проявляющих значительный электроноакцепторный эффект
(-СN, -NO2, -COOH), реакция идет против правила Марковникова
СH2=СН-СООН + НСl →
→ СН2Сl-СH2-СООН
(-СN, -NO2, -COOH), реакция идет против правила Марковникова
СH2=СН-СООН + НСl →
→ СН2Сl-СH2-СООН
Слайд 314. РЕАКЦИЯ ГИДРАТАЦИИ
Н+ , t
СH2=СН2 + Н2О
→ СН3-СH2-ОН
Н+ – это среда Н2SO4, H3PO4
В несимметричных алкенах –
по правилу Марковникова
Н+ – это среда Н2SO4, H3PO4
В несимметричных алкенах –
по правилу Марковникова
Слайд 33РЕАКЦИИ ПОЛИМЕРИЗАЦИИ
Процесс полимеризации алкенов открыт А.М. Бутлеровым
ПОЛИМЕРИЗАЦИЯ – процесс соединения одинаковых
молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием ВМС (полимера)
Слайд 34
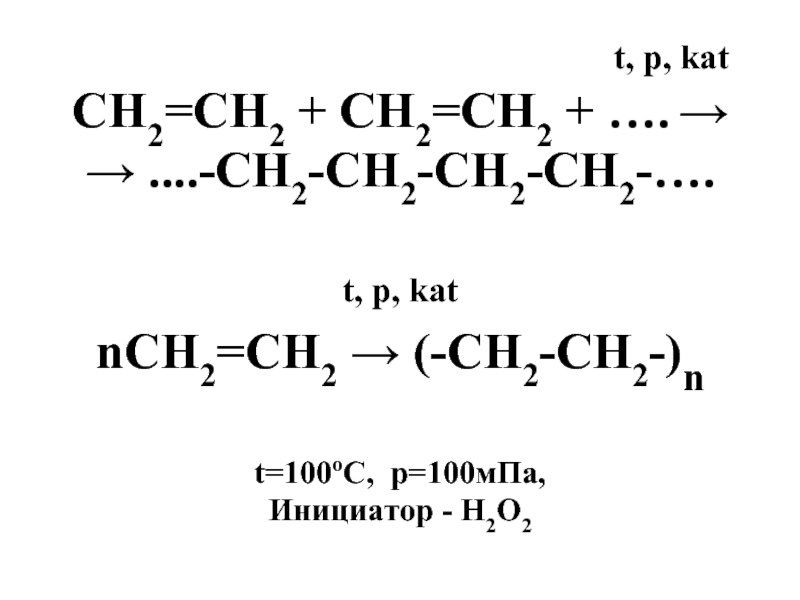
t, p, kat
СН2=СН2 + СН2=СН2 + …. →
→ ....-СН2-СН2-СН2-СН2-….
t, p, kat
nСН2=СН2 → (-СН2-СН2-)n
t=100oC, p=100мПа,
Инициатор - Н2О2
СН2=СН2 + СН2=СН2 + …. →
→ ....-СН2-СН2-СН2-СН2-….
t, p, kat
nСН2=СН2 → (-СН2-СН2-)n
t=100oC, p=100мПа,
Инициатор - Н2О2
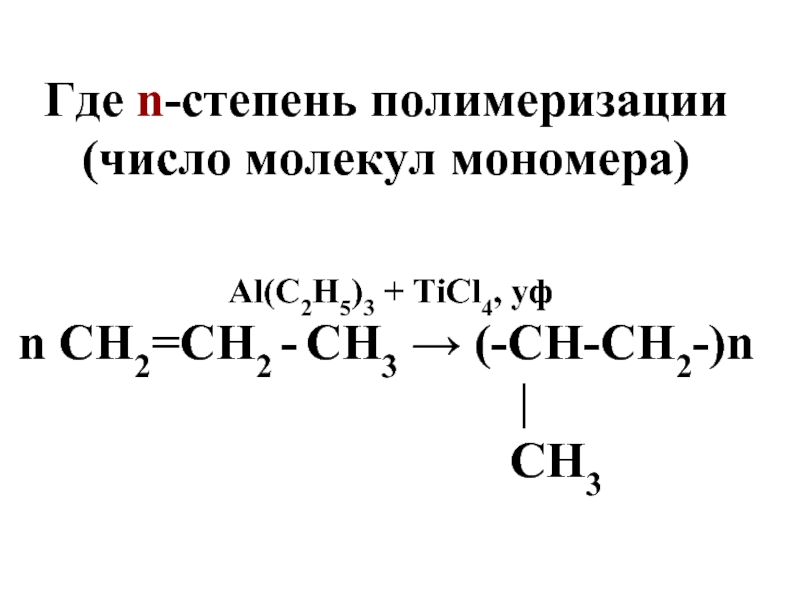
Слайд 35Где n-степень полимеризации (число молекул мономера)
Al(C2H5)3 + TiCl4, уф
n
СН2=СН2 - СН3 → (-СН-СН2-)n
|
СН3
|
СН3
Слайд 36Мономер – низкомолекулярное
в-во, из которого образуется полимер
Структурное звено –
многократноповторяющееся в макромолекуле группа атомов
Степень полимеризации – число, показывающее количество молекул мономера в составе полимера
Степень полимеризации – число, показывающее количество молекул мономера в составе полимера
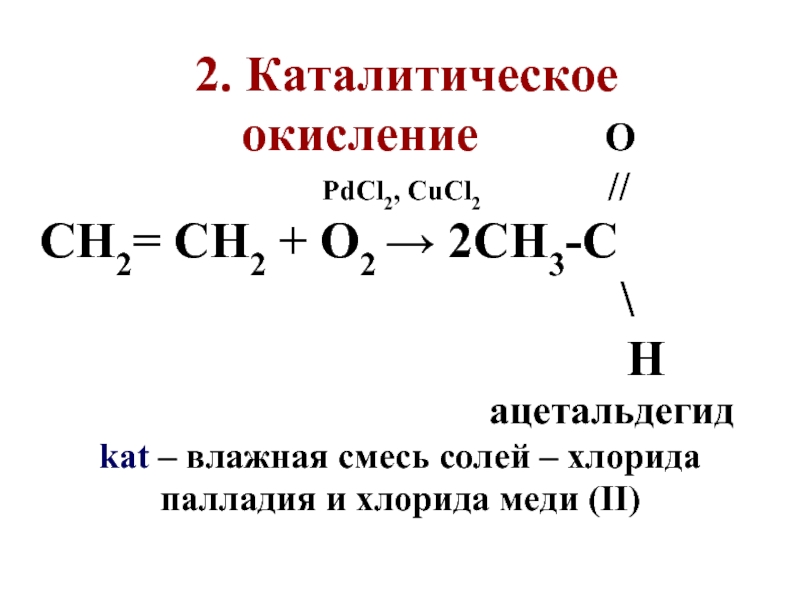
Слайд 41 2. Каталитическое
окисление
О
PdCl2, CuCl2 //
СН2= СН2 + О2 → 2СH3-C
\
H
ацетальдегид
kat – влажная смесь солей – хлорида палладия и хлорида меди (II)
PdCl2, CuCl2 //
СН2= СН2 + О2 → 2СH3-C
\
H
ацетальдегид
kat – влажная смесь солей – хлорида палладия и хлорида меди (II)
Слайд 42 3. Взаимодействие с О2 в присутствии катализатора- Аg
200, Аg
2СН2=СН2 + О2 → 2СН2-СН2
\ /
О
образуются эпоксиды
Эпоксиэтан
(этиленоксид)
2СН2=СН2 + О2 → 2СН2-СН2
\ /
О
образуются эпоксиды
Эпоксиэтан
(этиленоксид)
Слайд 434. р. Вагнера
Р-ция неполного,
мягкого окисления,
с сохранением углеродной цепи
Под действием
окислителей типа КMnO4, K2Cr2O7
Слайд 44 При действии водного КMnO4 (р) в слабощелочной среде происходит
гидроксилирование алкенов, это качественная реакция на «=»
Раствор КMnO4 при этом обесцвечивается
Раствор КMnO4 при этом обесцвечивается
Слайд 45р. Вагнера
(упрощенное уравнение)
СН2=СН2 + [О] + НОН → СН2-СН2
| |
НО ОН
Этиленгликоль
(этандиол-1,2)
НО ОН
Этиленгликоль
(этандиол-1,2)
Слайд 46р. Вагнера
(полное уравнение)
3СН2=СН2 + 2КMnO4 + 4НОН →
→3 СН2-СН2 +
2 MnO2 + 2КОН
| |
НО ОН
2C-2 - 2e →2C-1
Mn+7 + 3e →Mn+4
| |
НО ОН
2C-2 - 2e →2C-1
Mn+7 + 3e →Mn+4
Слайд 47Если р. Вагнера проводить в жестких условиях: t, кислая среда –
разрыв цепи в месте «=» с образованием кислородсодержащих соединений
Р. глубокого окисления
[O]
СН3- CH=СН-СН3 → 2 СН3-СООН
этановая кислота
Слайд 48 5 СН3-CH=СН-СН3 +8 KMnO4+12H2SO4 →
→10 СН3-СООН +8MnSO4 +4 K2SO4+12H2O
2C-1 -
8e →2C+3
Mn+7 + 5e →Mn+2
Mn+7 + 5e →Mn+2
Слайд 49 р. глубокого окисления (жёсткое окисление)
[O]
СН3- С=СН-СН3 →
|
CH3
→СН3-С=О + НООС-СН3
| этановая кислота
СН3
пропанон-2
СН3- С=СН-СН3 →
|
CH3
→СН3-С=О + НООС-СН3
| этановая кислота
СН3
пропанон-2
Слайд 50 5СН3-С=СН-СН3 + 6KMnO4 + 9H2SO4→
|
CH3
→5СН3-С=О +5НООС-СН3 +6MnSO4+ 3K2SO4+9H2O
|
СН3
C-1 - 4e →C+3
C0 - 2e →C+2
Mn+7 + 5e →Mn+2
CH3
→5СН3-С=О +5НООС-СН3 +6MnSO4+ 3K2SO4+9H2O
|
СН3
C-1 - 4e →C+3
C0 - 2e →C+2
Mn+7 + 5e →Mn+2
Слайд 51р. глубокого окисления
[O]
СН2=СН-СН2-СН3→СО2 +НООС-СН2-СН3
пропановая кислота
[HCOOH]-пром., неуст. → СО2 + Н2О
СН2=СН-СН2-СН3→СО2 +НООС-СН2-СН3
пропановая кислота
[HCOOH]-пром., неуст. → СО2 + Н2О
Слайд 52СН3-CH2-СН=СН2 + 2 KMnO4 +3H2SO4→
→СН3-CH2-СООН + СО2 + Н2О +
+ 2MnSO4 + K2SO4 + 3Н2О
C-1 - 4e →C+3
C-2 - 6e →C+4
Mn+7 + 5e →Mn+2
C-1 - 4e →C+3
C-2 - 6e →C+4
Mn+7 + 5e →Mn+2
Слайд 56ПРИМЕНЕНИЕ АЛКЕНОВ
Благодаря высокой реакционной способности алкены используют в
качестве сырья для химической прмышленности
Слайд 57 Этилен ускоряет созревание плодов и фруктов после их сбора, используют
в производстве этанола, этиленгликоля, эпоксидов, дихлорэтана, полиэтилена
Слайд 59На основе полученных полимеров (полиэтилен) производят волокна
Например, волокно
из полипропилена прочнее всех
известных синтетических волокон
Слайд 60СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ
1. ПРОМЫШЛЕННЫЕ
Крекинг алканов
Дегидрирование алканов
Гидрирование алкинов
2. ЛАБОРАТОРНЫЕ (внутримолекулярные)
Дегидратация спиртов
Дегидрогалогенирование моногалогеналканов
Дегалогенирование
дигалогеналканов (соседние атомы «С»)
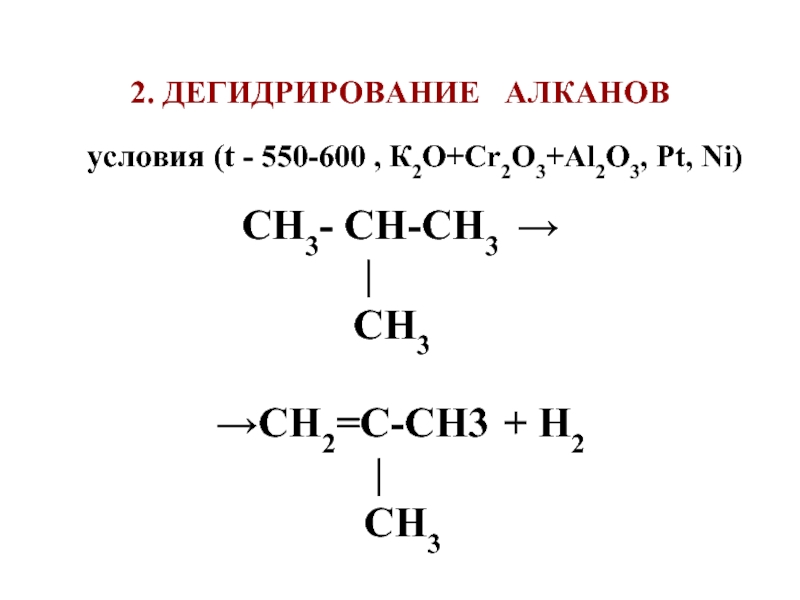
Слайд 622. ДЕГИДРИРОВАНИЕ АЛКАНОВ
условия (t -
550-600 , К2О+Сr2О3+Al2O3, Pt, Ni)
СН3- СН-СН3 →
|
CH3
→СН2=С-СН3 + Н2
|
СН3
СН3- СН-СН3 →
|
CH3
→СН2=С-СН3 + Н2
|
СН3
Слайд 633. ГИДРИРОВАНИЕ АЛКИНОВ
Ni, Pt, t
CnH2n-2 +H2 → CnH2n+2
Ni, Pt, t
СН3-СН2-С≡СН + Н2→ СН3- СН2- СН=СН2
СН3-СН2-С≡СН + Н2→ СН3- СН2- СН=СН2
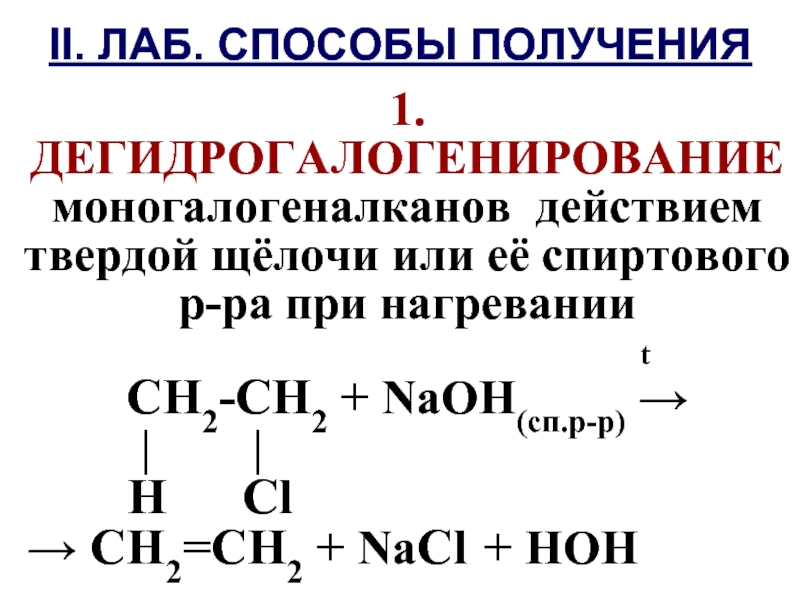
Слайд 641. ДЕГИДРОГАЛОГЕНИРОВАНИЕ моногалогеналканов действием твердой щёлочи или её спиртового р-ра при
нагревании
t
CН2-СН2 + NaOH(сп.р-р) →
| |
Н Сl
→ СН2=СН2 + NaСl + HOH
t
CН2-СН2 + NaOH(сп.р-р) →
| |
Н Сl
→ СН2=СН2 + NaСl + HOH
II. ЛАБ. СПОСОБЫ ПОЛУЧЕНИЯ
Слайд 65
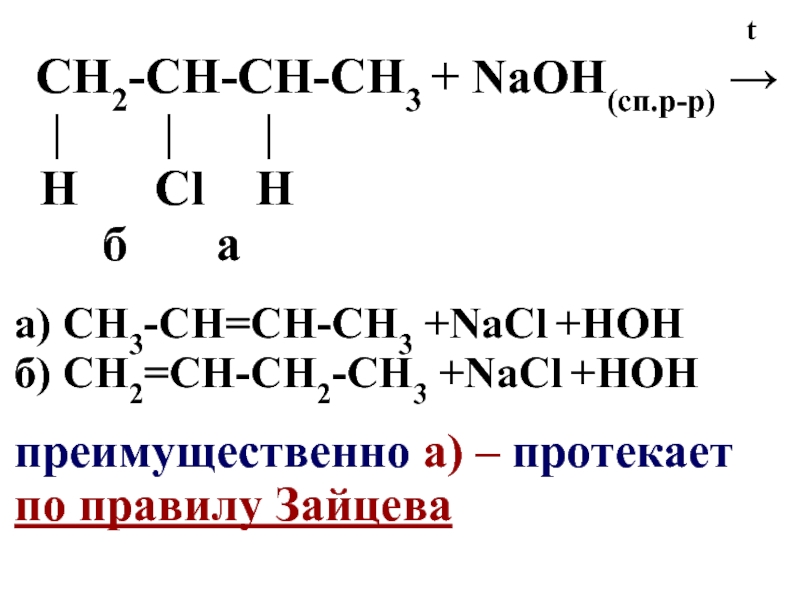
t
CН2-СН-СН-CН3 + NaOH(сп.р-р) →
| | |
Н Сl Н
б а
а) СН3-СН=СН-СН3 +NaСl +HOH
б) СН2=СН-СН2-СН3 +NaСl +HOH
преимущественно а) – протекает
по правилу Зайцева
CН2-СН-СН-CН3 + NaOH(сп.р-р) →
| | |
Н Сl Н
б а
а) СН3-СН=СН-СН3 +NaСl +HOH
б) СН2=СН-СН2-СН3 +NaСl +HOH
преимущественно а) – протекает
по правилу Зайцева
Слайд 66Согласно правилу Зайцева:
В реакциях отщепления у алканов атом водорода отщепляется
от атома углерода, связанного с наименьшим числом атомов водорода, т.е. от менее гидрированного
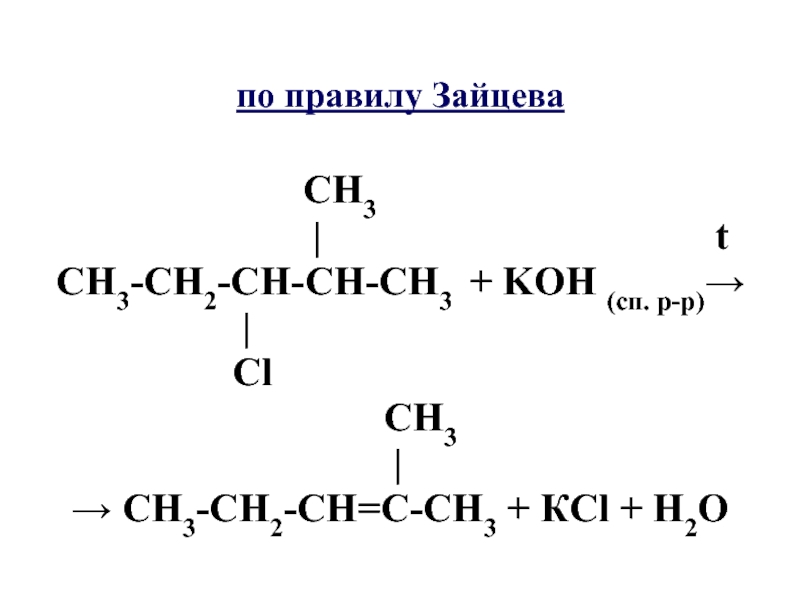
Слайд 67по правилу Зайцева
СН3
| t
СН3-СН2-СН-СН-СН3 + KOH (сп. р-р)→
|
Сl
СН3
|
→ СН3-СН2-СН=С-СН3 + КСl + H2O
| t
СН3-СН2-СН-СН-СН3 + KOH (сп. р-р)→
|
Сl
СН3
|
→ СН3-СН2-СН=С-СН3 + КСl + H2O
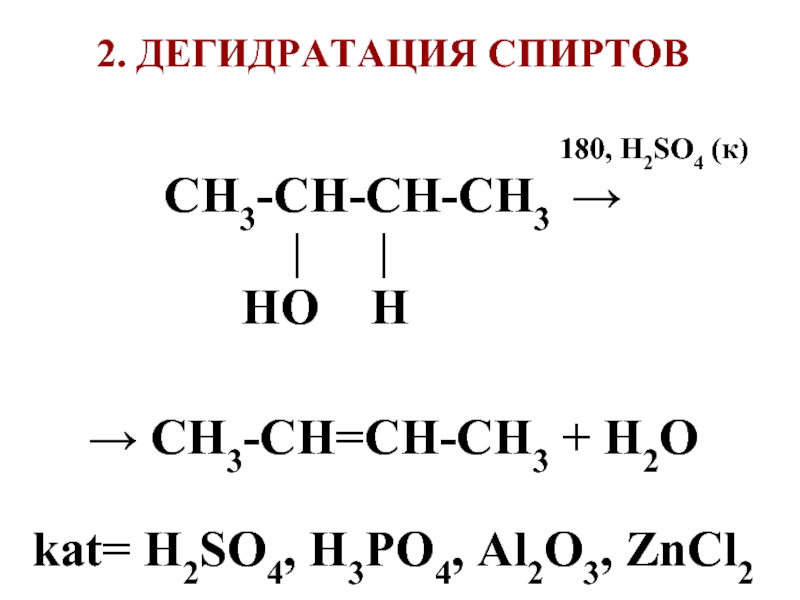
Слайд 682. ДЕГИДРАТАЦИЯ СПИРТОВ
180, H2SO4 (к)
СН3-СН-СН-СН3 →
| |
HO H
→ СН3-СН=СН-СН3 + H2O
kat= H2SO4, H3PO4, Al2O3, ZnCl2
СН3-СН-СН-СН3 →
| |
HO H
→ СН3-СН=СН-СН3 + H2O
kat= H2SO4, H3PO4, Al2O3, ZnCl2
Слайд 693. ДЕГАЛОГЕНИРОВАНИЕ дигалогеналканов с атомами галогена у соседних атомов «С» действием
Zn или Mg
t
CН3-СН-СН2 + Zn →
| |
Br Br
→ CН3-СН=СН2 + ZnBr2
t
CН3-СН-СН2 + Zn →
| |
Br Br
→ CН3-СН=СН2 + ZnBr2




























![р. Вагнера(упрощенное уравнение)СН2=СН2 + [О] + НОН → СН2-СН2](/img/tmb/3/232330/0c162c1a51b5862e66c8e070848a3fda-800x.jpg)


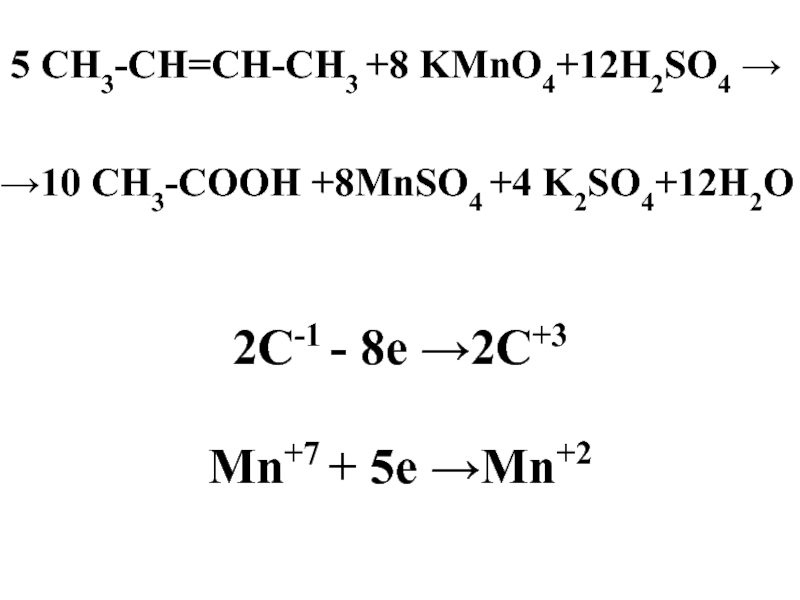
![р. глубокого окисления (жёсткое окисление) [O]СН3- С=СН-СН3 →](/img/tmb/3/232330/eb83d538db2b6ee833c6bc5e8226ce99-800x.jpg)
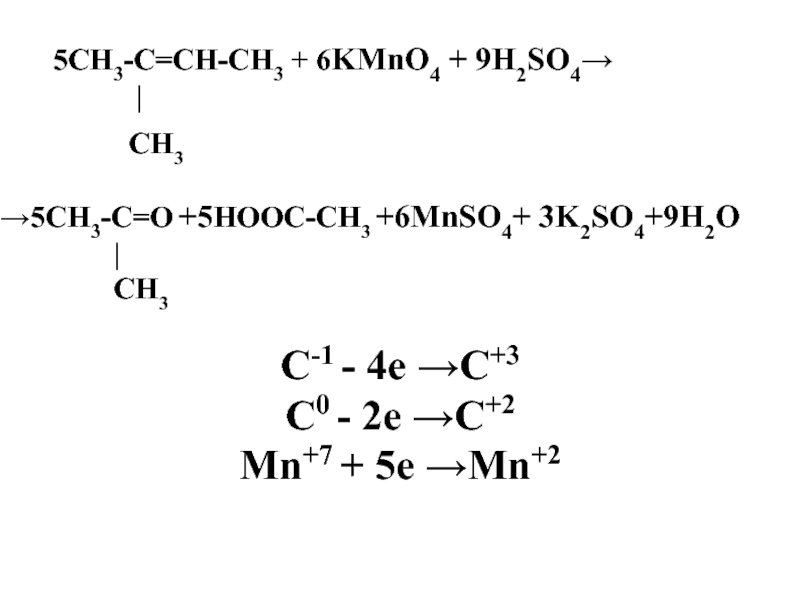
![р. глубокого окисления [O] СН2=СН-СН2-СН3→СО2](/img/tmb/3/232330/65270183f76919d1e5cd293c7871a728-800x.jpg)