- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тест для подготовки к ГИА-2012 презентация
Содержание
- 1. Тест для подготовки к ГИА-2012
- 2. Далее Инструкция для учащихся На
- 3. Далее Периодическая система химических элементов Д.И. Менделеева
- 4. Далее Растворимость солей, кислот и оснований в воде
- 5. Далее Электрохимический ряд напряжений
- 6. 1 Задание Распределение электронов по
- 7. 2 Задание В ряду оксидов
- 8. 3 Задание Какой вид химической
- 9. 4 Задание Далее 1 бал.
- 10. 5 Задание Далее 1 бал.
- 11. 6 Задание Далее 1 бал.
- 12. 7 Задание Далее 1 бал.
- 13. 8 Задание Далее 1 бал.
- 14. 9 Задание Далее 1 бал.
- 15. 10 Задание Далее 1 бал.
- 16. 11 Задание Далее 1 бал.
- 17. 12 Задание Далее 1 бал.
- 18. 13 Задание Далее 1 бал.
- 19. Далее Рассмотрите рисунок:
- 20. 14 Задание Далее 1 бал.
- 21. 15 Задание Далее 1 бал.
- 22. Ответы 1. 4 2. 3 3. 1
- 23. 16 Задание Выберите все правильные
- 24. 17 Задание Выберите все правильные
- 25. S + KNO3 → KNO2 +
- 26. CaCO3(t0)→ CaCO3 + HCl
- 27. Далее Напишите уравнения реакций, с
- 28. Далее
- 29. 20 Задание Далее 3 бал.
- 30. Далее
- 31. Далее При решении экспериментальной задачи
- 32. Итги
Слайд 1
20
45
Всего заданий
Время тестирования
мин.
Начать тестирование
Тест для подготовки
к ГИА-2012
Химия, 9 класс
Сиротина С.Н.,
учитель
с.Малые Бутырки
Слайд 2
Далее
Инструкция для учащихся
На выполнение теста отводится 45 минут.
Тест состоит из
Задания В1 и В2 с выбором двух правильных ответов.
Задания В3 и В4 – на установление соответствий .
В задании С2 после решения задачи выберите правильный ответ.
При выполнении работы вы можете пользоваться ПСХЭ Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором. Ссылки на справочные материалы находятся в правом верхнем углу слайда.
До истечения времени тестирования можно вернуться к предыдущим слайдам и исправить ответ.
??? Для работы теста необходимо, чтобы исполнение макросов в PowerPoint было разрешено.
Слайд 5
Далее
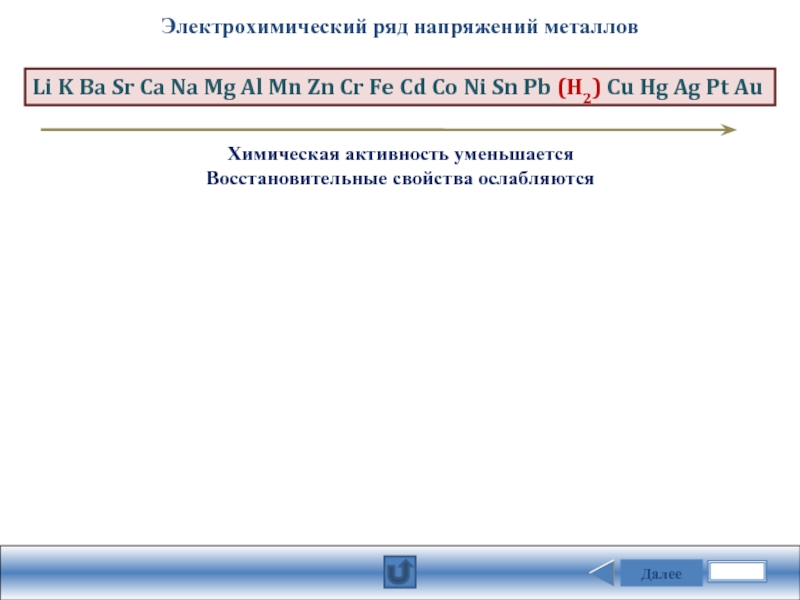
Электрохимический ряд напряжений металлов
Химическая активность уменьшается
Восстановительные свойства ослабляются
Li K Ba Sr
Слайд 6
1
Задание
Распределение электронов по энергетическим уровням 2; 8; 8; 1 – соответствует
Далее
1 бал.
3-м периоде, IA группе
4-м периоде, IVA группе
4-м периоде, IВ группе
4-м периоде, IA группе
А1
Слайд 7
2
Задание
В ряду оксидов P2O5 → SiO2→ Al2O3 свойства изменяются от:
Далее
1 бал.
кислотных
основных к кислотным
кислотных к амфотерным
основных к амфотерным
А2
Слайд 8
3
Задание
Какой вид химической связи в сульфиде калия?
Далее
1 бал.
ионная
ковалентная полярная
ковалентная неполярная
металлическая
А3
Слайд 9
4
Задание
Далее
1 бал.
Такую же степень окисления, как у фосфора в Р2О5, хлор
KClO3
HClO4
NaClO2
AlCl3
А4
Слайд 10
5
Задание
Далее
1 бал.
Основным оксидом и щелочью соответственно являются:
Al2O3 и KOH
CrO3 и NaOH
MgO
CaO и Zn(OH)2
А5
Слайд 11
6
Задание
Далее
1 бал.
Cумма коэффициентов в уравнении реакции между оксидом натрия и азотной
7
6
5
4
А6
Слайд 12
7
Задание
Далее
1 бал.
Наибольшее количество анионов образуется при диссоциации 1 моль
AlCl3
Na3PO4
Fe(OH)3
Zn(NO3)2
А7
Слайд 13
8
Задание
Далее
1 бал.
Сокращённое ионное уравнение
Fe3+ + 3OH- → Fe(OH)3 соответствует
взаимодействию:
хлорида
бромида железа (III) и гидроксида бария
нитрата железа (III) и гидроксида меди (II)
оксида железа (III) и гидроксида натрия
А8
Слайд 14
9
Задание
Далее
1 бал.
Какой из указанных металлов проявляет наибольшую химическую активность в реакции
кальций
алюминий
свинец
железо
А9
Слайд 15
10
Задание
Далее
1 бал.
Сколько веществ из указанных в ряду HCl, KOH, BaO, H2O,
2
3
4
5
А10
Слайд 16
11
Задание
Далее
1 бал.
Гидроксид магния реагирует с :
оксидом натрия
сульфатом калия
соляной кислотой
гидроксидом натрия
А11
Слайд 17
12
Задание
Далее
1 бал.
Между какими веществами протекает химическая реакция:
карбонатом кальция и азотной кислотой
хлоридом магния(р-р) и нитратом цинка(р-р)
силикатом натрия (р-р) и гидроксидом калия(р-р)
фосфатом бария и сульфидом свинца (II)
А12
Слайд 18
13
Задание
Далее
1 бал.
Верны ли следующие утверждения о
способах очистки веществ:
А. Поваренную соль
Б. Очистить кварцевый песок от алюминиевых опилок можно с помощью магнита.
верно только А
верно только Б
верны оба утверждения
оба утверждения неверны
А13
Слайд 20
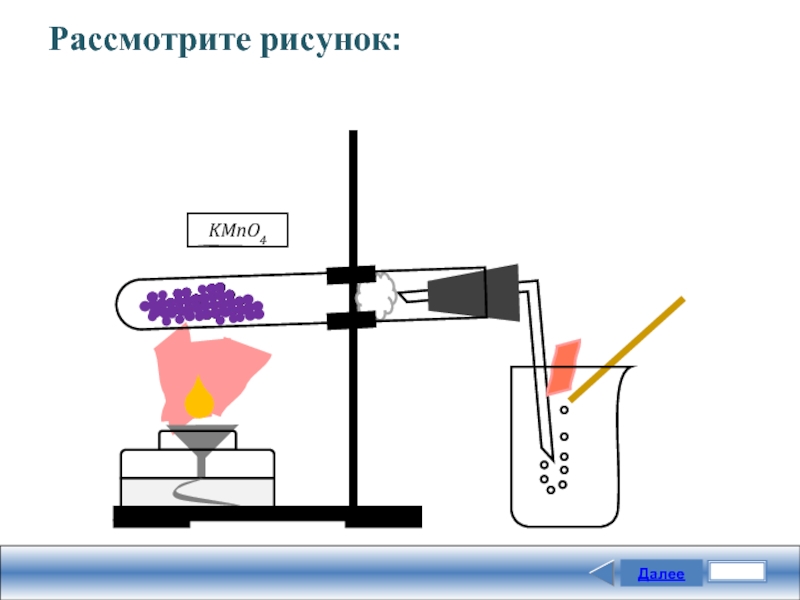
14
Задание
Далее
1 бал.
В приборе, изображённом на рисунке, получают и подтверждают наличие:
аммиака
водорода
кислорода
углекислого газа
А14
Слайд 21
15
Задание
Далее
1 бал.
Массовая доля кислорода в силикате кальция равна:
32,5%
41,4%
52,1%
65,7%
А15
Слайд 23
16
Задание
Выберите все правильные ответы!
Далее
2 бал.
В ряду химических элементов Ge → Si
увеличивается радиус атомов
возрастают восстановительные свойства
увеличиваются заряды ядер атомов
уменьшается относительная атомная масса
увеличивается электроотрицательность
В1
Слайд 24
17
Задание
Выберите все правильные ответы!
Далее
2 бал.
Этилен
относится к предельным углеводородам
горит в кислороде
вступает в реакцию полимеризации
не обесцвечивает бромную воду
содержит тройную связь между атомами углерода
В2
Слайд 25
S + KNO3 → KNO2 + SO2
NH3 + CuO → Cu
NO2 + Fe(OH)2 → Fe(NO3)3 + NO + H2O
18
Задание
Укажите все правильные позиции!
Далее
2 бал.
Э0→Э+4
Э-3→Э0
Установите соответствие между схемой превращения и изменением степени окислителя в ней.
В3
Э+4→Э+2
Э+5→Э+3
Э+2→Э0
1
2
3
1
2
3
4
5
Слайд 26
CaCO3(t0)→
CaCO3 + HCl →
CO2 + Ca(OH)2 →
19
Задание
Укажите все
Далее
2 бал.
CaCl2 + CO2 + H2
CaO + CO + O2
Установите соответствие между исходными веществами и продуктами реакции.
В4
CaO + CO2
CaCl2 + CO2 +H2O
CaCO3 + H2O
1
2
3
1
2
3
4
5
Слайд 27
Далее
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Si
Это задание компьютер не оценивает, проверь себя здесь.
С1
Слайд 29
20
Задание
Далее
3 бал.
К 848 г раствора с массовой долей фосфата калия 5%
62 г
31 г
1240 г
620 г
Проверь ход решения здесь.
С2
Слайд 31
Далее
При решении экспериментальной задачи на распознавание веществ: хлорида, сульфата и карбоната
проба 1: во все пробирки добавили раствор соляной кислоты, при этом в пробирке №1 выделился газ без запаха, не поддерживающий горения.
проба 2: в пробирки № 2 и 3 добавили хлорид бария, при этом в пробирке №3 выпал белый мелкокристаллический осадок.
проба 3: в пробирку №2 добавили нитрат серебра, при этом выпал белый творожистый осадок. Составьте 3 уравнения реакций, при помощи которых проводилось распознавание веществ.
Это задание проверь здесь.
С3