№ 546, г.Москва
Руководитель: Носова Е.П.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Васютин Н., Тришков И., Чижов А . Учащиеся 9 класса ГОУ СОШ № 546, г.Москва Руководитель: Носова Е.П. презентация
Содержание
- 1. Васютин Н., Тришков И., Чижов А . Учащиеся 9 класса ГОУ СОШ № 546, г.Москва Руководитель: Носова Е.П.
- 3. Вода - самое распространенное вещество на Земле.
- 5. Протий – самый легкий изотоп водорода. Обозначается
- 6. Дейтериевая вода оксид дейтерия D2O с кислородом
- 7. Тритиевая вода (сверхтяжелая вода) — вода, в молекулах
- 8. Общее число изотопных модификаций воды Если подсчитать
- 11. Бесцветная жидкость не имеющая вкуса и запаха
- 12. Выделением из воды или водорода с естественным
- 13. В природных вода 1 атом дейтерия приходится
- 14. Тяжелая вода, 200 мл
- 15. Тяжелая вода используется при получении атомной энергии. В ядерных реакторах, она служит веществом, замедляющим нейтроны.
- 16. Изменились ли свойства вещества с увеличением массы
- 17. Изменение состава ядра атома может изменить свойства всего вещества.
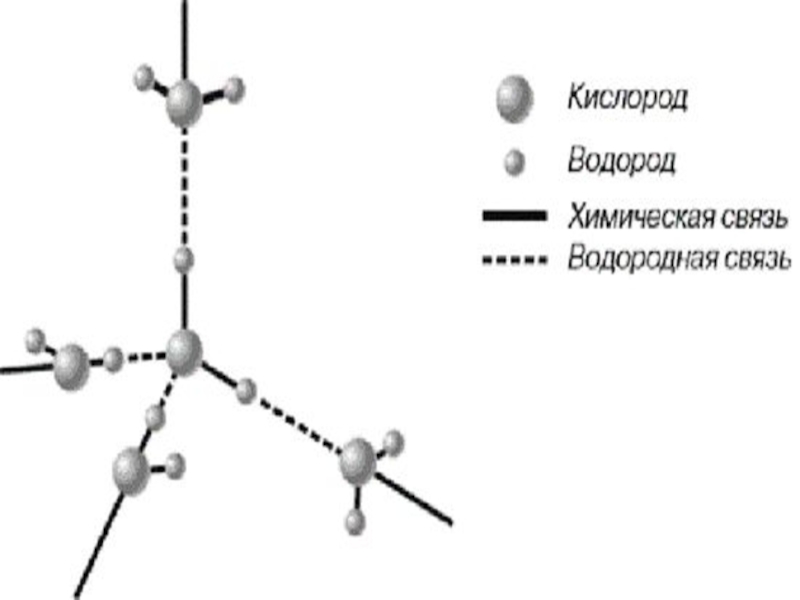
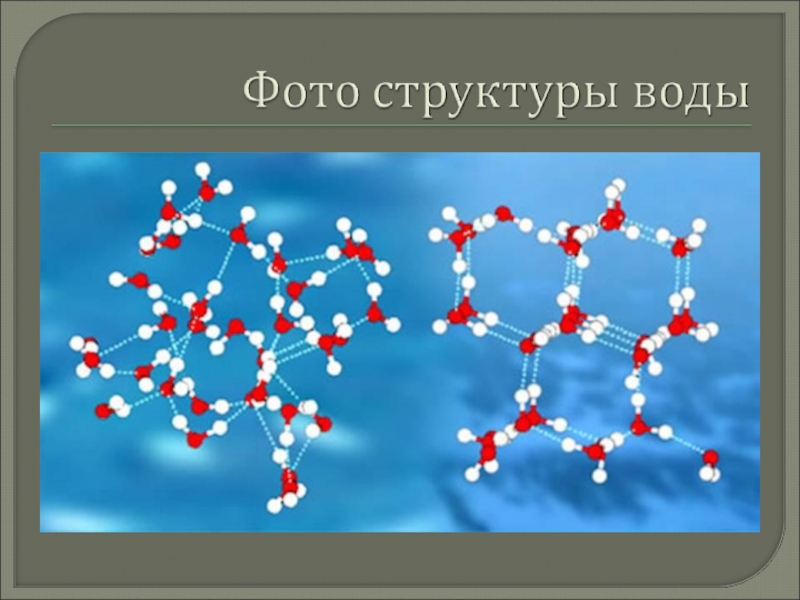
Слайд 3Вода - самое распространенное вещество на Земле.
Бесцветная жидкость не имеющая вкуса
и запаха.
t кипения 100С, кристаллизации 0С.
Единственное вещество в природе, которое встречается в трех агрегатных состояниях.
Максимальная плотность при 4С.
Вода очень прочное вещество, её молекула разрушается только при очень высокой температуре или под действием электрического тока. Так, разложение воды становится заметным лишь при 2000С.
Вода – одно из наиболее реакционноспособных веществ. В молекуле воды атомы водорода и кислорода находятся в устойчивых степенях окисления: +1 и -2 соответственно, поэтому вода обладает неярко выраженными окислительно-востоновительными свойствами.
t кипения 100С, кристаллизации 0С.
Единственное вещество в природе, которое встречается в трех агрегатных состояниях.
Максимальная плотность при 4С.
Вода очень прочное вещество, её молекула разрушается только при очень высокой температуре или под действием электрического тока. Так, разложение воды становится заметным лишь при 2000С.
Вода – одно из наиболее реакционноспособных веществ. В молекуле воды атомы водорода и кислорода находятся в устойчивых степенях окисления: +1 и -2 соответственно, поэтому вода обладает неярко выраженными окислительно-востоновительными свойствами.
Слайд 5Протий – самый легкий изотоп водорода. Обозначается символом 1Н. Ядро протия
состоит из одного протона , отсюда и название изотопа. Протий составляет 99,9885% от общего числа атомов водорода во Вселенной. Атомная масса равна 1.00782503207
Дейте́рий (лат. deuterium от греч. δεύτερον — «второй, вторичный»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Тритий (от греч. tritos - третий) T, или 3H, радиоактивный тяжелый изотоп водорода с атомной массой 3,016050. Ядро атома состоит из одного протона и двух нейтронов. Период полураспада 12 лет.
Дейте́рий (лат. deuterium от греч. δεύτερον — «второй, вторичный»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Тритий (от греч. tritos - третий) T, или 3H, радиоактивный тяжелый изотоп водорода с атомной массой 3,016050. Ядро атома состоит из одного протона и двух нейтронов. Период полураспада 12 лет.
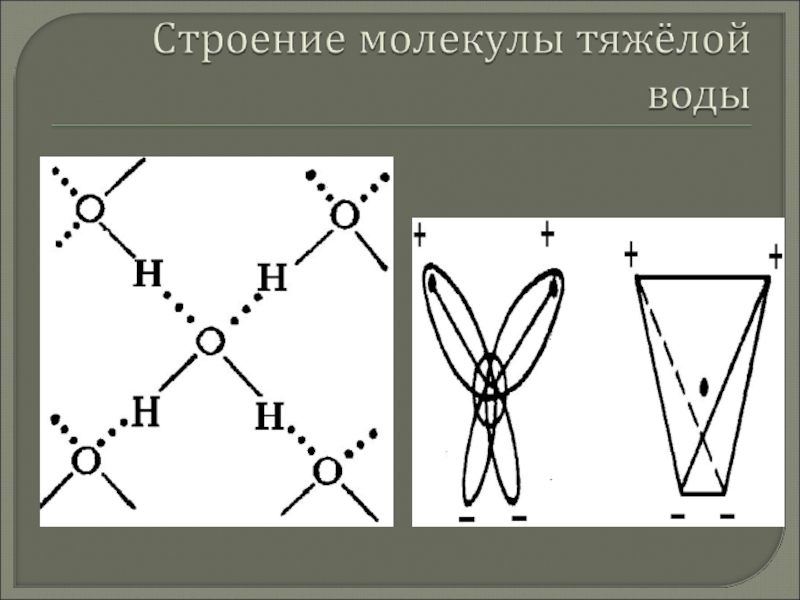
Слайд 6Дейтериевая вода
оксид дейтерия D2O с кислородом природного изотопного состава; мол. масса
20,02760; бесцветная жидкость без запаха и вкуса.
Оксид водорода природного изотопного состава с тяжелым HDO изотопом 18O - тяжелокислородная вода, мол.масса 20,0157.
Оксид протодейтерия HDO имеет мол. м. 19,02140.
В смесях D2O с H2O с большой скоростью протекает изотопный обмен
H2O + D2O <->2HDO
(дейтерий при малом содержании присутствует в воде почти целиком в форме HDO, а при высоком - в форме D2O).
Оксид водорода природного изотопного состава с тяжелым HDO изотопом 18O - тяжелокислородная вода, мол.масса 20,0157.
Оксид протодейтерия HDO имеет мол. м. 19,02140.
В смесях D2O с H2O с большой скоростью протекает изотопный обмен
H2O + D2O <->2HDO
(дейтерий при малом содержании присутствует в воде почти целиком в форме HDO, а при высоком - в форме D2O).
Слайд 7Тритиевая вода (сверхтяжелая вода) — вода, в молекулах которой атомы водорода замещены
атомами трития. В чистой форме называется окисью трития (T2O или 3H2O) или супертяжелой водой. Из-за собственной радиоактивности, чистый T2O имеет высокую коррозионную активность — при спонтанном превращении трития в 3He происходит выделение атомарного кислорода.
Для T2O температура плавления — 274,40 К, тройная точка — 277,64 К, плотность — 1,21459 г/см³.
Тритиевая вода содержится в обычной воде, однако распределение её неравномерно. Например, в водоёмах материков её больше, чем в океанах; а в океанских водах возле полюсов её больше, чем возле экватора.
Разновидности тритиевой воды HTO, DTO и Т2О применяются в качестве радиоактивных индикаторов влагонепроницаемости вещества.
Тритиевая вода также применяется как меченое соединение для исследования водного обмена.
Для T2O температура плавления — 274,40 К, тройная точка — 277,64 К, плотность — 1,21459 г/см³.
Тритиевая вода содержится в обычной воде, однако распределение её неравномерно. Например, в водоёмах материков её больше, чем в океанах; а в океанских водах возле полюсов её больше, чем возле экватора.
Разновидности тритиевой воды HTO, DTO и Т2О применяются в качестве радиоактивных индикаторов влагонепроницаемости вещества.
Тритиевая вода также применяется как меченое соединение для исследования водного обмена.
Слайд 8 Общее число изотопных модификаций воды
Если подсчитать все возможные нерадиоактивные соединения с
общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
Стабильные:
Н216O − лёгкая вода, или просто вода
Н217O
Н218O − тяжёлокислородная вода
HD16O − полутяжёлая вода
HD17O
HD18O
D216O − тяжёлая вода
D217O
D218O
Радиоактивные:
T216O
T217O
T218O
DT16O
DT17O
DT18O
HT16O
HT17O
HT18O
С учётом трития их число возрастает до 18. Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Стабильные:
Н216O − лёгкая вода, или просто вода
Н217O
Н218O − тяжёлокислородная вода
HD16O − полутяжёлая вода
HD17O
HD18O
D216O − тяжёлая вода
D217O
D218O
Радиоактивные:
T216O
T217O
T218O
DT16O
DT17O
DT18O
HT16O
HT17O
HT18O
С учётом трития их число возрастает до 18. Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Слайд 11Бесцветная жидкость не имеющая вкуса и запаха
Замерзает при +3.8С.
Кипит при 101,4С.
Плотность
1,1056 г/см3
Имеет максимальную плотность при11,6С.
В тяжелой воде не возможна жизнь.
В обычное воде содержится 0,02% примесей тяжелой воды.
Имеет максимальную плотность при11,6С.
В тяжелой воде не возможна жизнь.
В обычное воде содержится 0,02% примесей тяжелой воды.
Слайд 12Выделением из воды или водорода с естественным изотопным составом.
Производство разделяют на
2 стадии:
- начальное концентрирование (до 5-10% в пересчете на D2O)
- конечное концентрирование (от 5-10% до 99,8% D2O)
Низкотемпературная ректификация жидкого H2 с последующим сжиганием D2 в O2
Основные страны-производители :
Канада США
Индия Норвегия
Россия.
- начальное концентрирование (до 5-10% в пересчете на D2O)
- конечное концентрирование (от 5-10% до 99,8% D2O)
Низкотемпературная ректификация жидкого H2 с последующим сжиганием D2 в O2
Основные страны-производители :
Канада США
Индия Норвегия
Россия.
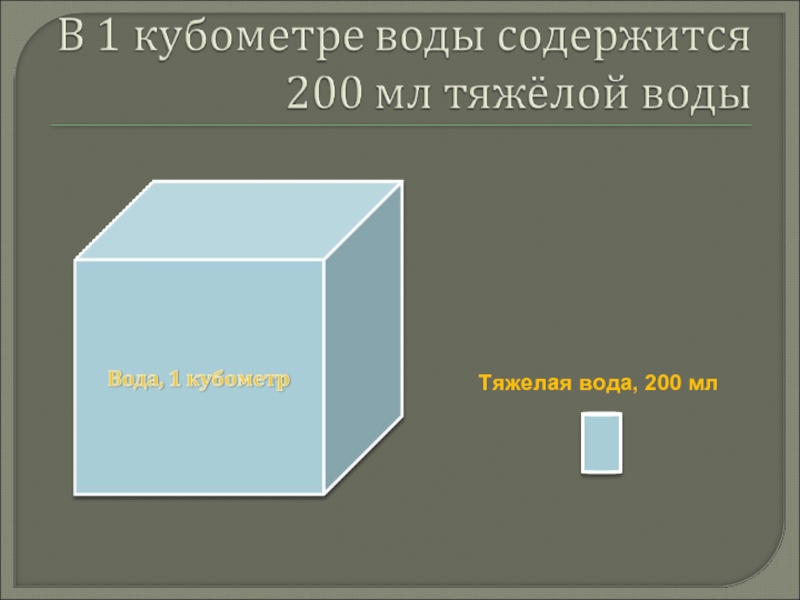
Слайд 13В природных вода 1 атом дейтерия приходится на 6400 атомов протия.
В
обычной воде всегда содержится 0,02% тяжёлой воды (то есть в 1 кубометре воды содержится 200 мл тяжёлой воды).
Суммарный объем тяжелой воды на Земле равен объему Черного моря.
Суммарный объем тяжелой воды на Земле равен объему Черного моря.
Слайд 15 Тяжелая вода используется при получении атомной энергии. В ядерных реакторах, она
служит веществом, замедляющим нейтроны.
Слайд 16Изменились ли свойства вещества с увеличением массы ядра химического элемента на
1,2… нейтрона?
Свойства каких веществ были рассмотрены в данной работе?
Как меняются свойства вещества с увеличением числа нейтронов в атоме?
Свойства каких веществ были рассмотрены в данной работе?
Как меняются свойства вещества с увеличением числа нейтронов в атоме?