- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курсовая работа Мусралиевой Людмилы Николаевны. презентация
Содержание
- 1. Курсовая работа Мусралиевой Людмилы Николаевны.
- 2. Кислоты
- 3. Кислоты - сложные вещества, состоящие из атомов
- 4. Кислоты содержатся В
- 5. Кислоты в дождевой воде Углекислый газ при
- 6. Кислоты в растениях Лишайники выделяют кислоты, называемые
- 7. Кислоты в организмах животных Муравей при укусе
- 8. Кислоты в организме человека Ряд кислот, играющих
- 9. Кислоты в пище животных и человека Здоровье человека определяется кислотно-щелочным балансом
- 10. Классификация кислот По
- 11. Физические свойства Кислоты -
- 12. Химические свойства : 1. Взаимодействие
- 13. 3. Взаимодействие с металлами:
- 14. Это интересно Индикаторы были открыты Р.Бойлем
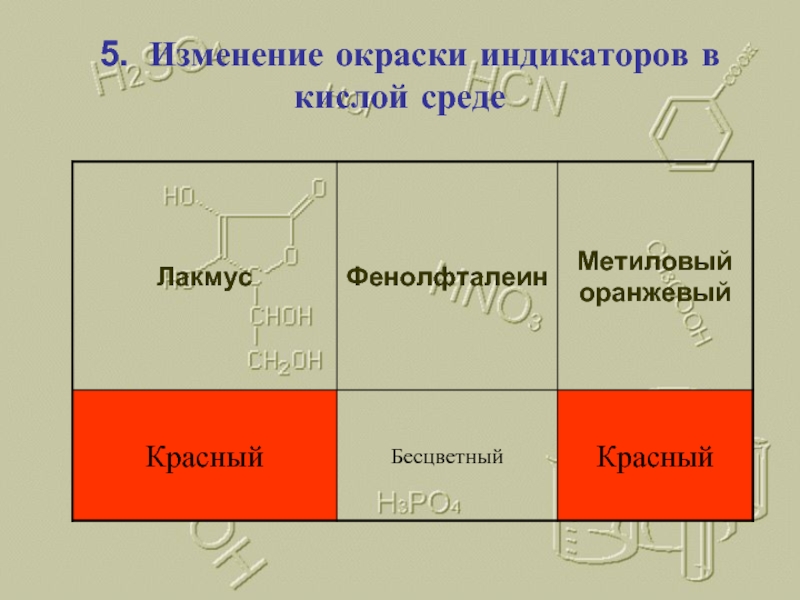
- 15. 5. Изменение окраски индикаторов в кислой среде
- 16. Разбавление серной кислоты Относительно смешивания серной кислоты
- 17. HCl - хлороводородная (соляная) HF -
- 18. Получение : 1. Взаимодействие кислотного оксида
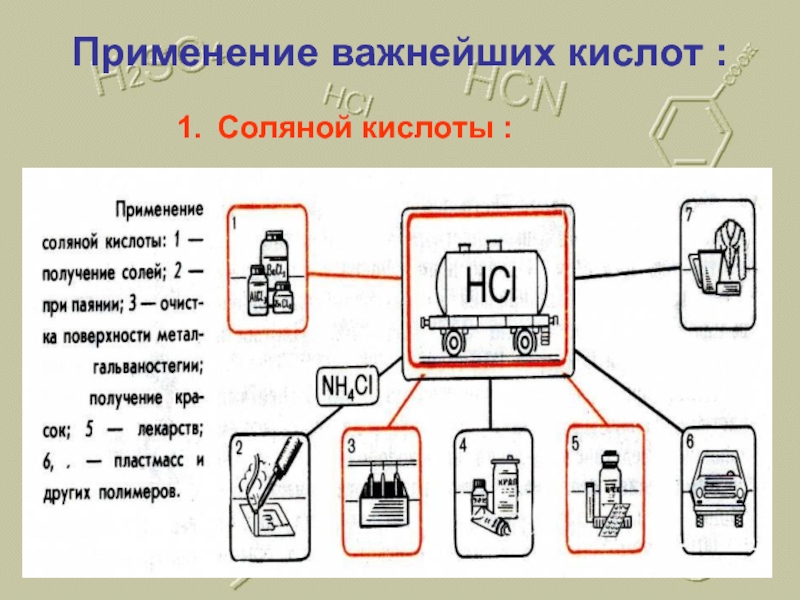
- 19. Применение важнейших кислот : Соляной кислоты :
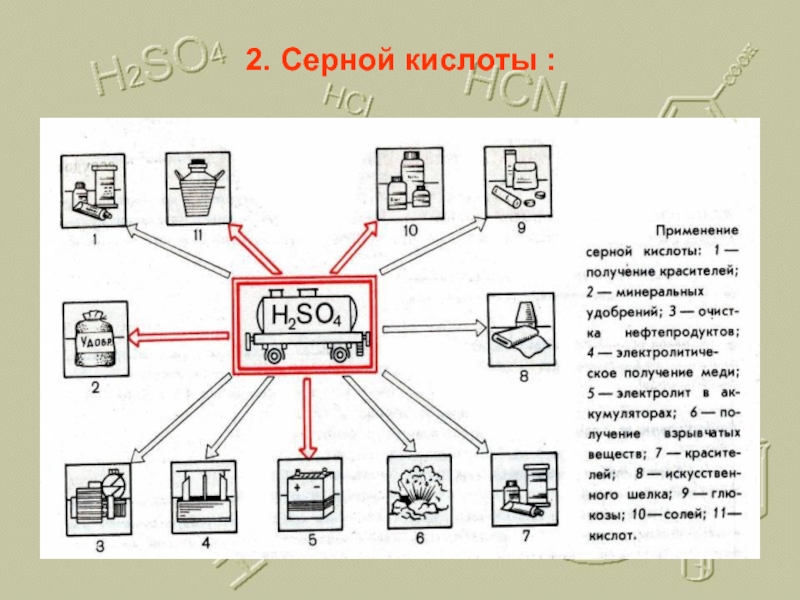
- 20. 2. Серной кислоты :
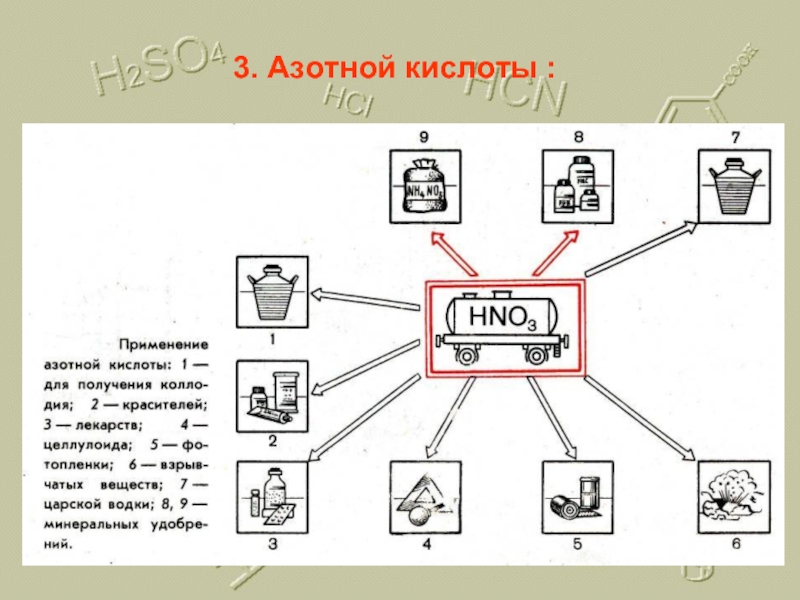
- 21. 3. Азотной кислоты :
Слайд 3Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка.
Слайд 4
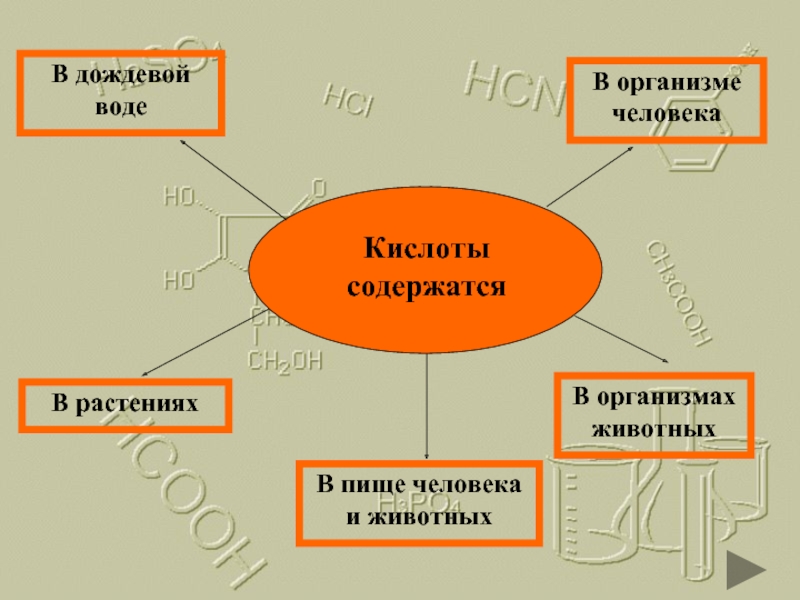
Кислоты содержатся
В растениях
В организмах животных
В организме человека
В пище человека и животных
В
Слайд 5Кислоты в дождевой воде
Углекислый газ при растворении дает раствор слабой угольной
Азотная кислота может находиться в дождевой воде после грозы
Сернистый газ, образовавшийся при извержении вулканов и сгорании топлива, окисляясь на воздухе и взаимодействуя с парами воды, дает серную кислоту
Слайд 6Кислоты в растениях
Лишайники выделяют кислоты, называемые лишайниковыми, которые разрушают горные породы
В
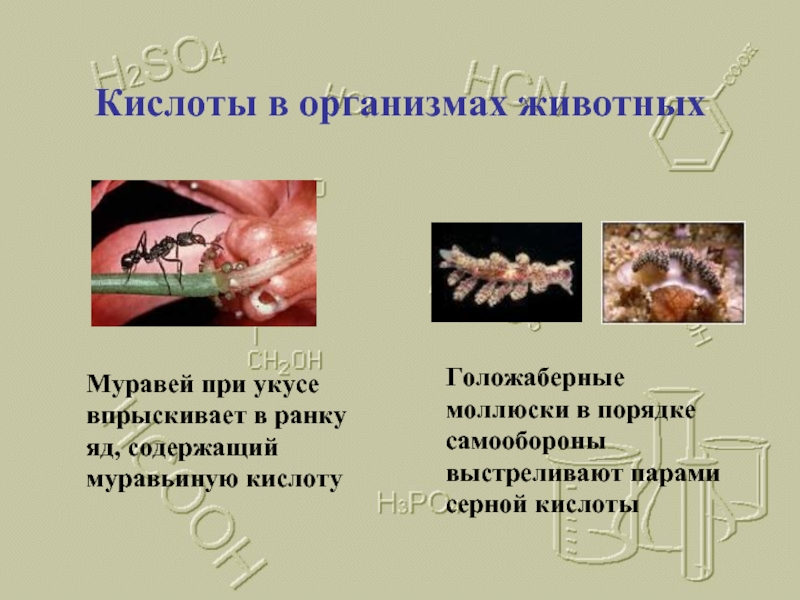
Слайд 7Кислоты в организмах животных
Муравей при укусе впрыскивает в ранку яд, содержащий
Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты
Слайд 8Кислоты в организме человека
Ряд кислот, играющих важную роль в организме человека,
Аминокислоты, соединяясь друг с другом, образуют великое множество белков
Соляная кислота, содержащаяся в желудочном соке, выполняет немало важных функций
Слайд 10
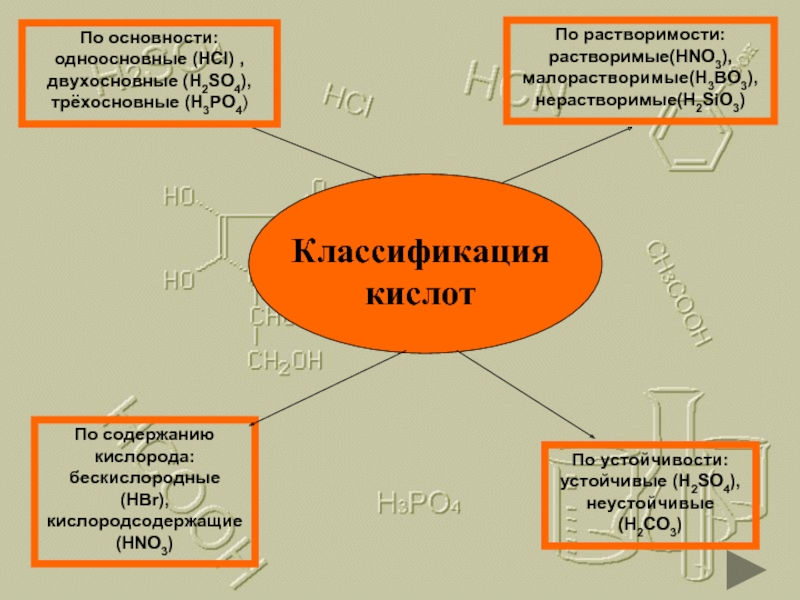
Классификация кислот
По содержанию кислорода: бескислородные (HBr), кислородсодержащие (HNO3)
По устойчивости: устойчивые (H2SO4),
По растворимости: растворимые(HNO3), малорастворимые(H3BO3), нерастворимые(H2SiO3)
По основности: одноосновные (HCl) , двухосновные (H2SO4), трёхосновные (H3PO4)
Слайд 11
Физические свойства
Кислоты - бесцветные жидкости (HCI,H2SO4,HNO3), твёрдые вещества (H3PO4,HPO3,H3BO3), кислые на
Слайд 12
Химические свойства :
1. Взаимодействие с основаниями (реакция нейтрализации):
H2SO4 + 2KOH → K2SO4
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2. Взаимодействие с основными оксидами:
CuO + 2HNO3 → Cu(NO3)2 + H2O
Слайд 13
3. Взаимодействие с металлами:
Zn + 2HCl → ZnCl2 + H2↑
2Al +
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
4. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 → BaSO4↓ +2HCl
2HCl + K2CO3 → 2KCl + H2O + CO2↑
Слайд 16Разбавление серной кислоты
Относительно смешивания серной кислоты с водой с давних пор
Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Слайд 17HCl - хлороводородная (соляная)
HF - фтороводородная (плавиковая)
HBr - бромоводородная
HI -
H2S - сероводородная
H2CO3 - угольная
H2SO4 - серная
HNO3 - азотная
H3PO4 - ортофосфорная
Названия распространенных кислот
Слайд 18Получение :
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 +
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 → 2HCl
H2 + S → H2S
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
2NaCl(тв.) + H2SO4(конц.) → Na2SO4 + 2HCl