средняя общеобразовательная школа №3»
Адрес: Псковская обл., г.Печоры, ул.Индустриальная, д.13
Сайт:http://pechssh-3.ucoz.ru
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Работу выполнила команда Три-А презентация
Содержание
- 1. Работу выполнила команда Три-А
- 2. Материалы: сахароза, карбонат натрия, гидрокарбонат натрия,
- 3. 1.Первоначальная температура воды была 20°С .
- 4. При добавлении в воду веществ температура стала изменяться.
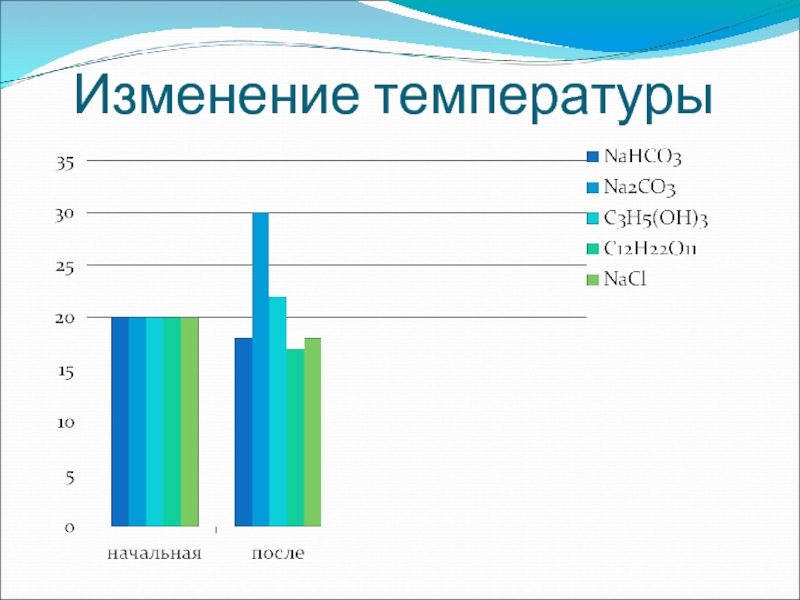
- 5. Изменение температуры
- 6. Температура снега равна 0°С , но
- 7. Размышление на тему… Для растворения
- 8. Объяснение тепловых явлений при растворении веществ Растворение
- 9. Д.И.Менделеев создал химическую теорию растворов. Он
- 10. Тест 1. Какие ученые
- 11. После представления своей
- 12. Проверяя работы, мы пришли
- 13. Ресурсы Книга для чтения по неорганической
Слайд 1«Тепловые эффекты при растворении веществ в воде»
Работу выполнила
команда «Три-А»
МОУ «Печорская
Слайд 2
Материалы: сахароза, карбонат натрия, гидрокарбонат натрия, глицерин, хлорид натрия, снег,
поваренная соль.
Оборудование: термометры из наборов школьных кабинетов химии.
Оборудование: термометры из наборов школьных кабинетов химии.
Слайд 6
Температура снега равна 0°С , но при добавлении в него поваренной
соли температура падает : чем больше соли , тем ниже температура .
Слайд 7Размышление на тему…
Для растворения хлорида натрия на разрушение его
кристаллической решетки требуется затратить около 800 кДж на 1 моль. В воде этот процесс происходит самопроизвольно. Откуда взялась энергия на разъединение ионов в кристалле NaCl ? Может ее источником служит тепловое движение молекул воды? Допустим, для приготовления раствора взяли воду при температуре 20° С. Известно, что потеря 1 литром H2O 4 кДж теплоты понижает температуру этого объема воды приблизительно на 1 ° С. Выходит, что при растворении 1 моля NaCl (58,5 г.) в 1 л. H2O, вода должна превратиться в лед. Однако на практике этого не происходит. Значит сам процесс растворения поставляет энергию, необходимую для разрушения связей в растворенном веществе.
Слайд 8Объяснение тепловых явлений при растворении веществ
Растворение веществ сопровождается двумя процессами:
Разрушение структуры
веществ и распределение его молекул или ионов во всем объеме растворителя, на что требуется затрата энергии (поглощение тепла) Q1
Химическое взаимодействие растворенного вещества и растворителя (происходит выделение тепла) Q2
Если Q1 > Q2, то при растворении выделяется теплота
Если Q1 < Q2, то при растворении поглощается теплота
Если Q1 = Q2, то тепловой эффект отсутствует
Процесс растворения газообразных веществ в воде почти всегда сопровождается выделением тепла т.к. молекулы не связаны между собой и поэтому легко взаимодействуют с растворителем.
Химическое взаимодействие растворенного вещества и растворителя (происходит выделение тепла) Q2
Если Q1 > Q2, то при растворении выделяется теплота
Если Q1 < Q2, то при растворении поглощается теплота
Если Q1 = Q2, то тепловой эффект отсутствует
Процесс растворения газообразных веществ в воде почти всегда сопровождается выделением тепла т.к. молекулы не связаны между собой и поэтому легко взаимодействуют с растворителем.
Слайд 9
Д.И.Менделеев создал химическую теорию растворов. Он обосновал теорию многочисленными опытными данными,
которые изложил в книге «Исследование водных растворов по их удельному весу» (1887 г.) «Растворы суть химические соединения определяемые силами, действующими между растворителем и растворенным веществом», - писал Менделеев в этой книге.
Русские химики И.А.Каблуков и в.А. Кистяковский доказали, что растворение веществ в воде приводит к образованию гидратов. (1888-1891г.г). Процесс образования гидратов называется гидратацией.
М.В.Ломоносов установил, что растворы замерзают при более низкой температуре, чем растворитель. В 1764 г. он писал: «Морозы соленого рассолу не могут в лед превратить удобно, как одолевают пресного».
Русские химики И.А.Каблуков и в.А. Кистяковский доказали, что растворение веществ в воде приводит к образованию гидратов. (1888-1891г.г). Процесс образования гидратов называется гидратацией.
М.В.Ломоносов установил, что растворы замерзают при более низкой температуре, чем растворитель. В 1764 г. он писал: «Морозы соленого рассолу не могут в лед превратить удобно, как одолевают пресного».
Слайд 10Тест
1. Какие ученые исследовали процесс растворения?
А) М.В.Ломоносов, Бутлеров А.М., Зелинский Н.Д., А.Лавуазье
Б) М.В.Ломоносов, Д.И.Менделеев, И.А.Каблуков, В.А. Кистяковский
В) Д.И.Менделеев, К. Шееле, Г. Дэви, В.В. Марковников
2. При растворении NaОН , H2SO4, Na2CO3 происходит
А) разогревание раствора Б) охлаждение раствора В) никаких изменений не происходит
3. Непрочное соединение, существующее в растворе
А) гидроксид Б) гидрид В) гидрат
4. Формулы кристаллогидратов
А) СuSO4•5 H2O; Na2CO3 •10 H2O; ZnSO4 •7 H2O Б) СuSO4, H2O, КОН В) Сu2+ , SO42-, H3O+
5. Почему растворение в воде безводного хлорида кальция сопровождается повышением температуры , а при растворении кристаллогидрата этой соли - понижением?
Б) М.В.Ломоносов, Д.И.Менделеев, И.А.Каблуков, В.А. Кистяковский
В) Д.И.Менделеев, К. Шееле, Г. Дэви, В.В. Марковников
2. При растворении NaОН , H2SO4, Na2CO3 происходит
А) разогревание раствора Б) охлаждение раствора В) никаких изменений не происходит
3. Непрочное соединение, существующее в растворе
А) гидроксид Б) гидрид В) гидрат
4. Формулы кристаллогидратов
А) СuSO4•5 H2O; Na2CO3 •10 H2O; ZnSO4 •7 H2O Б) СuSO4, H2O, КОН В) Сu2+ , SO42-, H3O+
5. Почему растворение в воде безводного хлорида кальция сопровождается повышением температуры , а при растворении кристаллогидрата этой соли - понижением?
Слайд 11
После представления своей презентации мы провели тестирование с целью
выяснения первоначальных знаний одноклассников по теме :
«Тепловые эффекты при растворении веществ в воде»
«Тепловые эффекты при растворении веществ в воде»
Слайд 12
Проверяя работы, мы пришли к общему мнению , что
большинство наших одноклассников с заданием справилось.
Учитель оценил нашу работу на «хорошо»
Учитель оценил нашу работу на «хорошо»
Слайд 13Ресурсы
Книга для чтения по неорганической химии. Часть II. Составитель Крицман
В.А. М., «Просвещение» 1984
Селиванова Н.М. , Разавин И.И. Неорганическая химия., Издательство «Высшая школа», М. 1971
Габриелян О.С. Химия 8 класс, Дрофа, М. 2007
Фельдман Ф.Г., Рудзитис Г.Е. Химия 9 класс, М. «Просвещение» 2008
Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. «Высшая школа», М. 1968
Селиванова Н.М. , Разавин И.И. Неорганическая химия., Издательство «Высшая школа», М. 1971
Габриелян О.С. Химия 8 класс, Дрофа, М. 2007
Фельдман Ф.Г., Рудзитис Г.Е. Химия 9 класс, М. «Просвещение» 2008
Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. «Высшая школа», М. 1968