- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физика и структурная биология в начале XXI века И. Н. Сердюк Лаборатория физики нуклеопротеидов, Институт Белка РАН, г. Пущино. и Лаборатория нейтронной физики, Объединенный Институт Ядерных Исследований, г. Дубна 22 Февраля, 2005 презентация
Содержание
- 1. Физика и структурная биология в начале XXI века И. Н. Сердюк Лаборатория физики нуклеопротеидов, Институт Белка РАН, г. Пущино. и Лаборатория нейтронной физики, Объединенный Институт Ядерных Исследований, г. Дубна 22 Февраля, 2005
- 2. Транскрипция Поток информации
- 3. Двойная спираль ДНК (Дж. Уотсон и Ф.
- 4. Рентгеновская структура гемоглобина (М. Перутц и Дж.
- 5. Первое революционное событие в структурной молекулярной биологии
- 6. Ондулятор Отклоняющий магнит Синхротронные
- 7. Нейтронные источники Стационарные (с тратой энергии) Импульсные
- 8. Трехмерная структура молекулы лизоцима и 157 молекул
- 9. Импульсная Фурье-ЯМР спектроскопия,
- 10. Методы рентгеновской кристаллографии и ЯМР обладают
- 12. Лазерная наведенная флюоресценция , В лазерной
- 13. Флюоресцентные метки, используемые в структурной биологии
- 14. Флюоресцентный перенос энергии.
- 15. GFP как клеточный репортер Двухцветная флюоресцентная
- 16. Визуализация одиночных молекул требует радикального изменения наблюдаемого
- 17. Двухфотонное возбуждение In 1931 M. Goppert-Mayer gave
- 18. Микроскопия ближнего поля Near-field scanning optical
- 19. Флюоресцентная микроскопия при полном внутреннем отражении Характерная
- 20. Конфокальная микроскопия Формирование линзой изображения двух
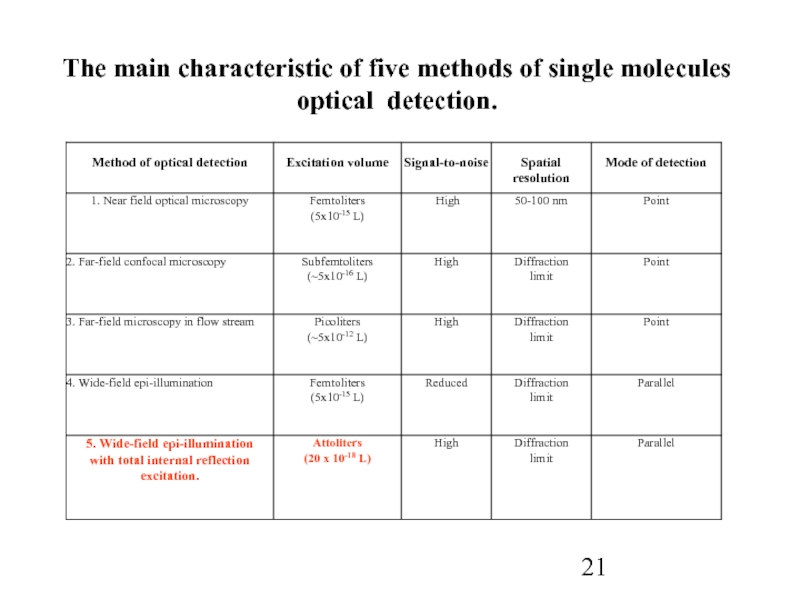
- 21. The main characteristic of five methods of single molecules optical detection.
- 22. П Е Р Е Р Ы В? Визуализация и манипулирование одиночными макромолекулами
- 23. Сканирующая туннельная микроскопия (G. Binning and
- 24. Микроскопия силового поля (безлинзовая микроскопия) Микроскопия силового
- 25. Изображение биологических макромолекул методом AFM Слева: изображение
- 26. Изображение биологических структур методом AFM ДНК
- 27. Наблюдение за ростом двумерных кристаллов методом AFM
- 28. Манипуляция одиночными макромолекулами Бусинка с высоким показателем
- 29. В оптическом твизере сильно сфокусированный лазерный луч
- 30. Метод AFM методе в режиме измерения силы.
- 31. Белковая архитектура и механическая стабильность Красные линии
- 32. Природные конфигурации ДНК «Искусственные»
- 33. Схематические диаграммы использования оптических твизеров при исследовании линейных молекулярных моторов
- 34. РНК-полимераза-
- 35. Сравнение основных механических характеристик молекулярных моторов.
- 36. F0F1 ATP фазный мотор двойного действия
- 37. Молекулярная архитектура бактериальной флагеллы как вращающегося устройства
- 38. I. Serdyuk N. Zaccai
- 39. Курс лекций проф. И.Н. Сердюк “Физические методы
- 40. Оптическое детектирование одиночных молекул в твердой фазе
Слайд 1Физика и структурная биология в начале XXI века
И. Н. Сердюк
Лаборатория физики
Институт Белка РАН, г. Пущино.
и
Лаборатория нейтронной физики,
Объединенный Институт Ядерных Исследований, г. Дубна
22 Февраля, 2005
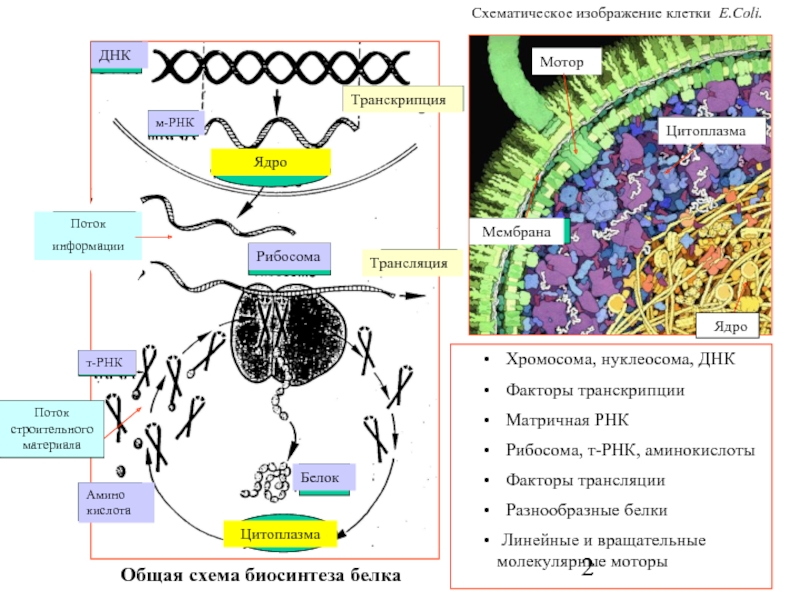
Слайд 2
Транскрипция
Поток
информации
ДНК
м-РНК
Рибосома
Общая схема биосинтеза белка
Поток строительного материала
Трансляция
Цитоплазма
т-РНК
Белок
Хромосома, нуклеосома, ДНК
Факторы транскрипции
Матричная РНК
Рибосома, т-РНК, аминокислоты
Факторы трансляции
Разнообразные белки
Линейные и вращательные молекулярные моторы
Схематическое изображение клетки Е.Coli.
Цитоплазма
Ядро
Мембрана
Мотор
Амино кислота
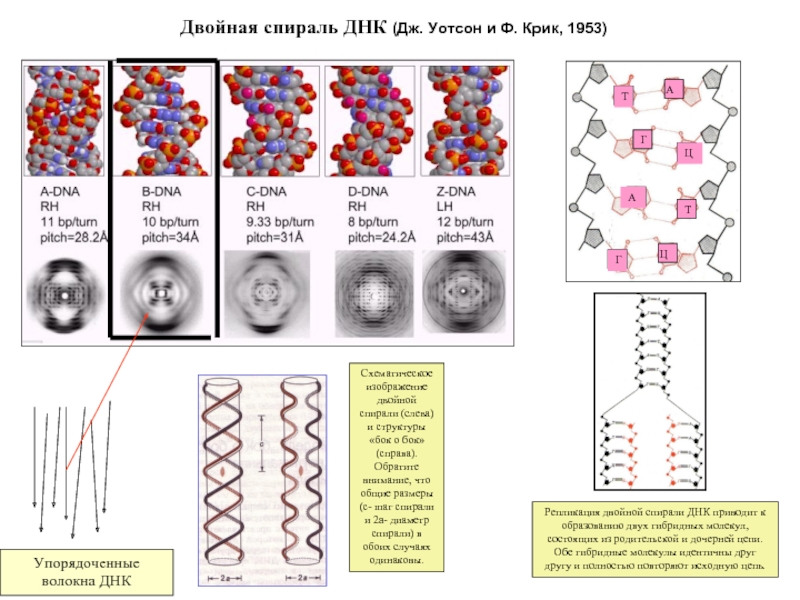
Слайд 3Двойная спираль ДНК (Дж. Уотсон и Ф. Крик, 1953)
Репликация двойной спирали
Схематическое изображение двойной спирали (слева) и структуры «бок о бок» (справа). Обратите внимание, что общие размеры (c- шаг спирали и 2а- диаметр спирали) в обоих случаях одинаковы.
A
T
Г
Ц
А
Т
Ц
Г
Упорядоченные волокна ДНК
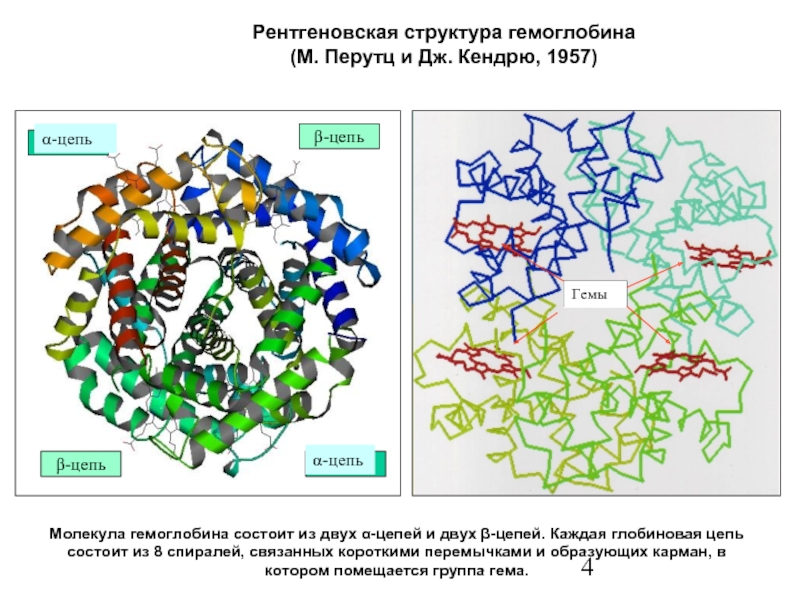
Слайд 4Рентгеновская структура гемоглобина
(М. Перутц и Дж. Кендрю, 1957)
Молекула гемоглобина состоит из
Гемы
β-цепь
β-цепь
α-цепь
α-цепь
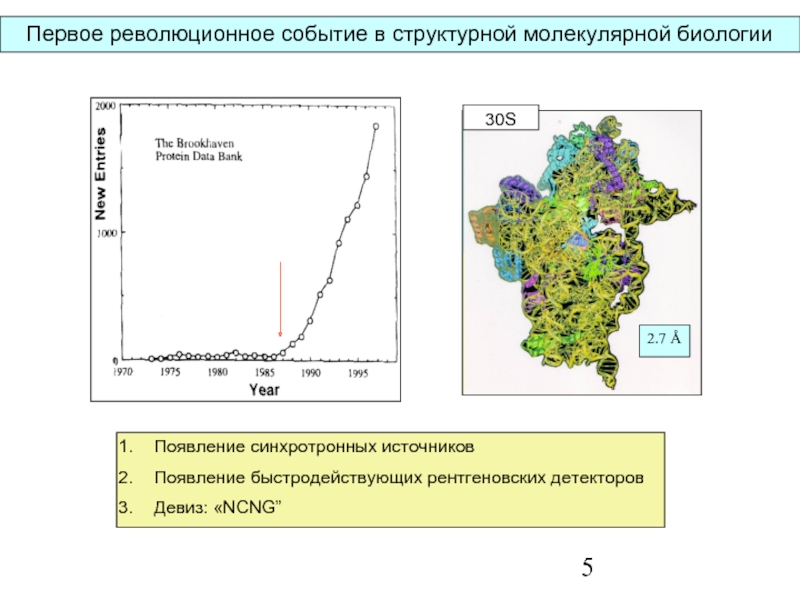
Слайд 5Первое революционное событие в структурной молекулярной биологии
Появление синхротронных источников
Появление быстродействующих рентгеновских
Девиз: «NCNG”
30S
2.7 Å
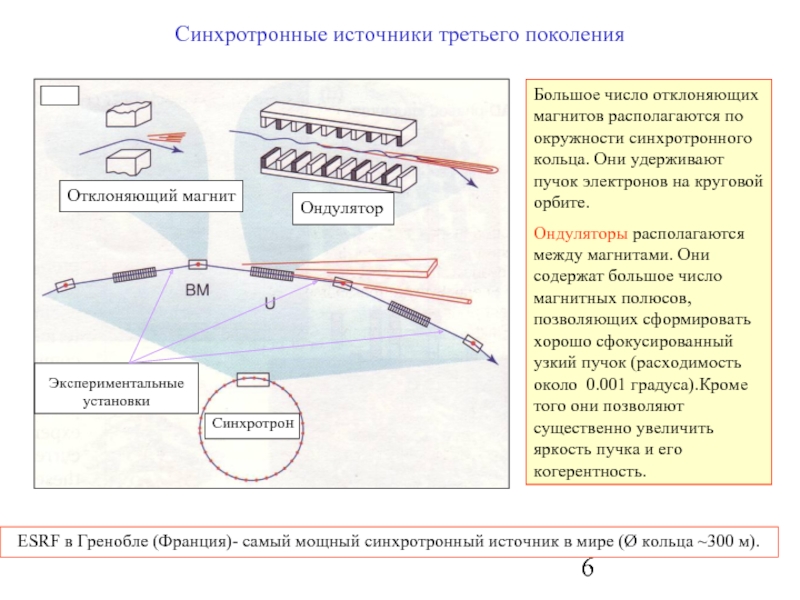
Слайд 6
Ондулятор
Отклоняющий магнит
Синхротронные источники третьего поколения
Синхротрон
Большое число отклоняющих магнитов располагаются по окружности
Ондуляторы располагаются между магнитами. Они содержат большое число магнитных полюсов, позволяющих сформировать хорошо сфокусированный узкий пучок (расходимость около 0.001 градуса).Кроме того они позволяют существенно увеличить яркость пучка и его когерентность.
Экспериментальные установки
ESRF в Гренобле (Франция)- самый мощный синхротронный источник в мире (Ø кольца ~300 м).
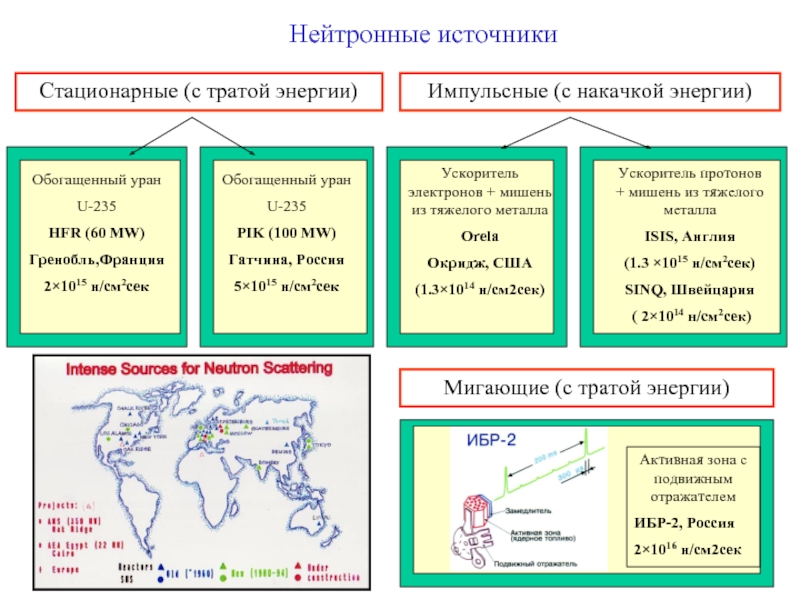
Слайд 7Нейтронные источники
Стационарные (с тратой энергии)
Импульсные (с накачкой энергии)
Ускоритель электронов + мишень
Orela
Окридж, США
(1.3×1014 н/см2сек)
Ускоритель протонов + мишень из тяжелого металла
ISIS, Англия
(1.3 ×1015 н/см2сек)
SINQ, Швейцария
( 2×1014 н/см2сек)
Мигающие (с тратой энергии)
Активная зона с подвижным отражателем
ИБР-2, Россия
2×1016 н/см2сек
Обогащенный уран
U-235
HFR (60 MW)
Гренобль,Франция
2×1015 н/см2сек
Обогащенный уран
U-235
PIK (100 MW)
Гатчина, Россия
5×1015 н/см2сек
Слайд 8Трехмерная структура молекулы лизоцима и 157 молекул связанной с ним воды
696 атомов водорода и 264 атомов дейтерия показаны небольшими сиреневыми и зелеными сферами, соответственно.
Атомы кислорода и углерода показаны большими красными и зелеными сферами, соответственно.
Нейтронная белковая кристаллография: лизоцим
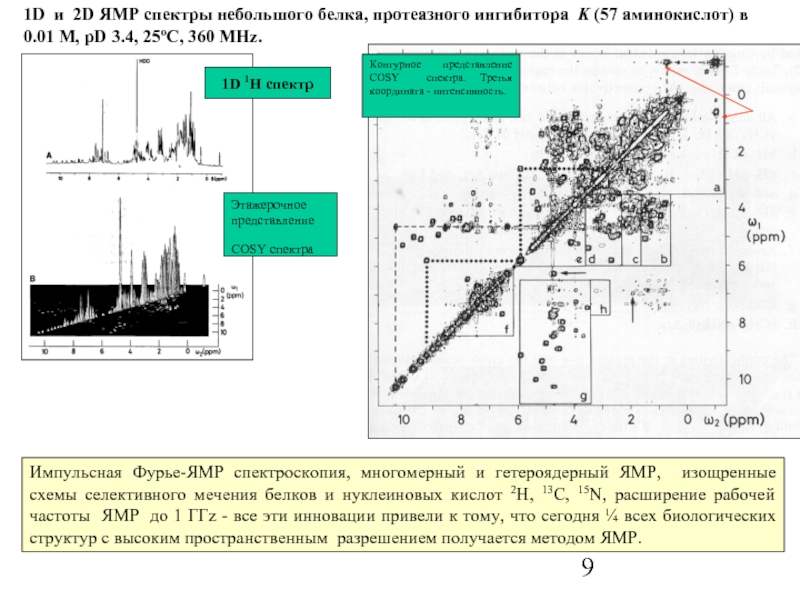
Слайд 9
Импульсная Фурье-ЯМР спектроскопия, многомерный и гетероядерный ЯМР, изощренные схемы селективного мечения
1D и 2D ЯМР спектры небольшого белка, протеазного ингибитора K (57 аминокислот) в 0.01 M, pD 3.4, 25oC, 360 MHz.
1D 1H спектр
Этажерочное представление
COSY спектра
Контурное представление COSY спектра. Третья координата - интенсивность.
Слайд 10 Методы рентгеновской кристаллографии и ЯМР обладают двумя принципиальными недостатками:
1)
2) не позволяют видеть, как функционируют биологические молекулы в реальном режиме времени
3) не позволяют видеть, как функционирует одна биологическая молекула.
Новые физические подходы,
Принципиальный переход от исследования макромолекул в больших объемах (доли миллилитра) к исследованию макромолекул в предельно малых объемах (доли аттолитра).
Уникальная возможность перейти от описания свойств макромолекул в ансамбле к описанию их свойств на одиночном уровне.
«Мы никогда не сможем работать с одиночными электронами, атомами и молекулами» (Эрвин Шредингер, 1952)
Слайд 11
Исследование структуры и функционирования одиночных биологических макромолекул
Детектирование одиночных флюоресцентно меченых молекул с помощью лазерной флюоресценции в предельно малых объемах (аттолитры)
Конфокальная микроскопия
Микроскопия ближнего поля
Визуализация одиночных макромолекул
Микроскопия силового поля
Манипулирование одиночными биологическими макромолекулами (растягивание модулярных белков и РНК, скручивание, растягивание, расcтегивание, разгрызание одиночных двойных спиралей ДНК, сборка и разборка нуклеосом
Микроскопия силового поля
Оптические и магнитные ловушки
Визуализация и описание работы линейных и роторных биологических моторов в терминах сил (пиконьютоны) и расстояний (нанометры), сопровождающих каждую фазу их рабочего цикла
1 attoliter= 10-18 L, 1 piconewton = 10-12 N, 1 nanometer = 10-9 m
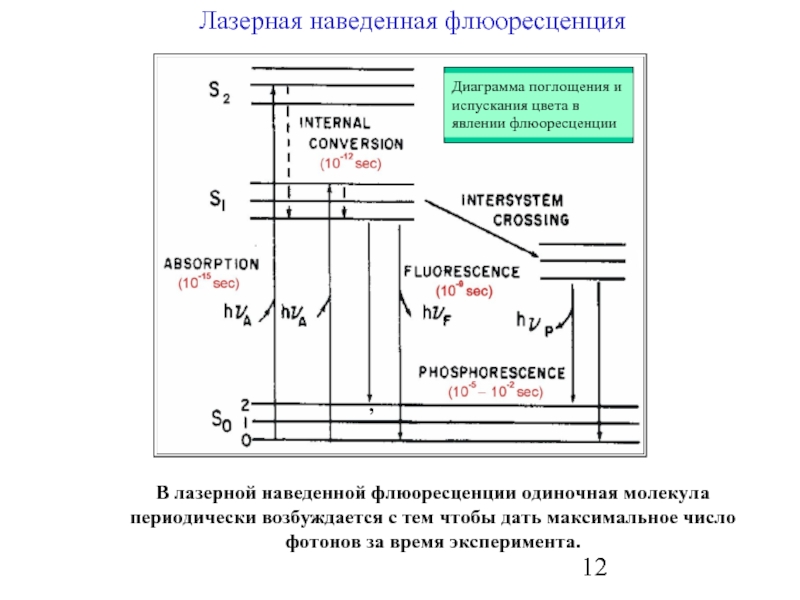
Слайд 12
Лазерная наведенная флюоресценция
,
В лазерной наведенной флюоресценции одиночная молекула периодически возбуждается с
Диаграмма поглощения и испускания цвета в явлении флюоресценции
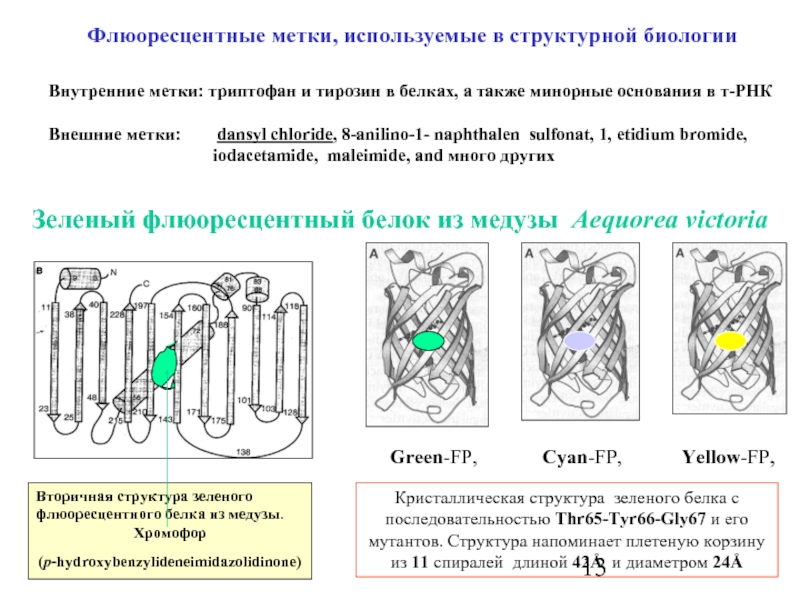
Слайд 13Флюоресцентные метки, используемые в структурной биологии
Внутренние метки: триптофан и тирозин в
Внешние метки: dansyl chloride, 8-anilino-1- naphthalen sulfonat, 1, etidium bromide,
iodacetamide, maleimide, and много других
Зеленый флюоресцентный белок из медузы Aequorea victoria
Вторичная структура зеленого флюоресцентного белка из медузы.
Хромофор
(p-hydroxybenzylideneimidazolidinone)
Green-FP, Cyan-FP, Yellow-FP,
Кристаллическая структура зеленого белка с последовательностью Thr65-Tyr66-Gly67 и его мутантов. Структура напоминает плетеную корзину из 11 спиралей длиной 42Å и диаметром 24Å
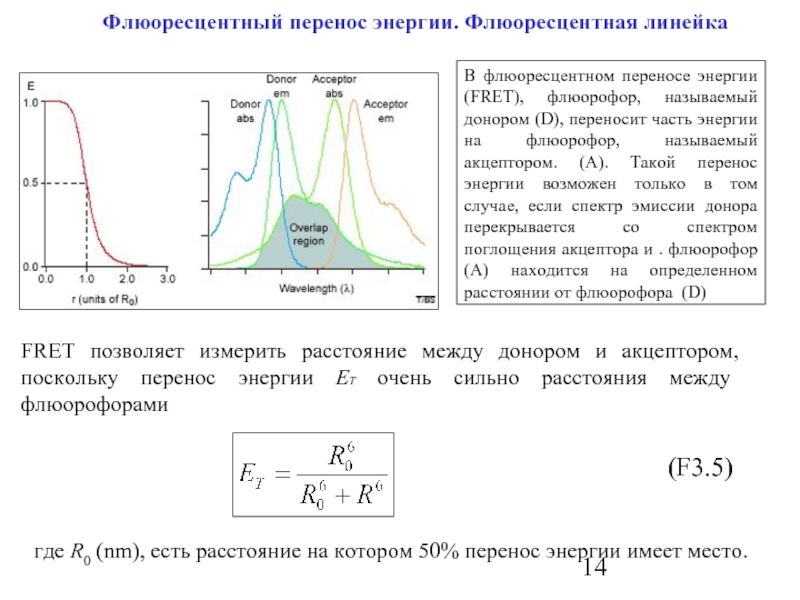
Слайд 14 Флюоресцентный перенос энергии. Флюоресцентная линейка
В флюоресцентном переносе
FRET позволяет измерить расстояние между донором и акцептором, поскольку перенос энергии EТ очень сильно расстояния между флюорофорами
где R0 (nm), есть расстояние на котором 50% перенос энергии имеет место.
(F3.5)
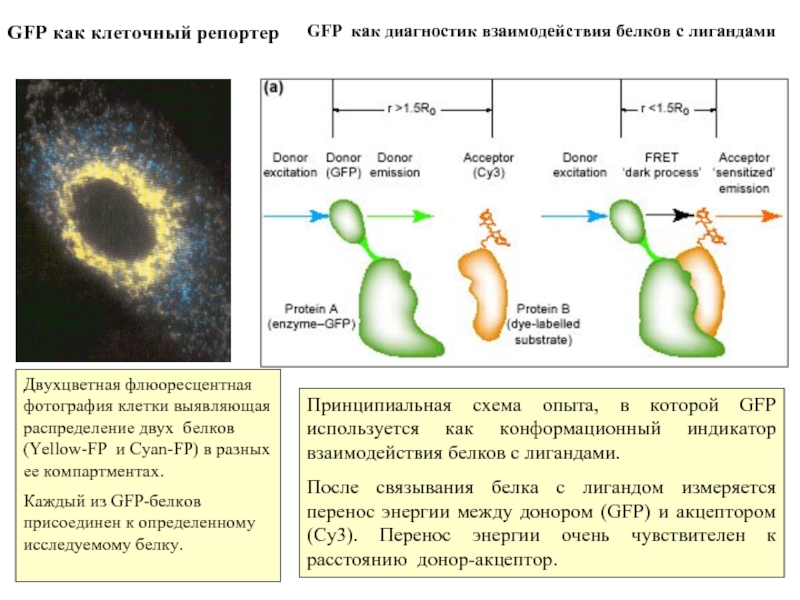
Слайд 15GFP как клеточный репортер
Двухцветная флюоресцентная фотография клетки выявляющая распределение двух
Каждый из GFP-белков присоединен к определенному исследуемому белку.
GFP как диагностик взаимодействия белков с лигандами
Принципиальная схема опыта, в которой GFP используется как конформационный индикатор взаимодействия белков с лигандами.
После связывания белка с лигандом измеряется перенос энергии между донором (GFP) и акцептором (Cy3). Перенос энергии очень чувствителен к расстоянию донор-акцептор.
Слайд 16Визуализация одиночных молекул требует радикального изменения наблюдаемого обьема вплоть до нескольких
Двухфотонное возбуждение в лазерной наведенной флюоресценции
Микроскопия ближнего поля
Флюоресцентная микроскопия в режиме полного внутреннего отражения
Конфокальная микроскопия
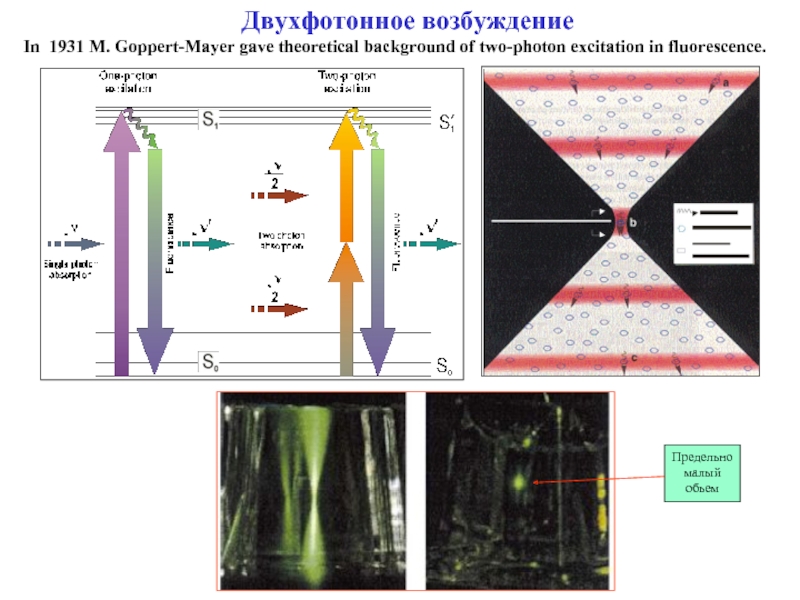
Слайд 17Двухфотонное возбуждение
In 1931 M. Goppert-Mayer gave theoretical background of two-photon excitation
Предельно малый обьем
Слайд 18Микроскопия ближнего поля
Near-field scanning optical microscopy (NSOM).
“Безлинзовая микроскопия”
Техника изображения
Одиночные молекулы
сульфородамина на стеклянной поверхности.
Диаметр 700 Å
Оптическое волокно
Одиночная молекула
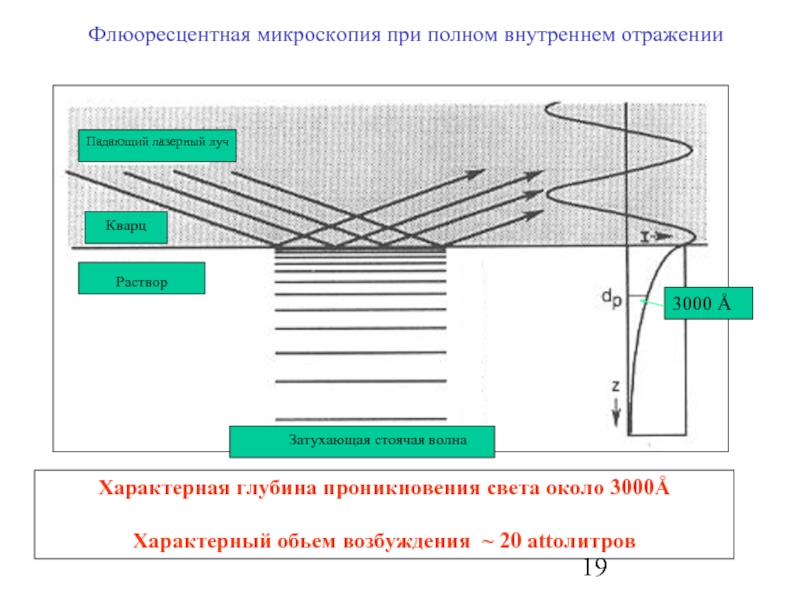
Слайд 19Флюоресцентная микроскопия при полном внутреннем отражении
Характерная глубина проникновения света около 3000Å
Характерный
3000 Å
Падающий лазерный луч
Кварц
Раствор
Затухающая стоячая волна
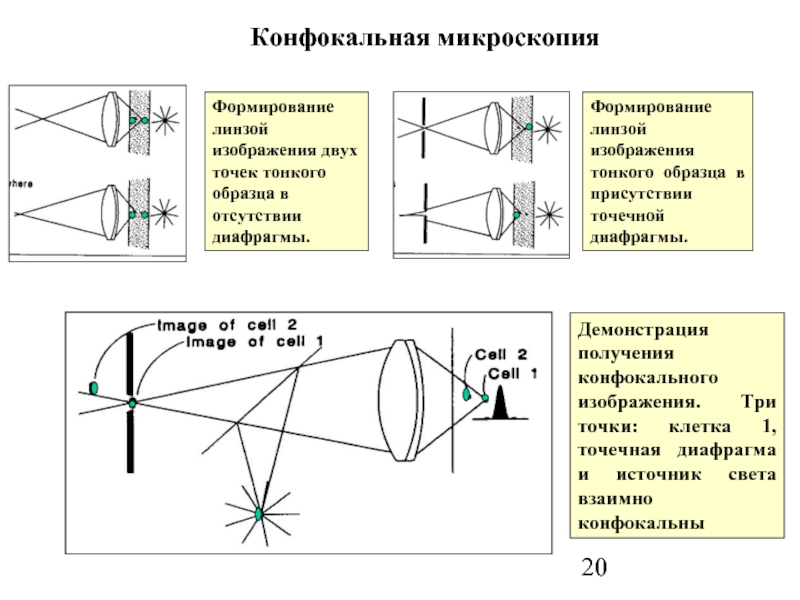
Слайд 20Конфокальная микроскопия
Формирование линзой изображения двух точек тонкого образца в отсутствии
Демонстрация получения конфокального изображения. Три точки: клетка 1, точечная диафрагма и источник света взаимно конфокальны
Формирование линзой изображения тонкого образца в присутствии точечной диафрагмы.
Слайд 23Сканирующая туннельная микроскопия
(G. Binning and H. Rohrer, 1980)
Iodine atoms on
A Liquid crystal (8CB) on graphite. Benzene rings are revealed.
Strands Z-DNA laying on graphite
Вакансия
Бензольное кольцо
ДНК?
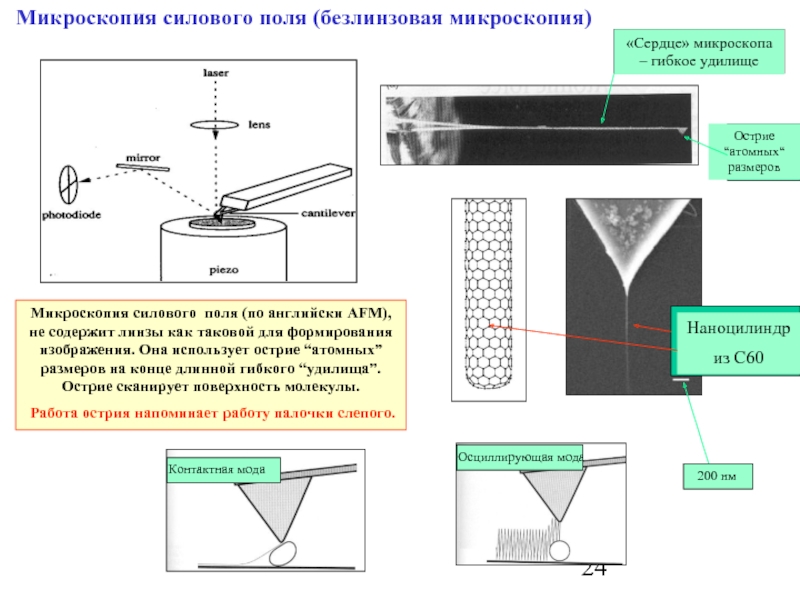
Слайд 24Микроскопия силового поля (безлинзовая микроскопия)
Микроскопия силового поля (по английски AFM), не
Работа острия напоминает работу палочки слепого.
Наноцилиндр
из C60
«Сердце» микроскопа – гибкое удилище
Острие “атомных“ размеров
Контактная мода
Осциллирующая мода
200 нм
Слайд 25Изображение биологических макромолекул методом AFM
Слева: изображение иммуноглобулина G методом AFM. Справа:
Три последовательных изображения ( 0, 12 и 24 минуты) показывают разрезание ДНК рестрикционной нуклеазой Bal 31.
Слайд 26Изображение биологических структур методом AFM
ДНК
Фальш
Кольцевая ДНК в B-форме. Диаметр
Слайд 27Наблюдение за ростом двумерных кристаллов методом AFM
Рост кристаллов белка аннексина V
Прямая визуализация дефектов в кристаллах аннексина
19 мин.
23 мин
26 мин
29 мин
31 мин
34 мин
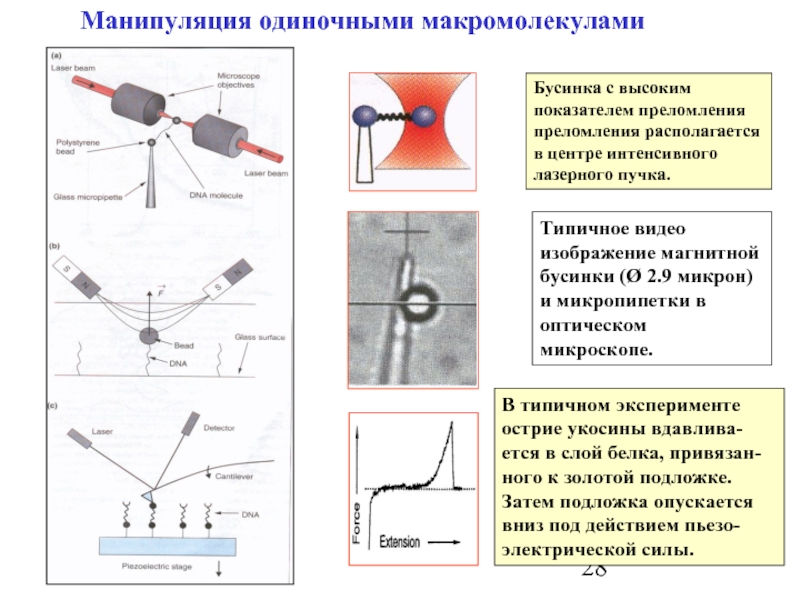
Слайд 28Манипуляция одиночными макромолекулами
Бусинка с высоким показателем преломления преломления располагается в центре
Типичное видео изображение магнитной бусинки (Ø 2.9 микрон) и микропипетки в оптическом микроскопе.
В типичном эксперименте острие укосины вдавлива-ется в слой белка, привязан- ного к золотой подложке. Затем подложка опускается вниз под действием пьезо-электрической силы.
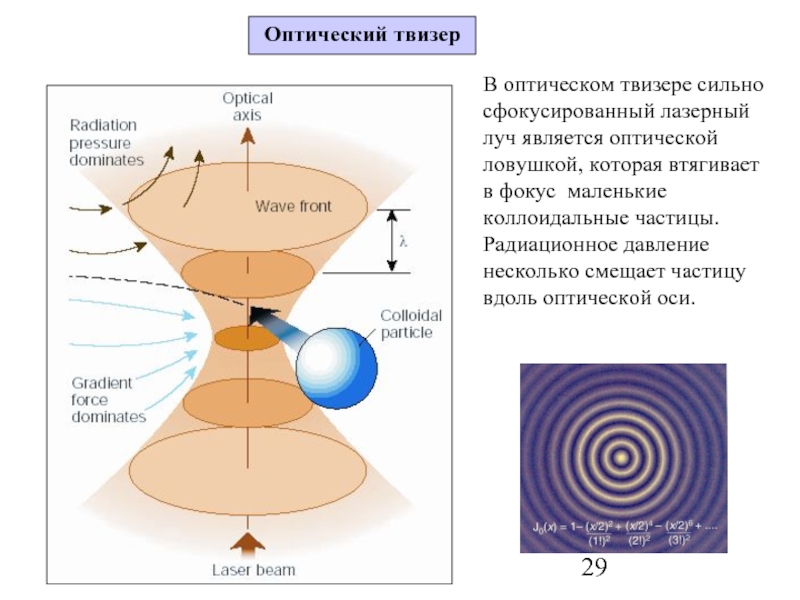
Слайд 29В оптическом твизере сильно сфокусированный лазерный луч является оптической ловушкой, которая
Оптический твизер
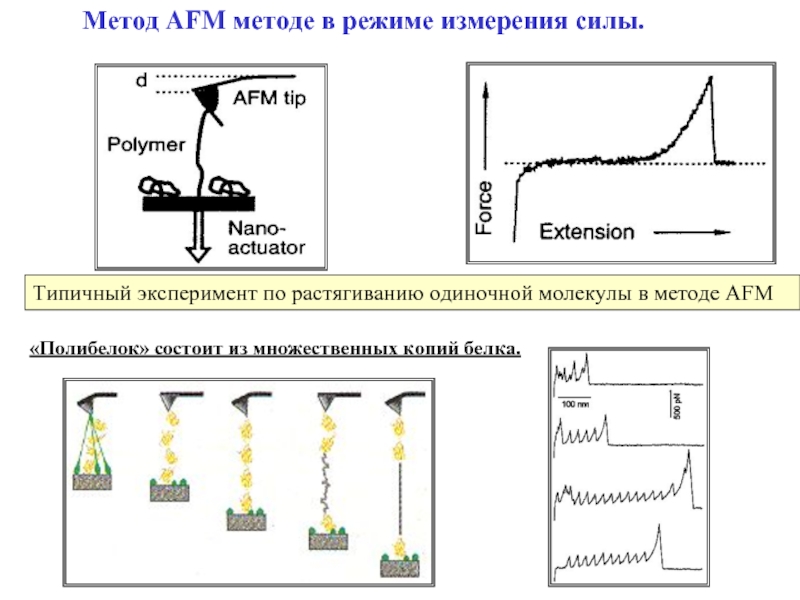
Слайд 30Метод AFM методе в режиме измерения силы.
Типичный эксперимент по растягиванию
«Полибелок» состоит из множественных копий белка.
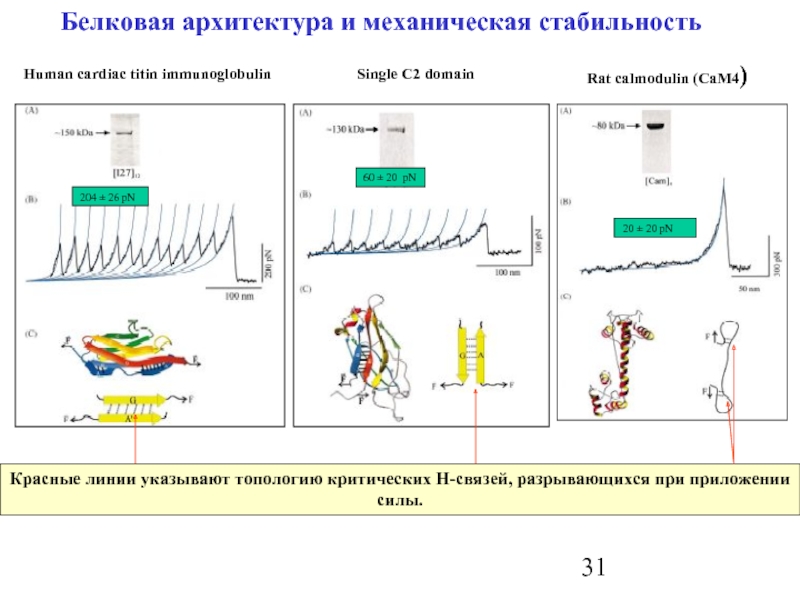
Слайд 31Белковая архитектура и механическая стабильность
Красные линии указывают топологию критических H-связей, разрывающихся
Human cardiac titin immunoglobulin
204 ± 26 pN
60 ± 20 pN
Single C2 domain
Rat calmodulin (CaM4)
20 ± 20 pN
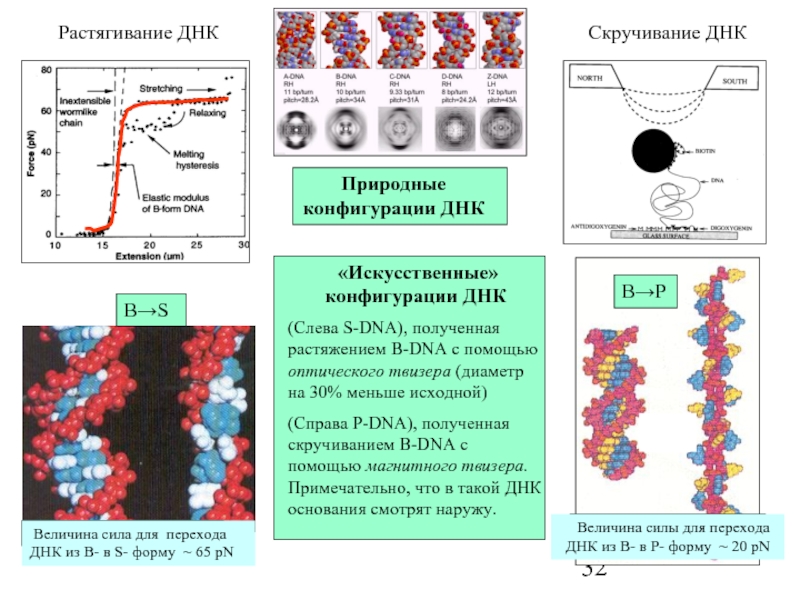
Слайд 32
Природные конфигурации ДНК
«Искусственные» конфигурации ДНК
(Cлева S-DNA), полученная растяжением B-DNA
(Cправа P-DNA), полученная скручиванием B-DNA с помощью магнитного твизера. Примечательно, что в такой ДНК основания смотрят наружу.
B→S
Растягивание ДНК
Скручивание ДНК
B→P
Величина силы для перехода ДНК из В- в P- форму ~ 20 pN
Величина сила для перехода ДНК из B- в S- форму ~ 65 pN
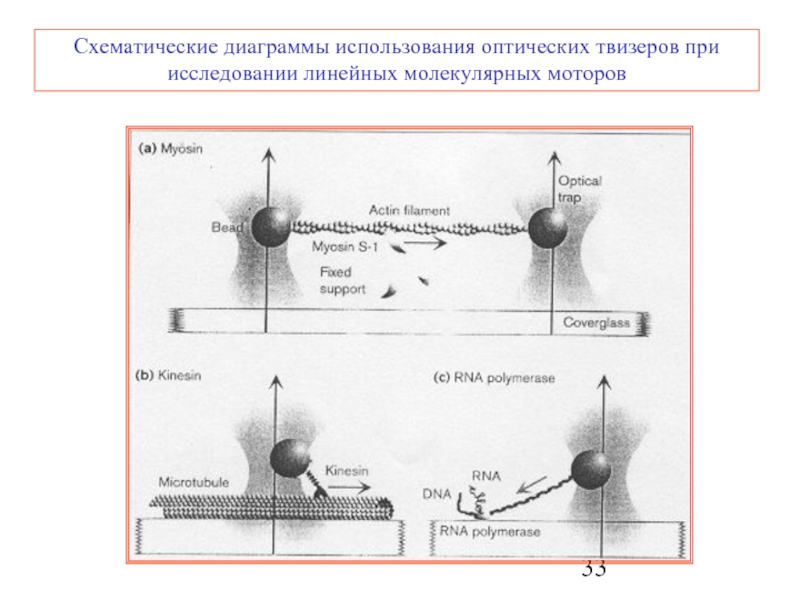
Слайд 33Схематические диаграммы использования оптических твизеров при исследовании линейных молекулярных моторов
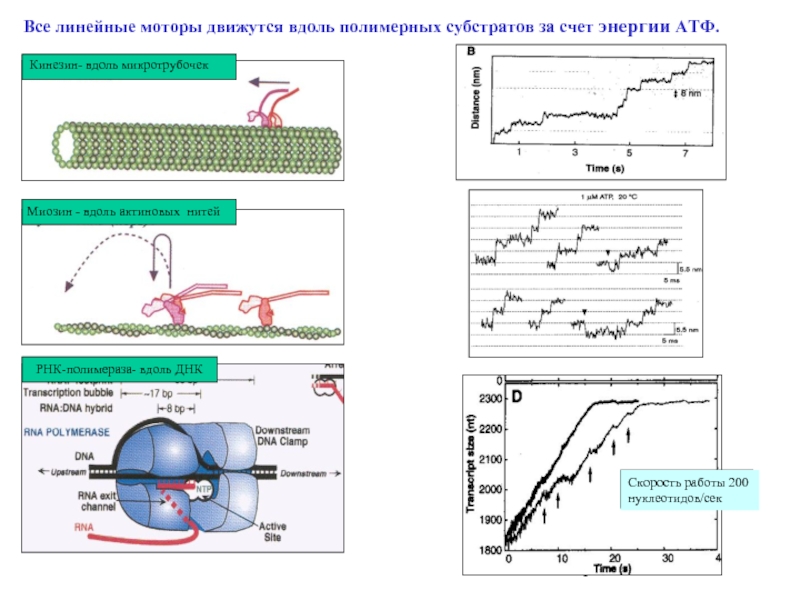
Слайд 34
РНК-полимераза- вдоль ДНК
Кинезин- вдоль микротрубочек
Миозин - вдоль актиновых нитей
Все линейные
Скорость работы 200 нуклeотидов/сек
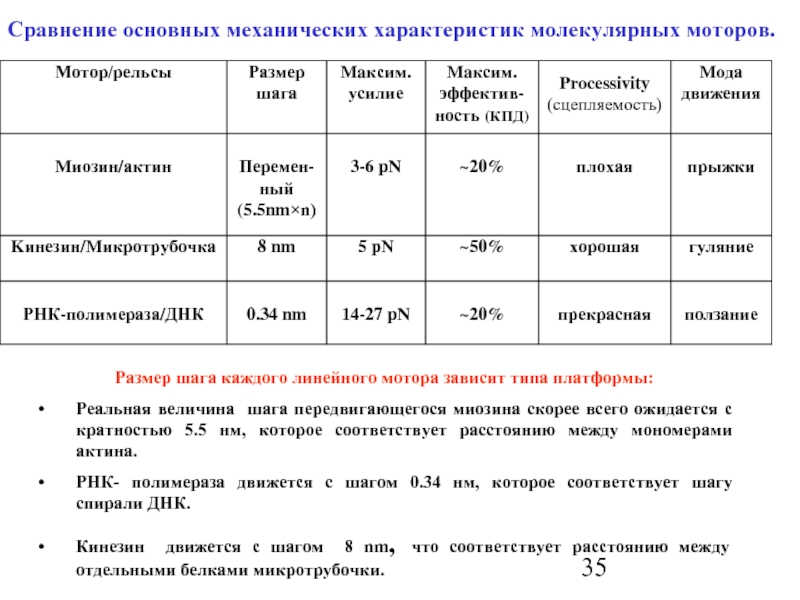
Слайд 35
Сравнение основных механических характеристик молекулярных моторов.
Размер шага каждого линейного мотора зависит
Реальная величина шага передвигающегося миозина скорее всего ожидается с кратностью 5.5 нм, которое соответствует расстоянию между мономерами актина.
РНК- полимераза движется с шагом 0.34 нм, которое соответствует шагу спирали ДНК.
Кинезин движется с шагом 8 nm, что соответствует расстоянию между отдельными белками микротрубочки.
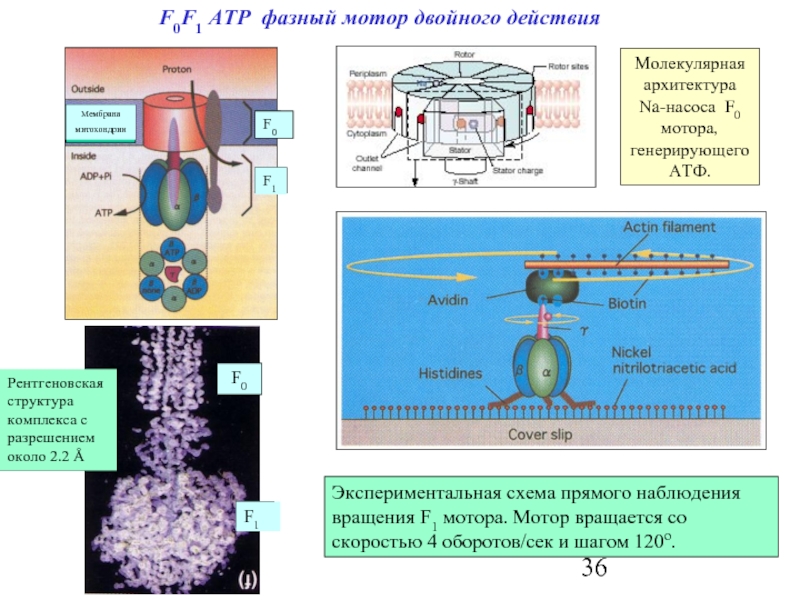
Слайд 36F0F1 ATP фазный мотор двойного действия
Молекулярная архитектура Na-насоса F0 мотора, генерирующего
Экспериментальная схема прямого наблюдения вращения F1 мотора. Мотор вращается со скоростью 4 оборотов/сек и шагом 120о.
Рентгеновскаяструктура комплекса с разрешением около 2.2 Å
Мембрана
митохондрии
F0
F1
F0
F1
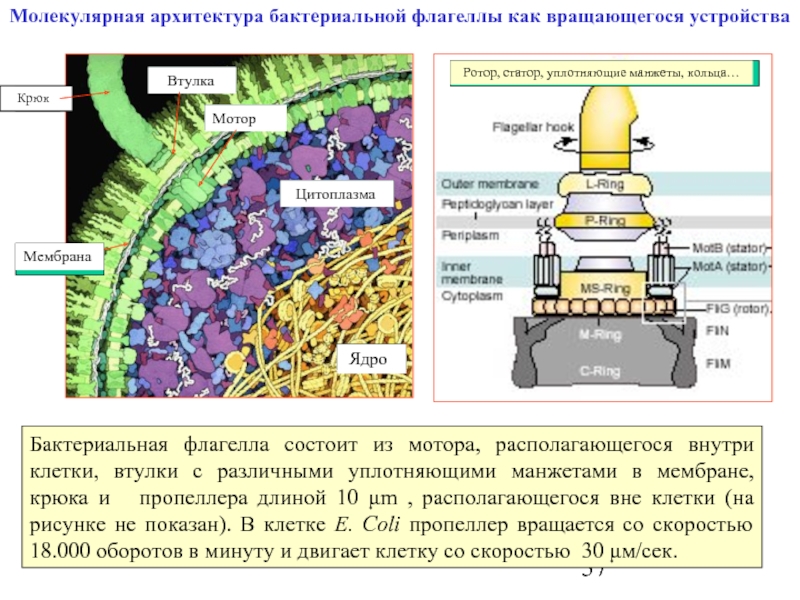
Слайд 37Молекулярная архитектура бактериальной флагеллы как вращающегося устройства
Бактериальная флагелла состоит из мотора,
Мотор
Крюк
Втулка
Мембрана
Ядро
Цитоплазма
Ротор, статор, уплотняющие манжеты, кольца…
Слайд 38
I. Serdyuk N. Zaccai J. Zaccai
“Physical methods in structural biology”
Introduction. From thermodynamic to single molecule detection
Section A. Biological macromolecules and Physical Tools
Section B. Mass and charge
Section D. Hydrodynamics
Section C. Thermodynamics
Section E. Optical Spectroscopy
Section F. Optical Microscopy
Section G. X-ray and Neutron Diffraction
Section H. Energy and Time
Section J. Atomic resolution imaging
Section K. Nuclear magnetic resonance
Conclusion. Back to beginning…
Слайд 39Курс лекций
проф. И.Н. Сердюк
“Физические методы в структурной биологии”
Введение. От термодинамики к
Лекция 1. Макромолекулы как гидродинамические частицы
Лекция 2. Диффузия, ультрацентрифугирование, электрофорез
Лекция 3. Ориентация макромолекул в электрическом и гидродинамическом поле, вязкость,
Лекция 4. Динамическое рассеяние света, флюоресцентная корреляционная спектроскопия,
световая микроскопия
Лекция 5. Флюоресцентная микроскопия, атомная силовая микроскопия, исследования на
одиночных молекулах
Лекция 6. Масс спектрометрия и термодинамика
Лекция 7. Абсорбционная и инфракрасная спектроскопия, Рамановское рассеяние, оптическая
активность
Лекция 8. Ядерный магнитный резонанс
Лекция 9. Макромолекулы как рассеивающие частицы. Рентгеноструктурный и нейтроноструктурный
анализ
Лекция 10. Малоугловое рассеяние, электронная микроскопия, двумерная инфракрасная
спектроскопия
Московский и Пущинский Государственные Университеты
Центр подготовки специалистов при ИБ РАН. www.mbec.protres.ru
Слайд 40Оптическое детектирование одиночных молекул в твердой фазе
Исследуемые молекулы (pentacene) внедрены в
Изображения флюоресцентно меченых липидов на поверхности мембраны:
А. Три разные концентрации липидов
Б. Девять последовательных изображений поверхности снятые через определенные промежутки времени (35 микросек) при самой низкой концентрации липидов. Вычисленный коэффициент диффузии Dlat= 1.42 10-8 cm2/sec
(Schmidt, et al, 1996)
А
Б