Учитель химии Коблякова Н.В.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок обобщения : Химические реакции.(Химическое путешествие , 8 класс.) презентация
Содержание
- 1. Урок обобщения : Химические реакции.(Химическое путешествие , 8 класс.)
- 2. Цель урока: повторить классификацию веществ, типы химических
- 3. 1 этап. Собери рюкзак 1.Какие бывают
- 4. СТРАНА ХИМИЧЕСКИХ РЕАКЦИЙ 7этап
- 5. 2 этап. Химическая железная дорога.
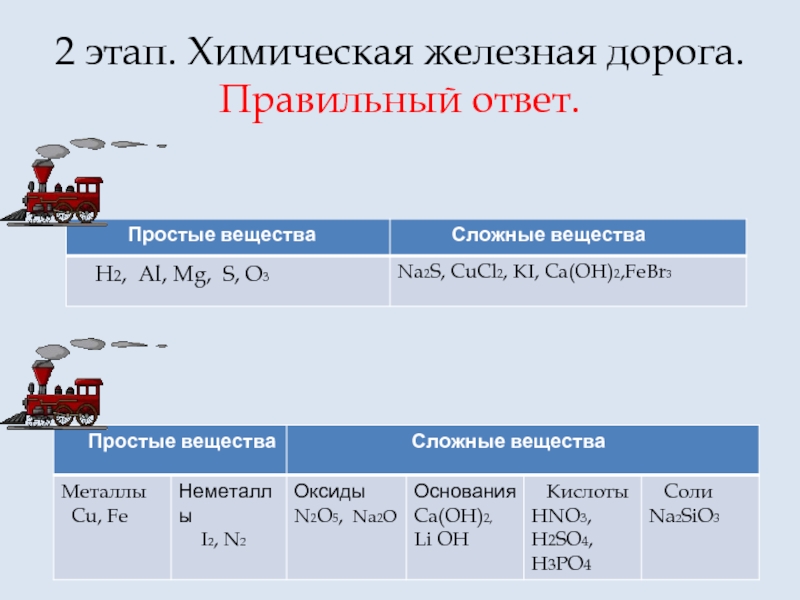
- 6. 2 этап. Химическая железная дорога. Правильный ответ. H2, Al, Mg, S, O3
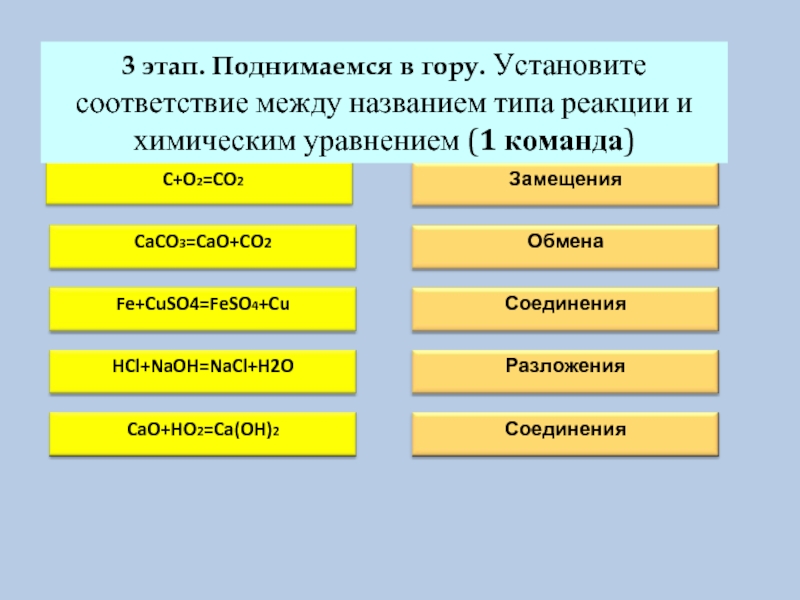
- 7. 3 этап. Поднимаемся в гору.
- 8. У 3 этап. Поднимаемся в гору. Установите
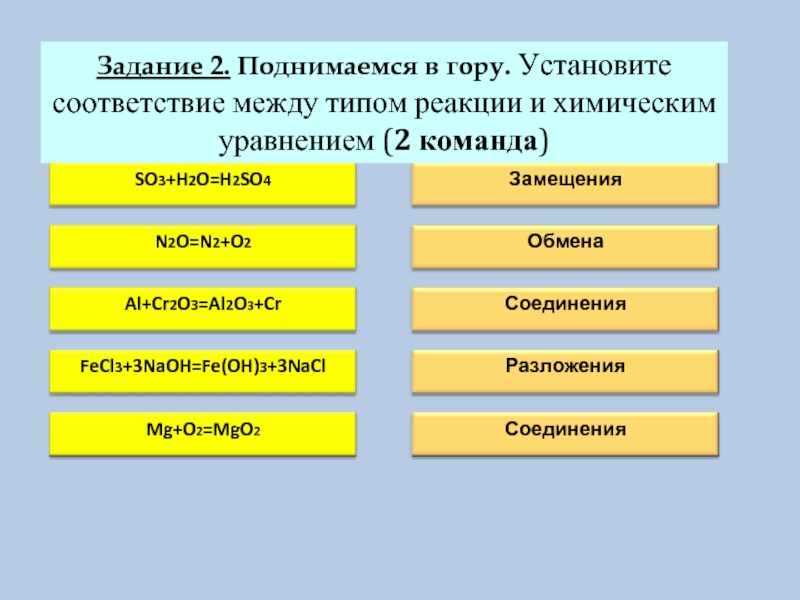
- 9. У Задание 2. Поднимаемся в гору. Установите
- 10. 4Этап «Наскальные рисунки».
- 11. 4 Этап «Наскальные рисунки». Правильный ответ. 1.Реакциясоединения,экзотермическая.
- 12. 5 этап .Река уравнений реакций. Составьте уравнения
- 13. 5 этап .Река уравнений реакций. Правильный ответ.
- 14. 6 этап. Привал.
- 15. 6 этап. Привал. Лабораторная работа «Признаки
- 16. 6 этап. Привал. Лабораторная работа «Признаки
- 17. 7 этап .Водопад реакций. 1) P+O2->…. 2)Al+…->AlCl3+H2 3)… +Cl2->AlCl3 4)Fe+…->FeCl3 5) H2+O2->…. 6)Na+…->NaOH+H2
- 18. 7 этап .Водопад реакций. Правильный ответ 1) 4P+5O2->2P2O5 2)2Al+6HCl->2AlCl3+3H2 3)2Al +3Cl2->2AlCl3 4)2Fe+3Cl2->2FeCl3 5) 2H2+O2->2H2O 6)2Na+2H2O->2NaOH+H2
- 19. 8 этап.«Путь домой». Вариант 1 1.Реакции, протекающие
- 20. 8 этап.«Путь домой». Правильный ответ. 1- а 2-б 3-в 4-б 5-а
- 21. Задание на дом Повторить п.29-31,№1стр.155,№1,№2стр.159.
Слайд 1Урок обобщения : «Химические реакции». (Химическое путешествие , 8
Слайд 2Цель урока: повторить классификацию веществ, типы химических реакций и признаки их
Задачи.
Образовательные: систематизировать знания обучающихся о классификации веществ, типах химических реакций, продолжить формирование умений наблюдать, записывать уравнения и предвидеть продукты химических реакций, продолжить формирование умения при написании реакций обмена, применения условий течения реакций между растворами до конца.
Развивающие: совершенствовать умения школьников при составлении химических уравнений, при выполнении лабораторных опытов; совершенствовать умения обучающихся сравнивать и обобщать; развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека; развивать аналитическое мышление.
Воспитательные: продолжить формирование диалектико-материалистического мышления обучающихся.
Слайд 31 этап. Собери рюкзак
1.Какие бывают явления?
2.Дайте определение физическим явлениям.
3.Дайте определение
4.Перечислите признаки химических реакций
5.По каким признакам классифицируют химические реакции?
6.Дайте определение экзотермическим реакциям .
7.Дайте определение эндотермическим реакциям .
8.Дайте определение реакциям соединения .
9.Дайте определение реакциям разложения.
10.Дайте определение реакциям замещения.
11.Дайте определение реакциям обмена.
12.На основании какого закона мы расставляем коэффициенты в уравнениях химических реакций ?Кто открыл этот закон?
Слайд 4 СТРАНА ХИМИЧЕСКИХ РЕАКЦИЙ
7этап . «Водопад реакций».
2 Этап. «Химическая
3 Этап. «Поднимаемся в гору».
1 Этап. «Собери рюкзак»
4.Этап. «Наскальные рисунки»
5.Этап. «Река уравнений»
6.Этап «Привал»
8.Этап. «Путь домой»
Слайд 52 этап. Химическая железная дорога.
Запишите формулы веществ в
H2,Na2S,Al,CuCl2,Mg,KI,S,Ca(OH)2,O3,FeBr3.:
Запишите формулы веществ в соответствующие
столбцы таблицы 2.
N2O5,I2,HNO3,Ca(OH)2,Na2O,H2SO4,Fe,H3PO4,N2,
Na2SiO3,LiOH,Cu.
Слайд 8У
3 этап. Поднимаемся в гору. Установите соответствие между названием типа реакции
Слайд 9У
Задание 2. Поднимаемся в гору. Установите соответствие между типом реакции и
Слайд 114 Этап «Наскальные рисунки».
Правильный ответ.
1.Реакциясоединения,экзотермическая.
2.Реакция разложения, эндотермическая.
3.Реакция замещения.
4.Реакция обмена.
Слайд 125 этап .Река уравнений реакций.
Составьте уравнения реакций и назовите продукты реакций
1)
2) NaOH+CuCl2 ->
3) SO3+H2O->
4) FeCl2+NaOH->
5) HCl+Na->
6) CuSO4+KOH->
7) C+O2->
8) BaCl2+K2SO4->
9) NaOH+HCl->
10) S+O2->
Слайд 135 этап .Река уравнений реакций.
Правильный ответ.
1) CuO+2HCl ->CuCl2+H2O
2) 2NaOH+CuCl2->Cu(OH)2+2NaCl
3) SO3+H2O->H2SO4
4) FeCl2+2NaOH->2NaCl
5) 2HCl+2Na->2NaCl+H2
6) CuSO4+2KOH->Cu(OH)2+K2SO4
7) C+O2->CO2
8) BaCl2+K2SO4->BaSO4+2KCl
9) 2NaOH+2HCl->2NaOH+H2O
10) S+O2->SO2
Слайд 156 этап. Привал.
Лабораторная работа
«Признаки химических реакций»
РАССМОТРИМ ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ.
1) Лабораторный
Na2SO4+BaCl2->…..
Наблюдаем………
2) Лабораторный опыт №2 «Выделение газа»
Na2CO3+HCl->……..
Наблюдаем……….
3)Лабораторный опыт №3 «Изменение цвета»
NaOH+ фенфталеин + HCl ->
Наблюдаем…..
4)Лабораторный опыт №4 «Выделение запаха»
NH4Cl+Ca(OH)2->
Наблюдаем…..
Слайд 166 этап. Привал.
Лабораторная работа
«Признаки химических реакций»
Правильный ответ
1) Лабораторный опыт №1
Na2SO4+BaCl2->BaSO4+2NaCl
Наблюдаем выпадение осадка белого цвета.
2) Лабораторный опыт №2 «Выделение газа»
Na2CO3+2HCl->2NaCl+CO2+H2O
Наблюдаем выделение углекислого газа.
3)Лабораторный опыт №3 «Изменение цвета»
2NaOH+ фенолфталеин + 2HCl ->NaCl+H2O
Наблюдаем изменение окраски фенолфталеина.
4)Лабораторный опыт №4 «Выделение запаха»
NH4Cl+Ca(OH)2-> CaCl2+2NH3+2H2O
Наблюдаем запах аммиака.
Слайд 177 этап .Водопад реакций.
1) P+O2->….
2)Al+…->AlCl3+H2
3)… +Cl2->AlCl3
4)Fe+…->FeCl3
5) H2+O2->….
6)Na+…->NaOH+H2
Слайд 187 этап .Водопад реакций.
Правильный ответ
1) 4P+5O2->2P2O5
2)2Al+6HCl->2AlCl3+3H2
3)2Al +3Cl2->2AlCl3
4)2Fe+3Cl2->2FeCl3
5) 2H2+O2->2H2O
6)2Na+2H2O->2NaOH+H2
Слайд 198 этап.«Путь домой».
Вариант 1
1.Реакции, протекающие с поглощением теплоты, называются:
а) эндотермическими;
б) термическими;
в) экзотермическими.
2.Из нескольких простых
более сложное вещество в реакции:
а) замещения;
б) соединения;
в) разложения.
3.Уравнение реакции обмена:
а) СаО + SiC2 = CaSiO3;
б) 2КС103 = 2КС1 + 302;
в) FeS + 2НС1 = FeCl2 + H2S.
4.Сумма всех коэффициентов в уравнении реакции, схема которой
А1 + С12 —► A1C13, равна:
а) 4;
б) 7;
в) 5.
5.Схема химической реакции, в которой правильно расставлены коэффициенты:
а) Н2 + С12->2НС1;
б) Са + 02-> 2СаО;
в) Zn + НС1-> ZnCl2 + Н2.