- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема урока : Кислоты(химическое путешествие) 8 класс. презентация
Содержание
- 1. Тема урока : Кислоты(химическое путешествие) 8 класс.
- 2. Цели урока :познакомить учащихся с составом,
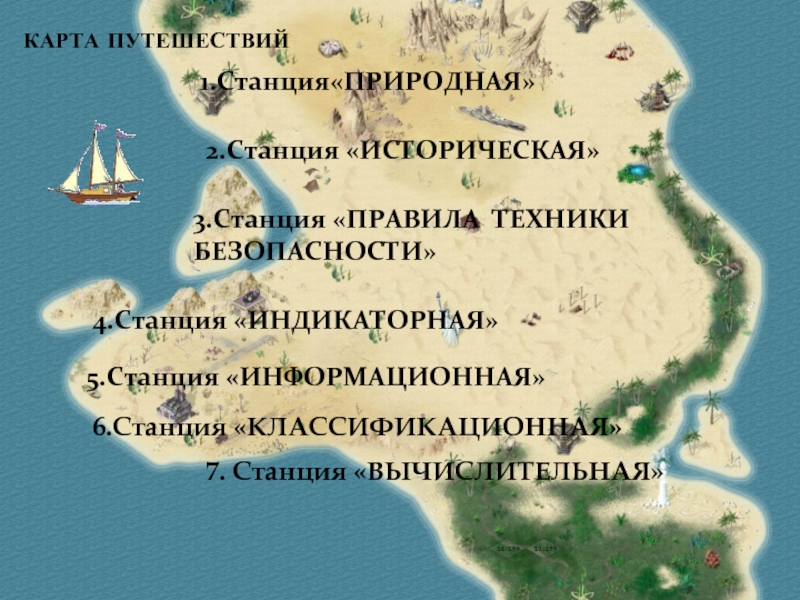
- 3. КАРТА ПУТЕШЕСТВИЙ 1.Станция«ПРИРОДНАЯ» 2.Станция «ИСТОРИЧЕСКАЯ» 3.Станция
- 4. «Возьми с собой в багаж» (1
- 5. «Возьми с собой в багаж» (2
- 6. У Задание 2. «Поднимаемся на палубу корабля»
- 7. У Задание 2. «Поднимаемся на палубу корабля»
- 8. Первая станция- «Природная»
- 9. 1 2 3 4 Установите соответствие :
- 10. Установите соответствие: А)муравьиная кислота Б)аскорбиновая
- 11. Вторая станция- «Историческая»
- 12. Вторая станция - «Историческая» 1.Почему самой
- 13. Третья станция- «Техники безопасности»
- 14. Правила техники безопасности (инструкция) При работе с
- 15. Правила разбавления кислот! Правила техники безопасности:
- 16. Четвёртая станция «Индикаторная» Инструктивная карта Задание
- 17. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ Вывод: независимо
- 18. Пятая станция «ИНФОРМАЦИОННАЯ». Кислоты –
- 19. Пятая станция «ИНФОРМАЦИОННАЯ». Кислоты –
- 20. Шестая станция «КЛАССИФИКАЦИОННАЯ» Кислоты ? HCl ?
- 21. Шестая станция «КЛАССИФИКАЦИОННАЯ» Кислоты Одноосновные HCl HBr
- 22. По содержанию кислорода. ?
- 23. По содержанию кислорода. Бескислородные
- 24. Седьмая станция «ВЫЧИСЛИТЕЛЬНАЯ» Задание1. А)
- 25. «Путь домой» . (выполни задания теста) Тест
- 26. «Путь домой» .
- 27. Домашнее задание Изучить П.20 Выучить определения Выполнить №5,8 в рабочей тетради с.67 Упр.4с.107 учебника
Слайд 1Тема урока : «Кислоты»
(химическое путешествие)
8 класс.
Подготовила:
учитель химии
Коблякова Н.В.
Слайд 2 Цели урока :познакомить учащихся с составом, названиями, классификацией и представителями класса
Задачи урока:
Образовательная:
сформировать знания учащихся о кислотах, их составе, способах классификаций и названий представителей класса кислот;
Развивающая:
совершенствовать умения экспериментировать, наблюдать, анализировать, делать выводы, умения слушать и слышать другого человека
Воспитательные:
продолжить формирование диалектико-материалистического мировоззрения учащихся об окружающих их веществах, формирование интереса к предмету.
обратить внимание учащихся на правила работы с кислотами.
Слайд 3КАРТА ПУТЕШЕСТВИЙ
1.Станция«ПРИРОДНАЯ»
2.Станция «ИСТОРИЧЕСКАЯ»
3.Станция «ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ»
5.Станция «ИНФОРМАЦИОННАЯ»
4.Станция «ИНДИКАТОРНАЯ»
6.Станция «КЛАССИФИКАЦИОННАЯ»
7. Станция
Слайд 4«Возьми с собой в багаж»
(1 команда)
Задание 1.Выпишите формулы оксидов из
Задание 2.Выпишите формулы оснований из списка: Mg(OH)2, NaOH,Na2CO3, P2O5, NO,NH3, Al(OH)3
Знания
Слайд 5«Возьми с собой в багаж»
(2 команда)
Задание 1. Выпишите оксиды
Задание 2. Выпишите основания из списка:Ca(OH)2, NaOH,H2CO3,P2O5,NO,KOH,
Знания
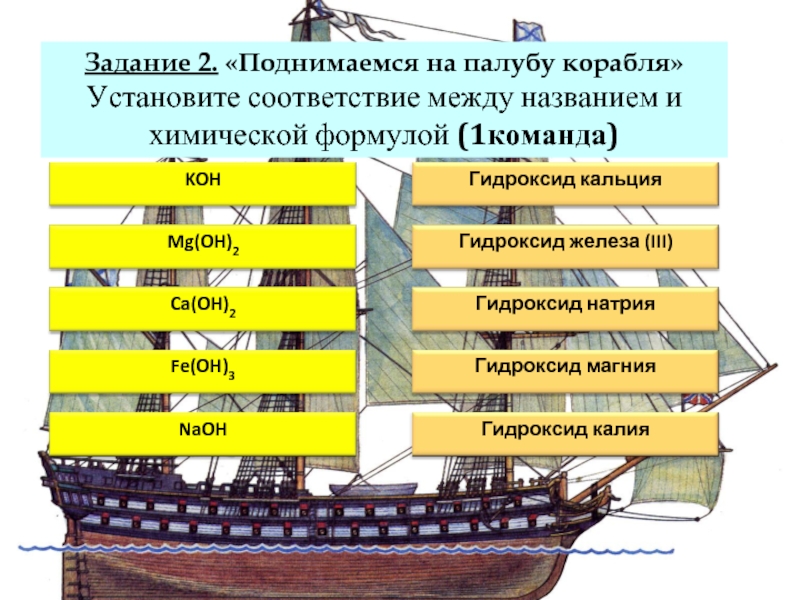
Слайд 6У
Задание 2. «Поднимаемся на палубу корабля» Установите соответствие между названием и
Слайд 7У
Задание 2. «Поднимаемся на палубу корабля» Установите соответствие между названием и
Слайд 91
2
3
4
Установите соответствие :
А) лимонная кислота
Б)щавелевая кислота
В)муравьиная кислота
Г)яблочная кислота
1
4
2
3
Слайд 10Установите соответствие:
А)муравьиная
кислота
Б)аскорбиновая кислота
В)уксусная кислота
Г)лишайниковые кислота
1
2
3
4
3
1
2
4
4
Слайд 12 Вторая станция - «Историческая»
1.Почему самой первой кислотой, которую открыл человек
2.Как раньше называли серную кислоту в России?
1. Какую кислоту называют «матерью» всех кислот?
2.Кем и когда была открыта угольная кислота?
Слайд 14Правила техники безопасности (инструкция)
При работе с кислотами необходимо соблюдать правила техники
1. Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
2. Заполнять пробирку можно только на 1/3 объема.
3. Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
4. При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать концентрированную кислоту с водой следует с большой осторожностью: надо вливать серную кислоту в воду, а не наоборот. Если вливать воду в серную кислоту, то часть воды за счет выделения теплоты может нагреться до кипения. Кислота начнет разбрызгиваться и может попасть на кожу, в глаза.
5.Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором питьевой соды и вновь смыть водой.
Слайд 15Правила разбавления кислот!
Правила техники безопасности:
Внимание!
Работать с кислотами
Слайд 16Четвёртая станция «Индикаторная»
Инструктивная карта
Задание
Исследуйте окраску кислот (азотной и лимонной ).Добавив
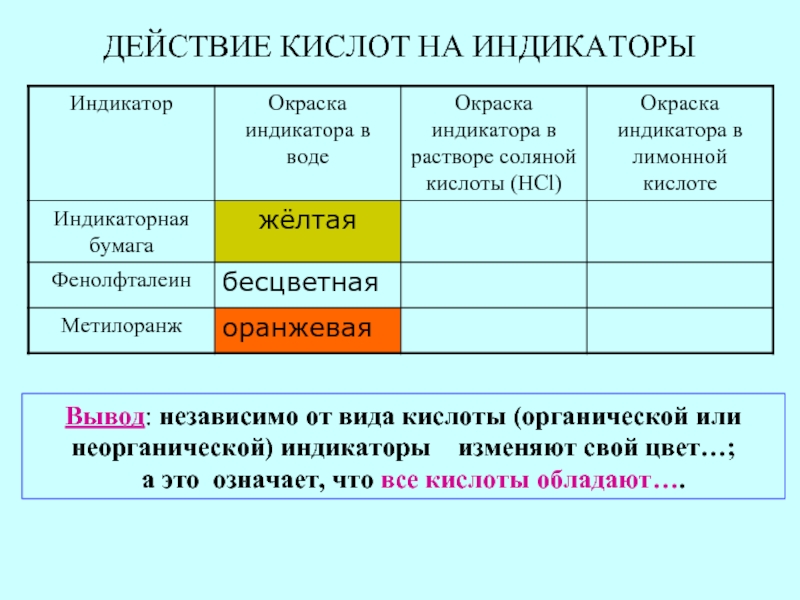
Слайд 17ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Вывод: независимо от вида кислоты (органической или
а это означает, что все кислоты обладают….
Слайд 18Пятая станция «ИНФОРМАЦИОННАЯ».
Кислоты
– это сложные вещества, состоящие из … и
Задание. Прочитайте формулы кислот. Что в них общего?
Запишите их названия :
H2SO3-
H2CO3-
H2SiO4-
HNO3-
HNO2-
H2SO4-
HCl-
H3PO4-
1.Пoставьте степени окисления в соединениях HCl, HNO3, H2SO4.Вычислите заряд кислотного остатка для данных кислот.
2.Поставьте степени окисления в соединениях H3PO4,H2SO4,H2CO3.Вычислите заряд кислотного остатка для данных кислот.
Слайд 19Пятая станция «ИНФОРМАЦИОННАЯ».
Кислоты
– это сложные вещества, состоящие из катиона
Задание. Прочитайте формулы кислот. Что в них общего?
Запишите их названия :
H2SO3- сернистая кислота
H2CO3- угольная кислота
H2SiO4-кремневая кислота
HNO3- азотная кислота
HNO2- азотистая кислота
H2SO4-серная кислота
HCl-соляная кислота
H3PO4-фосфорная кислота
1.
2.
H+Cl-, H+N+5O3-2, H2+S+6O4-2
H3+P+5O4-2, H2+S+6O4-2, H2+C+4O3 -2
Слайд 20Шестая станция «КЛАССИФИКАЦИОННАЯ»
Кислоты
?
HCl
?
?
H2S
H2SO4
Трехосновные
?
По количеству атомов водорода.
Слайд 21Шестая станция «КЛАССИФИКАЦИОННАЯ»
Кислоты
Одноосновные
HCl
HBr
Двухосновные
H2S
H2SO4
Трехосновные
H3PO4
По количеству атомов водорода.
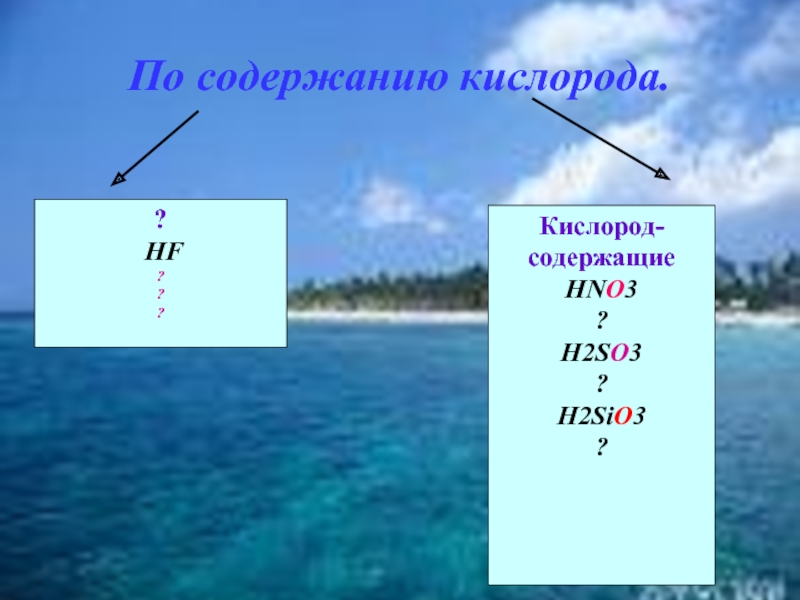
Слайд 23По содержанию кислорода.
Бескислородные
HF
HCl
HBr
HF
Кислород-
содержащие
HNO3
H2SO4
H2SO3
H3PO4
H2SiO3
H2CO3
Слайд 24Седьмая станция «ВЫЧИСЛИТЕЛЬНАЯ»
Задание1.
А) Определите массовые доли элементов в H2CO3.
Задание2.
А)Определите массовые доли элементов в H2SO4
Б)Найдите массу 0,3 моль азотной кислоты.
Слайд 25«Путь домой» .
(выполни задания теста)
Тест 24.1 (1 вариант)
1.Кислородсодержащей кислотой является
1)
2) сероводородная кислота
3) азотная кислота
4) йодоводородная кислота
2.Степень окисления фосфора в кислоте Н3Р04 равна 1)+5 2)+3 3)+2 4)+4
3.Вещество, раствор которого окрашивает лакмус в красный цвет, — это
1) «сухой лед» 2) едкий натр
3) едкое кали 4) «гашеная известь»
Тест 24.2 (2 вариант)
1.Бескислородной кислотой является
1) хлороводородная кислота
2) кремниевая кислота
3) угольная кислота
4) фосфорная кислота
2. Степень окисления кремния в кислоте H2Si03
1)+5 2)+3 3)+2 4)+4
3. Заряд у иона С03 равен
1)0 2)1+ 3)1- 4)2-