- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Принятие решений в здравоохранении и оценка медицинских технологий: Европейский опыт презентация
Содержание
- 1. Принятие решений в здравоохранении и оценка медицинских технологий: Европейский опыт
- 2. Стимулы для внедрения программ оценки медицинских технологий
- 3. «Двигатель» перемен для стран Восточной и Южной
- 4. Решения Европейского Суда в отношении применения
- 5. Расширение Евросоюза и установление органов по оценке
- 6. Модели «легких» и «тяжелых» агентств по оценке
- 7. Успешный опыт небольших организаций Шотландский медицинский консорциум
- 8. Результаты кратких оценок сопоставимы с результатами полноценных
- 9. При согласии относительно «правильной» методологии должно ли
- 10. При согласии относительно «правильной» методологии должно ли
- 11. И все же немного единообразия не помешает…
- 12. Новый вызов для производителей Удовлетворить потребности в
- 13. Новый вызов диктует необходимость адаптации стратегии планирования
- 14. Система оценки медицинских технологий направлена на выявление
- 15. Даже если система оценки медицинских технологий не
- 16. Если посмотреть на критерии в России… ПЖНВЛС
- 17. Исследования «не меньшей эффективности» (non-inferiority или equivalence
- 18. С позиции плательщика более раннее знание о
- 19. Новые технические возможности расширяют спектр методов исследований
- 20. Лучшее понимание необходимости различных подходов в оценке
- 21. Спасибо за внимание!
Слайд 1Принятие решений в здравоохранении и оценка медицинских технологий: Европейский опыт
Борисенко Олег
Старший экономист здравоохранения
Synergus AB
Слайд 2Стимулы для внедрения программ оценки медицинских технологий
Внутренние – оптимизация расходов ограниченного
Внешние - необходимость членства в международных организациях и союзах
Россия является членов множества организаций: APEC, Arctic Council, ARF, ASEAN (dialogue partner), BIS, BSEC, CBSS, CE, CERN (observer), CICA, CIS, CSTO, EAEC, EAPC, EBRD, FAO, FATF, G-20, G-8, GCTU, IAEA, IBRD, ICAO, ICC, ICRM, IDA, IFC, IFRCS, IHO, ILO, IMF, IMO, IMSO, Interpol, IOC, IOM (observer), IPU, ISO, ITSO, ITU, ITUC, LAIA (observer), MIGA, MINURSO, MONUSCO, NSG, OAS (observer), OECD (accession state), OIC (observer), OPCW, OSCE, Paris Club, PCA, PFP, SCO, UN, UN Security Council, UNCTAD, UNESCO, UNHCR, UNIDO, UNITAR, UNMIL, UNMIS, UNOCI, UNTSO, UNWTO, UPU, WCO, WFTU, WHO, WIPO, WMO, WTO (observer), ZC
В настоящее время реальным двигателем перемен является Таможенный Союз, в будущем возможно – Всемирная Торговая Организация
Есть примеры избирательного правоприменения международных норм – например, Россия не ратифицировала 20 статью Конвенции против коррупции ООН (незаконное обогащение)
Слайд 3«Двигатель» перемен для стран Восточной и Южной Европы
Директива Европейского Совета по
от 21 декабря 1988 года
Целью Директивы является обеспечение прозрачности процедур ценообразования и финансирования медицинских продуктов (лекарства, оборудование). Содержит ряд требований к процедурам, которые должны в случае применения должны гарантировать, что правительства стран-членов Евросоюза не создают дополнительных препятствий для торговли лекарствами и медицинским оборудованием
Основные требования:
Решения должны быть приняты в фиксированный срок (90/180 дней)
Требования, предъявляемые к заявкам, должны быть четко озвучены
Решения должны быть доведены до заявителя с обозначением причин решения
Должен быть создан механизм оспаривания решений на национальном уровне
Статья 6, параграф 3: «До … Члены должны опубликовать…критерии, которые должны быть приняты во внимание компетентными органами относительно включение и или не включения медицинских продуктов в листы [финансирования]»
Слайд 4Решения Европейского Суда
в отношении применения Директивы
Дело C-424/99 of 27 November
«Не адаптировав законы и административные процедуры в соответствии со … [обоснования не включения медицинских продуктов в списки финансирования] Республика Австрия нарушила свои обязательства по данной статье»
Дело C-229/00 of 12 June 2003 Комиссия против Финляндии
Отсутствие прозрачных процедур уведомления о причинах в отказе включения в списки лекарственных средств, подлежащих компенсации по высокой ставке
Дело C-245/03 of 20 January 2005 Мерк Шарп и Доум против Бельгии и дело C-296/03 of 20 January 2005 ГлаксоСмитКляйн против Бельгии
Превышение сроков принятия решений
Дело C-317/05 of 26 October 2006 Поль-Боскамп Гмбх против Федерального Объединенного Комитета (G-BA)
Не предоставление информации о дальнейших шагах после принятия решения о не включении препарата в списки для финансирования
Дело C-311/07 of 17 July 2008 Комиссия против Австрии
Не установление сроков принятия решений о включении медицинских продуктов в списки для финансирования
Дело C-352/07 of 2 April 2009 Менарини и другие заявители против Фармацевтического Агентства Италии
Отсутствие механизмов по регулированию ситуации с «замораживанием» цен на медицинские продукты
Слайд 5Расширение Евросоюза и установление органов по оценке медицинских технологий
Нет прямой зависимости
Не
Однако для всех Членов обязательным является следование Директиве по Прозрачности
Слайд 6Модели «легких» и «тяжелых» агентств по оценке медицинских технологий
«Тяжелые» - органы,
Обоснование: Точность и качество оценки, позиция государственной системы здравоохранения
Недостатки: Значительные расходы на проведение оценки, необходимость большого персонала
«Легкие» - органы, оценивающие отчеты, подготовленные индустрией
Обоснование: Экономия средств
Недостатки: Возможно – меньшее качество оценки
Дополнительные преимущества: Развитие рынка систематических обзоров и экономических оценок
Слайд 7Успешный опыт небольших организаций
Шотландский медицинский консорциум
30 человек, за исключением специалистов в
Оценка около 80 препаратов в год в интересах Национальной Службы Здравоохранения, 780 обзоров за 10 лет
Выполнение обзора в течение 6 месяцев
Положительные решения – 34%, положительные решения с ограничениями – 37%
Сопоставимость решений с решениями других организаций:
NICE – 80%
CDR (Канада) – 66%
PBAC (Австралия) – 74%
Слайд 8Результаты кратких оценок сопоставимы с результатами полноценных обзоров
Общие заключения не различаются
Традиционные обзоры чаще описывают клинические исходы, экономические факторы, социальные вопросы, дают большую глубину и детализацию информации;
Важнейшее условие для быстрых обзоров – полная методологическая прозрачность;
Быстрые обзоры зачастую выполняются в сложных областях, при отсутствии достаточной информации, включают исследования низкого качества
Ganann et al. Implementation Science 2010, 5:56
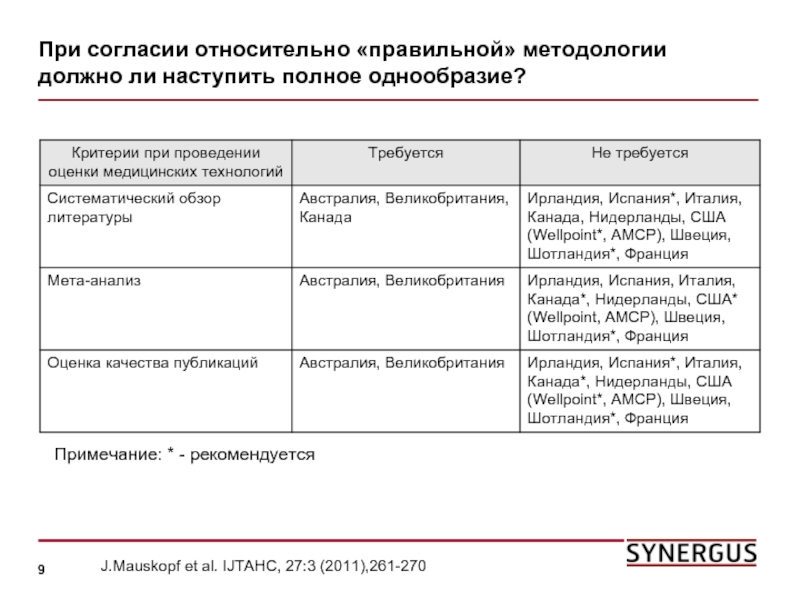
Слайд 9При согласии относительно «правильной» методологии должно ли наступить полное однообразие?
Примечание: *
J.Mauskopf et al. IJTAHC, 27:3 (2011),261-270
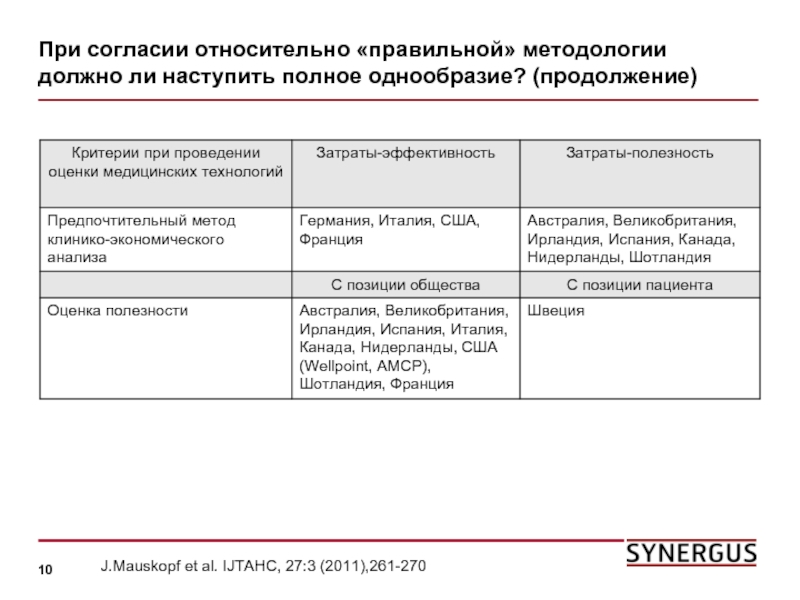
Слайд 10При согласии относительно «правильной» методологии должно ли наступить полное однообразие? (продолжение)
J.Mauskopf
Слайд 11И все же немного единообразия не помешает…
EuNetHTA – программа финансируемая Евросоюзом
Некоторые важные шаги в направлении консолидации усилий:
База данных планируемых и проводящихся исследований
Информация доступна (CADTH - Канада, CAHAIQ - Каталония, DACEHTA - Дания, KCE - Бельгия, NOKC - Норвегия, SBU - Швеция, NICE - Великобритания)
Информация недоступна (FinOHTA - Финляндия, HAS - Франция)
Концепция «Базового пакета для оценки» (CORE HTA)
Слайд 12Новый вызов для производителей
Удовлетворить потребности в доказательствах безопасности, эффективности и затратной
Регуляторов
Плательщиков
Клиницистов
И при этом не выйти за рамки ограниченного бюджета
Слайд 13Новый вызов диктует необходимость адаптации стратегии планирования и проведения клинических исследований
Планируемые
Потребности регуляторов (доказательства безопасности, влияние на суррогатные конечные точки, программа управления рисками и мониторинг безопасности после регистрации, сравнение с плацебо или отсутствием лечения, исследования для подтверждения эквивалентности (non-inferiority studies))
Потребности плательщиков (клинические значимые конечные точки, временной горизонт и клинические точки, сопоставимые с альтернативными технологиями, подтверждение превосходства над используемыми в настоящее время альтернативными технологиями, демонстрация структуры затрат, демонстрация влияния на бюджет, демонстрация затратной эффективности)
Потребности клиницистов (сравнение с лучшими имеющимися альтернативами, использование новых комбинированных конечных точек, демонстрация «прорыва» в лечении больных)
Кто доминирует?
Эти противоречия между различными сторонами порождает трудности в планировании исследовании, и последующей их интерпретации и использовании
Слайд 14Система оценки медицинских технологий направлена на выявление преимуществ новой технологии
Германия –
Австрия – значительное преимущество (для всех пациентов или подгруппы), преимущество (для всех пациентов или подгруппы), равная эффективность
Бельгия – добавленная ценность, равная ценность
Франция – большие улучшения (снижение смертности), значительные улучшения эффективности и/или уменьшение побочных эффектов, умеренные улучшения эффективности и/или уменьшение побочных эффектов, небольшие улучшения, отсутствие улучшений
Как правило, выраженность пользы от нового препарата влияет на уровень его финансирования
Слайд 15Даже если система оценки медицинских технологий не очень эффективна…
Не стоит сильно
Шотландский медицинский консорциум провел анализ собственных руководств в период с 2002 по 2008 гг.
В среднем польза от новых препаратов равнялась 0,5 QALY
22% - никакой пользы
28% - 0-0,1 QALY
25% - 0,1-0,5 QALY
13% - 0,5-1,0 QALY
12% - более 1 QALY
Brown et el. 2009
Слайд 16Если посмотреть на критерии в России…
ПЖНВЛС (Приказ Минздравсоцразвития России от 27
«5. Критериями для включения и/или исключения лекарственного средства при формировании Перечня являются:
научно-обоснованные данные об эффективности и безопасности препарата при определенном заболевании, синдроме или клинической ситуации;
научно-обоснованные данные о терапевтической эквивалентности препарата лекарственным средствам со схожими механизмами фармакологического действия;»
Перечень ОНЛС (Приказ Минздравсоцразвития России от 15 февраля 2006 г. N 93. «Об организации работы по формированию перечня лекарственных средств, отпускаемых по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи»):
«5. Перечень формируется на основании:
- оформленных надлежащим образом данных об эффективности и безопасности
препарата при определенном заболевании, синдроме или клинической ситуации;
- оформленных надлежащим образом данных терапевтической эквивалентности
препарата лекарственным средствам со схожими механизмами фармакологического действия;»
Слайд 17Исследования «не меньшей эффективности» (non-inferiority или equivalence studies)
Призваны продемонстрировать, что новая
Используются в случаях, когда не предполагается, что новая технология обладает большей эффективностью, однако предполагается большая простота использования, меньшее число побочных эффектов или меньшие затраты на лечение
Дизайн подвержен некоторым изменениям сравнению с «исследованиями превосходства» новых технологий (superiority studies) – отличная нулевая гипотеза, меньшее число пациентов, иногда – отсутствие маскирования, отличный метод анализа (анализ согласно распределения в группы затруднен)
Часто используются в области медицинского оборудования
Некоторые примеры:
ASSENT (Assessment of the Safety and Efficacy of a New Thrombolytic)-2,
GUSTO (Global Use of Strategies to Open Occluded Coronary Arteries)-III,
COBALT (Continuous Infusion Versus Double-Bolus Administration of Alteplase)
Исследования «не меньшей эффективности» хороший пример различий в подходах между позицией эпидемиолога/регулятора и плательщика
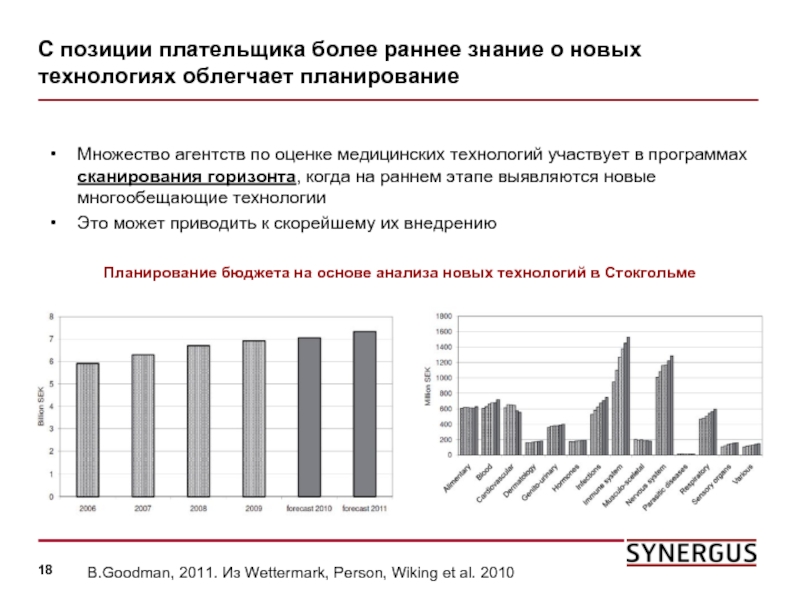
Слайд 18С позиции плательщика более раннее знание о новых технологиях облегчает планирование
Множество
Это может приводить к скорейшему их внедрению
B.Goodman, 2011. Из Wettermark, Person, Wiking et al. 2010
Планирование бюджета на основе анализа новых технологий в Стокгольме
Слайд 19Новые технические возможности расширяют спектр методов исследований
Шведские регистры в области ревматологии:
Swedish
Swedish biologics registries ARTIS (Antirheumatic Therapies Iin Sweden),
SSATG (Southern Sweden Antirheumatic Therapy Group)
STURE (Stockholm Tumor Necrosis Factor-a Follow-up Registry)
Swedish Early Psoriatic Arthritis Register (SwePsA)
И др.
Во многих странах создание регистров является условием допуска препарата на рынок, с целью мониторинга его эффективности
Не во всех странах это технически возможно (например, в Шотландии – слабое оснащение больниц информационными системами, практически отсутствуют регистры с больничными данными)
Слайд 20Лучшее понимание необходимости различных подходов в оценке лекарственных средств и медицинского
Некоторые отличия в подходах к оценке медицинского оборудования:
Использование «стандартных» критериев для диагностического оборудования может быть затруднено (QALY для оценки пользы от PSA-теста - требуется контроль всех параметров, за исключением самого теста)
Значение «эффекта обучения» - показатели значительно улучшаются с накоплением индивидуального опыта использования оборудования (оценка эффективности в разные временные промежутки)
Не всегда маскирование и рандомизация возможны (перспектива регистров больных)
Использование технологии может приводить к целому ряду других изменений в организации диагностического и лечебного процесса
Удобство использования (трудно измеримый показатель)
Отличное ценообразование (быстрая эрозия технологий, быстрое снижение цены)