- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Одесский автомобильно- дорожный колледжwww.avtodor.at.ua презентация
Содержание
- 1. Одесский автомобильно- дорожный колледжwww.avtodor.at.ua
- 2. Под стандартной теплотой образования понимают тепловой
- 3. Составила презентацию Ольга Катана В литературе часто
- 5. Энтальпия образования простых веществ принимается равной
- 6. Единицы измерения энтальпии образования - Дж/г, Дж/моль.
- 7. Сайт химии Иволга Если при образовании сложного
- 9. Разница энтальпий образования соединений обычно зависит от
- 10. Химические уравнения в которых указано количество выделившейся
- 11. Тепловые эффекты (энтальпии) получают обычно на основе
- 13. Не все вещества можно получить, помещая
- 14. В таких случаях приходит на помощь
- 16. Из закона Гесса вытекают три важных следствия
- 17. Следствие 2. Энтальпия реакции равна разности энтальпий
- 18. Иногда вместо энтальпий реакций используют теплоты
- 21. Задача. При сжигании 3 г магния выделилось
- 22. Задача. При сжигании 93 г фосфора выделилось
- 23. Задача. Вычислите тепловой эффект реакции Fe2O3 +
- 24. Сайт химии Иволга
Слайд 1
Одесский автомобильно- дорожный колледж
www.avtodor.at.ua
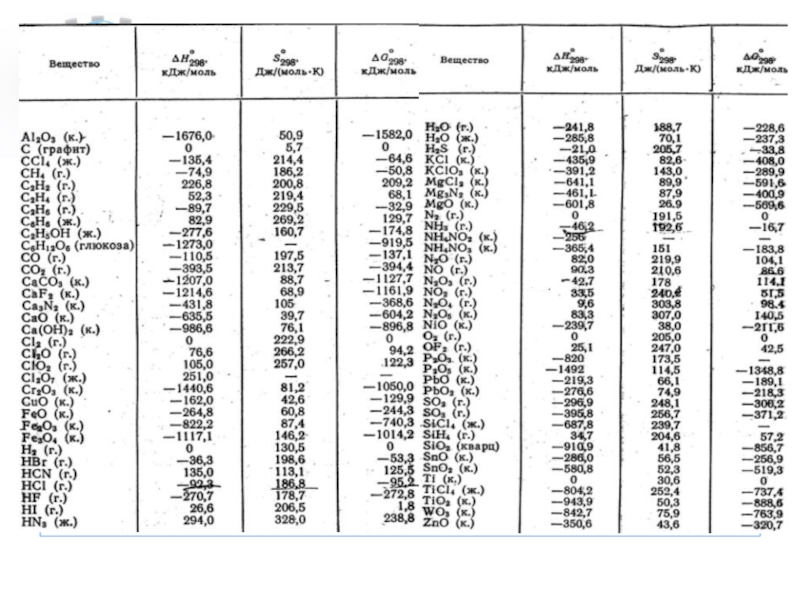
Стандартная энтальпия образования (стандартная теплота образования)
Слайд 2Под стандартной теплотой образования
понимают тепловой эффект реакции образования одного моля
вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль. Стандартная энтальпия образования обозначается ΔHfO. Здесь индекс f означает formation (образование), а перечеркнутый кружок, напоминающий диск Плимсоля[1] – то, что величина относится к стандартному состоянию вещества.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль. Стандартная энтальпия образования обозначается ΔHfO. Здесь индекс f означает formation (образование), а перечеркнутый кружок, напоминающий диск Плимсоля[1] – то, что величина относится к стандартному состоянию вещества.
Слайд 3Составила презентацию Ольга Катана
В литературе часто встречается другое обозначение стандартной энтальпии
– ΔH2980, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298 – температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество
Слайд 5Энтальпия образования простых веществ
принимается равной нулю, причем нулевое значение энтальпии
образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Слайд 6Единицы измерения энтальпии образования - Дж/г, Дж/моль.
Тепловой эффект любой реакции находится
как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции
(следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты) Термохимические эффекты можно включать в химические реакции.
(следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты) Термохимические эффекты можно включать в химические реакции.
Слайд 7Сайт химии Иволга
Если при образовании сложного вещества из простых энергия затрачивается,
то значение энтальпии для данного вещества положительное, а если выделяется, то отрицательное. Поскольку абсолютную энтальпию образования вещества определить невозможно, оперируют только с их разностями H в искусственно введенной шкале.
Слайд 9Разница энтальпий образования соединений обычно зависит от температуры
при которой проводится
процесс. В связи с этим в справочниках, как правило, указывают стандартное (относящееся к температуре 25 °С) значение энтальпии, что обозначают верхним индексом (0). Обозначение энтальпии образования соединения (из простых веществ) снабжают также нижним индексом (f) (от англ. formation – образование). Тогда для стандартной энтальпии образования воды имеем:
Слайд 10Химические уравнения в которых указано количество выделившейся или поглощенной теплоты
называются
термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества,
Слайд 11Тепловые эффекты (энтальпии)
получают обычно на основе экспериментальных данных. В специальном приборе,
который назван калориметром или калориметрической бомбой, проводят химическую реакцию с точно известными массами реагентов. Зная теплоемкость прибора, по изменению температуры в нем можно определить тепловой эффект реакции и занести найденное значение в справочник.
Слайд 13
Не все вещества можно получить, помещая простые вещества непосредственно в реактор.
Например, глюкозу С6Н12О6 нельзя получить при непосредственном контакте углерода, кислорода и водорода. Это вещество возникает в результате биохимических процессов в живой клетке.
Слайд 14
В таких случаях приходит на помощь закон Гесса, который гласит, что
тепловой эффект химической реакции определяется разностью энергетических состояний продуктов и реагентов и не зависит от пути реакции.
Слайд 16Из закона Гесса вытекают три важных следствия
Следствие 1. Энтальпия реакции равна
разности энтальпий образования продуктов и реагентов:
Hр = Hf (прод.) – Hf (реаг.).
Так, если уравнение реакции в общем виде записать следующим образом:
aА + bB = cC + dD,
то
Hр = cHf(C) + dHf(D) – aHf(A) – bHf(B).
Hр = Hf (прод.) – Hf (реаг.).
Так, если уравнение реакции в общем виде записать следующим образом:
aА + bB = cC + dD,
то
Hр = cHf(C) + dHf(D) – aHf(A) – bHf(B).
Слайд 17Следствие 2. Энтальпия реакции равна разности энтальпий сгорания реагентов и продуктов:
Hр
= Hсг(реаг.) – Hсг(прод.).
Для реакции:
aА + bB = cC + dD,
Hр = aHсг(А) + bHсг(B) – cHсг(C) – dHсг(D).
Следствие 3. Термохимические уравнения реакций можно складывать и вычитать, умножать и делить, записывать справа налево, несмотря на подчас практическую неосуществимость обратных реакций.
Для реакции:
aА + bB = cC + dD,
Hр = aHсг(А) + bHсг(B) – cHсг(C) – dHсг(D).
Следствие 3. Термохимические уравнения реакций можно складывать и вычитать, умножать и делить, записывать справа налево, несмотря на подчас практическую неосуществимость обратных реакций.
Слайд 18
Иногда вместо энтальпий реакций используют теплоты реакций, а вместо энтальпий образования
веществ их теплоты образования. Теплоты реакций и теплоты образования связаны с соответствующими энтальпиями простым соотношением:
Q = –H.
Q = –H.
Слайд 21Задача. При сжигании 3 г магния выделилось 75,15 кДж теплоты. Составьте
термохимическое уравнение реакции горения магния
Слайд 22Задача. При сжигании 93 г фосфора выделилось 2322 кДж теплоты. Составьте
термохимическое уравнение реакции горения. Найти теплоту образования фосфора
Слайд 23Задача. Вычислите тепловой эффект реакции Fe2O3 + 2Al Al2O3 + 2Fe, если
теплота образования оксида железа(III) составляет +821,5 кДж/моль, а теплота образования оксида алюминия +1675,7 кДж/моль (теплота образования простого вещества равна нулю).