- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 6 Термохимические методы получения водорода из воды презентация
Содержание
- 1. Лекция 6 Термохимические методы получения водорода из воды
- 2. Термодинамические основы термохимического разложения воды Термодинамика реакции
- 3. Для проведения обратимого изотермического процесса в соответствии
- 4. В предположении, что реагенты могут рассматриваться как
- 5. 1. водяной пар, поступающий при давлении р
- 6. Полное количество полученной работы при условии, что
- 7. Баланс теплоты. Так как все количества теплоты
- 8. Возможность замены работы теплотой в процессе разложения
- 9. Количество этой теплоты должно быть таким, чтобы
- 10. Учитывая формулу (23) для эксергии теплоты, найдем,
- 11. Концепция многостадийных реакций Изменение энергии Гиббса в
- 12. Вся последовательность реакций может происходить при какой-то
- 13. Теоретический КПД процесса термохимического разложения воды КПД
- 14. Источники тепла для ТХРРВ Ядерный реактор Цепочка
- 15. Одностадийный процесс ТХРВ Реально работать при
- 16. Двухстадийный термохимический процесс Максимальная полезная работа в
- 17. ZnO/Zn – наиболее интересный вариант Шаги
- 18. Рабочие температуры ниже, чем в одностадийном
- 19. Многостадийные ТХП Сконструированы с расчетом
- 20. Сера – Йодный цикл Включает реакции:
- 21. S-I цикл проходит при умеренных температурах,
- 22. UT-3 цикл CaBr2 (s) + H2O
- 23. Cu –I цикл Привлекателен низкими температурами.
- 24. Гибридные термохимические процессы В гибридных ТХРРВ используется
Слайд 1Лекция 6 Термохимические методы получения водорода из воды
Термодинамические основы термохимического разложения
Возможность замены работы теплотой в процессе разложения воды
Концепция многостадийных реакций
Теоретический КПД процесса термохимического разложения воды
Примеры многостадийных циклов
Слайд 2Термодинамические основы термохимического разложения воды
Термодинамика реакции разложения воды
Реакция разложения воды
при 7=298,15 К и при стандартном давлении р =0,1013 МПа
Можно определить необходимые затраты работы и теплоту при условии, что водяной пар, водород и кислород, находится при нормальных давлении и температуре.
Слайд 3Для проведения обратимого изотермического процесса в соответствии со вторым законом термодинамики
для осуществления обратимой изобарно-изотермической реакции необходимо затратить работу (5):
если процессы хоть в какой-то части необратимы, то в соответствии с основными законами термодинамики необходимая затрата работы возрастает.
Смысл работы, необходимой для проведения обратимой реакции
В реакторе устанавливаются равновесные парциальные давления компонентов рН20, рН2 и р02, определяемые уравнением изотермы реакции (6):
Т.к.реакция является изотермической и изобарной и по предположению равновесной (обратимой), то (7):
ΔН(Т) и ΔS(Т) – для равновесных давл. реагентов
Слайд 4В предположении, что реагенты могут рассматриваться как идеальные газы (для небольших
А изменение энтропии от Т зависит (8):
А при стандартном давлении (9):
Т.к. для идеального газа (10):
Из 8 и 9 : (11)
Или с учетом 6 (12):
Для равновесной реакции т.е. L’=0
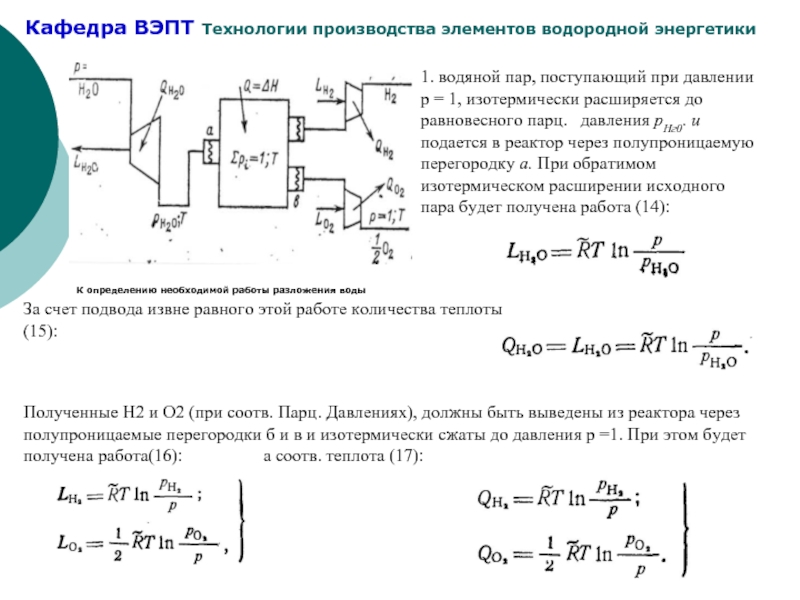
Слайд 51. водяной пар, поступающий при давлении р = 1, изотермически расширяется
За счет подвода извне равного этой работе количества теплоты (15):
Полученные Н2 и О2 (при соотв. Парц. Давлениях), должны быть выведены из реактора через полупроницаемые перегородки б и в и изотермически сжаты до давления р =1. При этом будет получена работа(16): а соотв. теплота (17):
Слайд 6Полное количество полученной работы при условии, что р=1, (18):
Сопоставляя 18 с
Затраты работы на осуществление обратимой реакции в идеально-газовой смеси связаны только с необходимостью обратимого расширения и сжатия реагентов от исходного давления до равновесного парциального и наоборот.
Величина ΔG0(T) изменяется с температурой в соответствии с термодинамическим соотношением (20):
Т.к. в нашем случае ΔS0(T)>0, с ростом температуры ΔG0 уменьшается. Для реакции разложения воды это приводит к тому, что при Т~5000 .К ΔG0 обращается в нуль. Но это не значит, что при такой температуре источники работы вообще не нужны.
При ΔG0(T)=0 lnKр(Т) = 0, откуда с учетом рН2 +ро2+Рн2о=1 и рН2 = 2рО2 получаем рН2 =0,5; рО2 = 0,25 и рН2О = 0,25, т. е. работа для расширения и сжатия реагентов будет нужна и в этом случае. Условие ΔG0(T)=-L’= 0 означает, что работы расширения и сжатия сбалансируются: работа, полученная при расширении водяного пара от 1 до рН20, будет как раз достаточна для сжатия водорода и кислорода от рН2 и р01 до 1.
Слайд 7Баланс теплоты. Так как все количества теплоты на схеме подводятся или
С учетом 15 и 17 это даст
Или
Слайд 8Возможность замены работы теплотой в процессе разложения воды
Согласно второму закону термодинамики
Максимальное количество работы, которую можно получить из теплоты, отобранной от источника с температурой Т, называют работоспособностью, или эксергией теплоты ЕQ(Т):
если для осуществления реакции разложения воды требуется затратить работу
то минимально возможное количество теплоты, которое может заменить эту работу, определится из условия, что эксергия этой теплоты равна необходимой работе (24):
Просто подвести к системе при температуре Т теплоту еще не значит реализовать ее эксергию. Нужно, отобрав теплоту от источника с температурой Т, отдать ее в окружающую среду при То.
Слайд 9Количество этой теплоты должно быть таким, чтобы убыль энтропии системы ΔS2(То)
При этом количество теплоты, отдаваемой в окружающую среду (26)
последовательность процессов, используемых для термохимического разложения воды, должна включать в себя процессы (реакции), идущие с возрастанием энтропии, и процессы с соответствующим ее убыванием.
Реакцию разложения воды можно осуществить при любой температуре Т, затрачивая только теплоту, отбираемую от источника с этой температурой.
Для сжатия реагентов от их равновесных давлений при температуре Т до давления р=1 необходима работа.
Таким образом, для проведения реакции при любой температуре необходимо либо подвести недостающую работу, либо осуществить сжатие газов за счет использования теплоты.
Полная эксергия теплоты, необходимой для осуществления РРВ, определится формулой (33):
отличается от (24) множителем То/Т
Слайд 10Учитывая формулу (23) для эксергии теплоты, найдем, что минимально необходимое количество
Подставляя (35)
Получаем
РРВ можно осуществить обратимо при любой температуре, затрачивая только теплоту. Вопрос в скорости реакции. При Т=298 К,
Кр=10-40
При Т=1270 К Кр ~ 10-8,
При Т=3600 К Кр ~ 0,1,
Слайд 11Концепция многостадийных реакций
Изменение энергии Гиббса в
многостадийном процессе разложения воды
РРВ
Условия: чтобы все реагенты в результате промежуточных реакций вернулись в первоначальные состояния и чтобы единственным результатом совокупности реакций (а) — (г) была РРВ.
Для этого должно выполняться равенство (37):
Каждое из ΔG0i,- может быть существенно меньшим ΔG0 Если, например, при 1000 К ΔG0i =20 ООО кДж-кмоль-1, то
Кр=0,08
Слайд 12Вся последовательность реакций может происходить при какой-то одной температуре Т. Однако
Удобно в качестве таких процессов использовать сами реакции (а), (б), ..., проводя их при различных температурах. При этом в числе реакций (а), (б), ... должны быть такие, для которых ΔS>0. и такие, для которых ΔS<0, причем необходимо, чтобы знак «больше» относился к реакциям, происходящим при высшей температуре в последовательности процессов, а знак «меньше» — к реакциям, происходящим при низшей температуре, в качестве которой для получения максимального эффекта следует принимать температуру То.
Изменение энтропии в многостадийном процессе разложения воды
Для ТХРВ Т~ 1275 К, перспективной , считается последовательность из 4—5 реакций, часть из которых — эндотермические, протекающие при температуре источника теплоты, а часть — экзотермические, протекающие при температуре, по возможности близкой к То.
Эндотермические и экзотермические реакции здесь.следует различать не по знаку теплового эффекта ΔН, а по знаку изменения энтропии ΔS, поскольку именно эта величина определяет теплообмен с окружающей средой при обратимом протекании реакции.
Слайд 13Теоретический КПД процесса термохимического разложения воды
КПД процесса ТХРВ (38):
ΔН0 (Т) —тепловой
Теплота Q(T) при обратимом проведении всех процессов должна, с одной стороны, заменить необходимую работу ΔG°(Т), а с другой, скомпенсировать собственно теплоту, затраченную на протекание обратимой реакции, ТΔS0(Т), поэтому (39):
Подставляя (39) в (38) с учетом:
получаем
Слайд 14Источники тепла для ТХРРВ
Ядерный реактор
Цепочка ЯР (40% кпд)+ электролизер (90% кпд)
ТХРРВ – достижим кпд 50%
10 тн Н2 в день от 30 МВт источника
Максимальная Т в ЯР (из безопасности) 1573 K.
Можно использовать: высокотемпературные газоохлаждаемые реакторы
с жидкометаллическим теплоносителем
С теплоносителем на расплавах солей
гелиевые реакторы наиболее подходящие для температур 1100- 1300 K.
Солнечная энергия
Концентрированием солнечной энергии можно получать Т~300К (намного больше, чем в ЯР)
Увеличение температуры позволяет увеличить эффективность РРВ
Солнечные концентраторы занимают много места
Что делать в облачные дни?
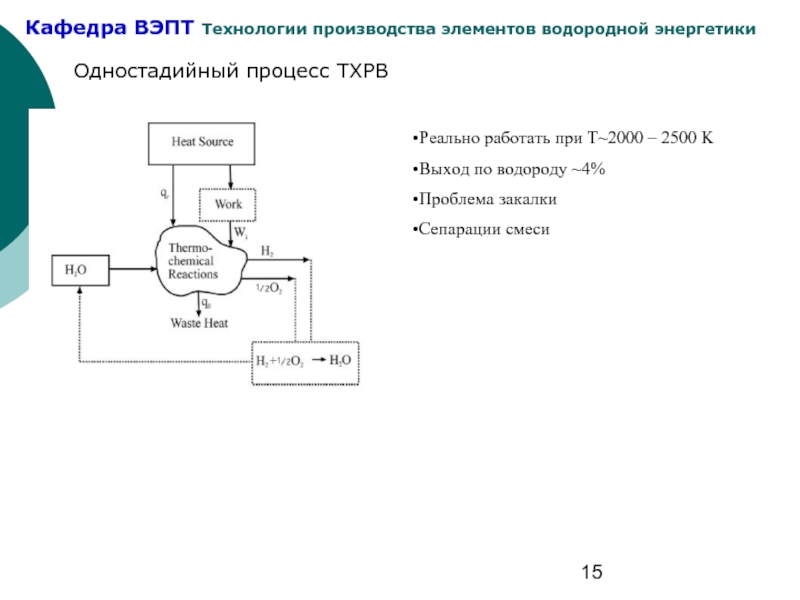
Слайд 15Одностадийный процесс ТХРВ
Реально работать при Т~2000 – 2500 K
Выход по водороду
Проблема закалки
Сепарации смеси
Слайд 16Двухстадийный термохимический процесс
Максимальная полезная работа в многостадийном процессе
Подбором реакций с подходящими
Простейший случай – двухстадийный процесс, включающий металло-оксидный цикл:
1) Оксид металла → восстановленный оксид металла + O2 (эндотермическая)
2) Восстановленный оксид металла + 2H2O → оксид металла + 2H2
На первой стадии металл с высокой степенью окисления восстанавливается до оксида с низкой степенью окисления, или низковалентный оксид восстанавливается до металла, выделяя кислород.
Затем восстановленный оксид или металл реагируют с водой при высокой температуре, окисляясь с выделением водорода.
Полная реакция – ТХРВ
Рабочие температуры:1700-3000 K.
Практическое применение ограничено использованием тепла от солнечных концентраторов.
1977 – первый двухстадийный цикл: Fe3O4/FeO. Другие пары: Co3O4 /CoO, Mn2O3/ MnO, TiO2/TiOx, ZnO/Zn, ZnFe2O4/Zn/Fe3O4
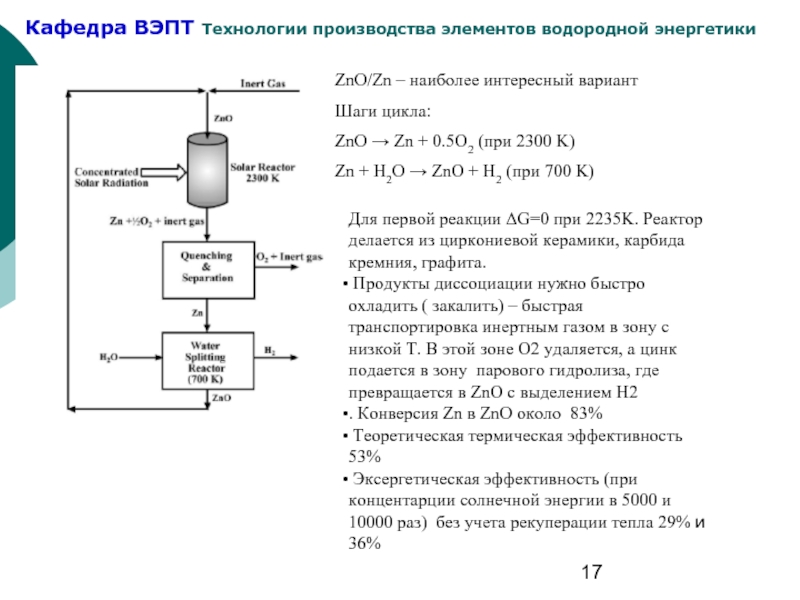
Слайд 17ZnO/Zn – наиболее интересный вариант
Шаги цикла:
ZnO → Zn + 0.5O2
Zn + H2O → ZnO + H2 (при 700 K)
Для первой реакции ΔG=0 при 2235K. Реактор делается из циркониевой керамики, карбида кремния, графита.
Продукты диссоциации нужно быстро охладить ( закалить) – быстрая транспортировка инертным газом в зону с низкой Т. В этой зоне О2 удаляется, а цинк подается в зону парового гидролиза, где превращается в ZnO c выделением Н2
. Конверсия Zn в ZnO около 83%
Теоретическая термическая эффективность 53%
Эксергетическая эффективность (при концентарции солнечной энергии в 5000 и 10000 раз) без учета рекуперации тепла 29% и 36%
Слайд 18 Рабочие температуры ниже, чем в одностадийном процессе.
Выход водорода выше
Достаточно легко
Не используются коррозийные агенты
Нужная температура в 2000 К может быть достигнута в концентраторах 1000 – 5000. Это упрощает конструкцию концентраторов.
Высокие потери на излучение – нужны тепловые экраны и т.д.
Необходимость быстрой закалки для предотвращения обратной реакции металла с кислородом
Высокотемпературное спекание частиц оксида металла – снижение активности от цикла к циклу
Осаждение металла на стенках реактора
Температурные режимы высоки для использования в крупнотоннажном производстве.
Процесс не выдерживает конкуренции с электролизом
Слайд 19Многостадийные ТХП
Сконструированы с расчетом на температуру ЯР 1500K.
Все химические
Приемлемость цикла для производства Н2 определяется термической эффективностью и технической осуществимостью.
Для достижения эффективной конверсии тепло – химическая энергия нужно использовать высоко эндотермические реакции. Для эффективного массообмена проточные реакторы.
Для высокопроизводительных производств нужно учитывать экологические аспекты и цены.
Первый многостадийный ТХП с кпд > 50% предложен в 1970 г. Mark-1
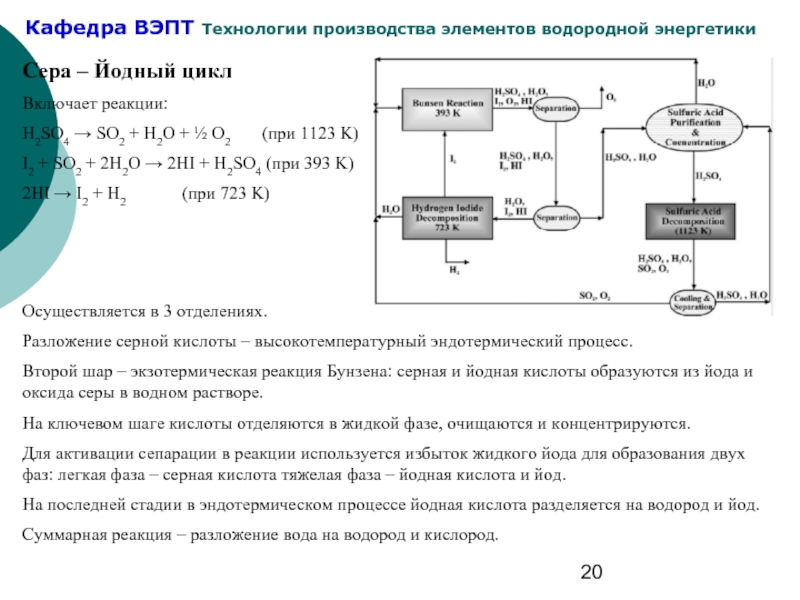
Слайд 20Сера – Йодный цикл
Включает реакции:
H2SO4 → SO2 + H2O +
I2 + SO2 + 2H2O → 2HI + H2SO4 (при 393 K)
2HI → I2 + H2 (при 723 K)
Осуществляется в 3 отделениях.
Разложение серной кислоты – высокотемпературный эндотермический процесс.
Второй шар – экзотермическая реакция Бунзена: серная и йодная кислоты образуются из йода и оксида серы в водном растворе.
На ключевом шаге кислоты отделяются в жидкой фазе, очищаются и концентрируются.
Для активации сепарации в реакции используется избыток жидкого йода для образования двух фаз: легкая фаза – серная кислота тяжелая фаза – йодная кислота и йод.
На последней стадии в эндотермическом процессе йодная кислота разделяется на водород и йод.
Суммарная реакция – разложение вода на водород и кислород.
Слайд 21 S-I цикл проходит при умеренных температурах, достижимых в ЯР и
Продемонстрирована эффективность 42 – 56 %
Все реакции проходят в жидкой фазе и нет отходов
В реакциях разложения серной и йодной кислот образуются агрессивные вещества – необходимо решать задачи коррозионной стойкости реактора.
После проведения реакции Бунзена, необходимо полное удаление йодной кислоты, чтобы избежать отложений серы на стадиях сепарации и разложения HI .
Полное удаление Н2 из HI и I2 в последней реакции затруднительно, что ограничивает эффективность процесса.
На стадии разложения серной кислоты вместо SO2 может формироваться SO3, который нужно тщательно отделять. Для избежания проблем с SO3 рабочие температуры приходится держать выше 1400K
Слайд 22UT-3 цикл
CaBr2 (s) + H2O (g) → CaO (s) +
CaO (s) + Br2 (g) → CaBr2 (s) + ½ O2 (g) (при 845 K)
Fe3O4 (s) + 8HBr (g) → 3FeBr2 (s) + 4H2O (g)+Br2 (g) (при 493 K)
3FeBr2 (s)+ 4H2O (g)→ Fe3O4 (s)+ 6HBr (g) + H2 (g) (при 833 K)
Первые две реакции производят бромистую кислоту с выделением кислорода. Две последние обеспечивают восстановление воды с выделением водорода.
Протекают в 4-х изолированных ректорах в изотермических или адиабатических условиях.
Реакции спаренные: в первой паре используется CaBr2 , во второй Fe3O4 . Полный цикл длится ~1 часа. После завершения цикла реакторы 1-2 и 3-4 меняются местами.
Теоретический кпд цикла UT-3 по производству водорода 49%, по эксэргии 53% .
Ограничением процесса является то, что используемые в цикле твердые вещества, особеннов близи точек плавления, могут спекаться, ухудшая эффективность процесса.
Слайд 23Cu –I цикл
Привлекателен низкими температурами.
2CuCl → CuCl2 + Cu (при
2CuCl2 + H2O → CuO. CuCl2 + 2HCl (573-648 K)
CuO. CuCl2 → 2CuCl + ½ O2 (723-803 K)
Cu + HCl → CuCl + ½ H2 (698-723 K)
Цикл идет с твердыми реагентами. В последней реакции используются мелкие частицы меди, чтобы полнностью перевести ее в CuCl, максимизируя выход Н2.
КПД цикла 49% [66].
Низкие температуры позволяют избежать многих инженерных и материаловедческих проблем.
В целом эффективность многостадийных циклов уменьшается с увеличением числа шагов из-за потерь тепла и трудностей разделения реагентов и продуктов.
Н2 получается единственным газом – не нужно очищать. Чистота Н2 в циклах ТХРВ 99.99%.
Слайд 24Гибридные термохимические процессы
В гибридных ТХРРВ используется и тепло и работа и
Эта электрохимическая реакция выбирается так, чтобы затраты электрической энергии были много ниже полных затрат энергии, необходимых для электролиза воды.
Достоинство: возможность реализовать двухстадийный процесс при Т много меньших чем нужно для двухстадийного ТХ цикла.
Процесс Марк-11
H2SO4 → SO2 + H2O + ½ O2 (1100 K)
2H2O + SO2 → H2SO4 + H2 (электролитически при 363 K)
Обратимый потенциал электролиза SO2 - 0.17 В, т.е. менее 10% от обратимого потенциала электролиза воды: (минимум 1.23В при 298K и 1 атм.) [65,69].
Серьезные проблемы коррозии на стадии электролиза из-за присутствия концентрированной серной кислоты (50%).
Полная термическая эффективность 48.8%
С точки зрения экономики с ним конкурируют современные методы электролиза воды .