- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 3 Производство водорода из жидких и газообразных углеводородов презентация
Содержание
- 1. Лекция 3 Производство водорода из жидких и газообразных углеводородов
- 2. Основные технологические стадии подготовки топлива для ТЭ
- 3. Состояние дел с производством водорода: из
- 4. Природный газ Обычно содержит 75- 95% метана
- 5. Жидкие УВ: бензин и дизельное топливо Преимущества:
- 7. Спирты: метанол и этанол – кандидаты в
- 8. Топливный процессор (fuel processing) – устройство для
- 9. a CO реагирует H2O образуя H2 and
- 10. Десульфурация- очистка от примесей серосодержащих газов В
- 11. Проблема: отравление катализаторов в ТП и ТЭ
- 12. Гидродесульфурация (ГДС) Используется для очистки ископаемых топлив
- 13. Удаление серы адсорбционными методами Принцип – селективная
- 14. Методы конверсии УВ Паровая каталитическая конверсия Парциальное
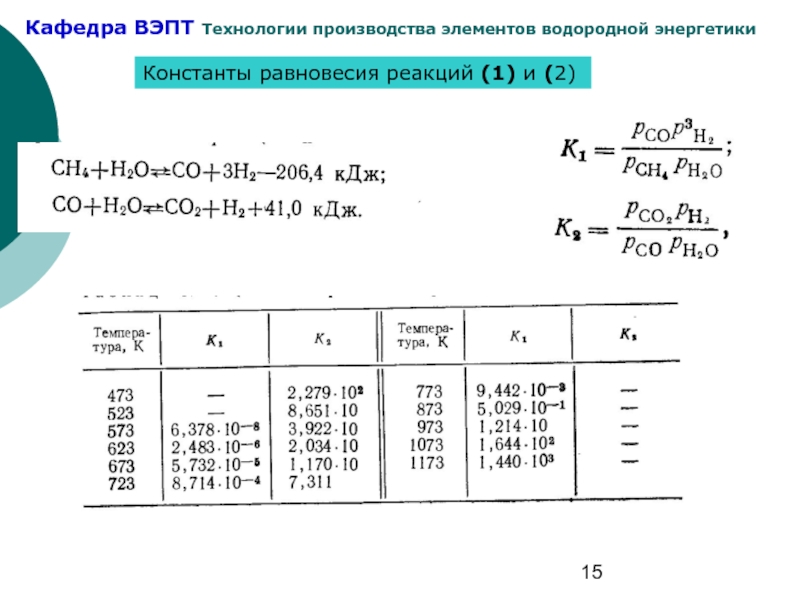
- 15. Константы равновесия реакций (1) и (2)
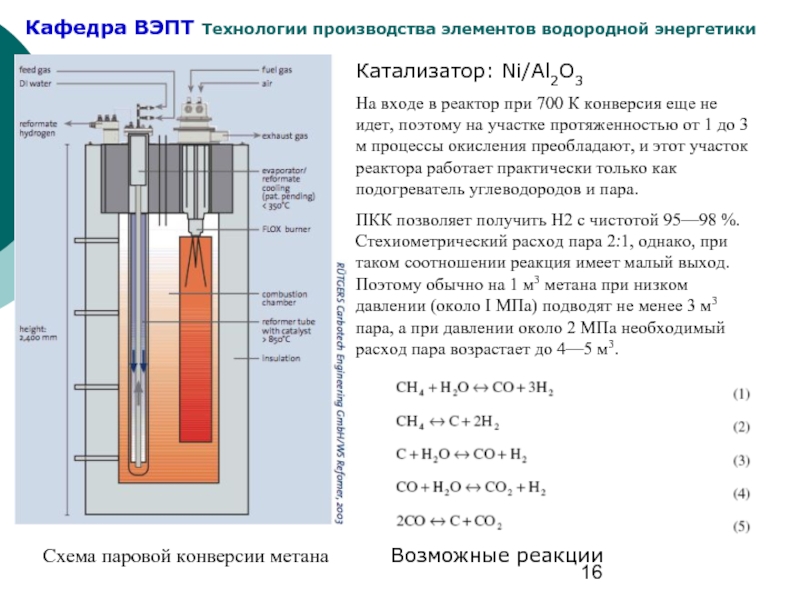
- 16. Схема паровой конверсии метана Катализатор: Ni/Al2O3 На
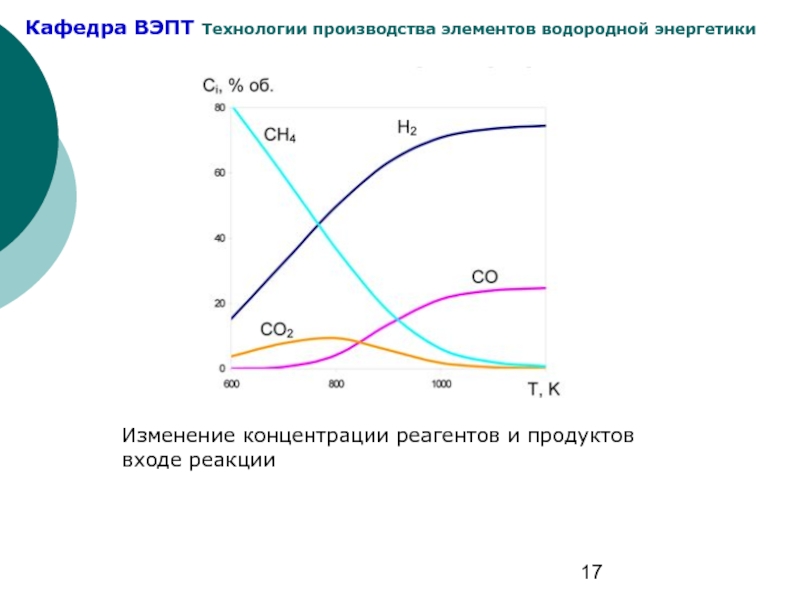
- 17. Изменение концентрации реагентов и продуктов входе реакции
- 18. Паровая конверсия с непрерывными выводом Н2 через
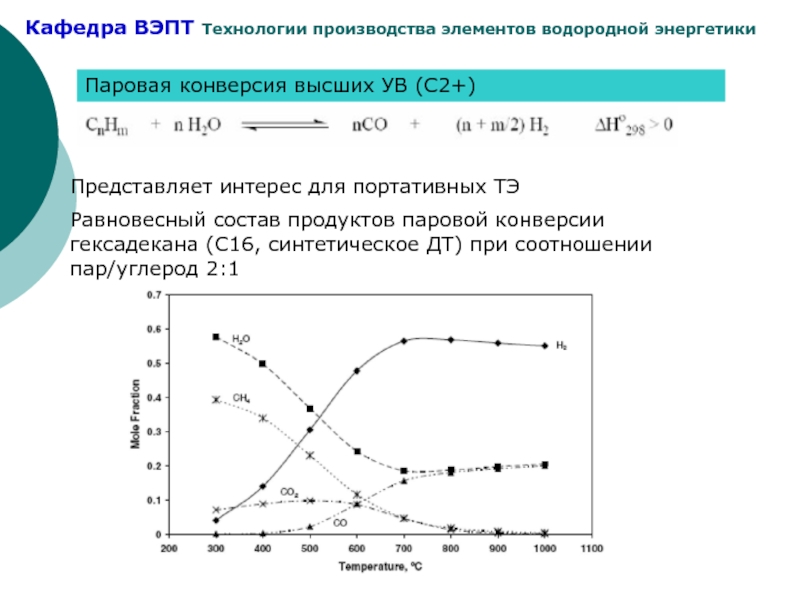
- 19. Паровая конверсия высших УВ (С2+) Представляет интерес
- 20. Паровая конверсия спиртов Достоинства КПП спиртов: Меньше
- 21. Парциальное окисление (метана) ПО: окисление топлива при
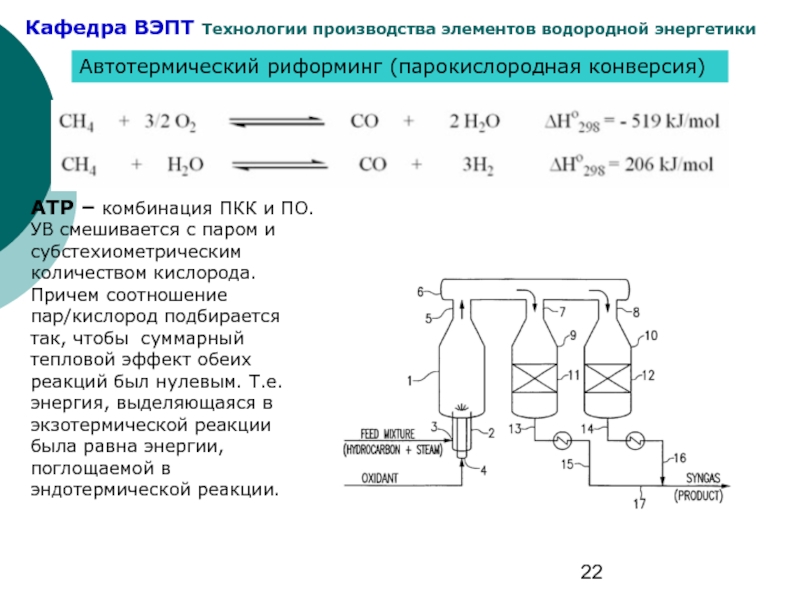
- 22. Автотермический риформинг (парокислородная конверсия) АТР – комбинация
- 23. Задачи, требующие решения в технологиях риформинга
- 24. Реакция сдвига В результате конверсии окиси
- 25. Методы удаления СО Селективное окисление Метанизация Мембранная
- 26. Метанизация: реакция обратная паровой конверсии Удобно, т.к.
- 27. Мембранная сепарация водорода Существует развитая технология очистки
Слайд 1Лекция 3 Производство водорода из жидких и газообразных углеводородов
Основные технологические
Возможные источники Н2
Методы удаления серы
УВ сырье для получения водорода
Паровая конверсия метана
Парциальное окисление
Парокислородная конверсия УВ
Слайд 2Основные технологические стадии подготовки топлива для ТЭ
УВ сырье
Десульфурация
(удаление серы)
Адсорбция
Гидродесульфация
Реформинг
Реактор сдвига
Удаление СО
Н2 топливо для ТЭ
Парциальное окисление
Высокотемпературный сдвиг
окисление
стравливание
Кат. Парц. окисление
Каталитическая паровая конверсия
Автотермический риформинг
Низкотемпературный сдвиг
Мембранная сепарация
метанизация
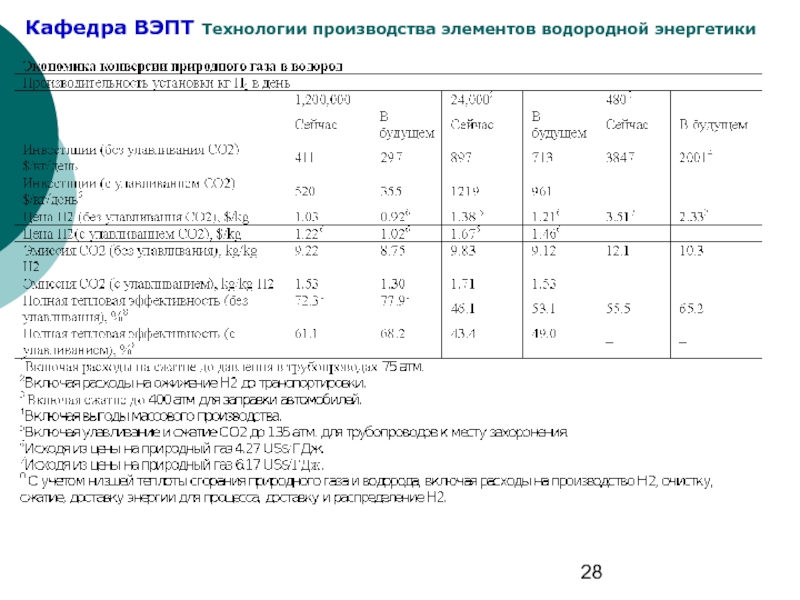
Слайд 3Состояние дел с производством водорода:
из природного газа 48% $5,6 за
Из нефти 30%
Из угля 18% $10,3 за ГДж
Электролиз 4% $ 20 за ГДж
Применение Н2 в ТЭ требует увеличения производства и создания удобных портативных генераторов Н2, в т.ч. для получения Н2 непосредственно в месте использования
Потенциальное сырье
Возобновляемые источники (биомасса, этанол и т.д.)
Не возобновляемые (УВ, уголь и т.д.)
Слайд 4Природный газ
Обычно содержит 75- 95% метана (СН4) + этан (С2Н6), пропан
По причинам безопасности одорируется сильно пахнущими сероорганическими соединениями
2. Сжиженный (бытовой газ)
В основном –(90-95%) пропан (С3Н8), бутан (С4Н10),
Легко сжижается (5 – 10 Атм.), высокая плотность энергии (46,5 МДж/кг), менее токсичный чем бензин
Слайд 5Жидкие УВ: бензин и дизельное топливо
Преимущества:
существует развитая инфраструктура распределения
Если сделать
Высокая плотность энергии: ~40 МДж/кг (у метанола 19 МДж/кг)
Недостатки:
Высокая температура конверсии
Состав бензина С4 – С10
Состав ДТ – С10-С22
Много примесей сложных УВ, серы, азота и т.д.
Слайд 7Спирты: метанол и этанол – кандидаты в носители энергии для портативных
Метанол СН3-ОН Этанол С2Н5-ОН
Достоинства метанола:
Есть технологии производства из синтез – газа (СО+Н2)
Реформинг идет при низких температурах (250 С)
Высокое отношение Н/С,
Нет С-С связей (снижение риска сажеобразования)
Нет серы
Можно напрямую использовать в метанольных ТЭ
Этанол:
Можно производить ферментацией крахмала, сахара или отходов зерна
Сейчас активно используется как добавка к обычным топливам (производство в США ~ 10 млн. л. в год.
Цена при производстве ферментацией биомассы ~ $0.25 за литр.
Н2 можно получить из этанола на катализаторах, но не решены проблемы образования сажи, ацетальдегида, этанола и других УВ, являющихся ядами для ТЭ.
Слайд 8Топливный процессор (fuel processing) – устройство для превращения исходного носителя энергии
Самый экономичный метод получения Н2 для стационарных ТЭ (>200 кВт) - реформинг ПГ
Для мобильных применений (сотовый -100 мВт, ноутбук – 30 Вт) – метанол, т.к. легко дозаправить. Энергоемкость картриджа с метанолом втрое выше, чем энергоемкость стандартного аккумулятора
Слайд 9a CO реагирует H2O образуя H2 and CO2 в реакции сдвига
b как топливо при внутреннем реформинге в РКТЭ и ТОТЭ.
c CO2 это яд для ЩТЭ, что делает невозможным использование в них таких топлив.
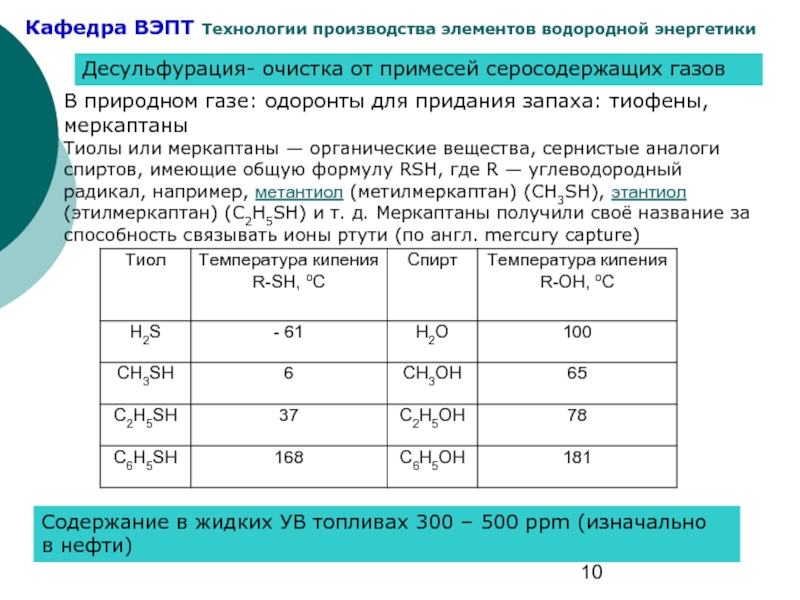
Слайд 10Десульфурация- очистка от примесей серосодержащих газов
В природном газе: одоронты для придания
Тиолы или меркаптаны — органические вещества, сернистые аналоги спиртов, имеющие общую формулу RSH, где R — углеводородный радикал, например, метантиол (метилмеркаптан) (CH3SH), этантиол (этилмеркаптан) (C2H5SH) и т. д. Меркаптаны получили своё название за способность связывать ионы ртути (по англ. mercury capture)
Содержание в жидких УВ топливах 300 – 500 ppm (изначально в нефти)
Слайд 11Проблема: отравление катализаторов в ТП и ТЭ
100ppm тиофена в бензине снижает
Конверсия С13-С15 УВ снижается с 93 до 77% при добавке 11 ppm бензотиофена и до 73% при 30 ppm и уже не восстанавливается даже при удалении серы
ТПТЭ в чистом Н2 – I=12 А, добавка 50 ppm Н2S снижает ток до 1.3 А в течение 1 часа
Топливо для ТПТЭ должно содержать менее 0.1 ppm серы
Методы очистки от серосодержащих УВ
гидродесульфурация
адсорбция
Слайд 12Гидродесульфурация (ГДС)
Используется для очистки ископаемых топлив сераорганические соединения конвертируются в Н2S
Параметры реакции:(300–360oC) давление H2 3.0–5.0 MPa, катализаторы: CoMo/Al2O3 или NiMo/Al2O3. Разработана для ФКТЭ с ПГ.
H2S конвертируется в элементарную серу или адсорбцией на оксиде цинка с образованием сульфида цинка:
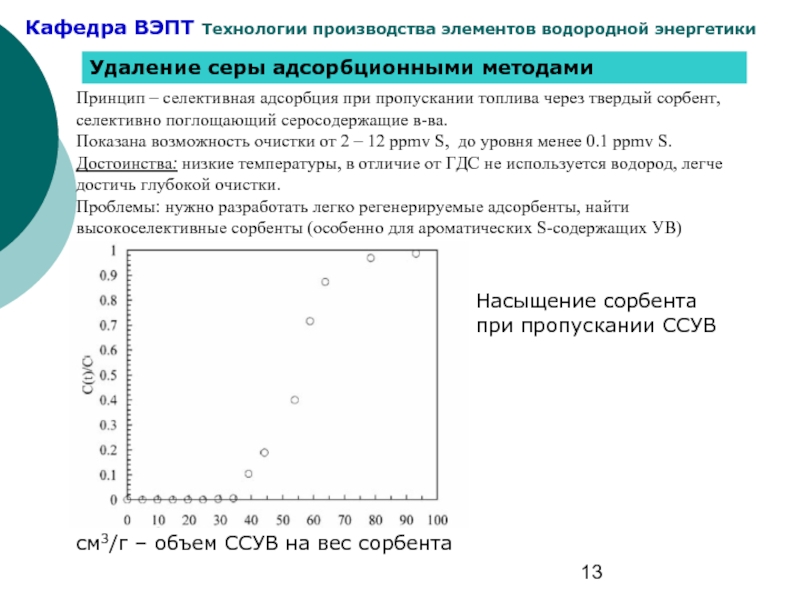
Слайд 13Удаление серы адсорбционными методами
Принцип – селективная адсорбция при пропускании топлива через
Показана возможность очистки от 2 – 12 ppmv S, до уровня менее 0.1 ppmv S.
Достоинства: низкие температуры, в отличие от ГДС не используется водород, легче достичь глубокой очистки.
Проблемы: нужно разработать легко регенерируемые адсорбенты, найти высокоселективные сорбенты (особенно для ароматических S-содержащих УВ)
Насыщение сорбента при пропускании ССУВ
Слайд 14Методы конверсии УВ
Паровая каталитическая конверсия
Парциальное окисление (кислородная конверсия
Автотермический реформинг
Итоговая реакция: СН4+2Н20↔С02+4Н2.
Принцип
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Слайд 16Схема паровой конверсии метана
Катализатор: Ni/Al2O3
На входе в реактор при 700 К
ПКК позволяет получить Н2 с чистотой 95—98 %. Стехиометрический расход пара 2:1, однако, при таком соотношении реакция имеет малый выход. Поэтому обычно на 1 м3 метана при низком давлении (около I МПа) подводят не менее 3 м3 пара, а при давлении около 2 МПа необходимый расход пара возрастает до 4—5 м3.
Возможные реакции
Слайд 18Паровая конверсия с непрерывными выводом Н2 через палладиевую мембрану
сдвигает равновесие реакции
при давлении 2 МПа, отношении компонентов пар — метан, равном 3:1, и парциальном давлении водорода в остаточном газе 0,16 МПа степень конверсии метана достигает 1 при выводе водорода уже при 823 К, а без вывода водорода степень конверсии 0,9 может быть достигнута только при 1153 К.
Количество чистого водорода, получаемого за мембраной, определяется также парциальным давлением водорода в газе на выходе из реактора. С повышением температуры растет парциальное давление водорода в газе, что интенсифицирует диффузию водорода через мембрану.
Слайд 19Паровая конверсия высших УВ (С2+)
Представляет интерес для портативных ТЭ
Равновесный состав продуктов
Слайд 20Паровая конверсия спиртов
Достоинства КПП спиртов:
Меньше затраты энергии.
Реакция идет при температурах (200–300oC)
Можно использовать дешевые медные катализаторы Cu/ZnO или Cu/ZnO/Al2O3.
Трудности: избежать формирования СО в обратной реакции сдвига.
Возможные реакции:
Слайд 21Парциальное окисление (метана)
ПО: окисление топлива при содержании кислорода меньше стехиометрического.
Достоинства:
возможность конверсии тяжелых УВ без катализатора
Высокие температуры в реакторе позволяют обойтись без стадии гидродесульфуризации (но Н2S удалять все равно нужно)
Скорости реакции выше, чем в паровой конверсии, что важно для быстрого старта
Нет воды – не нужно парогенератора
Недостатки:
Нет воды – меньше водорода на моль УВ – меньше парциальное давление Н2
Если использовать воздух – парциальное давление Н2 еще ниже – снижается эффективность ТЭ (по уравнению Нернста)
трудно управлять
Нельзя использовать для портативных применений
Слайд 22Автотермический риформинг (парокислородная конверсия)
АТР – комбинация ПКК и ПО. УВ смешивается
Слайд 23Задачи, требующие решения в технологиях риформинга
Выделение углерода в побочных реакциях
Для предотвращения коксования можно увеличить поток пара существенно выше стехиометрического – но это потребует нагрева дополнительного количества пара – снижение экономических показателей
Проблема коксования при риформинге жидких УВ выше, т.к. в сырье уже имеются С-С связи и есть примеси ароматических соединений.
Проблема спекания металлических частиц катализатора – уменьшение активной поверхности.
Слайд 24Реакция сдвига
В результате конверсии окиси углерода водяным паром по реакции
С целью повышения производительности процесса конверсию окиси углерода проводят в две стадии: на первой при температурах 623—673 К применяют высокотемпературный железохромовый катализатор,
на второй при 493—523 К — низкотемпературный медный.
После двух стадий конверсии можно получить концентрацию СО 0,5% . Но это все равно в 100 – 500 раз выше, чем можно подать в ТПТЭ
Обратимая, экзотермическая
Слайд 25Методы удаления СО
Селективное окисление
Метанизация
Мембранная сепарация
Анодный катализатор дезактивируется из-за адсорбции СО к
Воздух нужно добавлять аккуратно, чтобы не допустить окисления Н2 и не доводить до взрывоопасной смеси. The air has to be added in careful measures to avoid oxidizing the H2 and/or producing an explosive mixture.
Применяются добавки [O2]/[CO] = 1,5 - 2. При больших концентрациях СО нужно использовать несколько стадий, что усложняет систему.
~100 ppm это максимальный уровень CO, который можно удалить таким методом при 80oC.
Слайд 26Метанизация: реакция обратная паровой конверсии
Удобно, т.к. не нужно добавлять реагенты.
Недостаток
Метан – не яд, а разбавитель.
При повышенных концентрациях СО2 начинает работать реакция:
Например, на катализаторе Ni и Ni/Al2O3 скорость метанизации выше для CO2 чем для CO, даже если они присутствуют в одинаковых концентрациях.
Слайд 27Мембранная сепарация водорода
Существует развитая технология очистки Н2, основанная на его способности
Мембрана проницаема только для Н2, удаляется не только CO а также CO2, N2, и т.д., что позволяет увеличить парциальное давление Н2 на аноде.
Для снижения цены, мембраны делают на пористой несущей основе различными методами. Можно использовать Pt, Pd/Ag
CO препятствует проникновению Н2 из-за адсорбции на поверхность мембраны при температурах ниже 300 С.
Недостатки: высокая цена мембран, необходимость создания перепада давлений.
Основное применение найдет в компактных риформерах.