- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Воспаление в организме. (Лекция 4-5) презентация
Содержание
- 1. Воспаление в организме. (Лекция 4-5)
- 2. Признаки воспаления: покраснение, припухлость, повышенная местная температура, болезненность, нарушение функции
- 3. Воспаление – это защитная реакция, которая развивается,
- 11. Эндотелий
- 12. Активированные макрофаги выделяют цитокины (TNFα, IL-1),
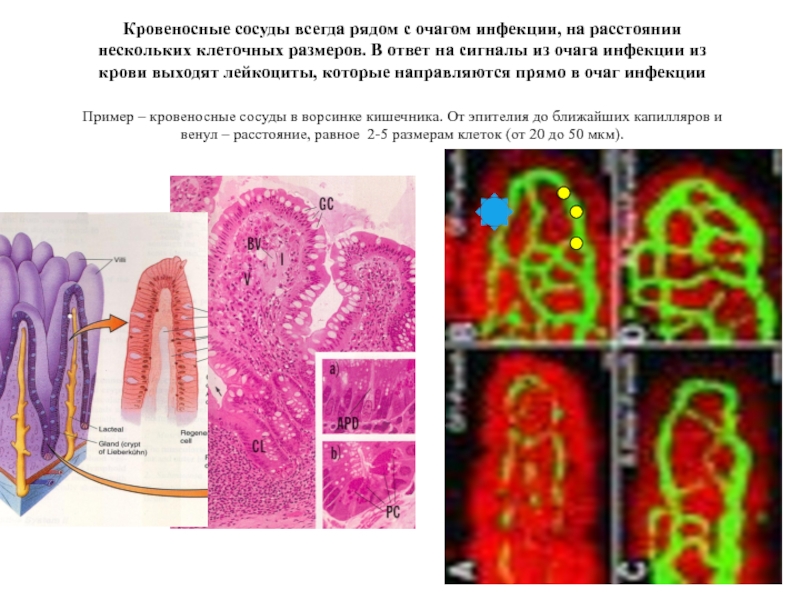
- 13. Кровеносные сосуды всегда рядом с очагом инфекции,
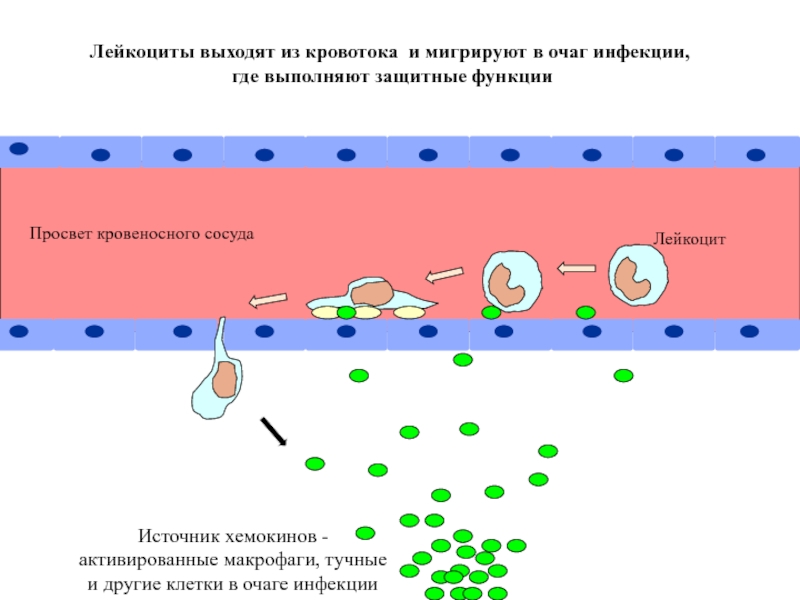
- 15. Последовательные стадии выхода лейкоцита из кровотока в
- 16. Всеми стадиями выхода лейкоцитов из кровотока управляют цитокины, молекулы межклеточной адгезии, молекулы внеклеточного матрикса
- 17. Гликолипид – в мембране нейтрофила,
- 18. СЕЛЕКТИНЫ белки клеточной мембраны,
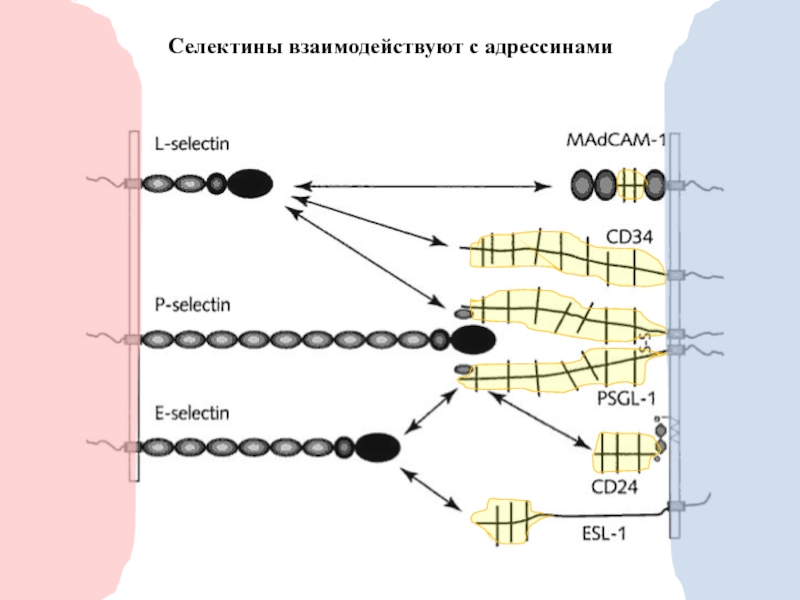
- 19. Селектины взаимодействуют с адрессинами
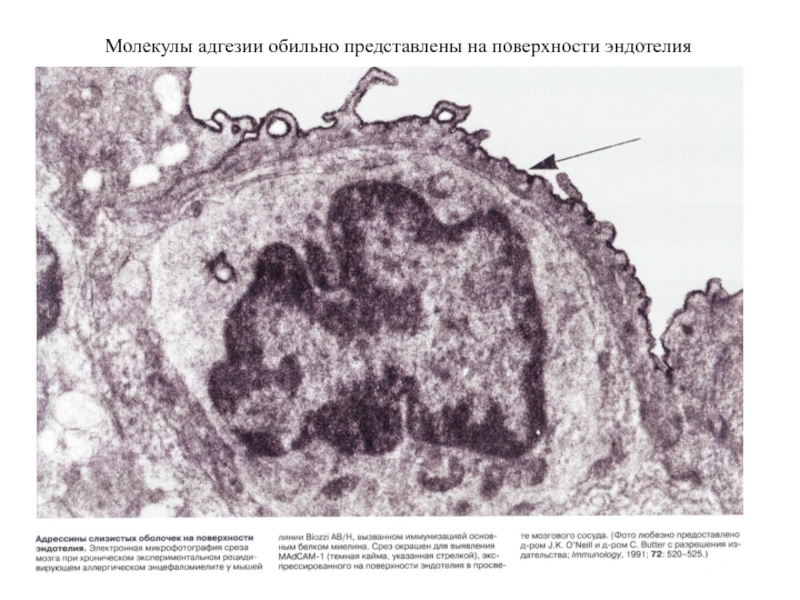
- 20. Молекулы адгезии обильно представлены на поверхности эндотелия
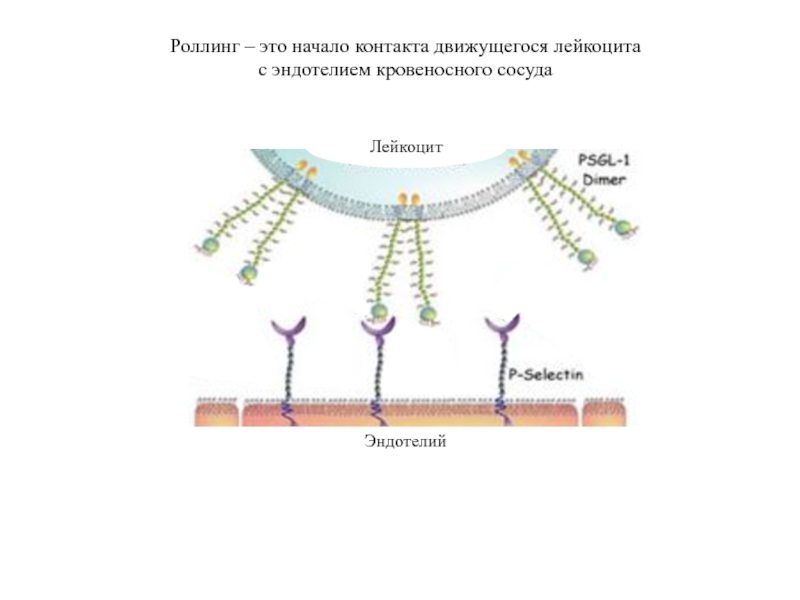
- 21. Роллинг – это начало контакта движущегося лейкоцита с эндотелием кровеносного сосуда
- 22. PSGL-1 лиганд селектина, покрашен красным
- 23. Адгезия лейкоцита на эндотелии, распластывание и
- 24. ИНТЕГРИНЫ белки клеточной мембраны, использующиеся для
- 25. FIG 13.7 Domain architecture of integrins. (
- 26. ЛИГАНДЫ ИНТЕГРИНОВ (молекулы клеточной адгезии, Cell Adhesion Molecules)
- 28. Активация лейкоцита (например, ИЛ-8) приводит к активации
- 29. Figure 1. The three overall integrin conformational
- 31. Интегрин представляет собой редкий случай, когда мембранная
- 32. Лейкоцит (зеленый) протискивается между клетками эндотелия (PECAM –красный) Парацеллюлярный транспорт лейкоцитов через эндотелий
- 33. Во время прохождения между эндотелиальными клетками
- 34. Schematic view of the movement of the
- 35. Трансцеллюлярный переход лейкоцитов сквозь эндотелий Лейкоциты –
- 36. Для прохождения сквозь эндотелиальную клетку лейкоцит использует
- 37. Кроме прохождения слоя эндотелиальных клеток, лейкоцит должен пройти сквозь базальную мембрану и слой перицитов
- 38. Везде Кишечник Панкреас Почки Печень Селезенка Костный
- 39. В стенке венулы базальная мембрана имеет небольшие
- 40. Перициты (P) – особый тип клеток, они
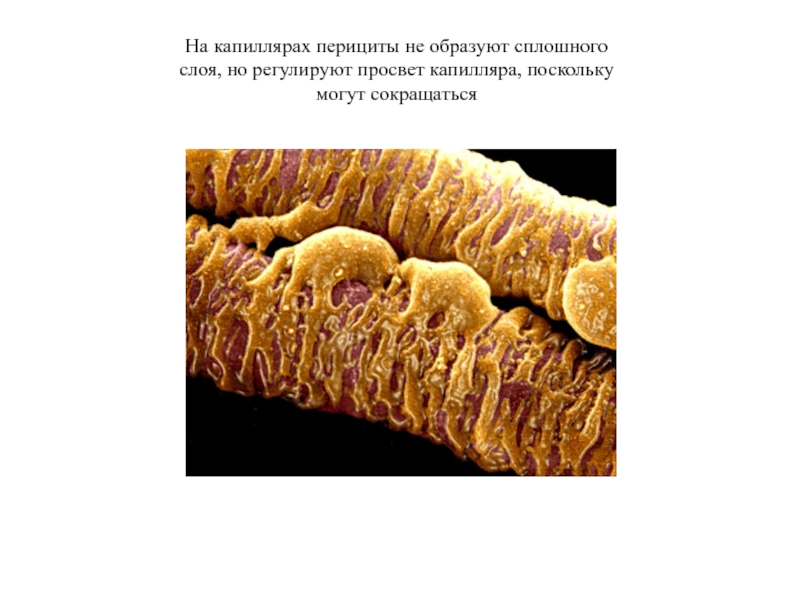
- 41. На капиллярах перициты не образуют сплошного слоя, но регулируют просвет капилляра, поскольку могут сокращаться
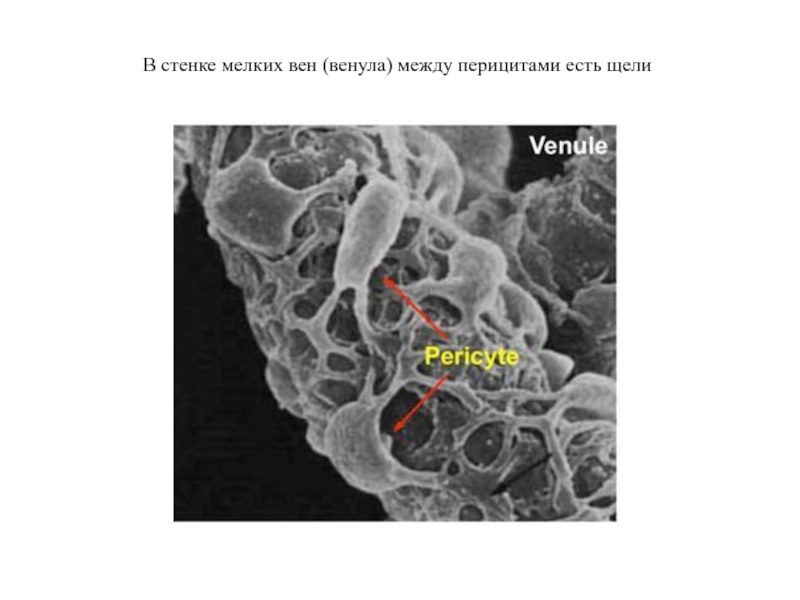
- 42. В стенке мелких вен (венула) между перицитами есть щели
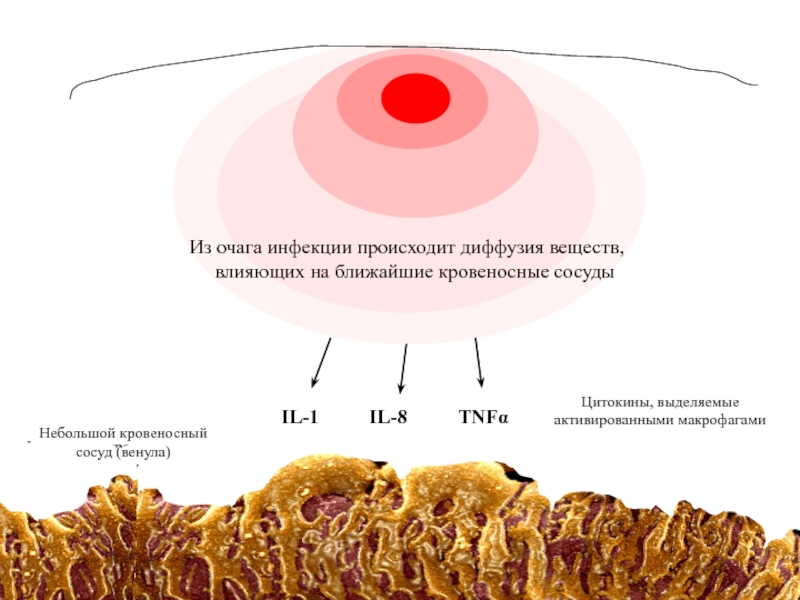
- 43. Из
- 44. Эндотелий
- 45. Перициты и клетки эндотелия активно участвуют
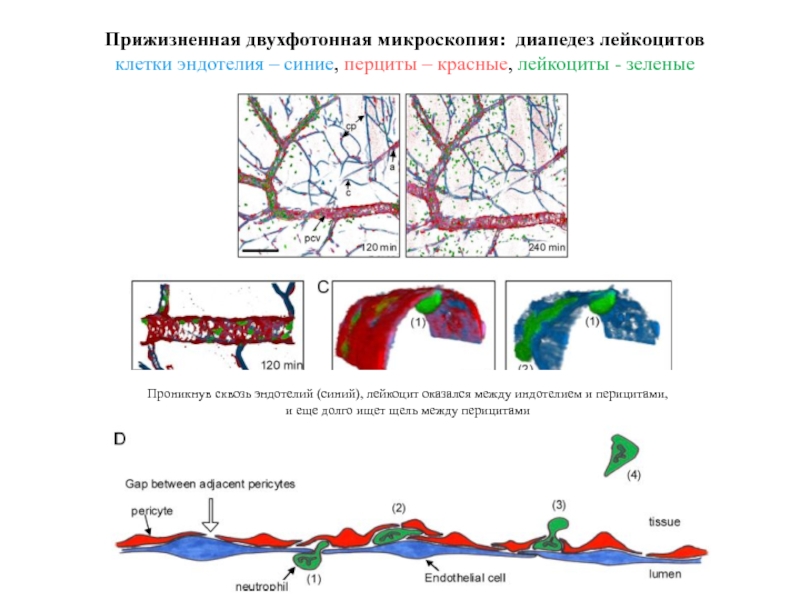
- 46. Прижизненная двухфотонная микроскопия: диапедез лейкоцитов клетки эндотелия
- 47. Cell movement 4
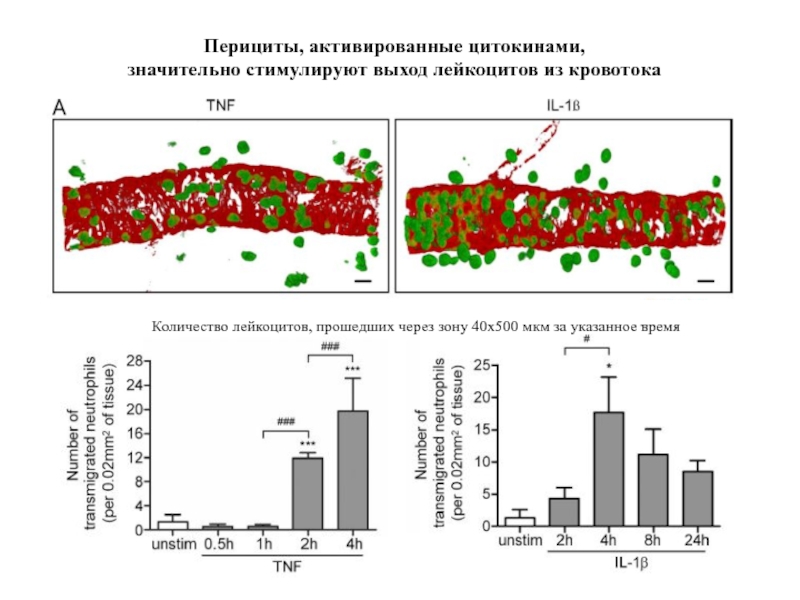
- 48. Перициты, активированные цитокинами, значительно стимулируют выход
- 49. Свершилось чудо: из целого сосуда вышли защитные
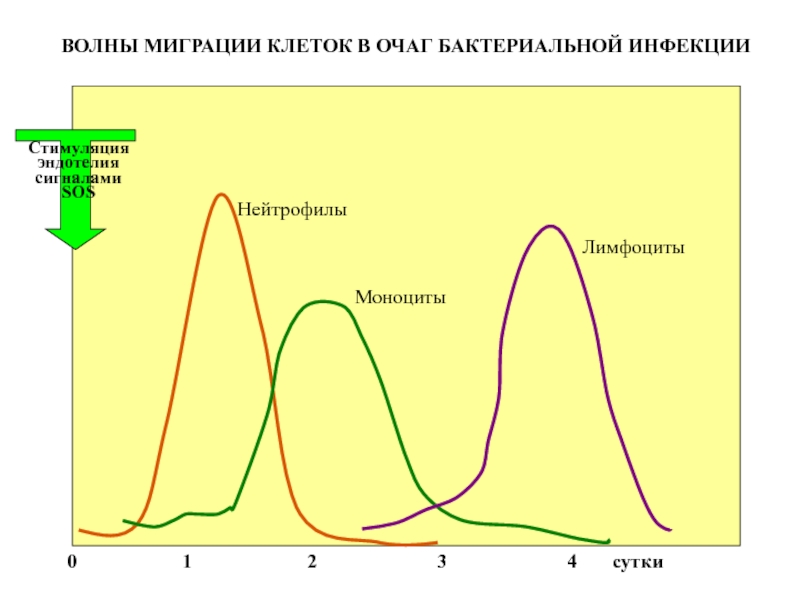
- 50. Нейтрофилы Моноциты Лимфоциты
- 51. Миниконкурс на лучшую идею, как устроить
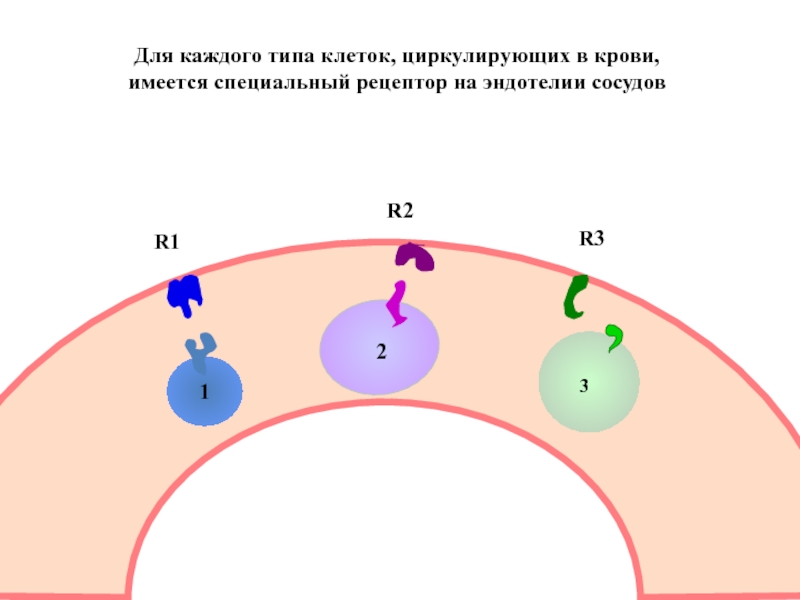
- 52. 1
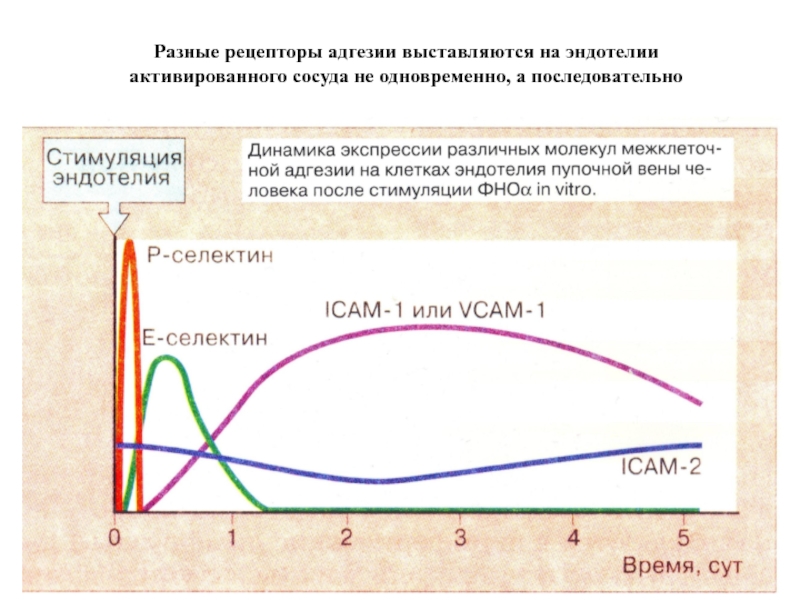
- 53. Разные рецепторы адгезии выставляются на эндотелии активированного сосуда не одновременно, а последовательно
- 54. 1
- 55. + Разнообразие интегринов 18 разновидностей α-цепи
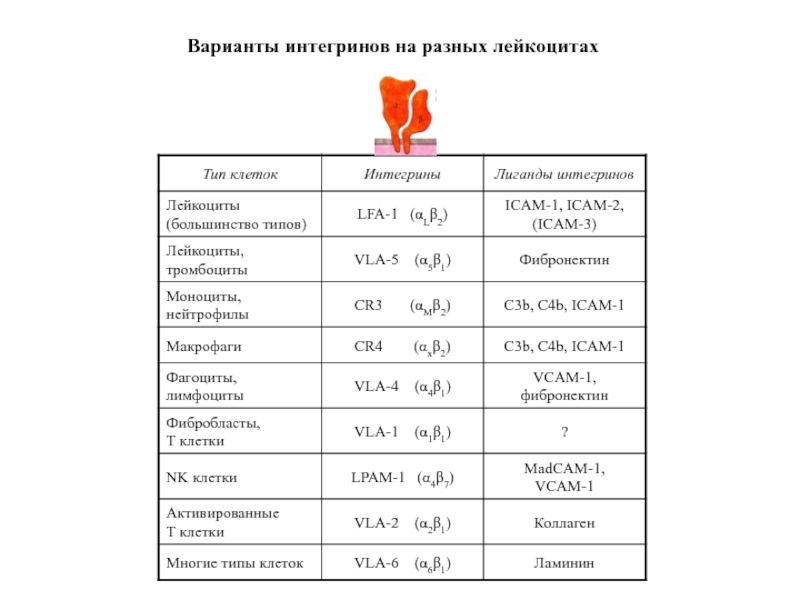
- 56. Варианты интегринов на разных лейкоцитах
- 57. Нейтрофилы Моноциты Лимфоциты
- 58. Нейтрофильные гранулоциты Макрофаги B1 лимфоциты Последовательная
- 59. Волны миграции NK, CD4 и CD8 лимфоцитов
- 60. Необходимые составляющие выхода лейкоцитов из кровотока в
- 62. Регуляция проницаемости сосудов для растворимых веществ
- 63. Дилатация Увеличение проницаемости для крупных молекул
- 64. Жидкая часть крови фильтруется в ткань через
- 65. Фильтрационное давление (ФД) обеспечивает фильтрацию жидкости в
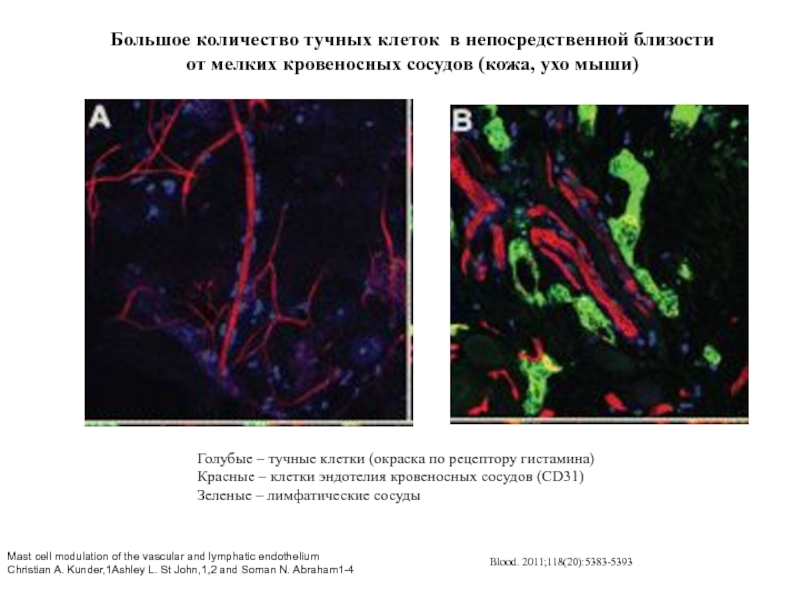
- 66. Большое количество тучных клеток в непосредственной близости
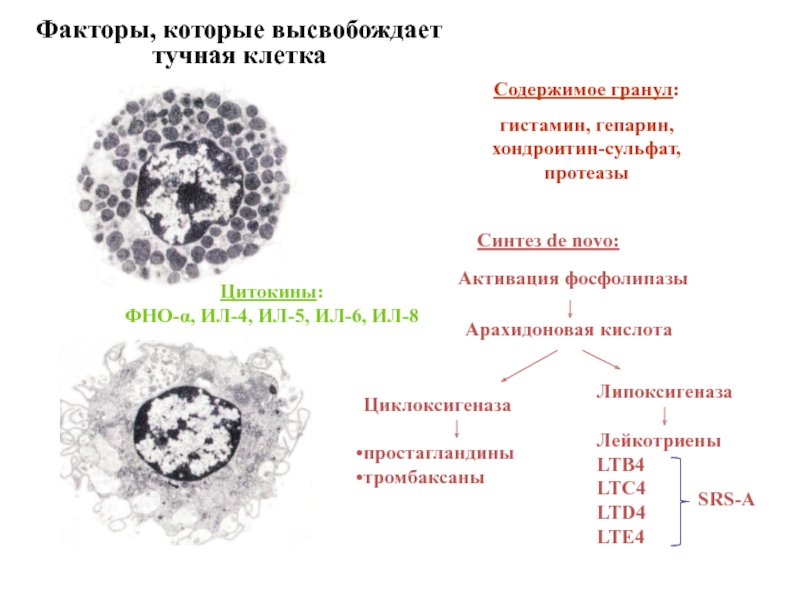
- 67. Факторы, которые высвобождает тучная клетка Содержимое
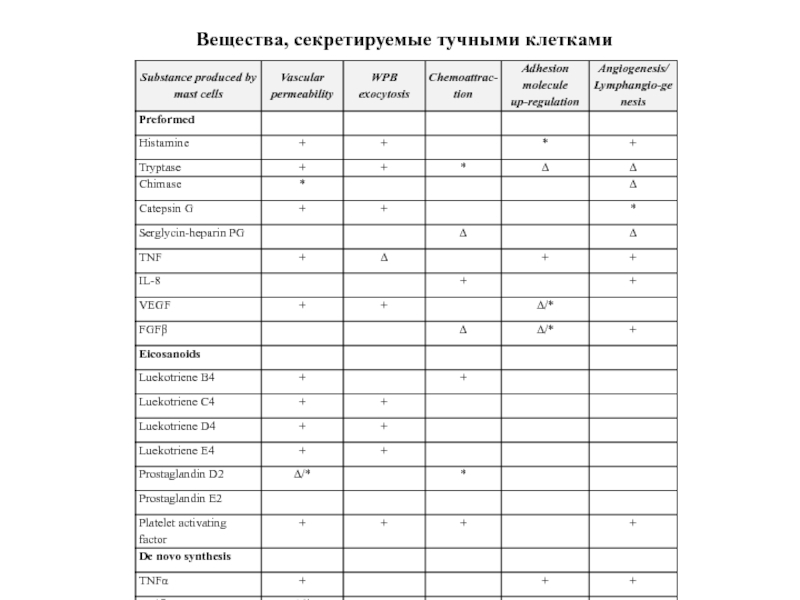
- 68. Вещества, секретируемые тучными клетками
- 69. Дефенсины вызывают дегрануляцию тучных клеток: действуют
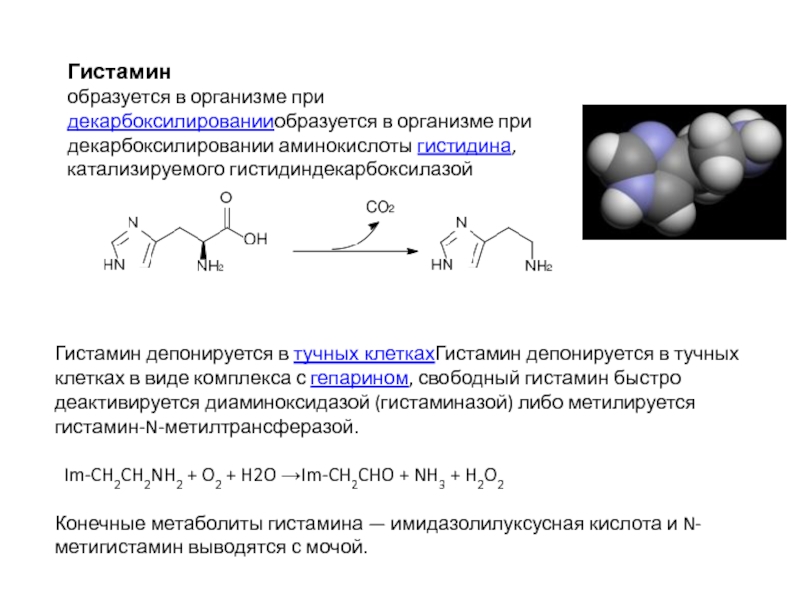
- 70. Гистамин образуется в организме при декарбоксилированииобразуется в
- 71. Рецепторы гистамина В организме существуют специфические
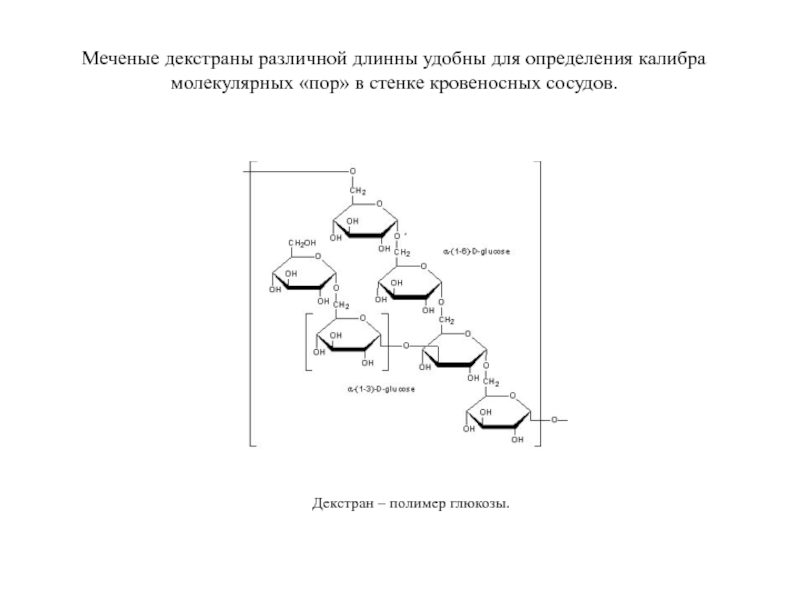
- 72. Меченые декстраны различной длинны удобны
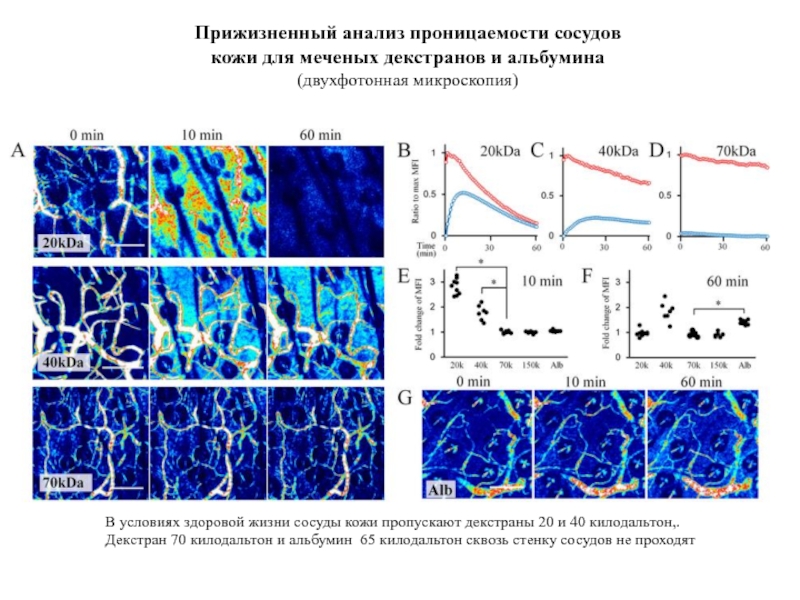
- 73. Прижизненный анализ проницаемости сосудов кожи для меченых
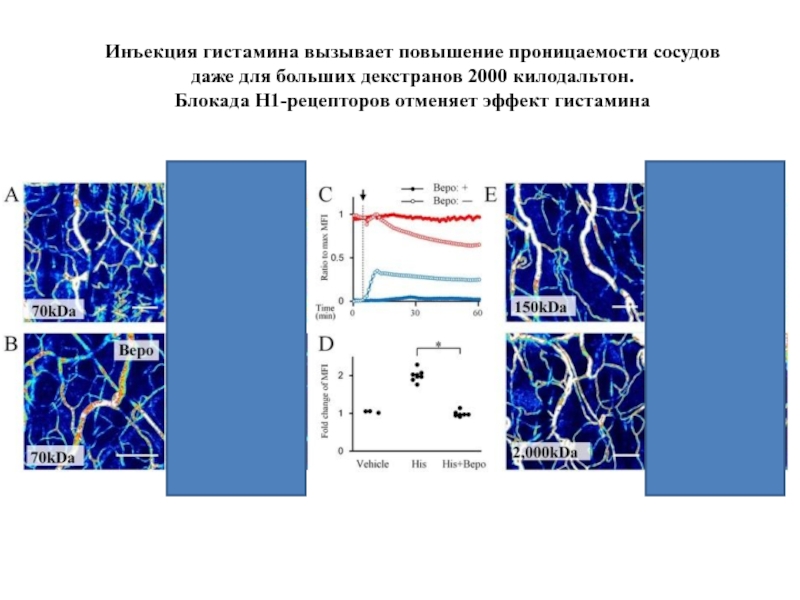
- 74. Инъекция гистамина вызывает повышение проницаемости сосудов даже
- 75. (A) Microvasculature in the ear skin. Arteriole
- 76. Просвет мелкой вены
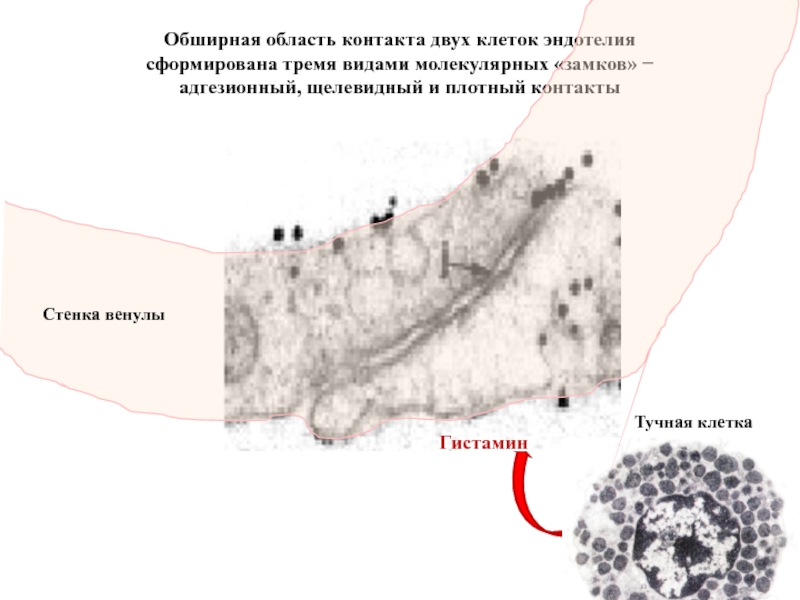
- 77. Обширная область контакта двух клеток эндотелия
- 78. Mehta D , and Malik A B
- 79. Сигнальные пути, приводящие к нарушению контактов между клетками эндотелия
- 80. Проницаемость контактов между клетками эндотелия повышается Из
- 81. C-реактивный белок (~120 kD), маннан-связывающий
- 82. Небольшой кровеносный
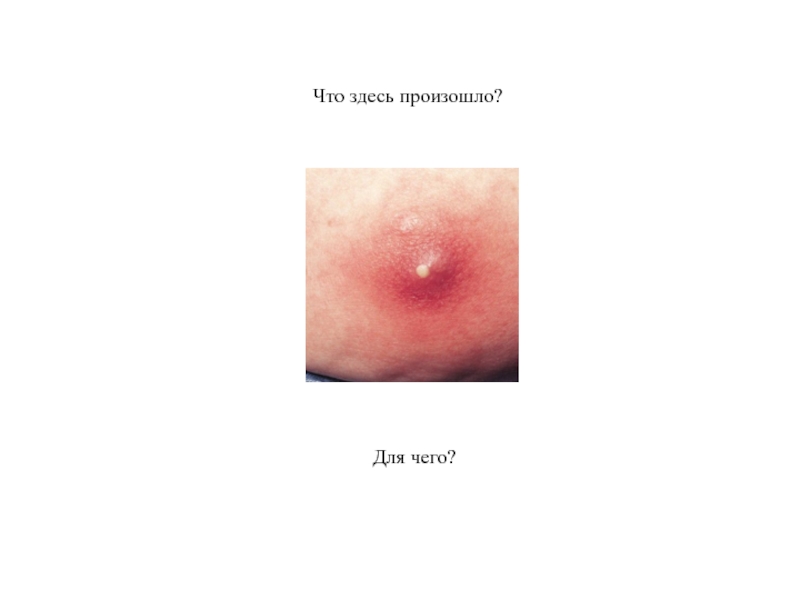
- 83. Что здесь произошло? Для чего?
- 84. Помимо местных событий в инфицированной ткани
- 85. Цитокины из очага воспаления попадают в кровь.
- 86. Системные эффекты цитокинов и других медиаторов воспаления
- 87. Общая логика воспаления 1. Реакция системная –
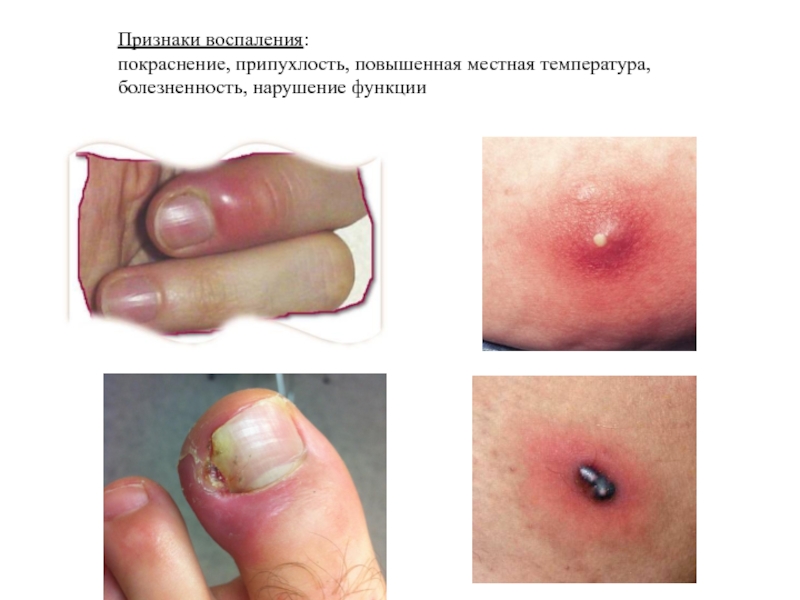
Слайд 2Признаки воспаления:
покраснение, припухлость, повышенная местная температура,
болезненность, нарушение функции
Слайд 3Воспаление – это защитная реакция, которая развивается, когда местная (пограничная) защита
При воспалении защиту осуществляет весь организм.
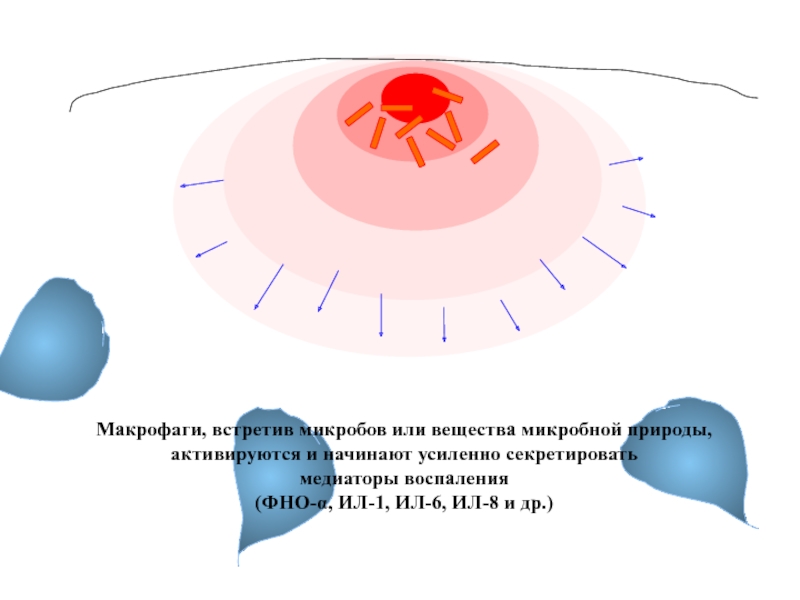
Слайд 4
Макрофаги, встретив микробов или вещества микробной природы,
активируются и начинают усиленно
медиаторы воспаления
(ФНО-α, ИЛ-1, ИЛ-6, ИЛ-8 и др.)
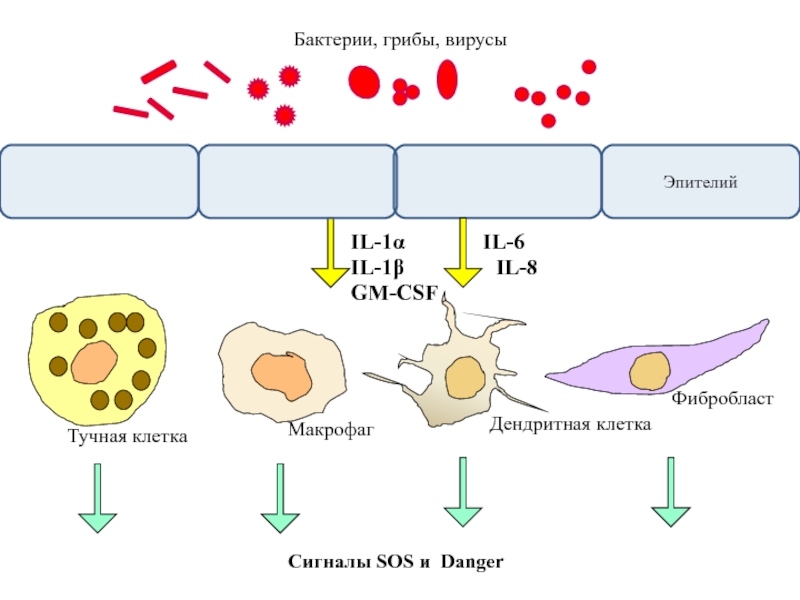
Слайд 9
IL-1α
IL-1β
IL-6
IL-8
GM-CSF
Фибробласт
Макрофаг
Дендритная клетка
Тучная клетка
Сигналы SOS и Danger
Бактерии, грибы, вирусы
Слайд 10
Из очага инфекции происходит диффузия веществ, влияющих на ближайшие кровеносные
В результате изменения сосудов из крови в пораженную ткань выходят защитные молекулы и клетки. В этом суть реакции воспаления.
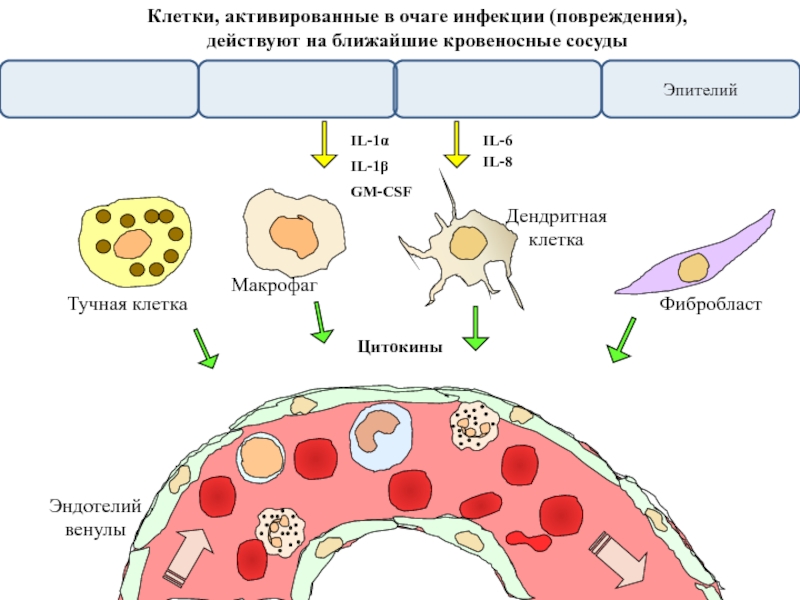
Слайд 11
Эндотелий
венулы
IL-1α
IL-1β
IL-6
IL-8
GM-CSF
Фибробласт
Макрофаг
Дендритная
клетка
Тучная клетка
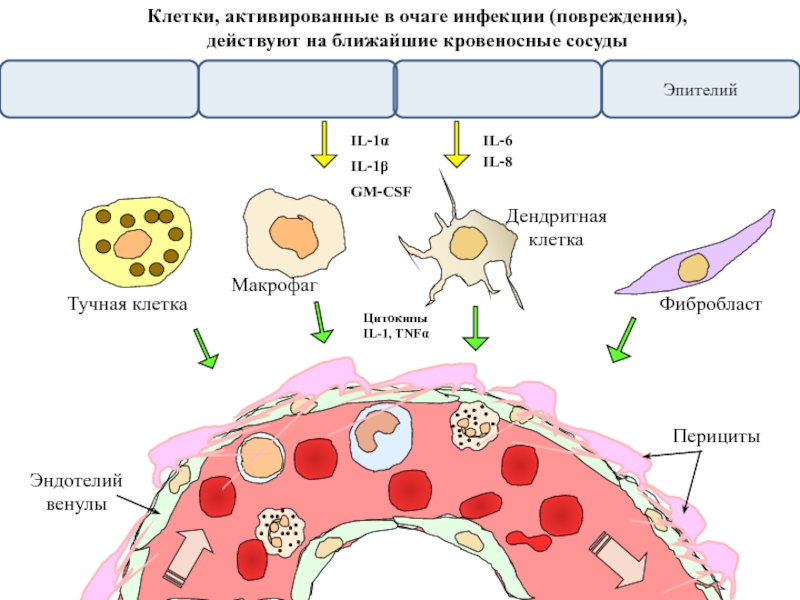
Клетки, активированные в очаге инфекции (повреждения),
действуют на ближайшие кровеносные
Цитокины
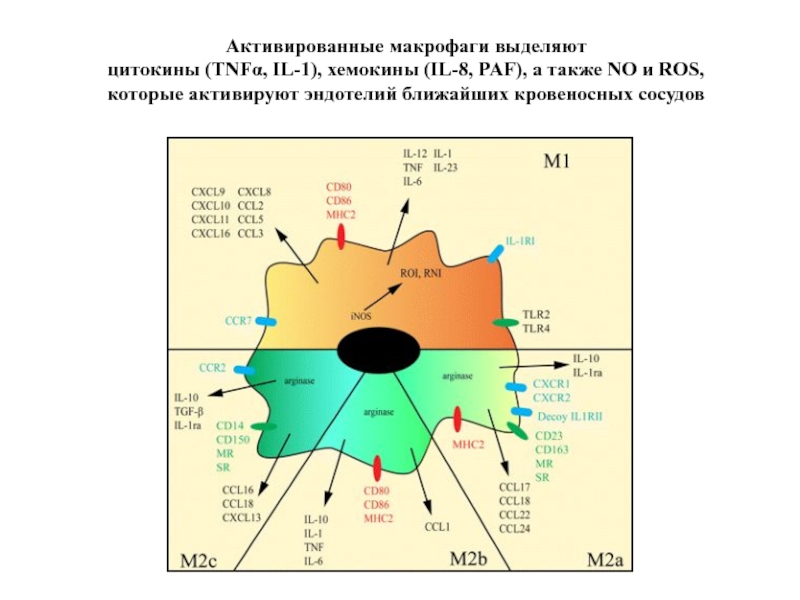
Слайд 12Активированные макрофаги выделяют
цитокины (TNFα, IL-1), хемокины (IL-8, PAF), а также
которые активируют эндотелий ближайших кровеносных сосудов
Слайд 13Кровеносные сосуды всегда рядом с очагом инфекции, на расстоянии нескольких клеточных
Слайд 14
Просвет кровеносного сосуда
Лейкоцит
Лейкоциты выходят из кровотока и мигрируют в очаг инфекции,
Источник хемокинов -
активированные макрофаги, тучные
и другие клетки в очаге инфекции
Слайд 15Последовательные стадии выхода лейкоцита из кровотока в ткань
S-Lex
VCAM-1
L-selectin
P-selectin
S-Lex
VCAM-1
Chemokines
PAF
ICAM-1
ICAM-2
VCAM
ICAM-1
(ICAM-2)
PECAM-1
CD99
Heparan-
sulfate
proteoglycan
Laminin
Fibrinogen
Fibronectin
Endothelial or
ECM
Слайд 16Всеми стадиями выхода лейкоцитов из кровотока управляют цитокины, молекулы межклеточной адгезии,
Слайд 17
Гликолипид – в мембране нейтрофила, является рецептором Е-селектина :
NeuAcα2-3Galβ1-4GlcNAcβ1-3[Galβ1-4(Fucα1-3)GlcNAcβ1-3]2[Galβ1-4GlcNAcβ1-3]2Galβ1-4Glcβ-Ceramide
Е-селектин
P-селектин
Лейкоцит
Эндотелий
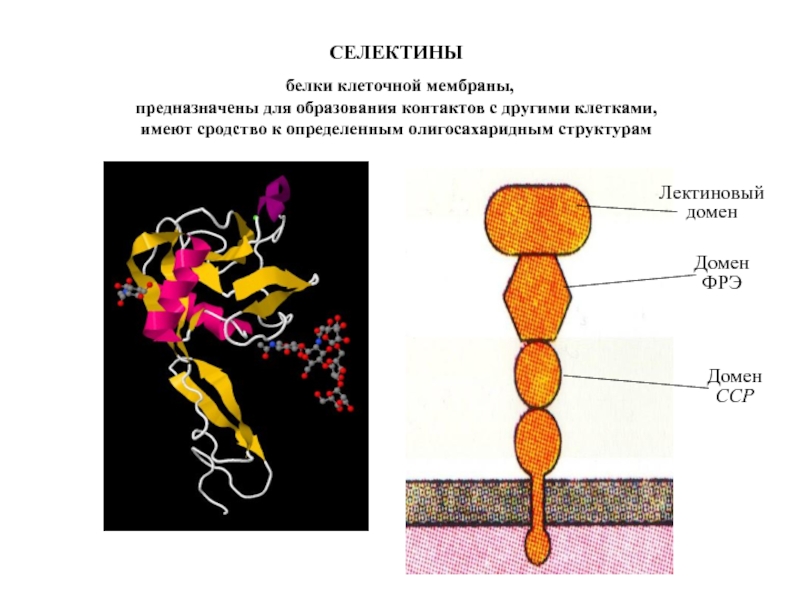
Слайд 18СЕЛЕКТИНЫ
белки клеточной мембраны,
предназначены для образования контактов с другими клетками,
имеют сродство к определенным олигосахаридным структурам
Лектиновый
домен
Домен
ФРЭ
Домен
CCP
Слайд 23Адгезия лейкоцита на эндотелии, распластывание и
движение по поверхности эндотелиальной клетки
определяются взаимодействием другой пары молекул –
интегрина и лиганда интегрина (CAM, от cell adhesion molecules)
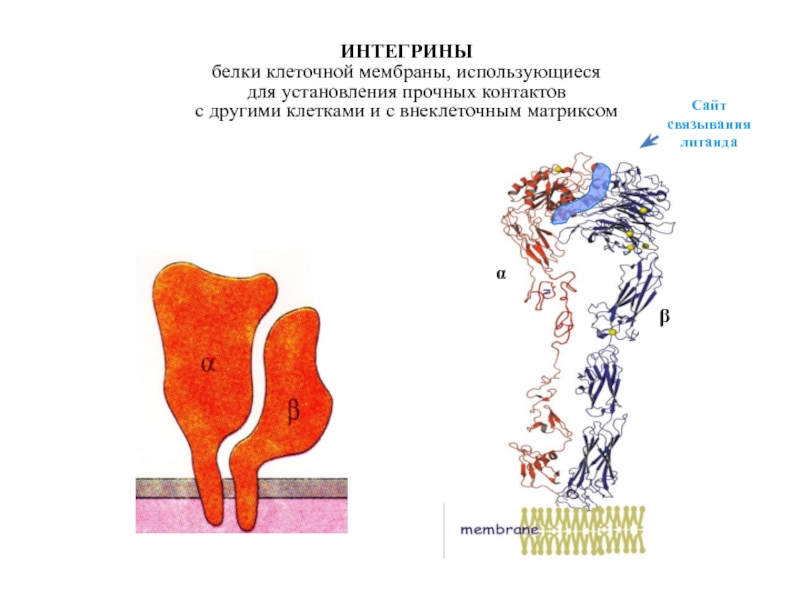
Слайд 24ИНТЕГРИНЫ
белки клеточной мембраны, использующиеся
для установления прочных контактов
с другими клетками
Сайт
связывания
лиганда
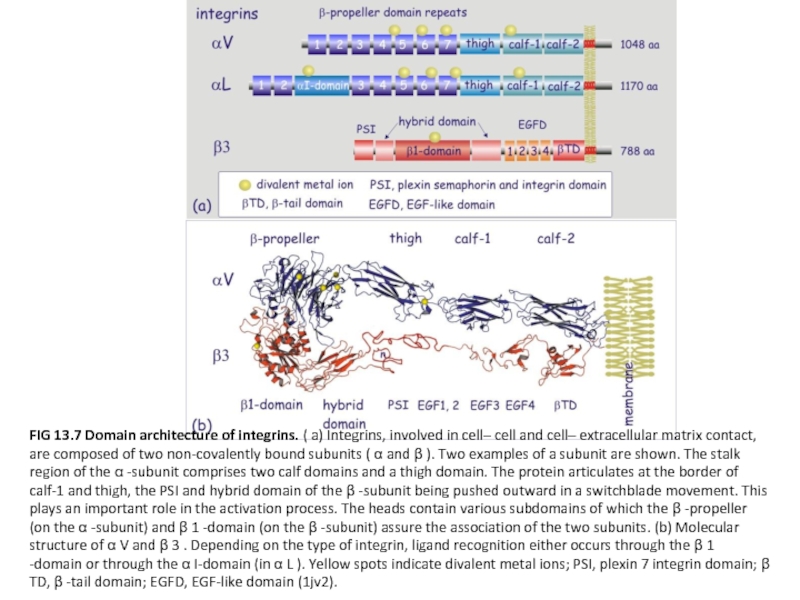
Слайд 25FIG 13.7 Domain architecture of integrins. ( a) Integrins, involved in
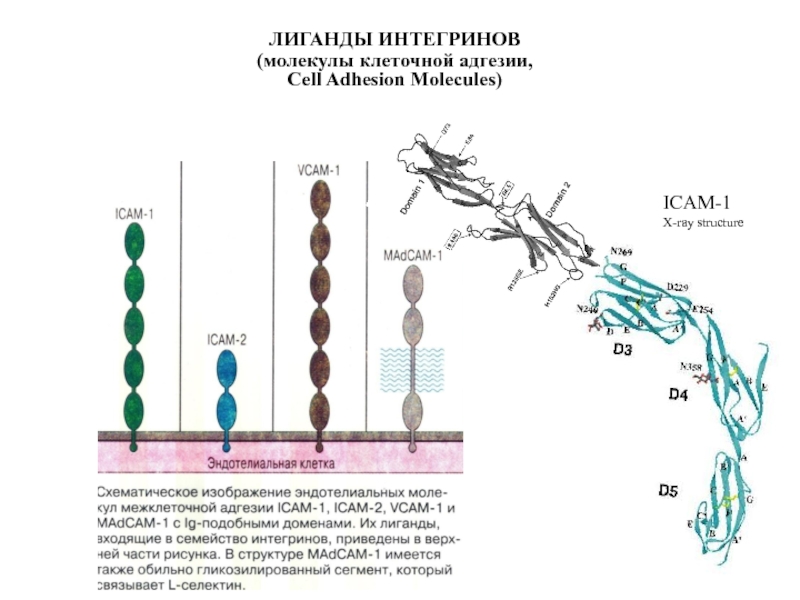
Слайд 27
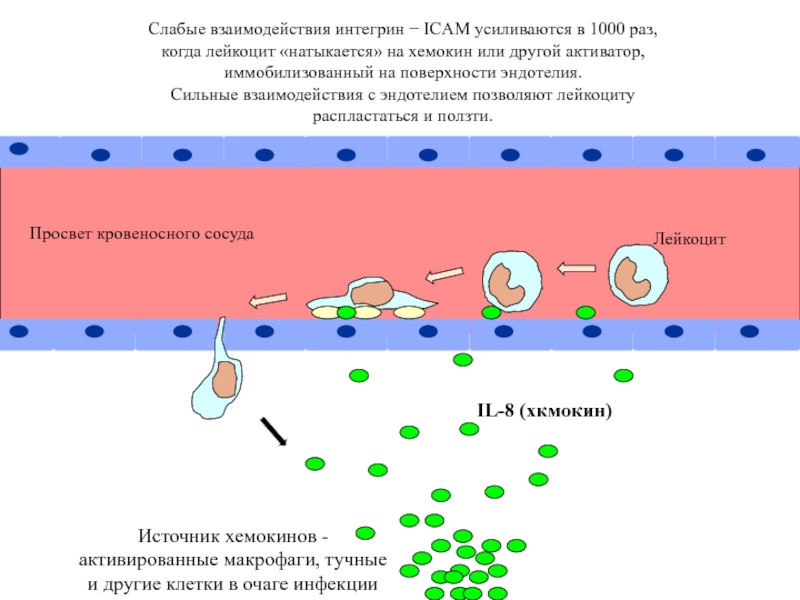
Просвет кровеносного сосуда
Лейкоцит
Слабые взаимодействия интегрин − ICAM усиливаются в 1000 раз,
когда лейкоцит «натыкается» на хемокин или другой активатор,
иммобилизованный на поверхности эндотелия.
Сильные взаимодействия с эндотелием позволяют лейкоциту
распластаться и ползти.
Источник хемокинов -
активированные макрофаги, тучные
и другие клетки в очаге инфекции
IL-8 (хкмокин)
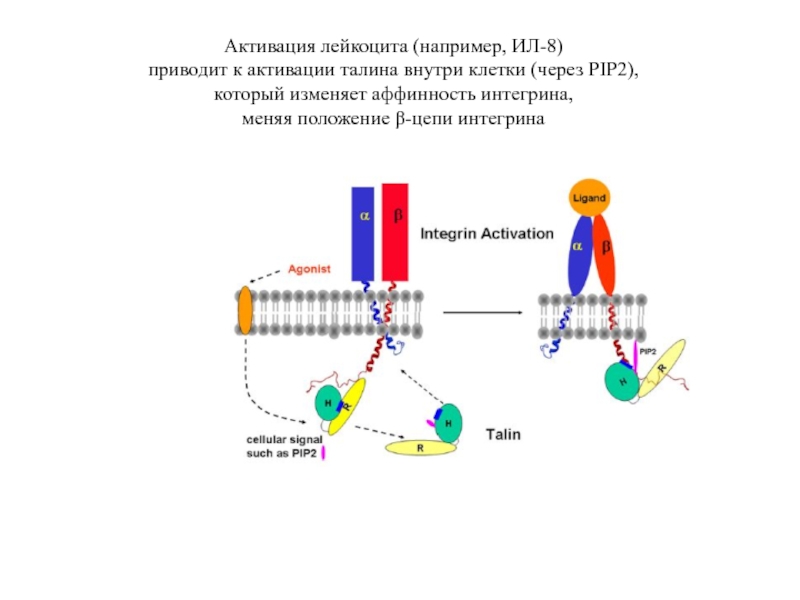
Слайд 28Активация лейкоцита (например, ИЛ-8)
приводит к активации талина внутри клетки (через PIP2),
который изменяет аффинность интегрина,
меняя положение β-цепи интегрина
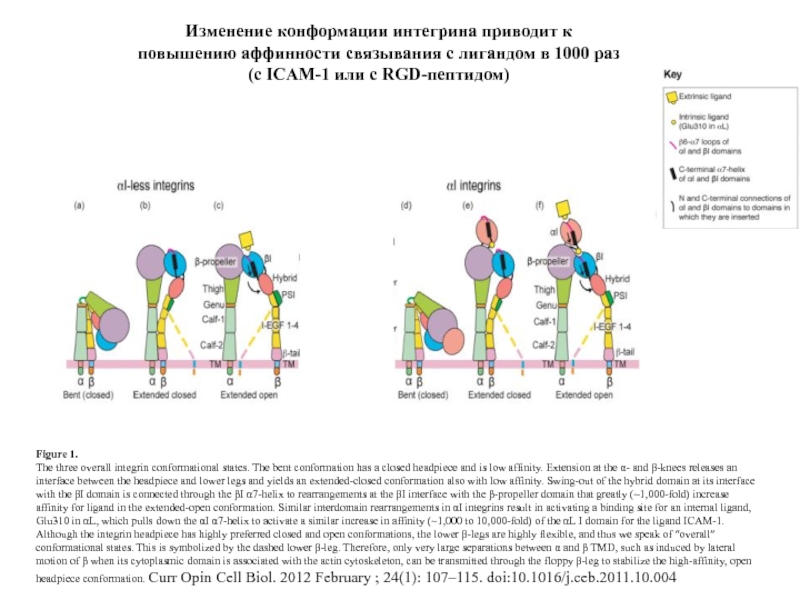
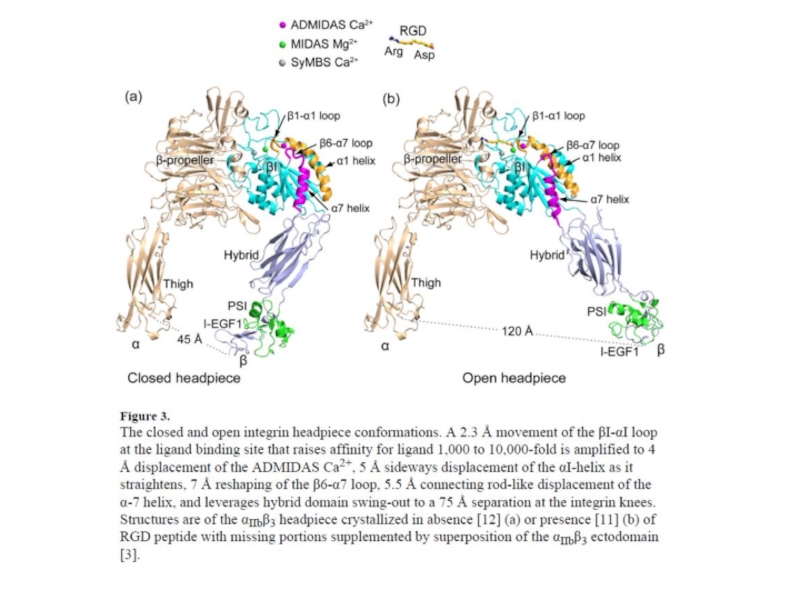
Слайд 29Figure 1.
The three overall integrin conformational states. The bent conformation has
headpiece conformation. Curr Opin Cell Biol. 2012 February ; 24(1): 107–115. doi:10.1016/j.ceb.2011.10.004
Изменение конформации интегрина приводит к
повышению аффинности связывания с лигандом в 1000 раз
(с ICAM-1 или с RGD-пептидом)
Слайд 31Интегрин представляет собой редкий случай, когда мембранная молекула сигналит в двух
Изнутри – наружу (Inside – out)
Внутри клетки сигнал с G-белка меняет таллин и актиновые филаменты, что раздвигает ножки интегрина, повышая аффинность внеклеточной части в 1000 раз
Снаружи – внутрь (Outside – in)
Высокоаффинное связывание с лигандом вызывает кластеризацию интегрина, что формирует сигнал внутри клетки.
Лейкоцит не просто распластывается. Он сильно активируется («взрыв» продукции ROS и других противоинфекционных веществ).
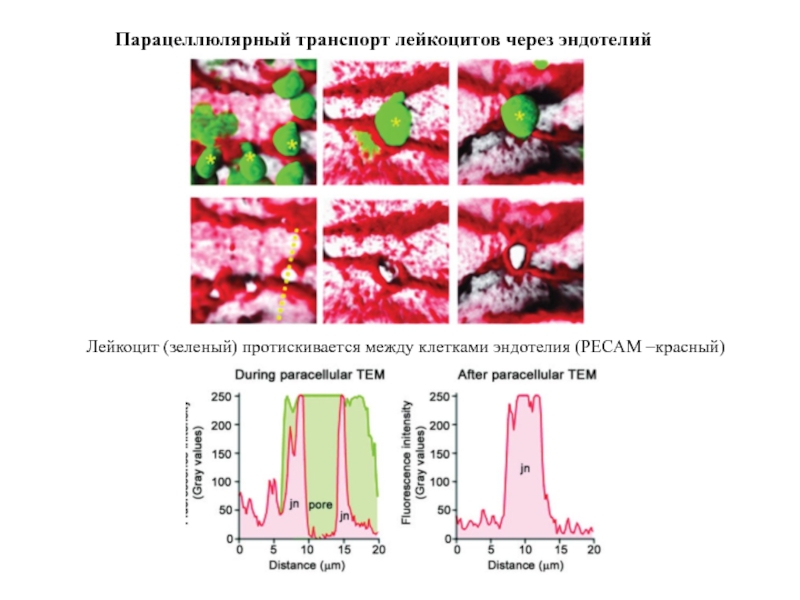
Слайд 32Лейкоцит (зеленый) протискивается между клетками эндотелия (PECAM –красный)
Парацеллюлярный транспорт лейкоцитов через
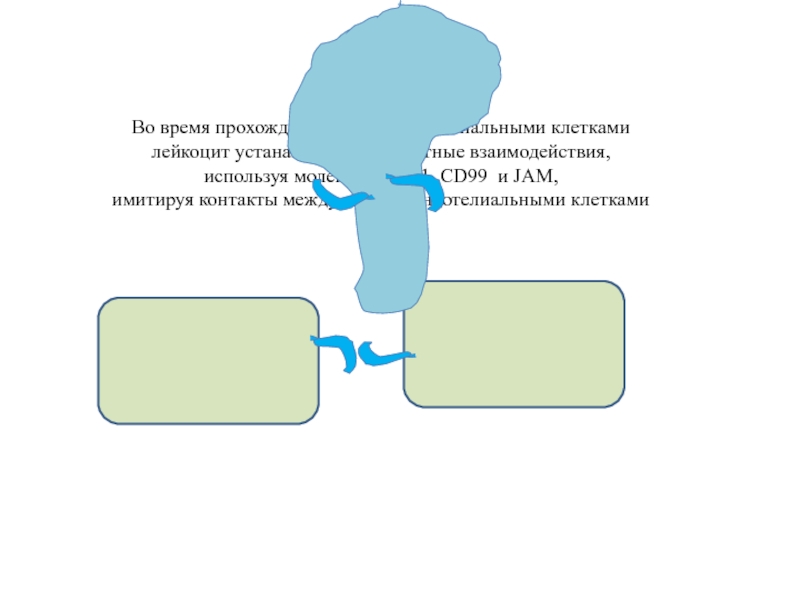
Слайд 33Во время прохождения между эндотелиальными клетками
лейкоцит устанавливает контактные взаимодействия,
используя
имитируя контакты между самими эндотелиальными клетками
Слайд 34Schematic view of the movement of the lateral border recycling compartment
В эндотелиальной клетке есть резерв адгезионных молекул для обновления контактов между соседними клетками эндотелия – пузырьки с мембранными молекулами PECAM, CD99, JAM (lateral border recycling compartment, LBRC).
Лейкоцит «подзывает» эти пузырьки к месту своего контакта с эндотелиальной клеткой и получает необходимое количество мембранных молекул для установления контактов с обеими эндотелиальными клетками
Прокатился за чужой счет
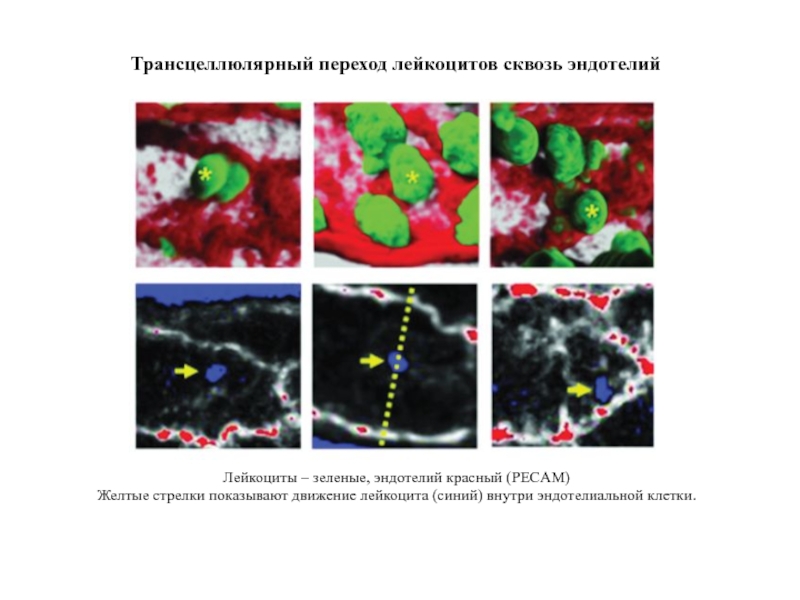
Слайд 35Трансцеллюлярный переход лейкоцитов сквозь эндотелий
Лейкоциты – зеленые, эндотелий красный (PECAM)
Желтые стрелки
Слайд 36Для прохождения сквозь эндотелиальную клетку лейкоцит использует
тот же трюк с
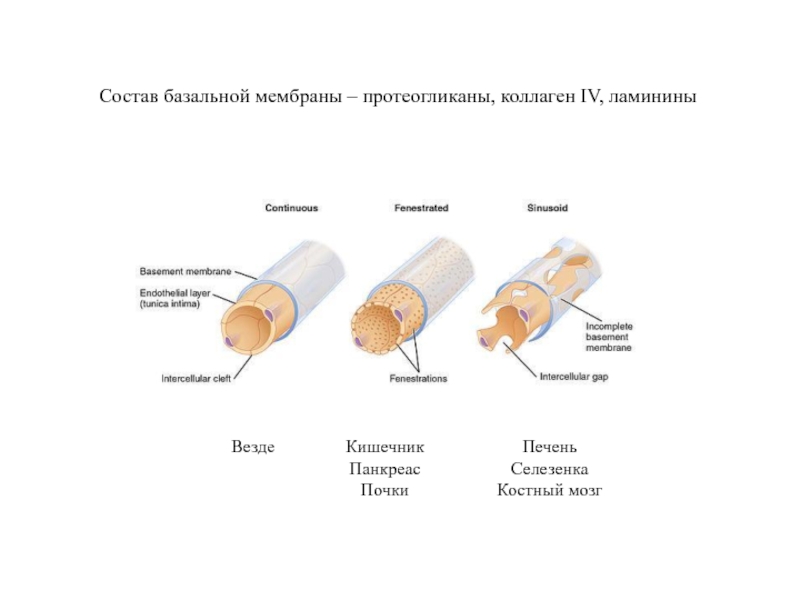
Слайд 37Кроме прохождения слоя эндотелиальных клеток,
лейкоцит должен пройти сквозь базальную мембрану
Слайд 38Везде
Кишечник
Панкреас
Почки
Печень
Селезенка
Костный мозг
Состав базальной мембраны – протеогликаны, коллаген IV, ламинины
Слайд 39В стенке венулы базальная мембрана имеет небольшие дефекты
(matrix proteins low expression
Под влиянием IL-1β дефекты увеличиваются. Именно в эти микроскопические щели и выползают нейтрофилы.
Средний размер щели
8-10 кв. мкм (4 x 2 мкм)
После IL-1β щели увеличиваются
Средний размер щели
14-18 кв. мкм (5 x 3 мкм)
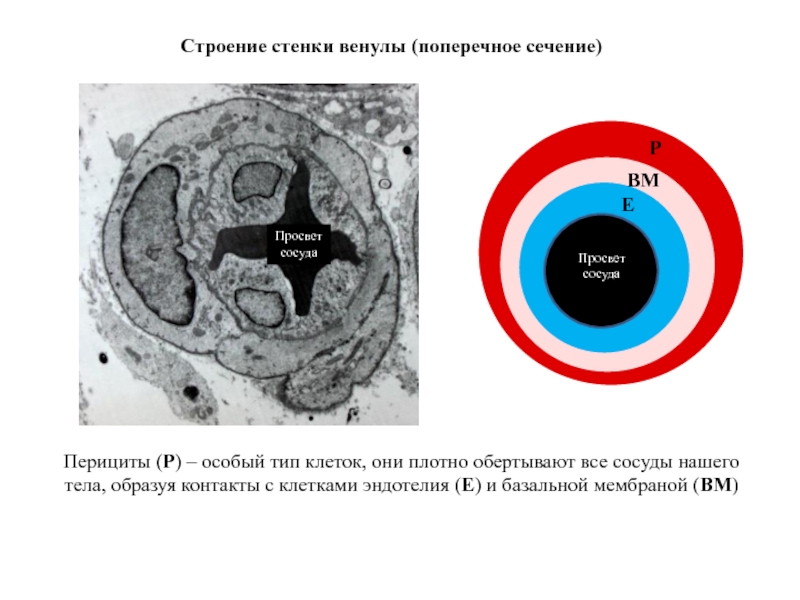
Слайд 40Перициты (P) – особый тип клеток, они плотно обертывают все сосуды
Строение стенки венулы (поперечное сечение)
Слайд 41На капиллярах перициты не образуют сплошного слоя, но регулируют просвет капилляра,
Слайд 43
Из очага инфекции происходит диффузия веществ, влияющих на ближайшие кровеносные сосуды
Небольшой
сосуд (венула)
Цитокины, выделяемые
активированными макрофагами
Небольшой кровеносный
сосуд (венула)
Цитокины, выделяемые
активированными макрофагами
Слайд 44
Эндотелий
венулы
IL-1α
IL-1β
IL-6
IL-8
GM-CSF
Фибробласт
Макрофаг
Дендритная
клетка
Тучная клетка
Клетки, активированные в очаге инфекции (повреждения),
действуют на ближайшие кровеносные
Цитокины
IL-1, TNFα
Перициты
Слайд 45Перициты и клетки эндотелия активно участвуют
в траспорте лейкоцитов сквозь стенку
В ответ на цитокины IL-1, TNFα и другие сигналы из очага инфекции
перициты и клетки эндотелия сосудов усиливают экспрессию адгезионных молекул
для лейкоцитов и продукцию факторов хемотаксиса, привлекающих лейкоциты из кровотока
Слайд 46Прижизненная двухфотонная микроскопия: диапедез лейкоцитов
клетки эндотелия – синие, перциты – красные,
Проникнув сквозь эндотелий (синий), лейкоцит оказался между индотелием и перицитами,
и еще долго ищет щель между перицитами
Слайд 48Перициты, активированные цитокинами,
значительно стимулируют выход лейкоцитов из кровотока
Количество лейкоцитов, прошедших
Слайд 49Свершилось чудо: из целого сосуда вышли защитные клетки – лейкоциты.
Ни эритроциты,
Следовательно, целостность стенки сосуда действительно была сохранена.
Лейкоциты вышли точно в том месте, где они нужны для защиты. Больше нигде в организме этого не произошло. Очень полезное событие и очень точное по локализации.
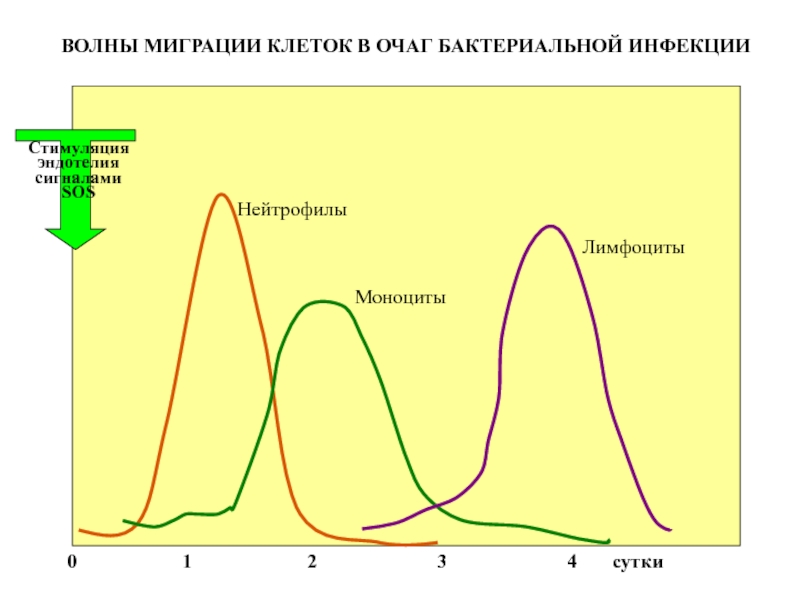
Мало того, в первый день вышли одни защитники, во второй – другие,
в третий – третьи. Это еще одно удивительное чудо.
Слайд 50
Нейтрофилы
Моноциты
Лимфоциты
Стимуляция
эндотелия
сигналами SOS
0
ВОЛНЫ МИГРАЦИИ КЛЕТОК В ОЧАГ БАКТЕРИАЛЬНОЙ ИНФЕКЦИИ
Слайд 51Миниконкурс на лучшую идею, как устроить
очередное чудо – волны миграции
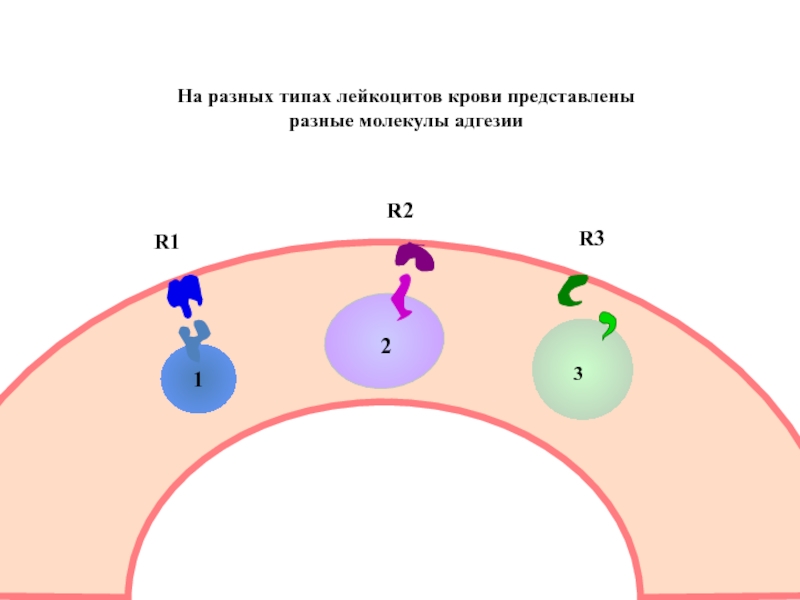
Слайд 52
1
2
3
R1
R2
R3
Для каждого типа клеток, циркулирующих в крови,
имеется специальный рецептор на
Слайд 53Разные рецепторы адгезии выставляются на эндотелии активированного сосуда не одновременно, а
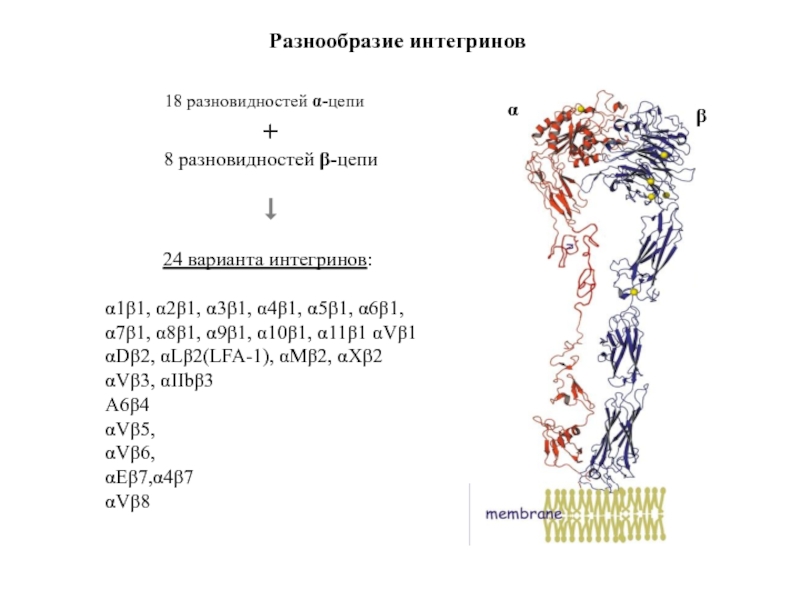
Слайд 55+
Разнообразие интегринов
18 разновидностей α-цепи
8 разновидностей β-цепи
24 варианта интегринов:
α1β1, α2β1, α3β1,
αDβ2, αLβ2(LFA-1), αMβ2, αXβ2
αVβ3, αIIbβ3
Α6β4
αVβ5,
αVβ6,
αEβ7,α4β7
αVβ8
Слайд 57
Нейтрофилы
Моноциты
Лимфоциты
Стимуляция
эндотелия
сигналами SOS
0
ВОЛНЫ МИГРАЦИИ КЛЕТОК В ОЧАГ БАКТЕРИАЛЬНОЙ ИНФЕКЦИИ
Слайд 58Нейтрофильные гранулоциты
Макрофаги
B1 лимфоциты
Последовательная
миграция гранулоцитов,
макрофагов и лимфоцитов
в очаг воспаления
(экспериментальное
воспаление в брюшной полости мыши)
дни
дни
дни
Млн.
клеток
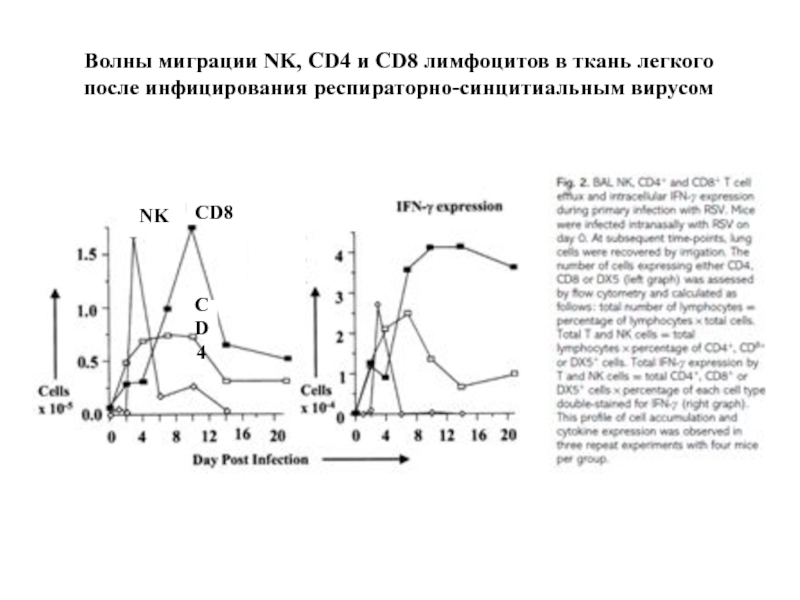
Слайд 59Волны миграции NK, CD4 и CD8 лимфоцитов в ткань легкого
после инфицирования
NK
CD8
CD4
Слайд 60Необходимые составляющие выхода лейкоцитов из кровотока в ткань
1. Активирующий цитокин из
3. Активирующие вещества (цитокины, гистамин) должны вызвать повреждение плотных контактов (tight junctions) между клетками эндотелия
2. Активирующие вещества (цитокины) должны вызвать экспрессию адгезионных молекул на поверхности эндотелия.
4. Лейкоцит должен найти активирующий цитокин на поверхности эндотелия, активироваться, изменить интегрин, распластаться.
5. Лейкоцит должен почуять фактор хемотаксиса (тоже иммобилизован) и неуклонно ползти к его источнику, развивая большое механическое усилие – вспомните фильм хемотаксис с преодолением препятствия в виде пипетки.
6. Лейкоцит должен иметь молекулы, комплементарные молекулам межклеточных контактов, чтобы на время встать в монослой эндотелия, как полноценный участник этого слоя.
7. Лейкоциту необходимы молекулы для взаимодействия с перицитом – распластывание, движение, прохождение в щели между перицитами
8. Лейкоцит должен уметь проходить сквозь плотный волокнистый гель – базальную мембрану, построенную из протеогликанов и фибриллярных белков. Нужны ферменты, расплавляющие базальную мембрану. Пример – аминопептидаза (CD13), без которой моноциты не могут выходить в ткань, в частности, в брюшную полость.
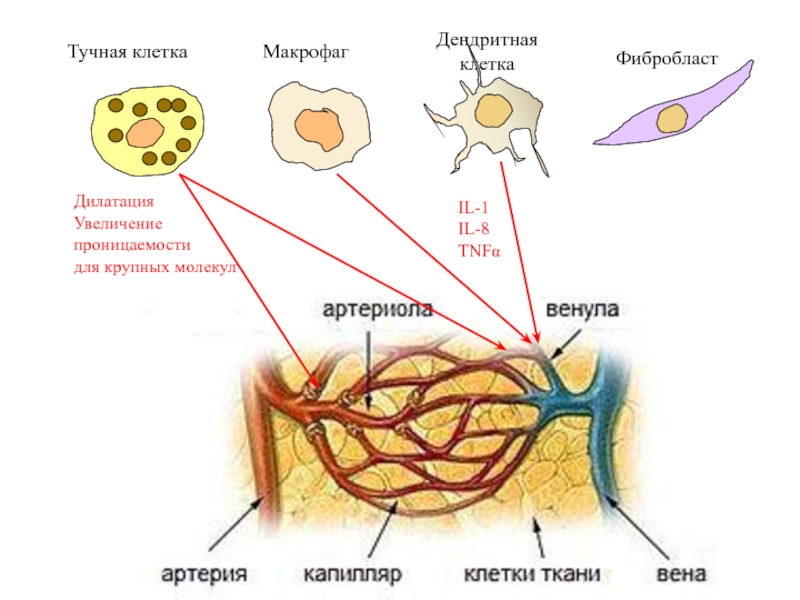
Слайд 63Дилатация
Увеличение
проницаемости
для крупных молекул
IL-1
IL-8
TNFα
Фибробласт
Макрофаг
Дендритная
клетка
Тучная клетка
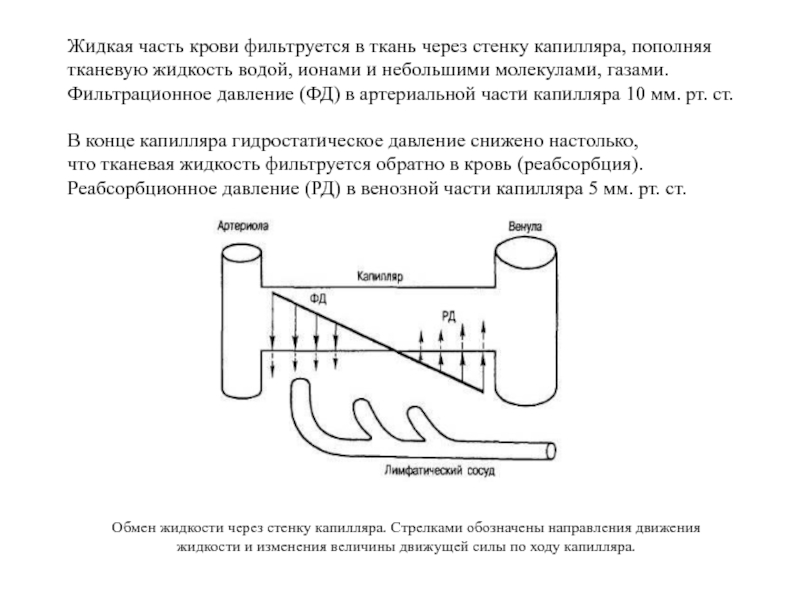
Слайд 64Жидкая часть крови фильтруется в ткань через стенку капилляра, пополняя тканевую
Фильтрационное давление (ФД) в артериальной части капилляра 10 мм. рт. ст.
В конце капилляра гидростатическое давление снижено настолько,
что тканевая жидкость фильтруется обратно в кровь (реабсорбция).
Реабсорбционное давление (РД) в венозной части капилляра 5 мм. рт. ст.
Обмен жидкости через стенку капилляра. Стрелками обозначены направления движения жидкости и изменения величины движущей силы по ходу капилляра.
Слайд 65Фильтрационное давление (ФД) обеспечивает фильтрацию жидкости в артериальном конце капилляра, в
ФД = ГДк + ОДт - ОДк = 30 + 5 - 25 = 10 (мм рт. ст.)
По мере продвижения крови по капилляру ГДк снижается до 15 мм рт.ст., поэтому силы, способствующие фильтрации, становятся меньше сил, противодействующих фильтрации. Таким образом, формируется реабсорбционное давление (РД), обеспечивающее перемещение жидкости в венозном конце изинтерстиция в капилляры.
РД = ОДк - ГДк - ОДт = 25 - 15 - 5 = 5 (мм рт.ст.)
Соотношение и направления сил, обеспечивающих фильтрацию и реабсорбцию жидкости в капиллярах, показаны на рисунке слева.
Таким образом, фильтрационное давление больше, чем реабсорбционное, но поскольку проницаемость для воды венозной части микроциркуляторного русла выше проницаемости артериального конца капилляра, то количество фильтрата лишь незначительно превышает количество реабсорбируемой жидкости; излишек воды из тканей удаляется через лимфатическую систему.
Слайд 66Большое количество тучных клеток в непосредственной близости от мелких кровеносных сосудов
Голубые – тучные клетки (окраска по рецептору гистамина)
Красные – клетки эндотелия кровеносных сосудов (CD31)
Зеленые – лимфатические сосуды
Mast cell modulation of the vascular and lymphatic endothelium
Christian A. Kunder,1Ashley L. St John,1,2 and Soman N. Abraham1-4
Blood. 2011;118(20):5383-5393
Слайд 67Факторы, которые высвобождает тучная клетка
Содержимое гранул:
гистамин, гепарин,
хондроитин-сульфат,
протеазы
Синтез de novo:
Активация фосфолипазы
Арахидоновая
Циклоксигеназа
простагландины
тромбаксаны
Липоксигеназа
Лейкотриены
LTB4
LTC4
LTD4
LTE4
SRS-A
Цитокины:
ФНО-α, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8
Слайд 69Дефенсины вызывают дегрануляцию тучных клеток:
действуют наномолярные концентрации дефенсинов
дегрануляция происходит
критически зависит от положительных зарядов дефенсинов и
отрицательных зарядов сиаловых кислот гликокаликса тучной клетки.
Neutrophil Defensins Induce Histamine Secretion from Mast Cells:
Mechanisms of Action. - The Journal of Immunology, 1999, 163, 947-953.
Слайд 70Гистамин
образуется в организме при декарбоксилированииобразуется в организме при декарбоксилировании аминокислоты гистидина,
Гистамин депонируется в тучных клеткахГистамин депонируется в тучных клетках в виде комплекса с гепарином, свободный гистамин быстро деактивируется диаминоксидазой (гистаминазой) либо метилируется гистамин-N-метилтрансферазой.
Im-CH2CH2NH2 + O2 + H2O →Im-CH2CHO + NH3 + H2O2
Конечные метаболиты гистамина — имидазолилуксусная кислота и N-метигистамин выводятся с мочой.
Слайд 71Рецепторы гистамина
В организме существуют специфические рецепторы, для которых гистамин является естественным
Тип Локализация Эффекты
H1 рецепторы Гладкие мышцы, эндотелий, центральная нервная система (постсинаптические) Вазодилатация, бронхоконстрикция, спазм гладкой мускулатуры бронхов, раздвижение клеток эндотелия (и, как следствие, транссудации жидкости в околососудистое пространство, отек и крапивница), стимуляция секреции гормонов гипофизом.
H2 рецепторы Париетальные клетки желудка Стимуляция секреции желудочного сока.
H3 рецепторы Центральная и периферическая нервная система (пресинаптические) Подавление высвобождения нейромедиаторов (ГАМК, ацетилхолина, серотонина, норадреналина).
Слайд 72
Меченые декстраны различной длинны удобны для определения калибра молекулярных «пор» в
Декстран – полимер глюкозы.
Слайд 73Прижизненный анализ проницаемости сосудов кожи для меченых декстранов и альбумина
(двухфотонная микроскопия)
В
Декстран 70 килодальтон и альбумин 65 килодальтон сквозь стенку сосудов не проходят
Слайд 74Инъекция гистамина вызывает повышение проницаемости сосудов даже для больших декстранов 2000
Блокада H1-рецепторов отменяет эффект гистамина
Слайд 75(A) Microvasculature in the ear skin. Arteriole (red), capillaries (green), and
Intravital analysis of vascular permeability in mice using two-photon microscopy
Gyohei Egawa et al
Scientific Reports, 3, 2013 doi:10.1038/srep01932
Гистамин повышает проницаемость пост-капиллярных венул
Слайд 77
Обширная область контакта двух клеток эндотелия сформирована тремя видами молекулярных «замков»
адгезионный, щелевидный и плотный контакты
Стенка венулы
Тучная клетка
Гистамин
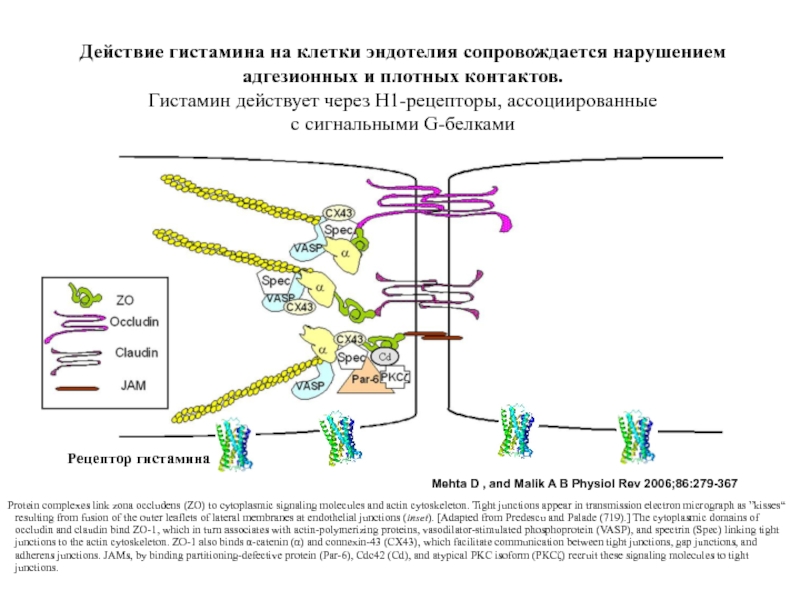
Слайд 78Mehta D , and Malik A B Physiol Rev 2006;86:279-367
Protein complexes
Действие гистамина на клетки эндотелия сопровождается нарушением адгезионных и плотных контактов.
Гистамин действует через H1-рецепторы, ассоциированные
с сигнальными G-белками
Рецептор гистамина
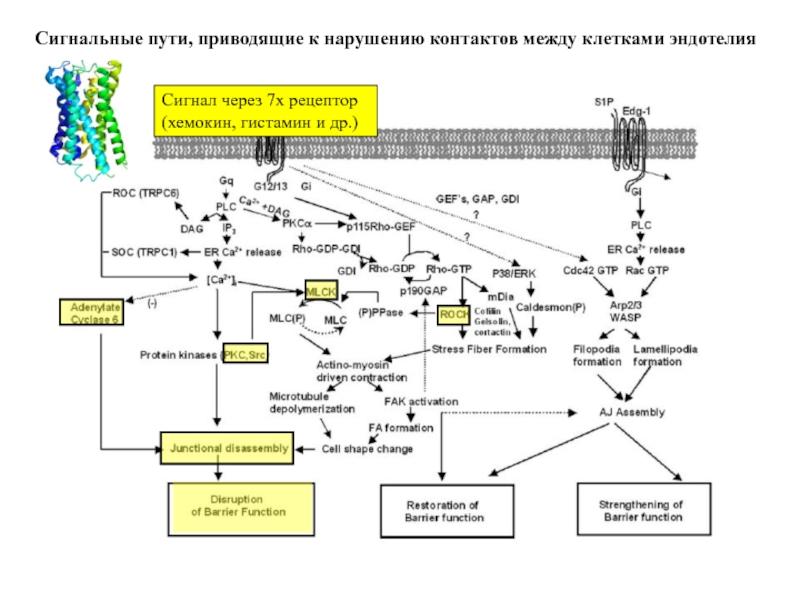
Слайд 80Проницаемость контактов между клетками эндотелия повышается
Из крови – в ткань (
защитные вещества
Слайд 81
C-реактивный белок (~120 kD),
маннан-связывающий лектин (400-700 kD),
гамма-глобулины (150-900 kD)
альфа-глобулины
белки комплемента (~ 200-400 kD)
Какие крупные молекулы защитят от инфекции:
Слайд 82
Небольшой кровеносный
сосуд (венула)
Цитокины, выделяемые
активированными макрофагами
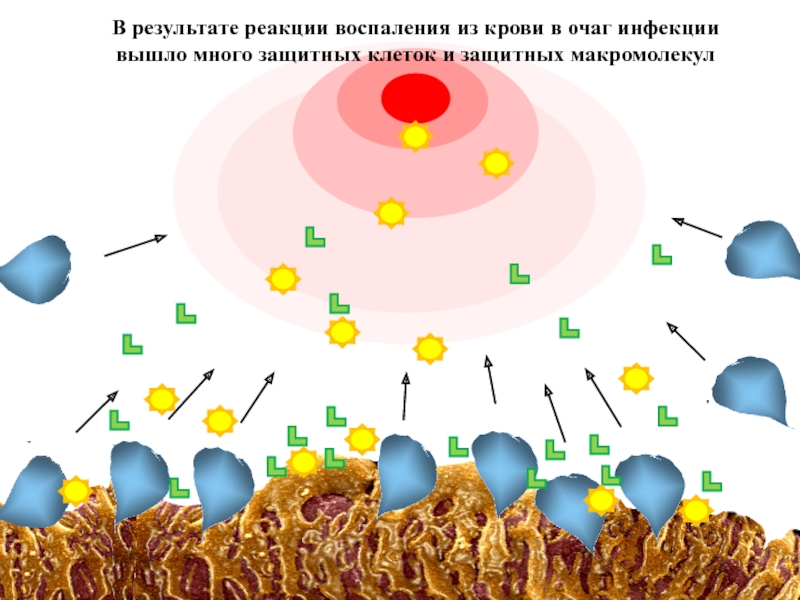
В результате реакции воспаления из
вышло много защитных клеток и защитных макромолекул
Слайд 84Помимо местных событий в инфицированной ткани
(выход из крови в ткань
в организме происходят системные изменения.
Они затрагивают весь организм и называются
системными признаками воспаления
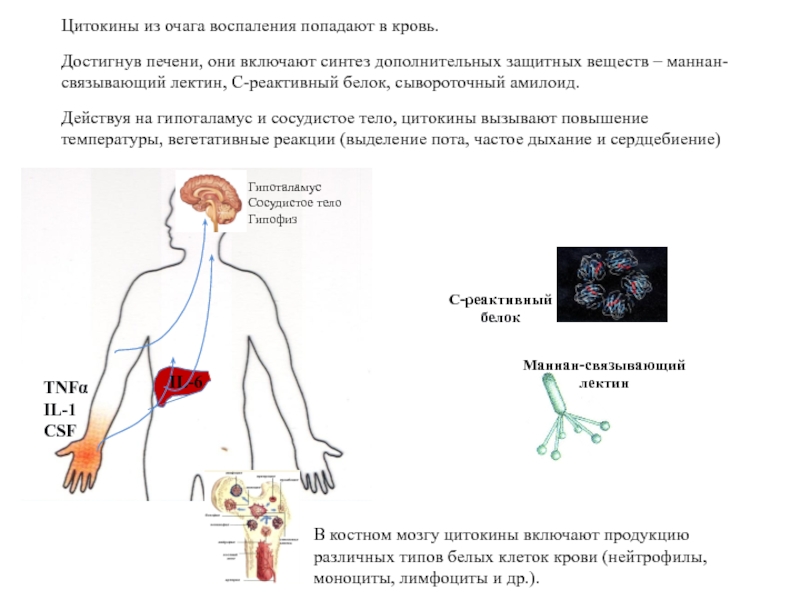
Слайд 85Цитокины из очага воспаления попадают в кровь.
Достигнув печени, они включают синтез
Действуя на гипоталамус и сосудистое тело, цитокины вызывают повышение температуры, вегетативные реакции (выделение пота, частое дыхание и сердцебиение)
Маннан-связывающий
лектин
IL-6
Гипоталамус
Сосудистое тело
Гипофиз
TNFα
IL-1
CSF
В костном мозгу цитокины включают продукцию различных типов белых клеток крови (нейтрофилы, моноциты, лимфоциты и др.).
Слайд 86Системные эффекты цитокинов и других медиаторов воспаления вовлекают в процесс защиты
Пирогенный эффект – повышение температуры тела
Изменения в ЦНС и вегетативной нервной системе
Изменения в эндокринной системе
Продукция защитных клеток в костном мозге
Продукция защитных белков в печени
Гликонеогенез (превращение запасов жира в энергетические субстраты)
Слайд 87Общая логика воспаления
1. Реакция системная – задействован весь организм, но при
все делается для победы в очаге вторжения (Пришельцы в фокусе).
Попадание в цель очень точное.
2. Реакция каскадная со множеством звеньев, позволяющих
«раскручивать» большую защиту при малых инициирующих сигналах.
6. Реакция регулируется во времени в очень широком диапазоне. Быстрая защита (проницаемость для молекул) начинается в течение минут. Медленная фаза – направленная миграция клеток - развертывается в течение часов –десятков часов, и может продолжаться многие месяцы и годы.
3. Реакция не специфична в отношении индуктора (причины). Однотипная защита развивается против самых разных индукторов.
4. Реакция эффективная, но травматичная. Может наносить серьезные повреждения собственным органам и тканям.
5. Реакция избыточная, с большим уровнем надежности (патрулирование клетками и молекулами в пределах всего организма, хотя проблема сосредоточена в относительно небольшом фрагменте тела).





![Гликолипид – в мембране нейтрофила, является рецептором Е-селектина :NeuAcα2-3Galβ1-4GlcNAcβ1-3[Galβ1-4(Fucα1-3)GlcNAcβ1-3]2[Galβ1-4GlcNAcβ1-3]2Galβ1-4Glcβ-CeramideЕ-селектинP-селектинЛейкоцитЭндотелий](/img/tmb/6/509538/42666f03749bfcf142184ed2742385bf-800x.jpg)