- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вірус Епштейн-Барр презентация
Содержание
- 1. Вірус Епштейн-Барр
- 2. Вірус Епштейн-Барр В-лімфотропний вірус людини родина Herpesviridae,
- 3. Епідеміологія ВЕБ Поширений по всій земній кулі
- 4. Інфекція EBV детектується в деяких випадках в
- 5. Відкриття EBV В 1958, Denis Burkitt
- 6. Інфекційний мононуклеоз – постійна персистенція ВЕБ в
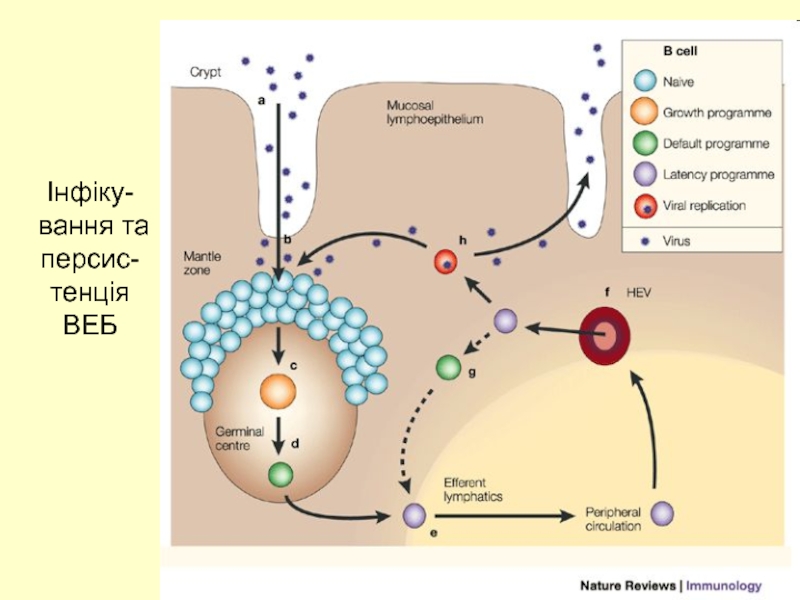
- 7. Інфіку-вання та персис-тенція ВЕБ
- 8. Вірус активно розмножується лише в ≈20% В-лімфоцитів
- 11. EBV в B клітинах інфекційний мононуклеоз X-подібне
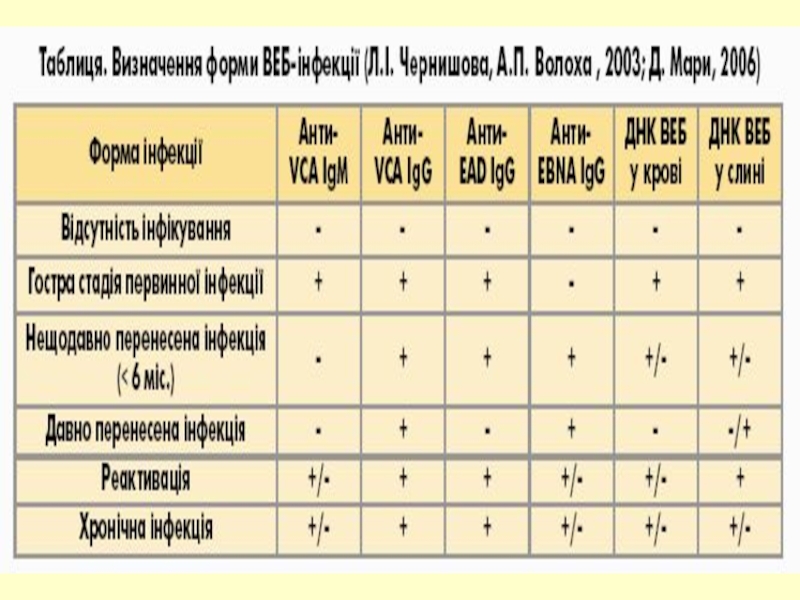
- 12. Специфічні антигени капсидний (VCA) ядерний (EBNA) ранні (дифузний EAD та локалізований EAR) мембранний (MA)
- 14. Хвороби, що викликає Epstein-Barr Virus
- 15. У ядрі клітини-хазяїна ДНК ВЕБ може формувати
- 16. Germinal Center Mantle Zone Розповсюдження слиною іn
- 18. Захист від імунної системи Аналоги інтерлейкінів людини:
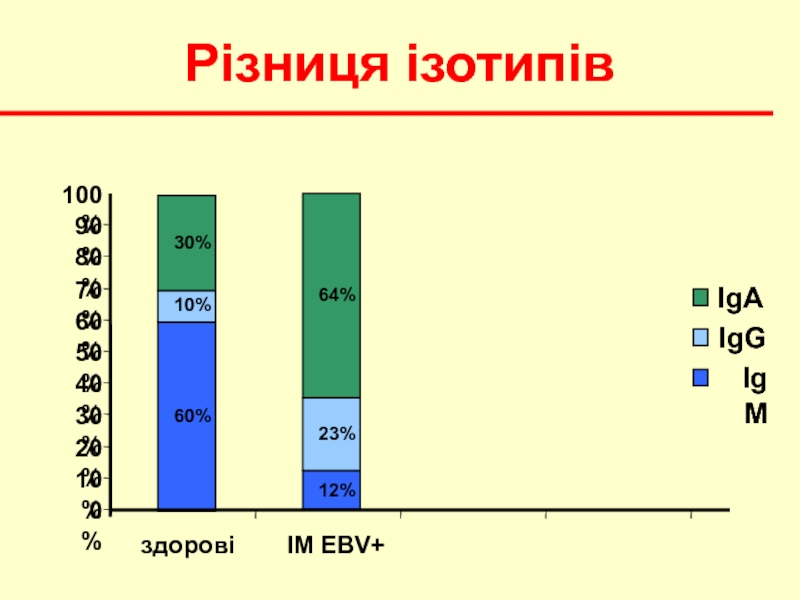
- 19. Різниця ізотипів 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
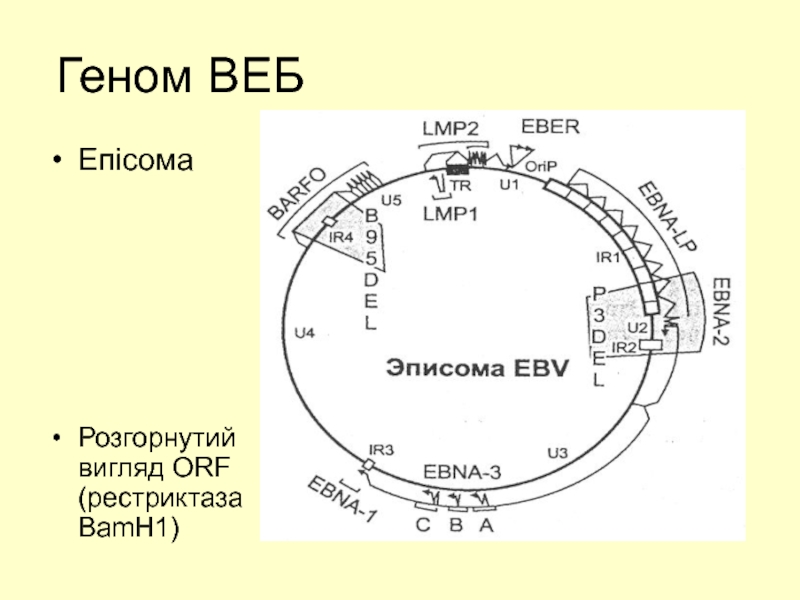
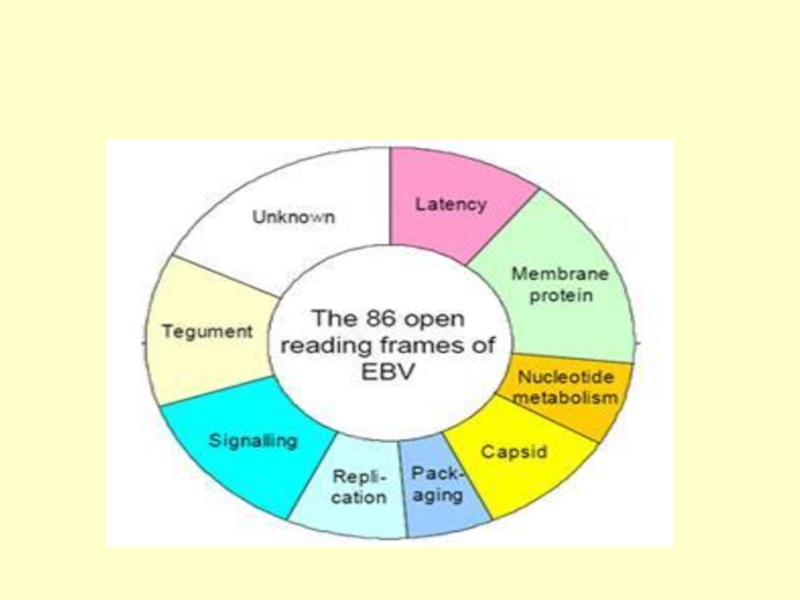
- 20. Геном ВЕБ Епісома Розгорнутий вигляд ORF (рестриктаза BamH1)
- 21. длДНК лінійна Може утворювати епісому (циркуляція)
- 23. Гени латентності ВЕБ 6 ядерних EBNA-1 EBNA-2
- 25. Фази латентного персистування ВЕБ Latency 0 –
- 26. Рис. 4. Латентные белки, экспрессируемые вирусом Эпштейна—Барр (ВЭБ) по программам III и II латенции
- 27. EBNA1 EBNA1 єдиний білок, що експресується у
- 28. From L. J. Kleinsmith, Principles of Cancer Biology. Copyright (c) 2006 Pearson Benjamin Cummings.
- 29. EBNA2 EBNA2 імітує транскрипційну функцію Notch (трансмембранний
- 30. EBNA EBNA-3A, EBNA-3C, EBNA-LP транс-активують гени та сприяють трансформації клітин
- 31. LMP-1 Інтегрований мембранний білок – функція: ліганд-незалежний
- 33. Молекулярні сигнальний шлях Цитоплазматичний домен LMP-1
- 34. LMP-2A Інтегрований мембранний білок; звязаний із src
- 35. EBNA-LP – потенційний модулятор апоптозу, прогресії
- 36. Epstein-Barr virus експресує дві малі РНК
- 37. Дозрівання В-клітин Активований В-л\ф –мігрує в
- 38. Антиген-залежна активація та диференціація В-кл наївний B
- 39. Можливий шлях встановлення латенції EBV Adapted from
- 40. Делікатний баланс Зміни в імунній системі – високий ризик для EBV лімфоми:
- 41. Memory M or G or A
- 42. Програма росту III тип латенции -
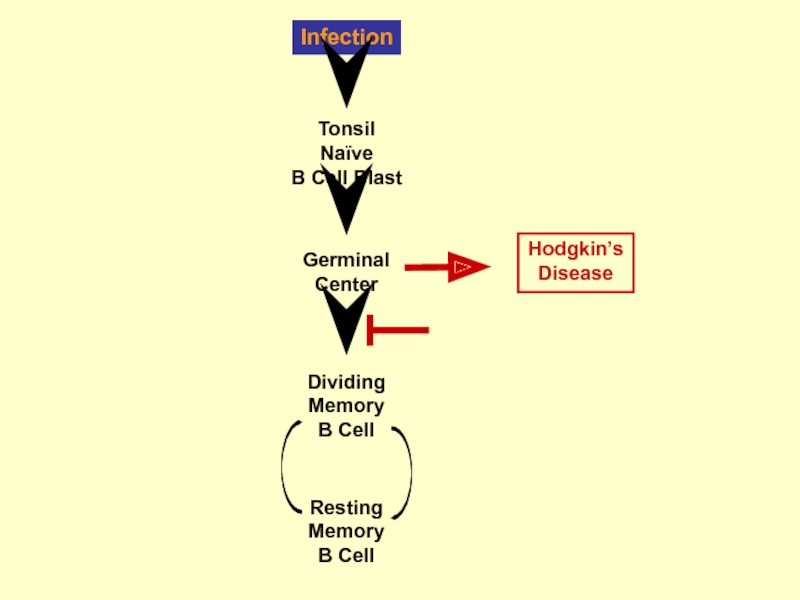
- 43. Infection Resting Memory B Cell Tonsil Naïve
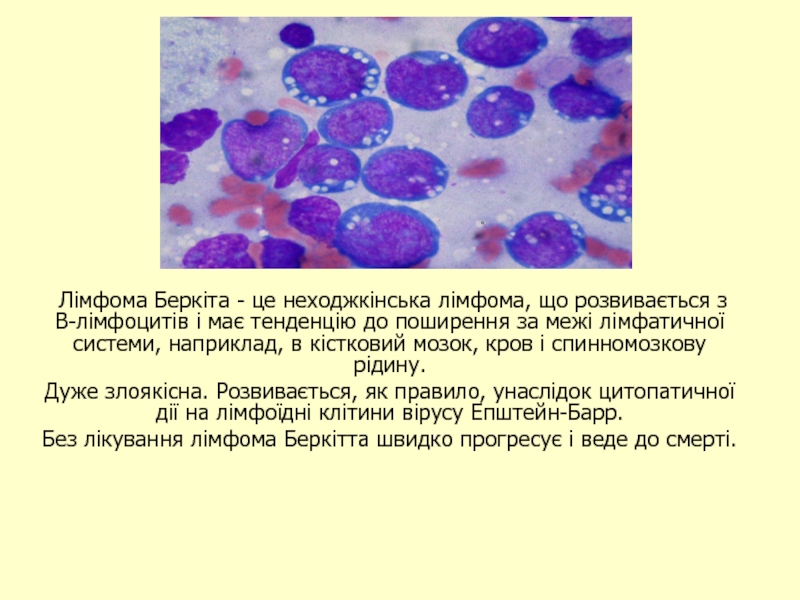
- 45. Лімфома Беркіта - це неходжкінська лімфома,
- 46. Infection Resting Memory B Cell Tonsil Naïve
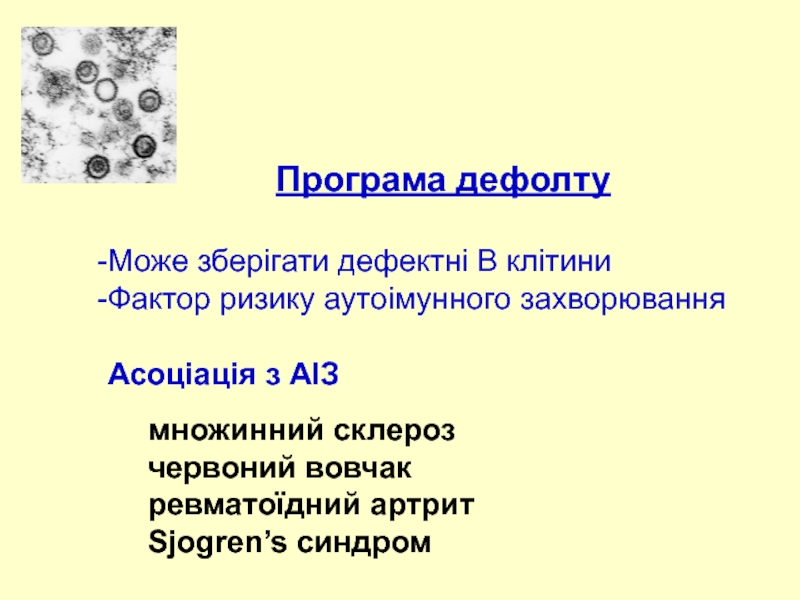
- 47. Програма дефолту Може зберігати дефектні B
- 48. Вірус використовує програму росту для активації ново-інфікованих
- 49. EBV персистує в зародкових центрах, звідки походять
- 50. EBV використовує біологію дозрівння В клітин для
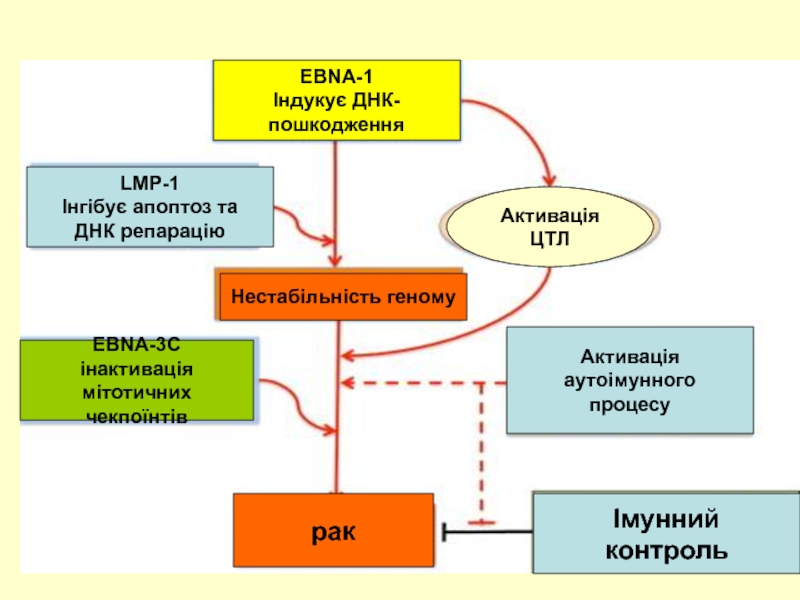
- 51. EBNA-1 Індукує ДНК- пошкодження LMP-1 Інгібує
- 52. Первинні В-кл Зниження ФР за рахунок
- 53. Первинні В-кл Зниження ФР за рахунок
- 54. Дякую за увагу)
- 55. На відміну від інших лімфом, лімфома Беркітта
- 56. Инфекционный агентТип лимфомы 1. Вирусы, трансформирующие
- 57. data indicating that the tumorigenic potential
- 58. Абдомінальна форма Особливо слід виділити абдомінальну форму,
- 59. Онкоген LMP-1 Короткий N-кінцевий позаклітинний домен Трансмембранний
- 60. Симптоми Класичний варіант пухлини - одиничні або
Слайд 2Вірус Епштейн-Барр
В-лімфотропний вірус людини
родина Herpesviridae, п/род γ-герпесвірусів, вірус герпесу 4 типу
суперкапсид
нуклеокапсид
лінійна
має онкогенні властивості
тропізм до В- та Т-лімфоцитів
Кодує близько 100 протеїнів
Глікопротеїни : gp350, gp85, gp25, gp42 та ін.
Слайд 3Епідеміологія ВЕБ
Поширений по всій земній кулі
Передача – повітряно-крапельним шляхом зі слиною,
Описані випадки вертикальної передачі
Контагіозність ВЕБІ помірна
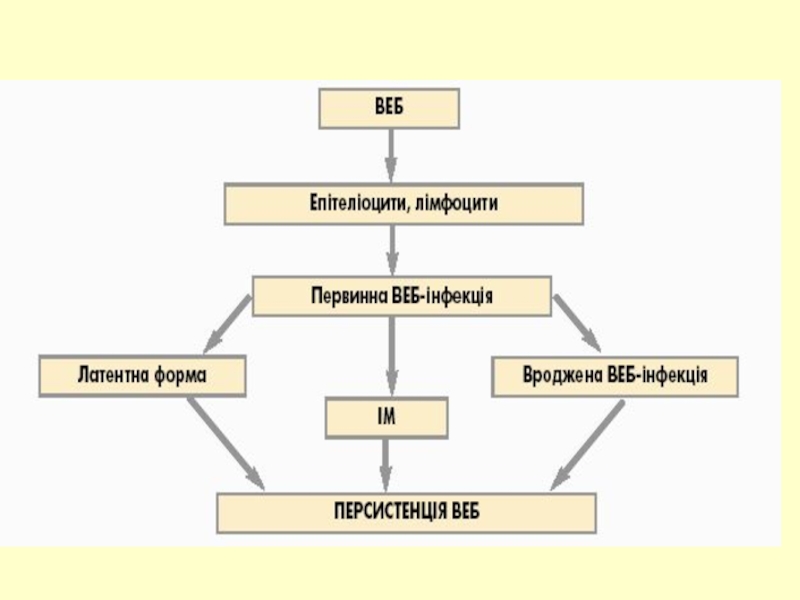
Слайд 4Інфекція EBV детектується в деяких випадках в слині здорових людей ,
Реплікація в епітеліальних та лімфатичних клітинах.
Реалізуються різні транскрипційні програми під час латентного періоду.
Характеризується як онкогенних вірус людини.
Захворювання : безсимптомне, інфекційний мононуклеоз,
Слайд 5Відкриття EBV
В 1958, Denis Burkitt описав рак , захворювання у дітей
Підтверджена вірусна етіологія
Вірус вперше описав у 1964 Epstein,
Barr вперше виявила електронно-мікроскопічно віріони в культурі лімфобластів, отриманних від пацієнта з ЛБ.
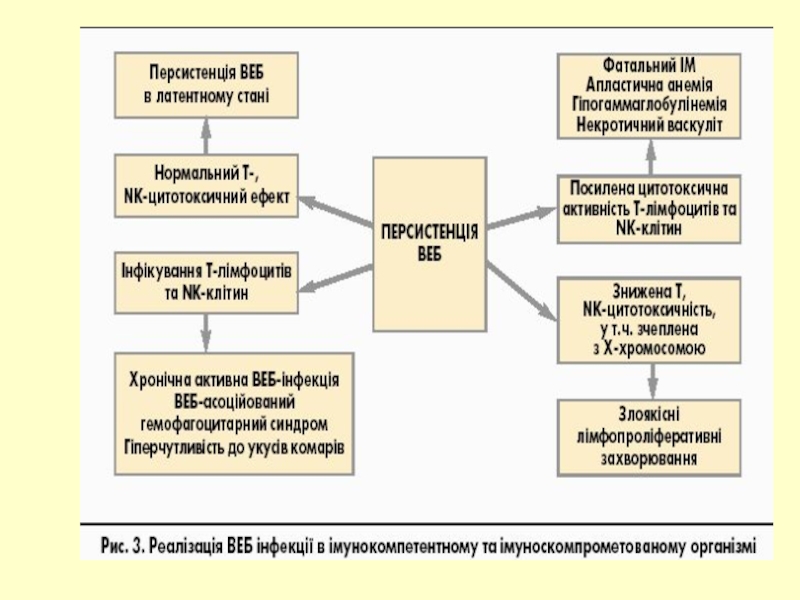
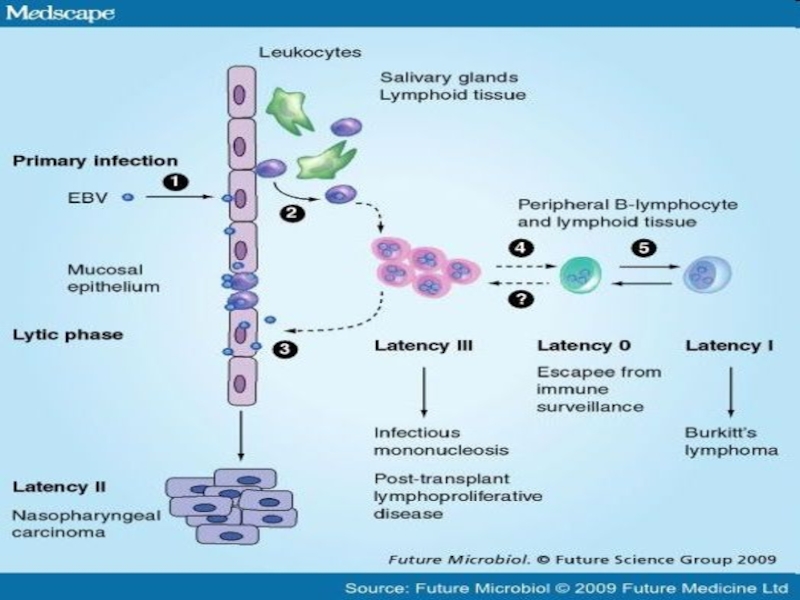
Слайд 6Інфекційний мононуклеоз – постійна персистенція ВЕБ в організмі хазяїна (105 –
Персистенція вірусу в В-клітинах пам”яті пожиттєва
У разі пошкодження будь-якого елемента ІВ маленький пул ВЕБ-інфікованих клітин може розширюватися і призводити до розвитку лімфопроліферативного синдрому
Слайд 8Вірус активно розмножується лише в ≈20% В-лімфоцитів gp350/220 EBV з
Може уражувати Т-лімфоцити, NK-клітини макрофаги, нейтрофіли, епітеліоцити
Контроль над кількістю проліферуючих В-лімфоцитів – Т-лімфоцитами-супресорами, NK- та ін.
Слайд 11 EBV в B клітинах
інфекційний мононуклеоз
X-подібне ЛПЗ
хронічно-активний EBV
хвороба Ходжкіна
лімфома Беркітта
лімфопроліферативні захворюівання
EBV
назофарингіальна карцинома
карцинома шлунку
T/NK клітинна лімфома ротоглотки
периферичні T клітинні лімфоми
оральна лейкоплакія
пухлини м”язових тканин у осіб з трансплантацією
хвороби асоційовані з EBV
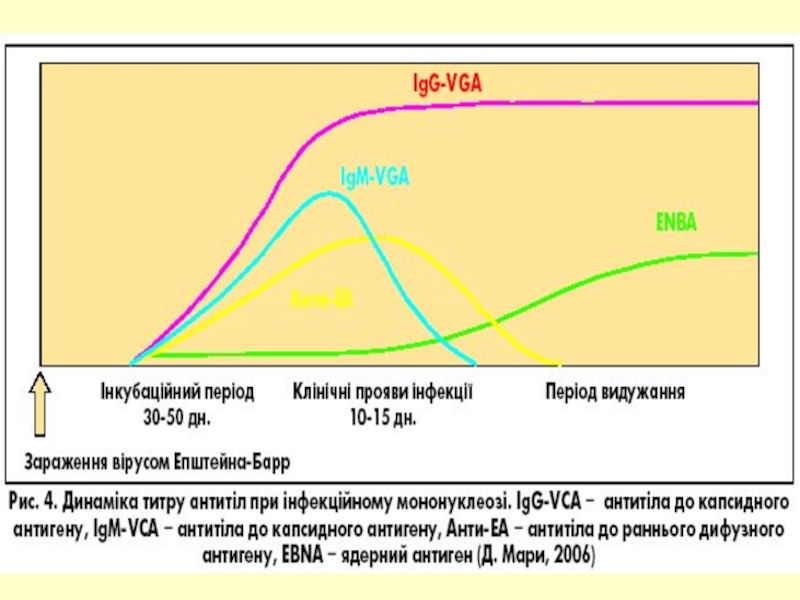
Слайд 12Специфічні антигени
капсидний (VCA)
ядерний (EBNA)
ранні (дифузний EAD та локалізований EAR)
мембранний (MA)
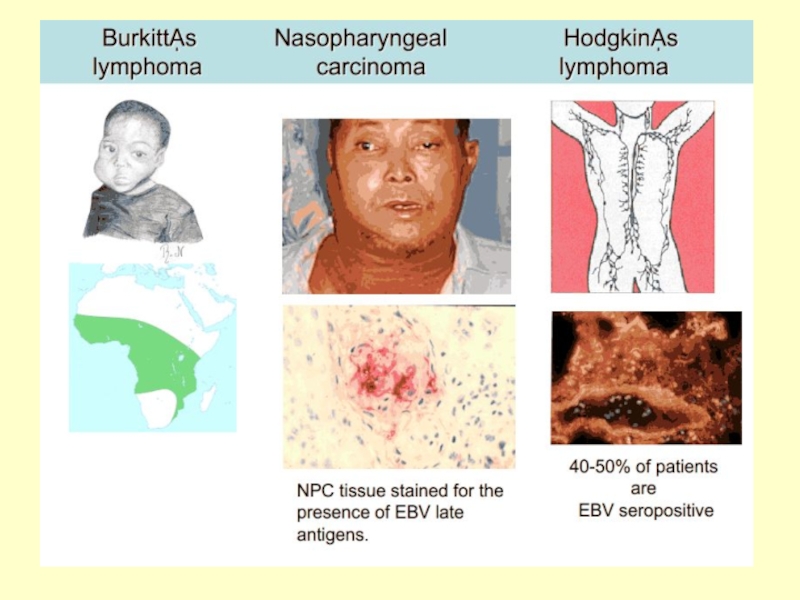
Слайд 14Хвороби, що викликає Epstein-Barr Virus
Інфекційний мононуклеоз
Хронічно-активний EBV
X-подібне лімфопроліферативне
захворювання ЛПЗ
оральна лейкоплакія
Хвороба Ходжкіна EBV- EBV-
НФК
T- кл лімфома
Лімфома Беркітта
Провокована
Проліферація
клітин
Експресія
генів
Слайд 15У ядрі клітини-хазяїна ДНК ВЕБ може формувати кільцеву структуру – епісому
Неправильна імунна відповідь на ВЕБ може зумовлюватися аномальною генетичною рекомбінацією, що призводить до онкогенної активації і розвитку злоякісних пухлин.
Деякі індивідууми не здатні до нормальної імунної відповіді на ВЕБ через Х-зв'язану генетичну схильність. На Х-хромосомі було знайдено генетичний маркер лімфопроліферативного синдрому.
Пацієнти з Х-зв'язаним лімфопроліферативним синдромом (Х-ЛПС) можуть переносити ВЕБ-інфекцію у вигляді різних маніфестацій патологічного процесу, в 75% осіб спостерігається або фатальний ІМ, або злоякісна лімфома (частіше Беркітта)
Лімфома Беркіта - злоякісна лімфоїдна пухлина, що локалізується найчастіше у нирках, яєчниках, верхній щелепі, підшлунковій залозі, позаочеревинних лімовузлах, мозкових оболонках, мозковій речовині.
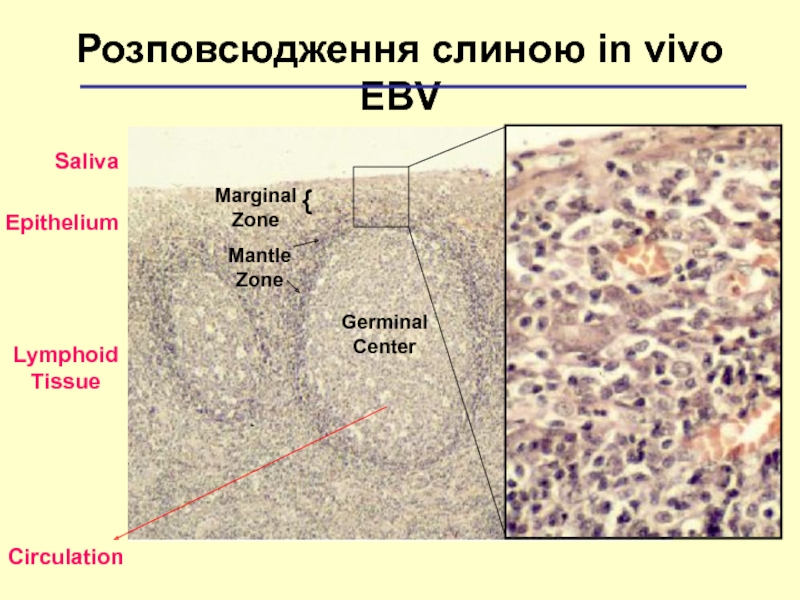
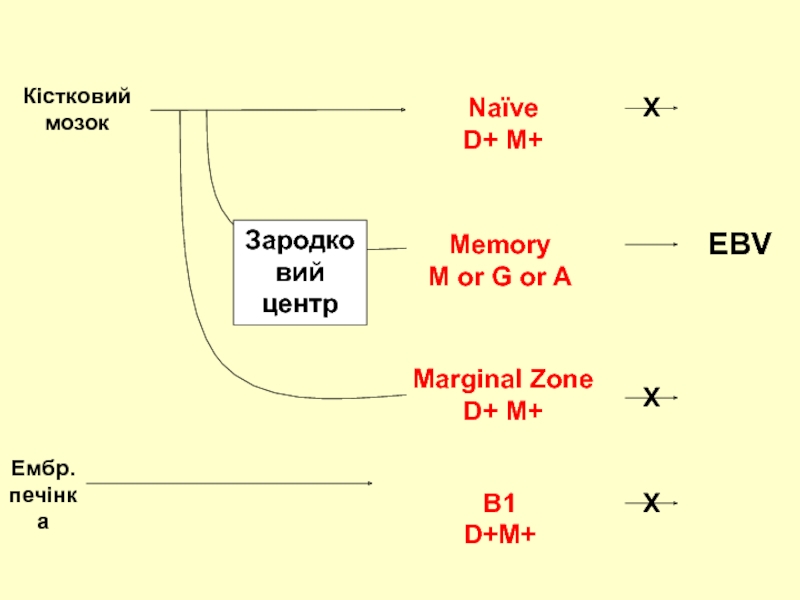
Слайд 16Germinal
Center
Mantle
Zone
Розповсюдження слиною іn vivo EBV
Marginal
Zone
{
Epithelium
Lymphoid
Tissue
Saliva
Circulation
Слайд 18Захист від імунної системи
Аналоги інтерлейкінів людини:
IL-10 подібний білок, що пригнічує Т-клітини,
Інший вірусний білок (В13) пригнічує ІЛ-12.
Неправильна імунна відповідь на ВЕБ-інфекцію може призводить до онкогенної активації та розвитку злоякісних пухлин.
Аномальна генетична рекомбінація (призводить до онкогенної активації і розвитку злоякісних пухлин)
Слайд 21
длДНК лінійна
Може утворювати епісому (циркуляція)
Надранні, ранні та пізні гени
Літична інфекція –
Латентна інфекція?B-кл проліферація
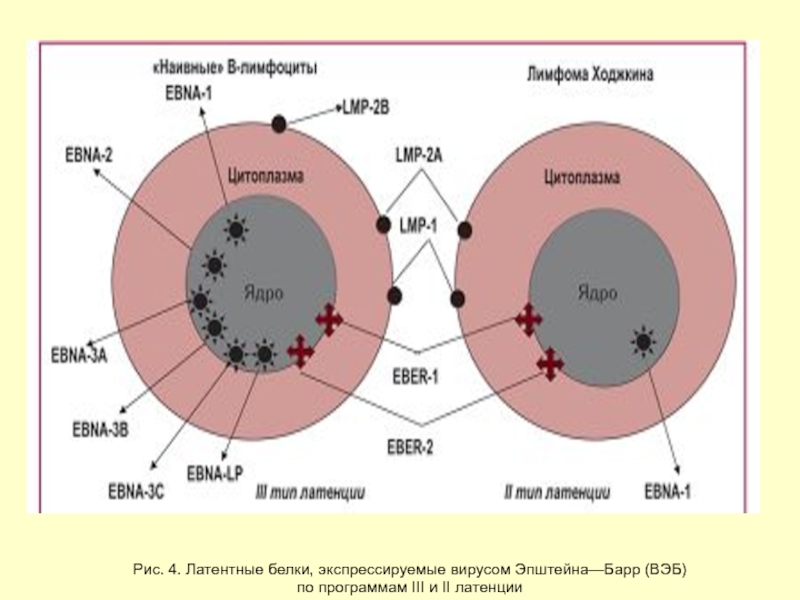
Слайд 23Гени латентності ВЕБ
6 ядерних
EBNA-1
EBNA-2
EBNA-3 (або 3А)
EBNA-4 (або 3В)
EBNA-5 (або LP)
EBNA-6 (або
3 мембранні
LMP-1
LMP-2
LMP-3
Слайд 25Фази латентного персистування ВЕБ
Latency 0 – повне мовчання вірусного геному.
Latency І
Latency ІІІ – усі 9 протеїнів латентності; автономна проліферація.
Latency ІІ –перехід від Latency І до Latency ІІ. (EBER-1, EBER-2, EBNA-1, LMP-1, LMP-2),
Слайд 26Рис. 4. Латентные белки, экспрессируемые вирусом Эпштейна—Барр (ВЭБ)
по программам III
Слайд 27EBNA1
EBNA1 єдиний білок, що експресується у всіх програмах латентності та літичного
Епісомний стан
EBNA1 синтезується в обмеженій кількості, щоб запобігти розпізнавання CTL
EBNA1 – типовий приклад маскування від протеосомної обрабки в процесі генерації пептидів для презентації антигену МНС I.
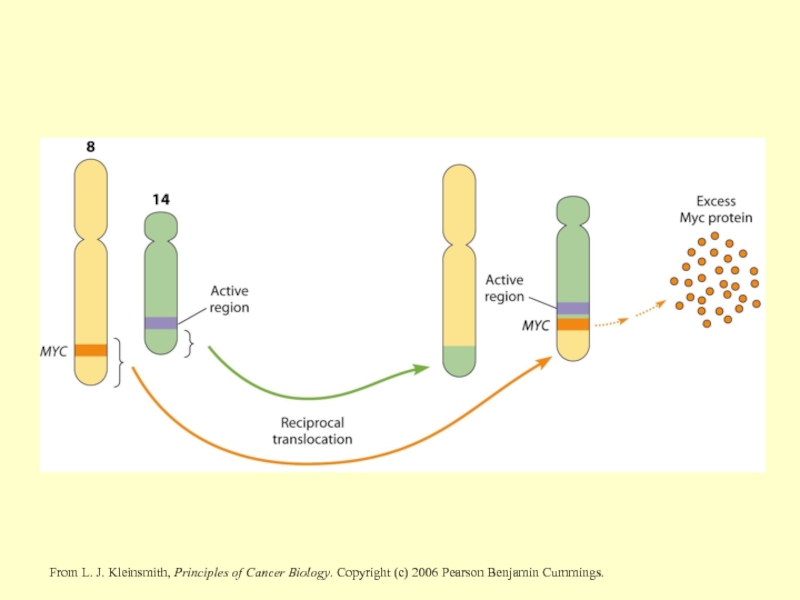
EBNA1, разом EBNA3C та LMP1, сприяє геномній нестабільності та переміщення C-Myc.
Слайд 28From L. J. Kleinsmith, Principles of Cancer Biology. Copyright (c) 2006
Слайд 29EBNA2
EBNA2 імітує транскрипційну функцію Notch (трансмембранний білок, що перетворює контакти з
Ключова роль у встановленні та підтримці латентної стадії
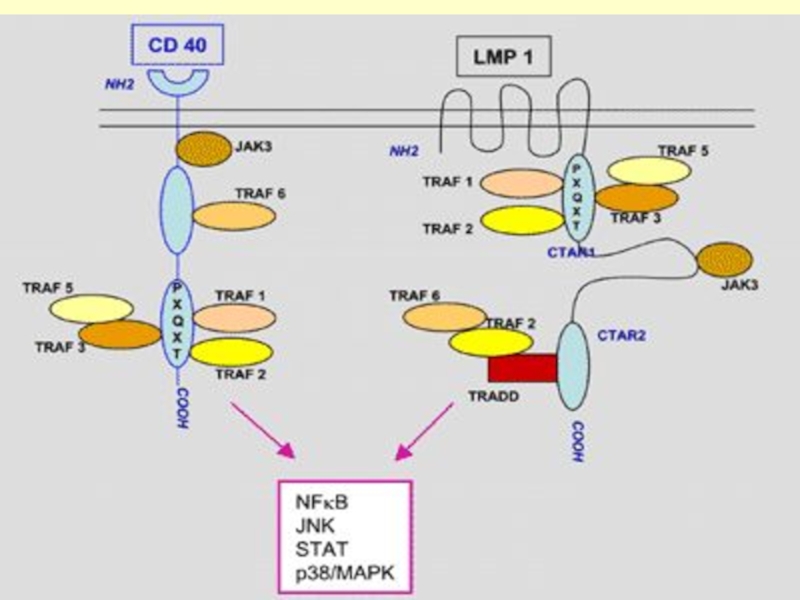
Слайд 31LMP-1
Інтегрований мембранний білок – функція: ліганд-незалежний рецептор, індукує експресію В кл
LMP-1 мімікрін CD40 – сигнальний шлях (in vivo у трансгенний мишах)
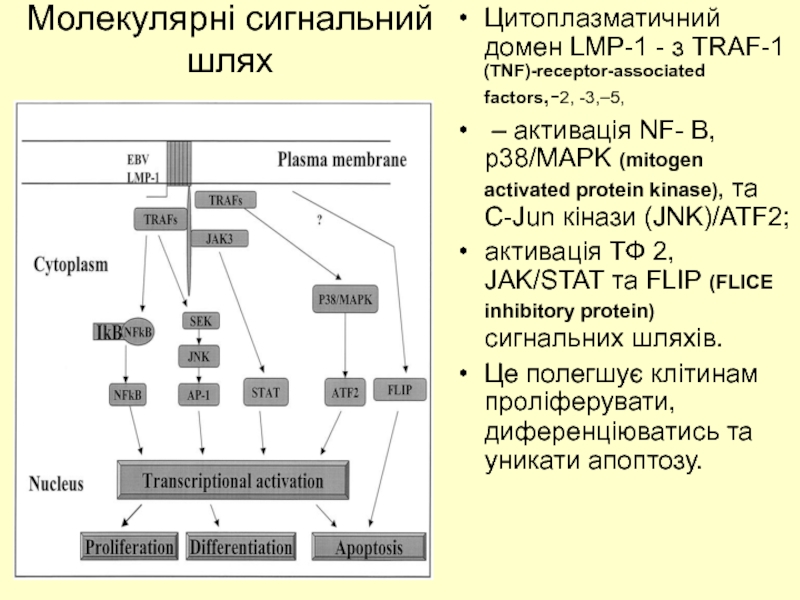
Слайд 33Молекулярні сигнальний шлях
Цитоплазматичний домен LMP-1 - з TRAF-1 (TNF)-receptor-associated factors,-2,
– активація NF- B, p38/MAPK (mitogen activated protein kinase), та C-Jun кінази (JNK)/ATF2;
активація ТФ 2, JAK/STAT та FLIP (FLICE inhibitory protein) сигнальних шляхів.
Це полегшує клітинам проліферувати, диференціюватись та уникати апоптозу.
Слайд 34LMP-2A
Інтегрований мембранний білок; звязаний із src родиною тирозин кіназ
Зміна сигнального шляху
Посилює виживання B-кл у трансгенних мишах які не здатні експресувати ВcR (RAG -/- миша)
активує кіназу Akt/PBK, викликаючи ряд ефектів, найбільш яскравим пригнічення апоптоза
Слайд 35
EBNA-LP – потенційний модулятор апоптозу, прогресії клітинного циклу та транскрипційних програм
EBNA-LP
Alpha та beta Герпесвіруси кодують білки здатні взаємодіяти та модулювати PML NBs або PML NB-асоційовані білки та протистояти клітинному захисту .
Слайд 36
Epstein-Barr virus експресує дві малі РНК = EBERs (EBV-encoded RNAs) та
EBERs - найпоширеніші вірусні транскрипти в період латентної інфекції в різних типах клітин та хворобливих станів
Показана потенційна роль мікроРНК в онкогенезі, імунних механізмах та регуляції генів
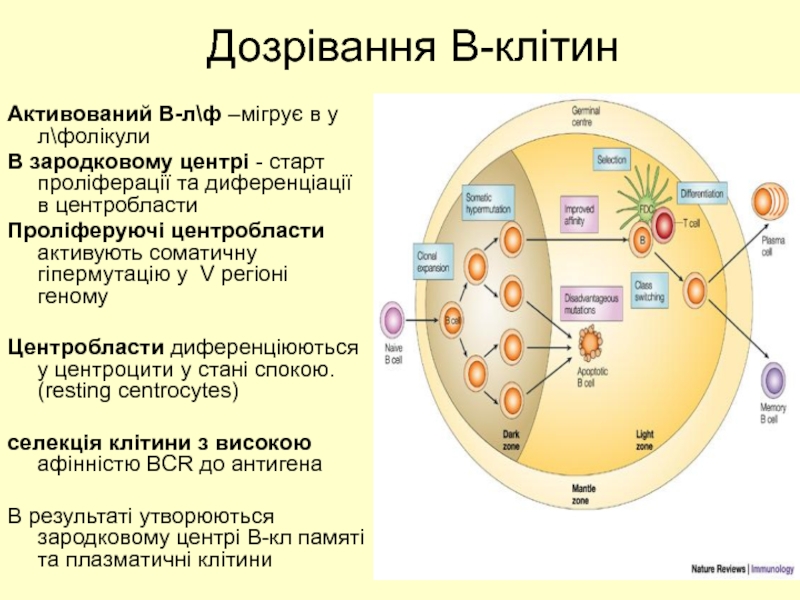
Слайд 37Дозрівання В-клітин
Активований В-л\ф –мігрує в у л\фолікули
В зародковому центрі - старт
Проліферуючі центробласти активують соматичну гіпермутацію у V регіоні геному
Центробласти диференціюються у центроцити у стані спокою. (resting centrocytes)
селекція клітини з високою афінністю BCR до антигена
В результаті утворюються зародковому центрі В-кл памяті та плазматичні клітини
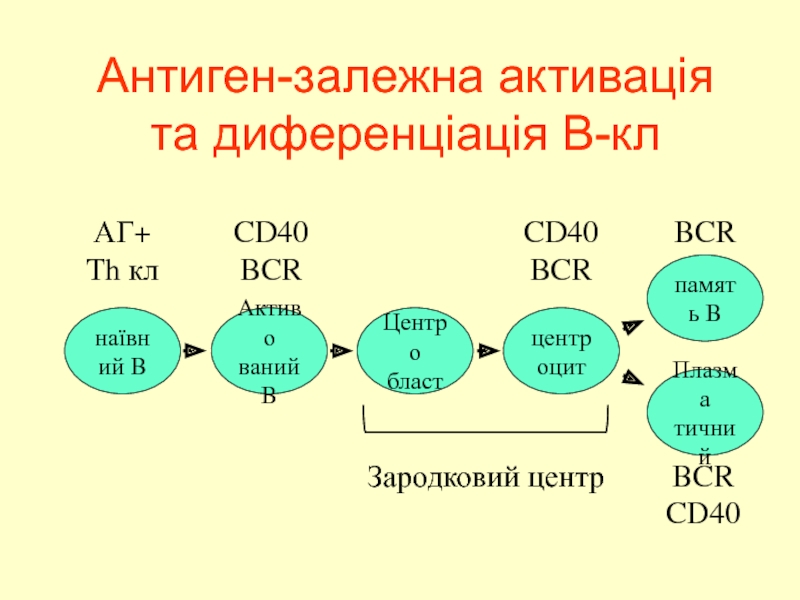
Слайд 38Антиген-залежна активація та диференціація В-кл
наївний B
Активо
ваний
B
Центро
бласт
центроцит
память B
АГ+
Th кл
CD40
BCR
BCR
CD40
BCR
Плазма
тичний
BCR
CD40
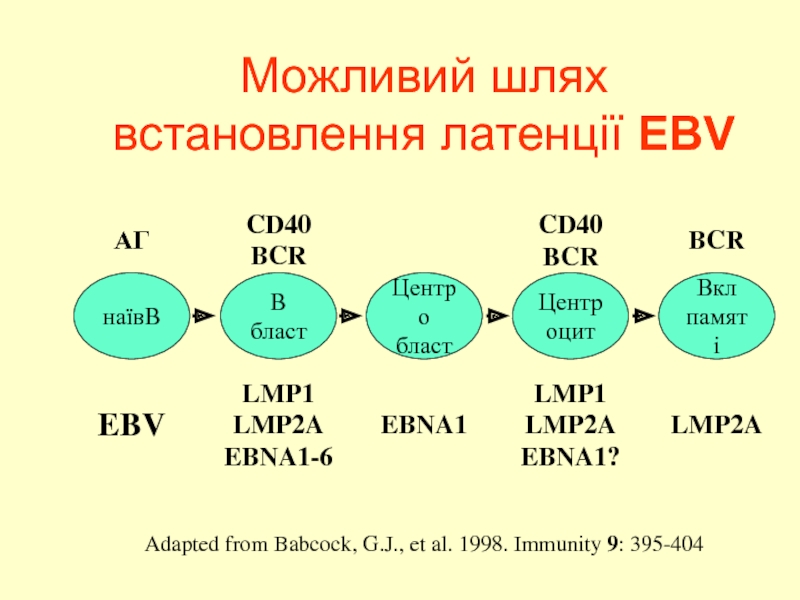
Слайд 39Можливий шлях встановлення латенції EBV
Adapted from Babcock, G.J., et al. 1998.
наївB
B бласт
Центро
бласт
Центроцит
Вкл
памяті
EBV
LMP1
LMP2A
EBNA1-6
EBNA1
LMP1
LMP2A
EBNA1?
LMP2A
АГ
CD40
BCR
BCR
CD40
BCR
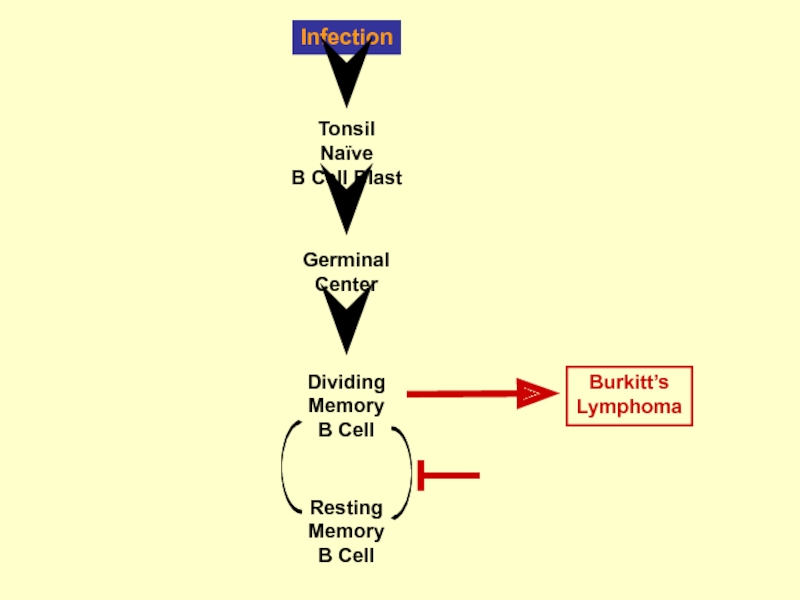
Слайд 42Програма росту
III тип латенции - «наївні» В-кл+ ВЕБ, експресують всі латентні
в гермінальному центрі (ГЦ) – проліферують розмножуються утворюють клони –збільшення пулу клітини для інфікування
Асоціація з пухлинами у людей
імунобластна лімфома (PTLD/AIDS)
хвороба Ходжкіна
лімфома Беркітта
назофарінгіальна карцинома
карцинома шлунку
Слайд 45 Лімфома Беркіта - це неходжкінська лімфома, що розвивається з В-лімфоцитів
Дуже злоякісна. Розвивається, як правило, унаслідок цитопатичної дії на лімфоїдні клітини вірусу Епштейн-Барр.
Без лікування лімфома Беркітта швидко прогресує і веде до смерті.
Слайд 47Програма дефолту
Може зберігати дефектні B клітини
Фактор ризику аутоімунного захворювання
Асоціація з АІЗ
множинний
червоний вовчак
ревматоїдний артрит
Sjogren’s синдром
Слайд 48Вірус використовує програму росту для активації ново-інфікованих клітин так, щоб вони
Слайд 49EBV персистує в зародкових центрах, звідки походять B клітини пам’яті.
Непомітні для
Не патогенні для господаря
Підтримуються гомеостазом як нормальні клітини пам’яті.
Слайд 50EBV використовує біологію дозрівння В клітин для встановлення інфекції, персистенції та
Підсумок - персистенція
Слайд 51
EBNA-1
Індукує ДНК-
пошкодження
LMP-1
Інгібує апоптоз та
ДНК репарацію
Нестабільність геному
EBNA-3C
інактивація мітотичних
чекпоїнтів
Активація ЦТЛ
Активація
аутоімунного
процесу
рак
Імунний
контроль
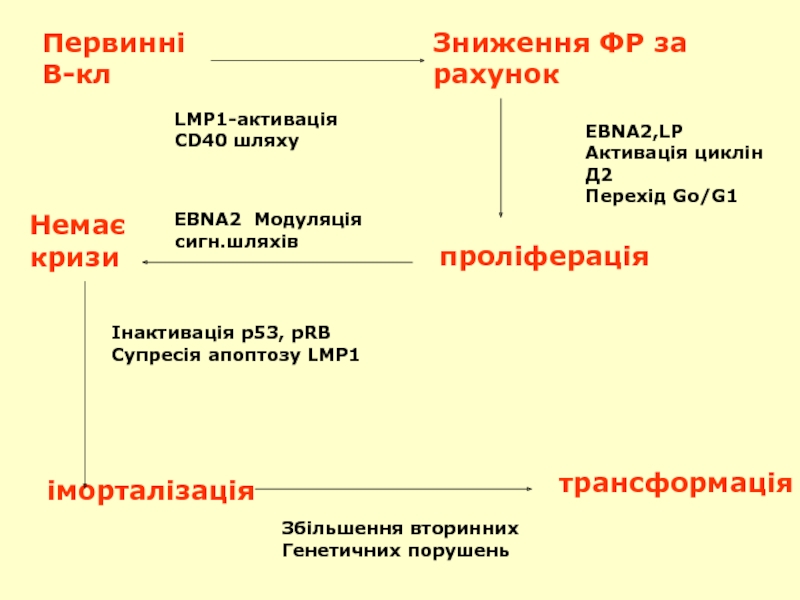
Слайд 52Первинні
В-кл
Зниження ФР за
рахунок
EBNA2,LP
Активація циклін Д2
Перехід Go/G1
проліферація
EBNA2 Модуляція сигн.шляхів
Немає
кризи
Інактивація p53, pRB
Супресія
іморталізація
трансформація
Збільшення вторинних
Генетичних порушень
LMP1-активація
CD40 шляху
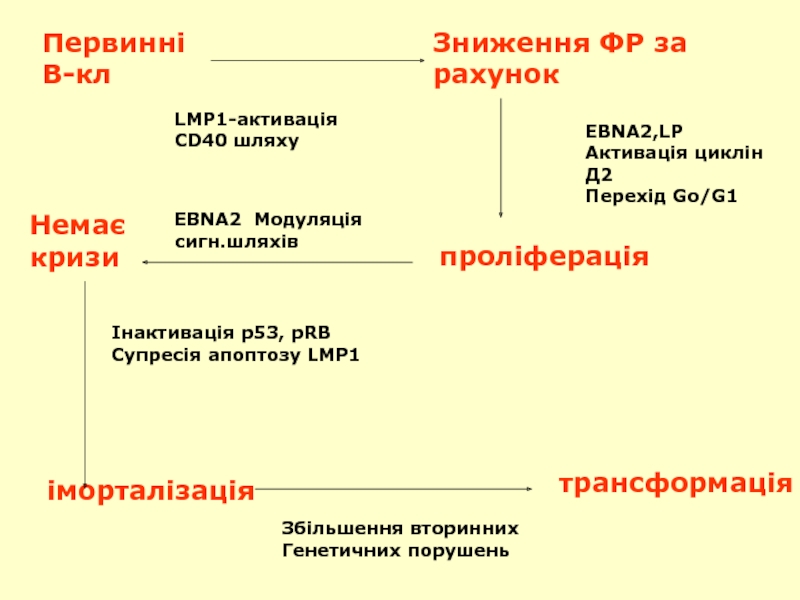
Слайд 53Первинні
В-кл
Зниження ФР за
рахунок
EBNA2,LP
Активація циклін Д2
Перехід Go/G1
проліферація
EBNA2 Модуляція сигн.шляхів
Немає
кризи
Інактивація p53, pRB
Супресія
іморталізація
трансформація
Збільшення вторинних
Генетичних порушень
LMP1-активація
CD40 шляху
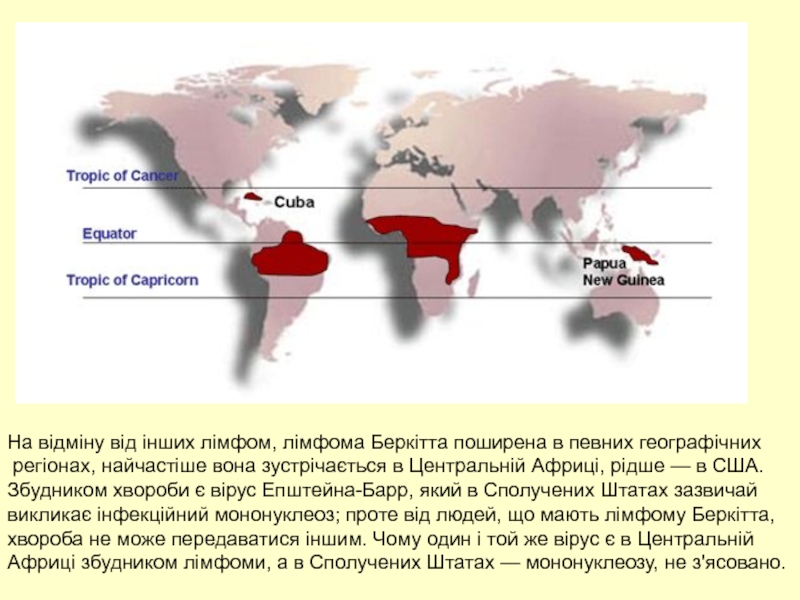
Слайд 55На відміну від інших лімфом, лімфома Беркітта поширена в певних географічних
Збудником хвороби є вірус Епштейна-Барр, який в Сполучених Штатах зазвичай
викликає інфекційний мононуклеоз; проте від людей, що мають лімфому Беркітта,
хвороба не може передаватися іншим. Чому один і той же вірус є в Центральній
Африці збудником лімфоми, а в Сполучених Штатах — мононуклеозу, не з'ясовано.
Слайд 56
Инфекционный агентТип лимфомы
1. Вирусы, трансформирующие лимфоциты
Вирус Эпштейна—Барр
Герпесвирус 8-го типа
Лимфома Беркитта, СПИД-ассоциированные НХЛ(особенно НХЛ ЦНС, диффузная В-крупноклеточная лимфома)Посттрансплантационные гемобластозыЭкстранодальные NK / T-клеточные НХЛПервичная выпотная лимфомаМультицентрическая болезньКаслмана Т-клеточный лейкоз / лимфома
2. Агенты, вызывающие иммуносупрессиюВИЧСПИД-ассоциированные лимфомы
3. Агенты, вызывающие хроническую иммунную стимуляциюPlasmodium falciparumВирус гепатита СВирус гепатита В Helicobacter pylori Campilobacter jejuniChlamidia psittaciBorrella burgdorferiMALT — лимфоидная ткань, ассоциированная со слизистойЛимфома БеркиттаДиффузная В-крупноклеточная лимфома Лимфоплазмоцитарная НХЛНХЛ маргинальной зоныДанные отсутствуют Неходжкинская MALT-лимфома желудкаМалая интестинальная неходжкинская MALT-лимфома Неходжкинская MALT-лимфома придатков глазаКожная неходжкинская MALT-лимфо
Слайд 57
data indicating that the tumorigenic potential of EBV-negative Burkitt lymphoma cells
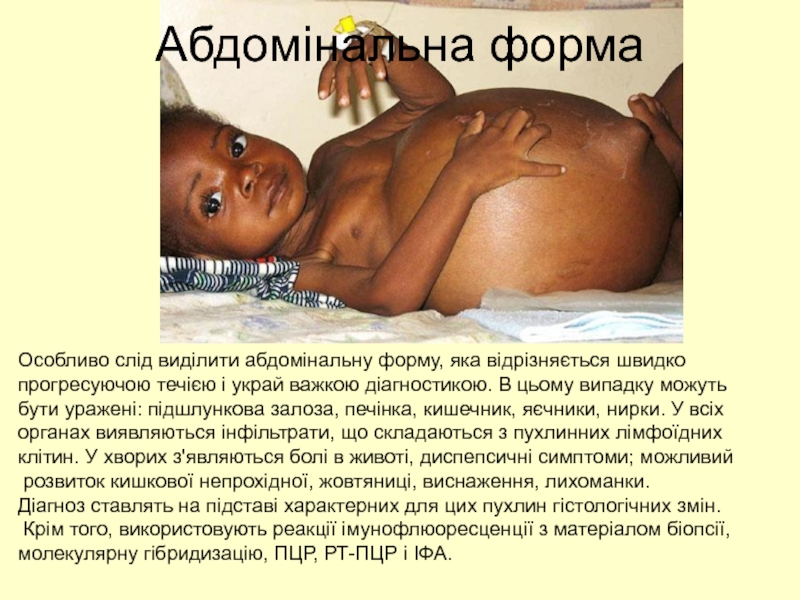
Слайд 58Абдомінальна форма
Особливо слід виділити абдомінальну форму, яка відрізняється швидко
прогресуючою течією
бути уражені: підшлункова залоза, печінка, кишечник, яєчники, нирки. У всіх
органах виявляються інфільтрати, що складаються з пухлинних лімфоїдних
клітин. У хворих з'являються болі в животі, диспепсичні симптоми; можливий
розвиток кишкової непрохідної, жовтяниці, виснаження, лихоманки.
Діагноз ставлять на підставі характерних для цих пухлин гістологічних змін.
Крім того, використовують реакції імунофлюоресценції з матеріалом біопсії,
молекулярну гібридизацію, ПЦР, РТ-ПЦР і ІФА.
Слайд 59Онкоген LMP-1
Короткий N-кінцевий позаклітинний домен
Трансмембранний (6 доменів) домен
Великий С-кінцевий цитоплазматичний домен
LMP-1
Індукує експресію NF-kB через активацію TRAF (tumor necrosis factor-receptor associated factor)
LMP-1 не має ліганд-зв'язуючого домену → немає зв'язування із TRAF-2 і -3 → конститутивна активація проліферації
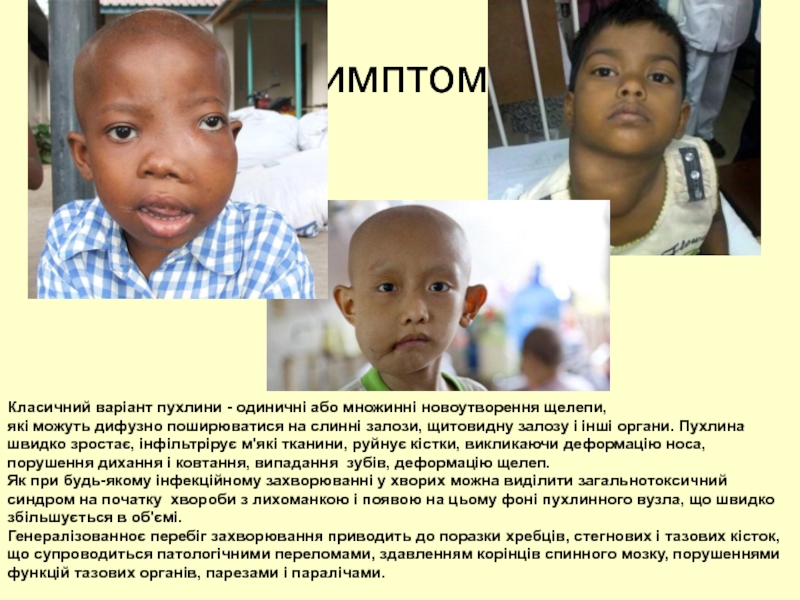
Слайд 60Симптоми
Класичний варіант пухлини - одиничні або множинні новоутворення щелепи,
які можуть
Як при будь-якому інфекційному захворюванні у хворих можна виділити загальнотоксичний синдром на початку хвороби з лихоманкою і появою на цьому фоні пухлинного вузла, що швидко збільшується в об'ємі.
Генералізованноє перебіг захворювання приводить до поразки хребців, стегнових і тазових кісток, що супроводиться патологічними переломами, здавленням корінців спинного мозку, порушеннями функцій тазових органів, парезами і паралічами.