- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Трансплантация стволовых клеток в лечении различных заболеваний презентация
Содержание
- 1. Трансплантация стволовых клеток в лечении различных заболеваний
- 2. Хронический миелолейкоз – 40-80% Острый нелимфобластный лейкоз
- 3. Ближайшие перспективы применения стволовых клеток Рассеянный склероз
- 4. Этапы развития науки о стволовых клетках и
- 5. 1970-е Первая аутологичная трансплантация костного мозга больному
- 6. 2000-е - дифференцированное применение различных видов стволовых клеток (гемопоэтических, мезенхимных, предшественников эндотелиоцитов/ангиобластов); использование генотерапии
- 7. Стволовые клетки – клетки, способные к самообновлению
- 8. Стволовые клетки – функции и жизнедеятельность
- 9. Тотипотентные стволовые клетки Плюрипотентные стволовые клетки Полипотентные стволовые клетки Унипотентные стволовые клетки
- 10. Тотипотентные стволовые клетки источник – бластоциста, которая
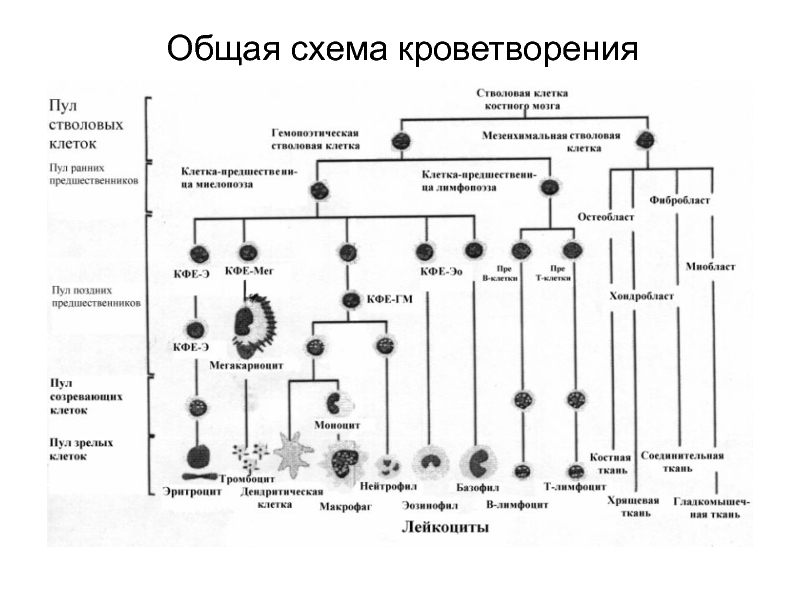
- 11. Общая схема кроветворения
- 12. ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ КОСТНЫЙ МОЗГ
- 13. В клинической практике используются: Неселективные
- 14. Иммунофенотип стволовых клеток. Иммуноселекция Гемопоэтические стволовые
- 15. Дифференцировка стволовых клеток Тип стволовых клеток
- 16. Дифференцировка стволовых клеток Тип стволовых клеток
- 17. Дифференцировка стволовых клеток Тип стволовых клеток
- 18. Количество трансплантаций гемопоэтических стволовых клеток в мире
- 19. 1). ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ СТВОЛОВЫХ
- 20. Количество родственных и неродственных аллогенных трансплантаций больным
- 21. Трансплантация ex vivo модифицированных клеток находит клиническое
- 22. Трансплантация аллогенных стволовых клеток используется для
- 23. Методология аллогенной трансплантации гемопоэтических стволовых клеток Основные
- 24. Предтрансплантационная подготовка больного к аллогенной трансплантации стволовых
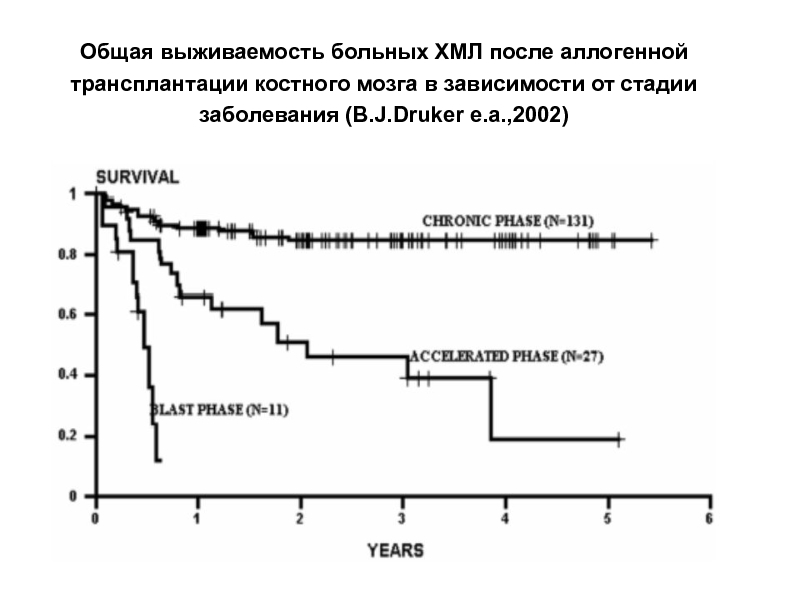
- 25. Общая выживаемость больных ХМЛ после аллогенной трансплантации
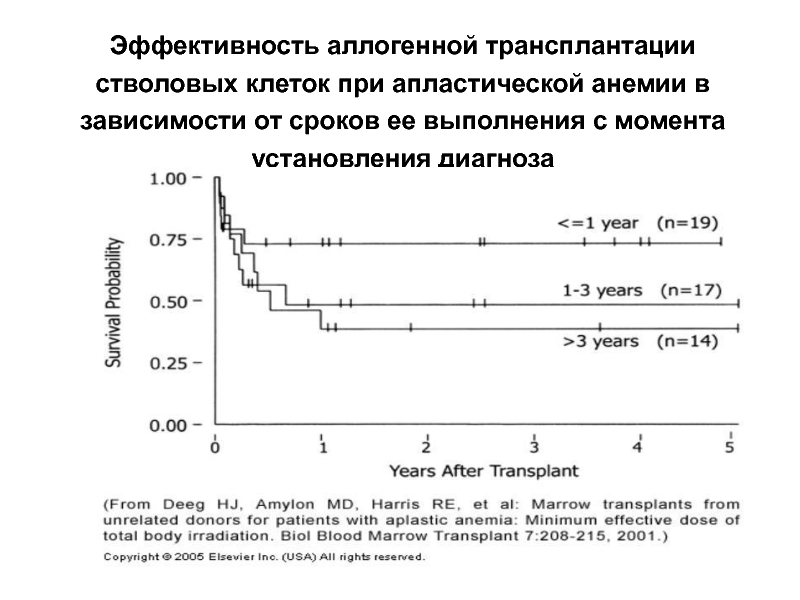
- 26. Эффективность аллогенной трансплантации стволовых клеток при апластической
- 27. Подбор/поиск HLA-совместимого донора Этапность подбора
- 28. Заготовка клеток пуповинной крови не менее
- 29. Обязательным компонентом трансплантации аллогенных гемопоэтических клеток является
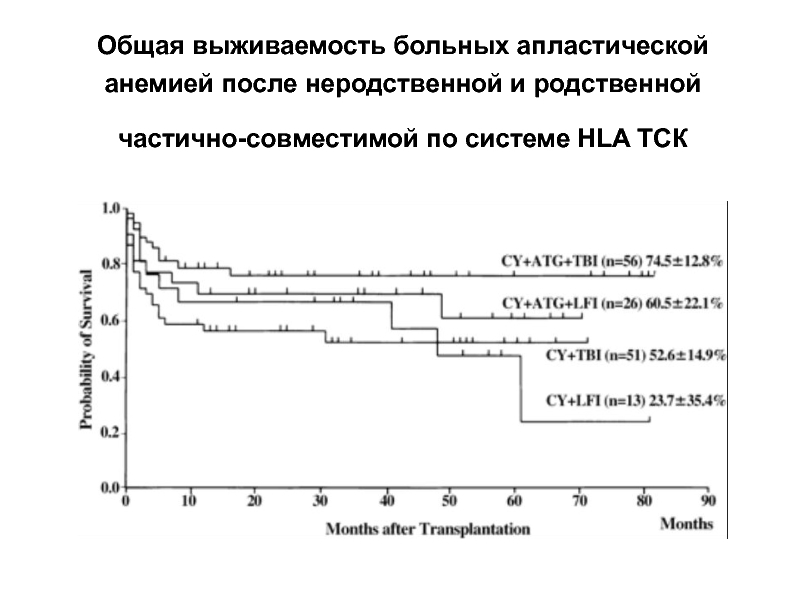
- 32. Общая выживаемость больных апластической анемией после неродственной
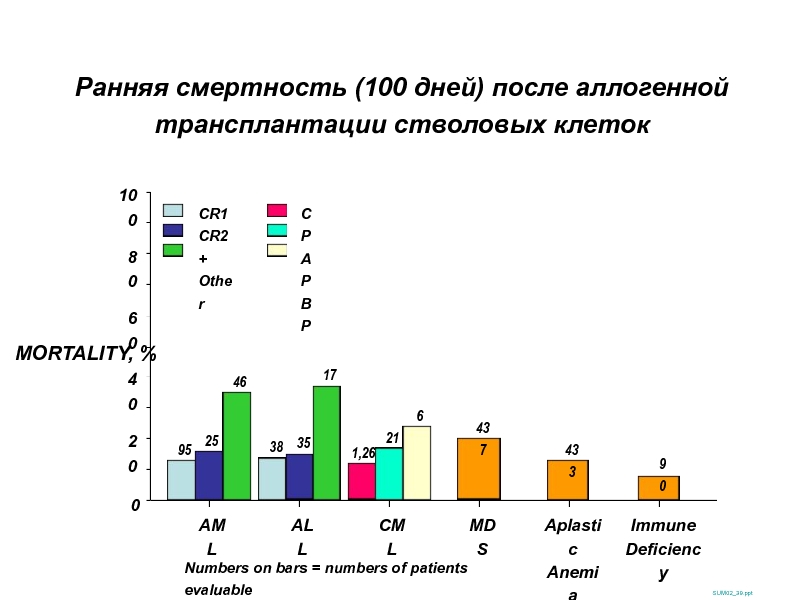
- 33. Ранняя смертность (100 дней) после аллогенной трансплантации
- 34. Основные причины ранней смерти после HLA-совместимой аллогенной
- 35. Профилактика РТПХ циклоспорин А 3-12,5 мг/кг с
- 36. Профилактика токсических и инфекционных осложнений Форсированный диурез
- 37. Оценка приживления донорских стволовых стволовых клеток Гематологические
- 38. Ранние осложнения аллогенной трансплантации стволовых клеток Острая
- 40. Поздние осложнения аллогенной трансплантации стволовых клеток Хроническая
- 41. Аутологичная трансплантация гемопоэтических стволовых клеток выполняется с
- 42. цитотоксичность Чувствительность опухолевых и гемопоэтических клеток к
- 43. Методология аутологичной трансплантации гемопоэтических стволовых клеток Основные
- 44. Причины смерти после аутологичной трансплантации стволовых клеток
- 46. выживаемость, % 100 0 20 40 60
- 47. Общая выживаемость больных острыми лимфобластными лейкозами после
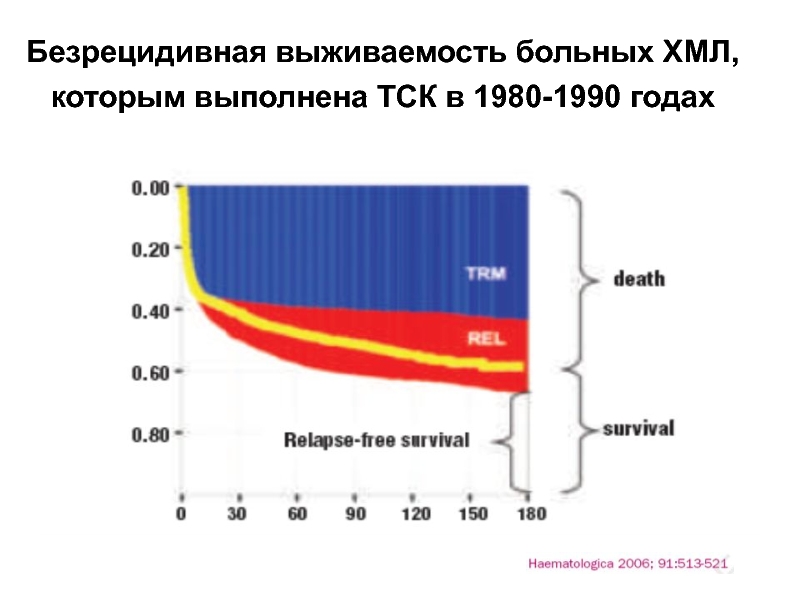
- 49. Безрецидивная выживаемость больных ХМЛ, которым выполнена ТСК в 1980-1990 годах
- 50. Бессобытийная и общая выживаемость больных
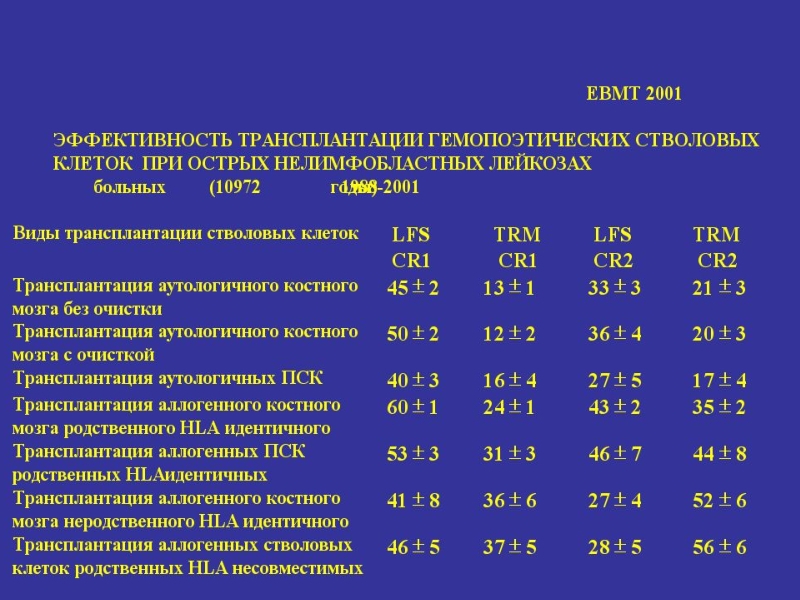
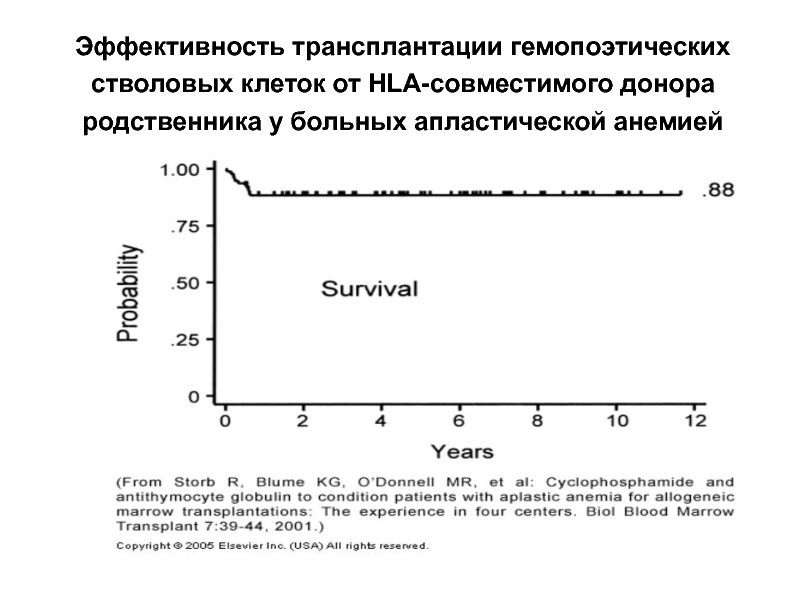
- 51. Эффективность трансплантации гемопоэтических стволовых клеток от HLA-совместимого донора родственника у больных апластической анемией
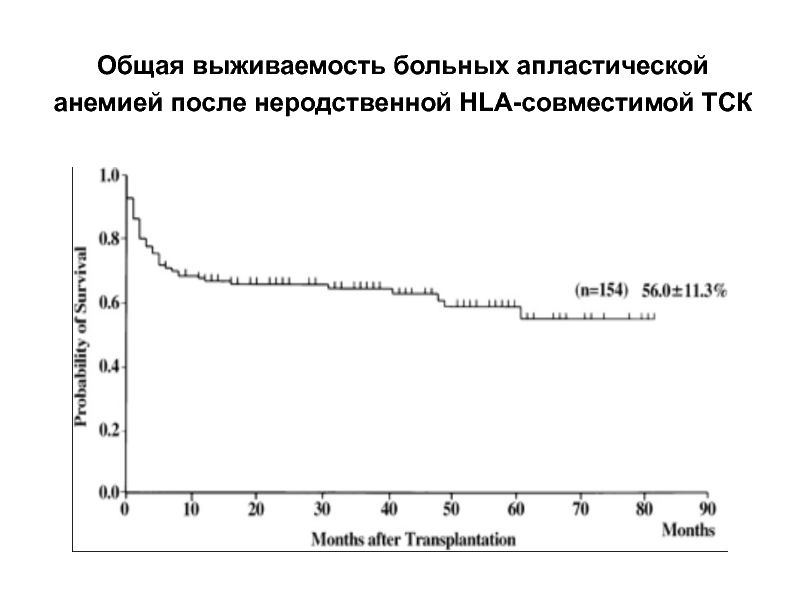
- 52. Общая выживаемость больных апластической анемией после неродственной HLA-совместимой ТСК
- 53. Концептуальная основа для трансплантации стволовых клеток при
- 54. Схема трансплантации ГСК при аутоиммунных заболеваниях
- 55. Эффективность трансплантации ГСК при аутоиммунных заболеваниях (
- 56. Трансплантация стволовых клеток в лечении сахарного диабета
- 57. Использование стволовых клеток у экспериментальных животных в
- 58. Потенцильные возможности терапии ГСК в кардиологии
- 59. Доказательство возможности образования кардиомиоцитов из циркулирующих стволовых
- 60. Методы введения стволовых клеток в/в введение
- 61. Возможные эффекты введения стволовых клеток у больных
- 62. Проточная цитометрия трансплантата Количество CD-34+ клеток
- 63. Данные ОФЕКТ больного С. до и после
Слайд 1Трансплантация стволовых клеток в лечении различных заболеваний
6 курс
профессор Моисеев С.И.
Слайд 2Хронический миелолейкоз – 40-80%
Острый нелимфобластный лейкоз - 40-70%
Острый лимфобластный лейкоз -
Апластическая анемия - 50-80%
(анемия Фанкони) - 70%
Талассемия - 70%
Множественная миелома - 10-30%
Злокачественные лимфомы (III-IV) - 40-70%
Миелодиспластический синдром - 40-86%
Врожденные иммунодефициты и
ферментопатии - 80%
Аутоиммунные заболевания - 30%
Солидные и герминальные опухоли - 30%
Хронический лимфолейкоз - 10-30%
Слайд 3Ближайшие перспективы применения стволовых клеток
Рассеянный склероз
Болезнь Паркинсона
Повреждение головного и спинного мозга
Инсульт
Болезнь
Диабет
Ишемическая болезнь сердца
Кардиомиопатии
Врожденные заболевания костей
Слайд 4Этапы развития науки о стволовых клетках и клеточной терапии
1908 Александр
1953 Показано, что трансплантация костного мозга может спасти животных, получивших смертельную дозу радиации.
1960-е первые попытки пересадки аллогенного костного мозга больным лейкемией
Слайд 51970-е Первая аутологичная трансплантация костного мозга больному лимфомой
1980-е Первая трансплантация
1988 Э. Глюкман в клинике Святого Людвига в Париже провела первую операцию по трансплантации пуповинной крови ребенку с анемией Фанкони.
1990 Е. Д. Томас, впервые осуществивший пересадку костного мозга, получил Нобелевскую премию в области медицины
Слайд 62000-е - дифференцированное применение различных видов стволовых клеток (гемопоэтических, мезенхимных, предшественников
использование генотерапии
Слайд 7Стволовые клетки – клетки, способные к самообновлению (самоподдержанию) и дифференцировке в
E. Herzog et al. Blood,2003,102, 3483-3493
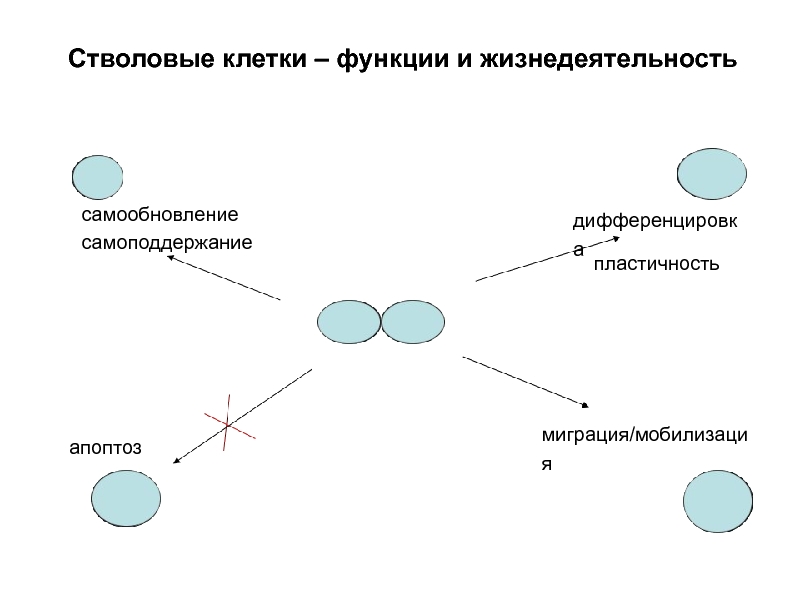
Слайд 8Стволовые клетки – функции и жизнедеятельность
самообновление
самоподдержание
дифференцировка
миграция/мобилизация
апоптоз
пластичность
Слайд 9
Тотипотентные стволовые клетки
Плюрипотентные стволовые клетки
Полипотентные стволовые клетки
Унипотентные стволовые клетки
Слайд 10Тотипотентные стволовые клетки
источник – бластоциста, которая формируется к 5 дню оплодотворения
способны
- клетки тканей эмбриона
- клетки экстраэмбриональные (плацента)
- клетки тканей новорожденного
- клетки тканей взрослого человека
( высокая пластичность )
получены и зарегистрированы несколько клеточных линий эмбриональных стволовых клеток
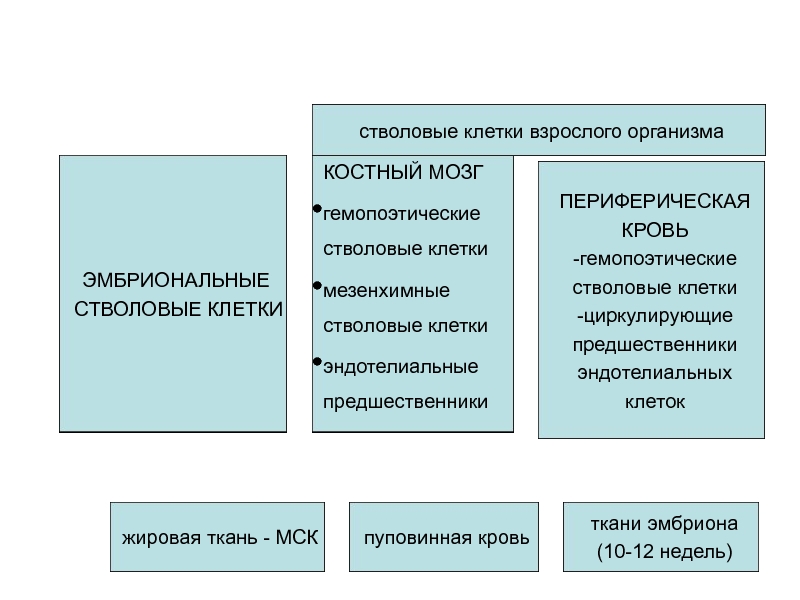
Слайд 12
ЭМБРИОНАЛЬНЫЕ
СТВОЛОВЫЕ КЛЕТКИ
КОСТНЫЙ МОЗГ
гемопоэтические
стволовые клетки
мезенхимные
стволовые клетки
эндотелиальные
предшественники
ПЕРИФЕРИЧЕСКАЯ
КРОВЬ
-гемопоэтические
стволовые клетки
-циркулирующие
предшественники
эндотелиальных
клеток
стволовые клетки взрослого организма
жировая
пуповинная кровь
ткани эмбриона
(10-12 недель)
Слайд 13В клинической практике используются:
Неселективные СК КМ
Неселективные СК ПК (мобилизация СК
Селективные СК КМ ( ГСК, МСК, ЭП)
Селективные СК ПК (ГСК, МСК, ЭП)
Мезенхимные стволовые клетки
комбинация
Слайд 14Иммунофенотип стволовых клеток. Иммуноселекция
Гемопоэтические стволовые клетки
(CD133+, CD34+, CD45+ )
Мезенхимные
( CD105+, CD45-; CD29+, CD45-, CD34-;)
Мезенхимные стволовые клетки/ангиобласты ( CD106+)
Ендотелиальные предшественники (СD133+,CD34±, KDR+)
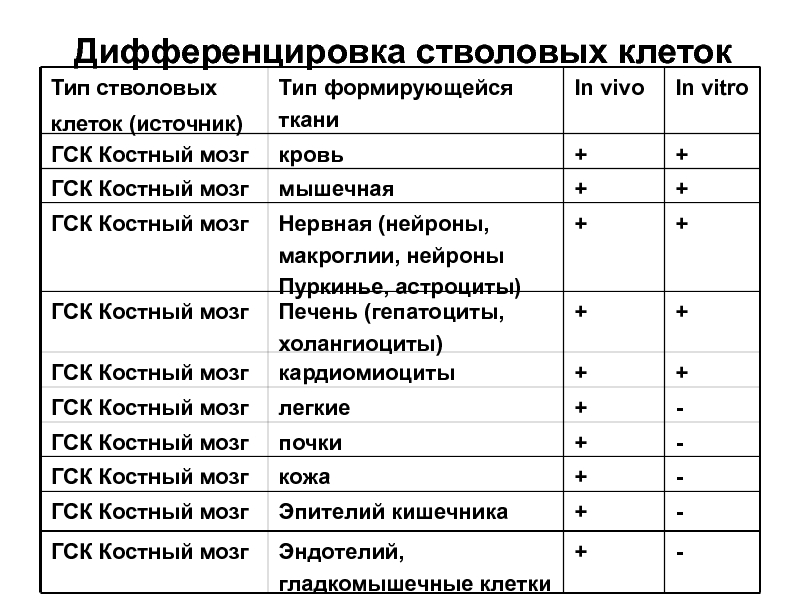
Слайд 15Дифференцировка стволовых клеток
Тип стволовых
клеток (источник)
Тип формирующейся ткани
In vivo
In vitro
ГСК Костный мозг
кровь
+
+
ГСК
мышечная
+
+
ГСК Костный мозг
Нервная (нейроны, макроглии, нейроны Пуркинье, астроциты)
+
+
ГСК Костный мозг
Печень (гепатоциты, холангиоциты)
+
+
ГСК Костный мозг
кардиомиоциты
+
+
ГСК Костный мозг
легкие
+
-
ГСК Костный мозг
почки
+
-
ГСК Костный мозг
кожа
+
-
ГСК Костный мозг
Эпителий кишечника
+
-
ГСК Костный мозг
Эндотелий, гладкомышечные клетки
+
-
Слайд 16Дифференцировка стволовых клеток
Тип стволовых
клеток (источник)
Тип формирующейся ткани
In vivo
In vitro
ГСК ПК
кровь
+
+
ГСК ПК
кардиомиоциты
+
+
ГСК
Нервная
+
+
ГСК ПК
печень
+
+
ГСК ПК
кардиомиоциты
+
+
ГСК ПК
легкие
+
-
ГСК ПК
почки
+
-
ГСК ПК
кожа
+
-
ГСК ПК
Эпителий кишечника
+
-
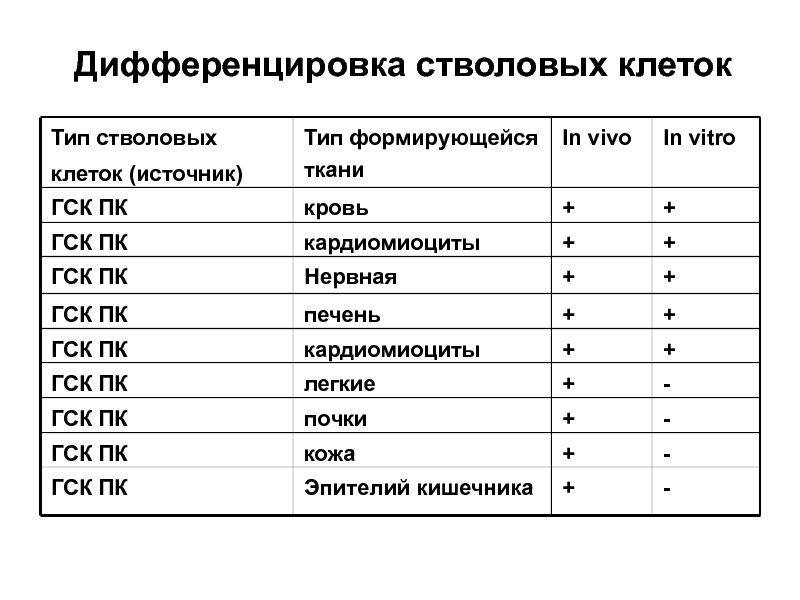
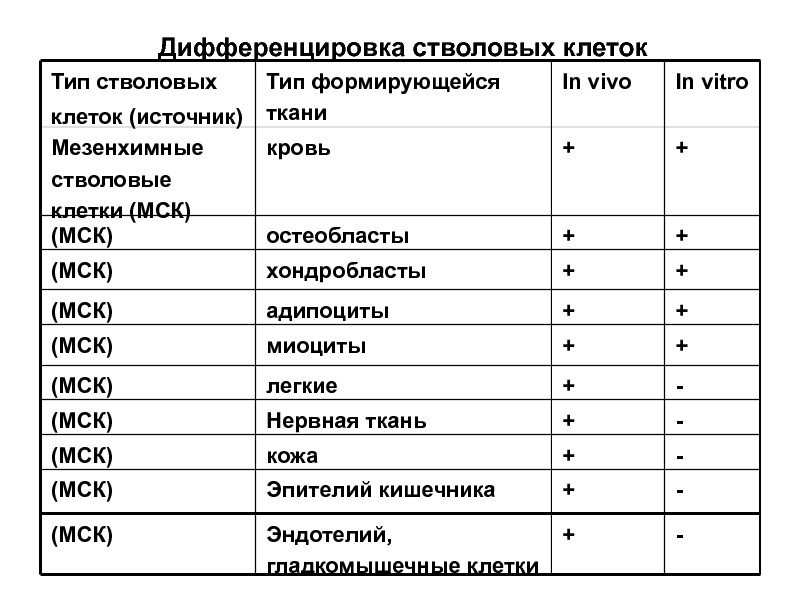
Слайд 17Дифференцировка стволовых клеток
Тип стволовых
клеток (источник)
Тип формирующейся ткани
In vivo
In vitro
Мезенхимные стволовые клетки
кровь
+
+
(МСК)
остеобласты
+
+
(МСК)
хондробласты
+
+
(МСК)
адипоциты
+
+
(МСК)
миоциты
+
+
(МСК)
легкие
+
-
(МСК)
Нервная ткань
+
-
(МСК)
кожа
+
-
(МСК)
Эпителий кишечника
+
-
(МСК)
Эндотелий, гладкомышечные клетки
+
-
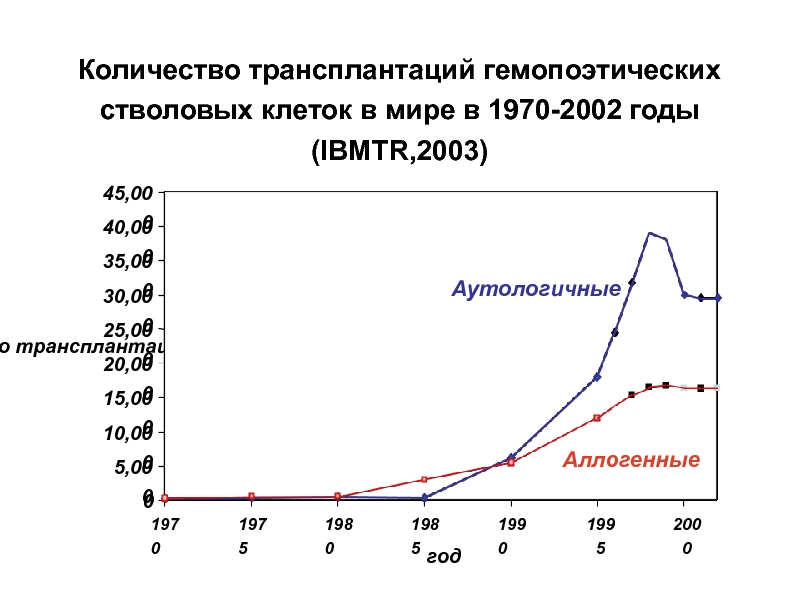
Слайд 18Количество трансплантаций гемопоэтических стволовых клеток в мире в 1970-2002 годы (IBMTR,2003)
число
год
1970
1975
1980
1985
1990
1995
Аутологичные
Аллогенные
2000
0
5,000
10,000
15,000
20,000
25,000
30,000
35,000
40,000
45,000
Слайд 19
1). ТРАНСПЛАНТАЦИЯ
АЛЛОГЕННЫХ
СТВОЛОВЫХ КЛЕТОК
- Трансплантация аллогенного костного мозга
- Трансплантация
аллогенных
стволовых клеток
- Трансплантация клеток
пуповинной крови
- HLA-совместимых от донора-
pодственника
- HLA-частично-совместимых от
донора-родственника
- HLA-совместимых от неродственного донора
- HLA-частично-совместимых от неродственного донора
2). ТРАНСПЛАНТАЦИЯ
АУТОЛОГИЧНЫХ
СТВОЛОВЫХ КЛЕТОК
- Трансплантация аутологичного
костного мозга
- Трансплантация аутологичных
периферических стволовых клеток
- С ОЧИСТКОЙ
- БЕЗ ОЧИСТКИ
3). ТРАНСПЛАНТАЦИЯ СИНГЕННЫХ
СТВОЛОВЫХ КЛЕТОК
4).” МИНИ”- ТРАНСПЛАНТАЦИЯ
5). ТРАНСПЛАНТАЦИЯ EX VIVO МОДИФИЦИРОВАННЫХ КЛЕТОК
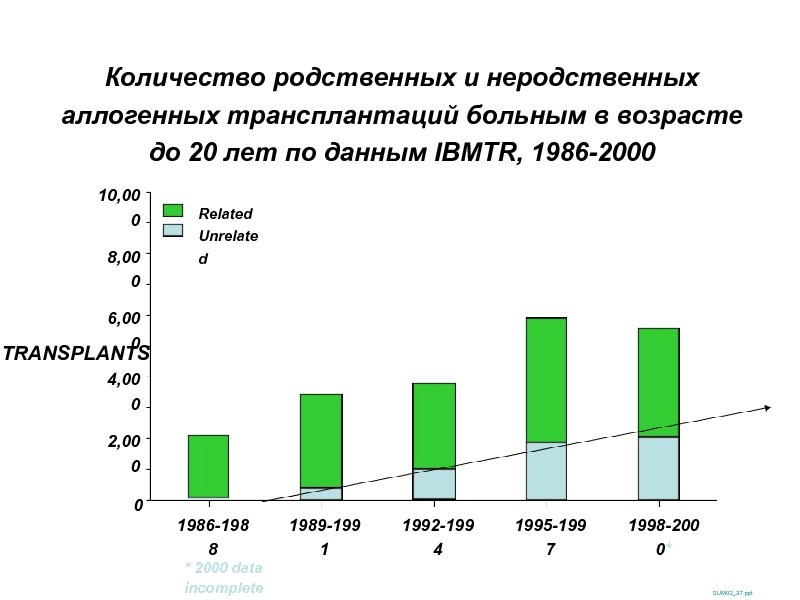
Слайд 20Количество родственных и неродственных аллогенных трансплантаций больным в возрасте до 20
SUM02_37.ppt
TRANSPLANTS
10,000
0
2,000
4,000
6,000
8,000
1986-1988
1989-1991
1992-1994
1995-1997
1998-2000*
* 2000 data incomplete
Related
Unrelated
Слайд 21Трансплантация ex vivo модифицированных клеток находит клиническое применение при решении следующих
культивирование аутологичных стволовых клеток для снижения контаминации опухолевыми клетками. Чаще проводят у больных с солидными опухолями, но возможно и у больных гемобластозами при использовании культуральной системы с нормальной подложкой;
наращивание количества стволовых клеток при невозможности заготовки их достаточного количества и при выполнении двойной трансплантации стволовых клеток; наращивание стволовых клеток пуповинной крови для трансплантации взрослым больным (вес > 40 кг);
проведение генной терапии
Слайд 22Трансплантация аллогенных стволовых клеток используется для
Замещения дефектного гемопоэза после высокодозной
Замещения дефектного гемопоэза при наследственных заболеваниях с нарушением гемопоэза и иммунитета
Проведения клеточной терапии (иммунотерапии) химиорезистентных опухолей
Слайд 23Методология аллогенной трансплантации гемопоэтических стволовых клеток
Основные этапы выполнения аллогенной трансплантации стволовых
предтрансплантационная подготовка больного,
подбор/поиск HLA совместимого донора,
кондиционирование к трансплантации,
заготовка стволовых клеток крови (оценка количественной и качественной полноценности трансплантата),
инфузия/трансплантация стволовых клеток,
иммуносупрессивная терапия (профилактика отторжения трансплантата и реакции трансплантат против хозяина)
профилактика токсических и инфекционных осложнений
проведение иммуномодулирующей терапии
оценка полноты химеры костного мозга
Слайд 24Предтрансплантационная подготовка больного к аллогенной трансплантации стволовых клеток
Достижение полной клинико-гематологической ремиссии
Достижение полного или частичного гематологического ответа у больных хроническим миелолейкозом в хронической фазе, достижение второй хронической фазы у больных с бластным кризом или фазой акселерации
- Профилактика сенсибилизации и цитомегаловирусной инфекции при проведении гемокомпонентной терапии
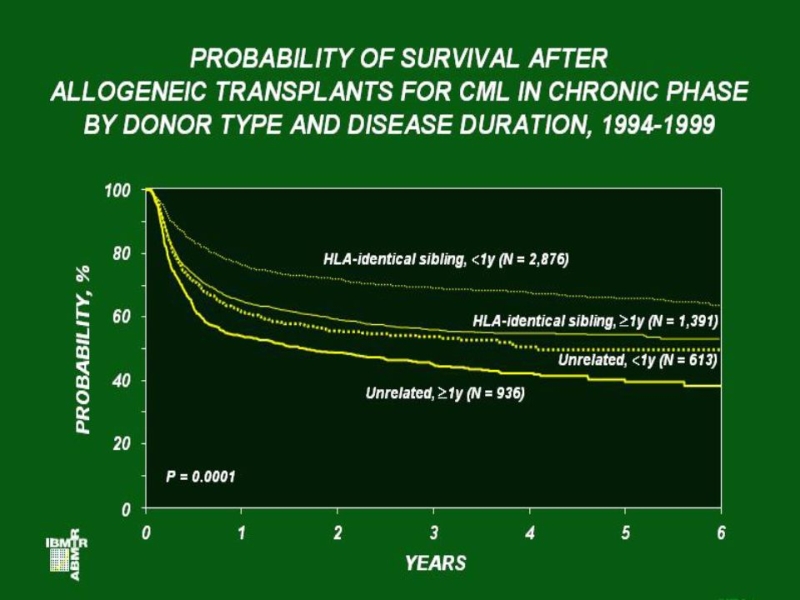
Слайд 25Общая выживаемость больных ХМЛ после аллогенной трансплантации костного мозга в зависимости
Слайд 26Эффективность аллогенной трансплантации стволовых клеток при апластической анемии в зависимости от
Слайд 27Подбор/поиск HLA-совместимого донора
Этапность подбора донора
Этапность обследования
HLA-совместимый сиблинг или донор-родственник
HLA-совместимый неродственный
(запрос в донорский регистр)
3. HLA-частично-совместимый родственный или неродственный донор
Допуск в соответствии с инструкциями для доноров крови (>18 <60 лет)
HLA типирование по локусам А,В, DR
исследование на носительство вирусов (вирус иммунодефицита 1 и 2 типа, человеческий Т-лимфотропный вирус, вирус гепатита В, гепатита С, ЦМВ и др).
определение больших и малых эритроцитарных антигенов
Слайд 28Заготовка клеток пуповинной крови
не менее 3х107/кг веса больного мононуклеарных клеток,
не менее 1,2 х 105/кг веса больного CD34+ клеток
Эффективность заготовки стволовых клеток – 80%
Слайд 29Обязательным компонентом трансплантации аллогенных гемопоэтических клеток является проведение химиолучевой подготовки или
Слайд 32Общая выживаемость больных апластической анемией после неродственной и родственной частично-совместимой по
Слайд 33Ранняя смертность (100 дней) после аллогенной трансплантации стволовых клеток
SUM02_39.ppt
MORTALITY, %
100
0
20
40
60
80
464
359
1,267
90
67
952
AML
ALL
CML
MDS
Aplastic
Anemia
Immune
Deficiency
Numbers on
CR1
CR2+
Other
386
173
212
433
437
258
CP
AP
BP
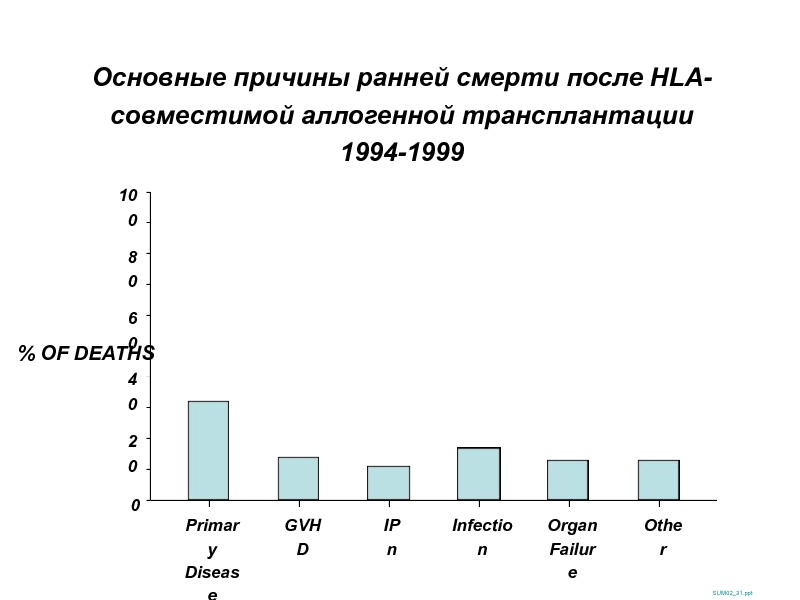
Слайд 34Основные причины ранней смерти после HLA-совместимой аллогенной трансплантации
1994-1999
SUM02_31.ppt
% OF DEATHS
100
0
20
40
60
80
Primary
Disease
GVHD
IPn
Infection
Organ
Failure
Other
Слайд 35Профилактика РТПХ
циклоспорин А 3-12,5 мг/кг с -1 дня до +100-й день
метотрексат 15 мг/м2 день +1-й,
10 мг/м2 день +3,+6,+11-й.
(селлсепт, глюкокортикоиды, АТГ,
Т-деплеция, Г-КСФ,такролимус)
Слайд 36Профилактика токсических и инфекционных осложнений
Форсированный диурез
Аллопуринол
Дифенин
Гепарин
Деконтаминация кишечника
Ацикловир (ганцикловир)
Бисептол
Флуконазол
Внутривенные иммуноглобулины
Слайд 37Оценка приживления донорских стволовых стволовых клеток
Гематологические показатели
Цитогенетическое исследование
Молекулярно-генетическое исследование (ПЦР,
Большие и малые эритроцитарные антигены
Слайд 38Ранние осложнения аллогенной трансплантации стволовых клеток
Острая реакция трансплантат против хозяина
Геморрагический цистит
Венооклюзионная
Капиллярный leak синдром
Синдром приживления
Диффузные альвеолярные геморрагии
Тромботическая микроангиопатия
Синдром полиорганной дисфункции
Инфекционные осложнения
Геморрагические осложнения
Гемолитическая анемия
отторжение/неприживление стволовых клеток
Слайд 40Поздние осложнения аллогенной трансплантации стволовых клеток
Хроническая РТПХ
Инфекционные осложнения
Фиброз легких
Эндокринная недостаточность
Катаракта
Отставание
Вторичные опухоли
Аменорея, бесплодие
Слайд 41Аутологичная трансплантация гемопоэтических стволовых клеток выполняется с целью восстановления гемопоэза после
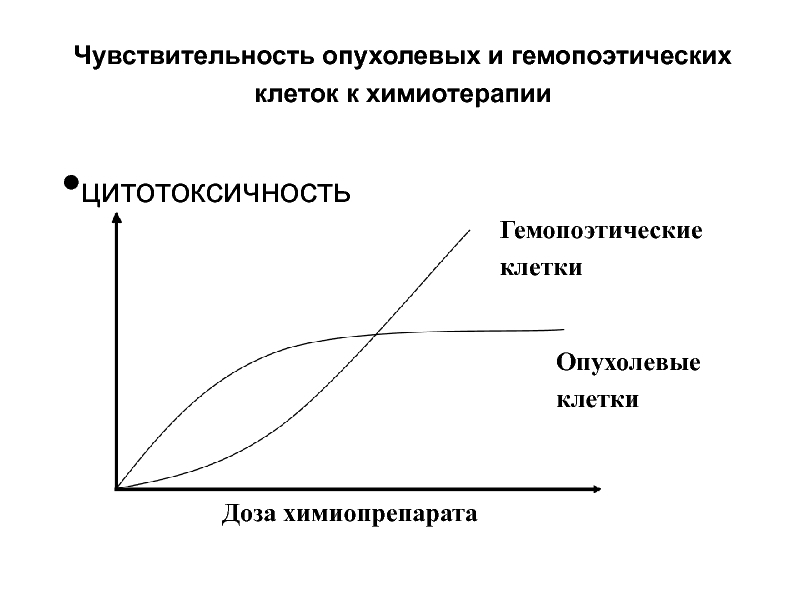
Слайд 42цитотоксичность
Чувствительность опухолевых и гемопоэтических клеток к химиотерапии
Опухолевые клетки
Гемопоэтические клетки
Доза химиопрепарата
Слайд 43Методология аутологичной трансплантации гемопоэтических стволовых клеток
Основные этапы выполнения аутологичной трансплантации стволовых
предтрансплантационная подготовка больного,
заготовка аутотрансплантата (оценка количественной и качественной полноценности трансплантата, очистка?),
кондиционирование к трансплантации,
профилактика токсических и инфекционных осложнений
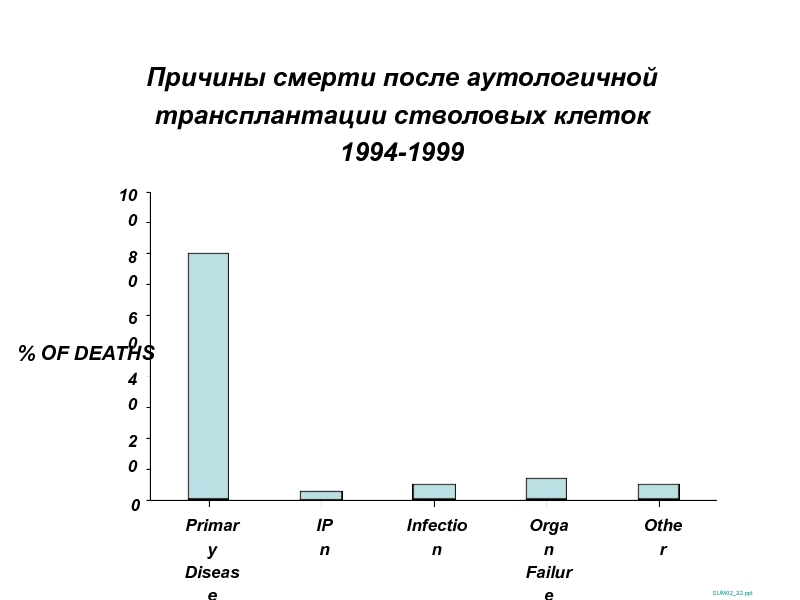
Слайд 44Причины смерти после аутологичной трансплантации стволовых клеток
1994-1999
SUM02_32.ppt
% OF DEATHS
100
0
20
40
60
80
Primary
Disease
IPn
Infection
Organ
Failure
Other
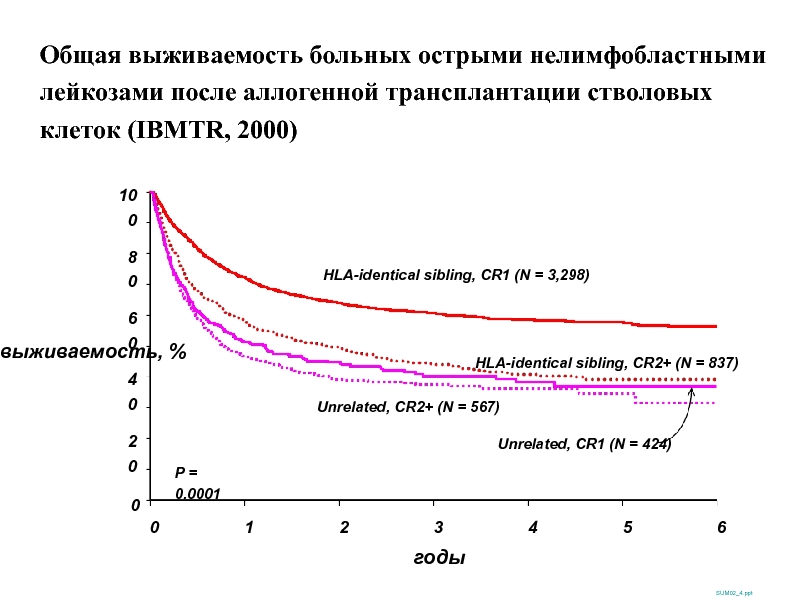
Слайд 46выживаемость, %
100
0
20
40
60
80
0
годы
SUM02_4.ppt
P = 0.0001
HLA-identical sibling, CR1 (N = 3,298)
HLA-identical sibling, CR2+
Unrelated, CR1 (N = 424)
Unrelated, CR2+ (N = 567)
1
2
3
4
6
5
Общая выживаемость больных острыми нелимфобластными лейкозами после аллогенной трансплантации стволовых клеток (IBMTR, 2000)
Слайд 47Общая выживаемость больных острыми лимфобластными лейкозами после алллогенной трансплантации стволовых клеток
выживаемость, %
100
0
20
40
60
80
0
годы
SUM02_6.ppt
P = 0.0001
1
2
3
4
6
5
HLA-identical sibling, CR1 (N = 561)
HLA-identical sibling, CR2+ (N = 962)
Unrelated, CR2+ (N = 805)
Unrelated, CR1 (N = 280)
Слайд 50
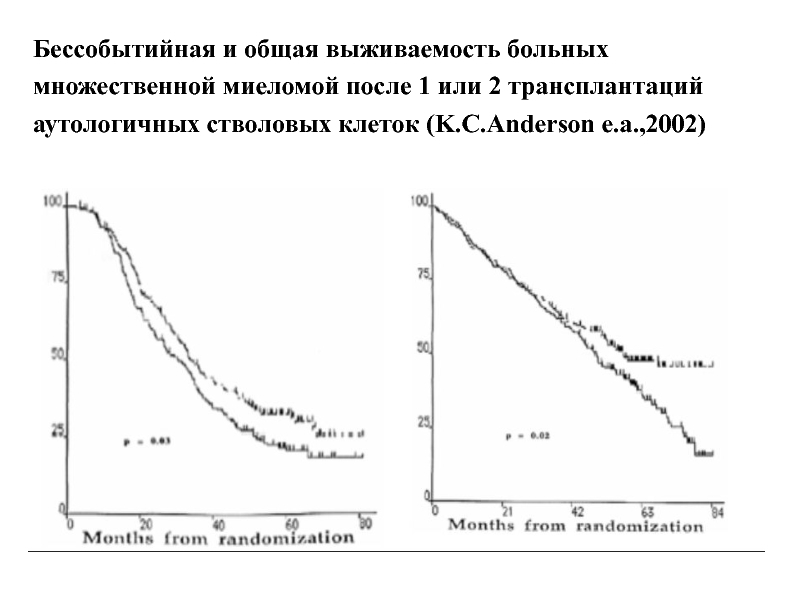
Бессобытийная и общая выживаемость больных
множественной миеломой после 1 или 2
аутологичных стволовых клеток (K.C.Anderson e.a.,2002)
Слайд 51Эффективность трансплантации гемопоэтических стволовых клеток от HLA-совместимого донора родственника у больных
Слайд 53Концептуальная основа для трансплантации стволовых клеток при аутоиммунных заболеваниях
Эрадикация иммунных эффекторов
Восстановление
Восстановление иммунной системы (без аутореактивности) за счет приживления трансплантата
Выключение пусковых механизмов заболевания
Противовоспалительный эффект – профилактика необратимых изменений органов
Стимуляция репарационных процессов в поврежденных тканях
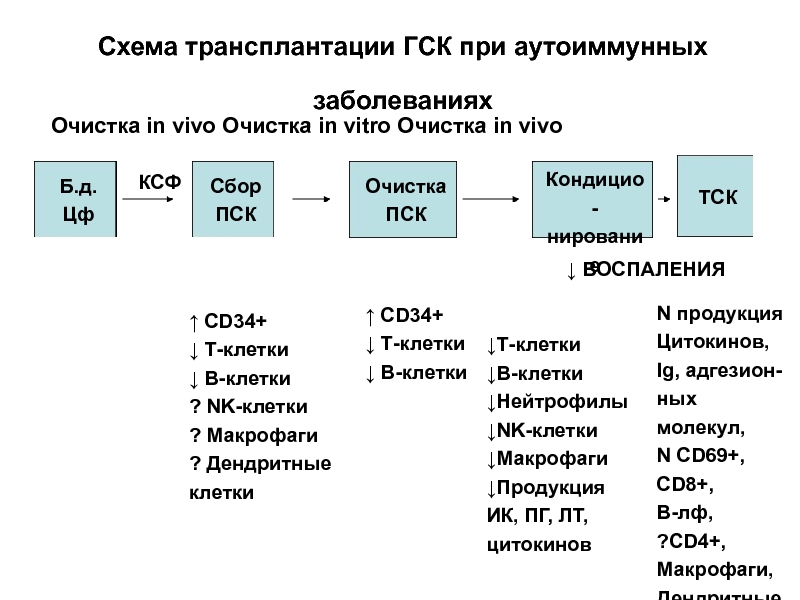
Слайд 54Схема трансплантации ГСК при аутоиммунных заболеваниях
Очистка in vivo Очистка in
Б.д. Цф
Сбор
ПСК
Очистка
ПСК
Кондицио-
нирование
ТСК
КСФ
↓ ВОСПАЛЕНИЯ
↑ CD34+
↓ Т-клетки
↓ В-клетки
? NK-клетки
? Макрофаги
? Дендритные
клетки
↑ CD34+
↓ Т-клетки
↓ В-клетки
↓Т-клетки
↓В-клетки
↓Нейтрофилы
↓NK-клетки
↓Макрофаги
↓Продукция
ИК, ПГ, ЛТ,
цитокинов
N продукция
Цитокинов,
Ig, адгезион-
ных молекул,
N СD69+,
CD8+,
В-лф,
?CD4+,
Макрофаги,
Дендритные
клетки
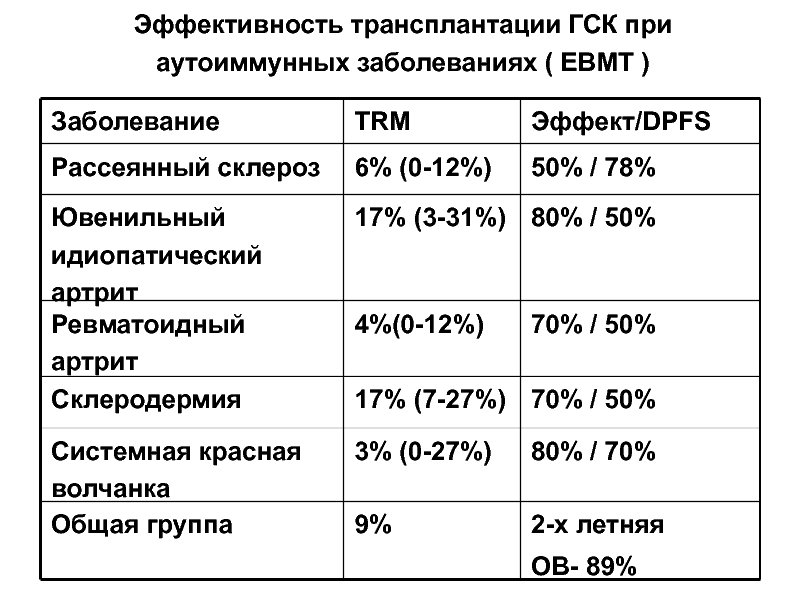
Слайд 55Эффективность трансплантации ГСК при аутоиммунных заболеваниях ( EBMT )
Заболевание
TRM
Эффект/DPFS
Рассеянный склероз
6% (0-12%)
50%
Ювенильный идиопатический артрит
17% (3-31%)
80% / 50%
Ревматоидный артрит
4%(0-12%)
70% / 50%
Склеродермия
17% (7-27%)
70% / 50%
Системная красная волчанка
3% (0-27%)
80% / 70%
Общая группа
9%
2-х летняя
ОВ- 89%
Слайд 56Трансплантация стволовых клеток в лечении сахарного диабета
Трансплантация аутологичных стволовых клеток для
Трансплантация аутологичных стволовых клеток для лечения макроангиопатий (диабетической стопы) при диабете II типа
Слайд 57Использование стволовых клеток у экспериментальных животных в ранний постинфарктный период снижает
(Orlic D et al., 2001)
Слайд 58Потенцильные возможности терапии ГСК в кардиологии
Дифференцировка в кардиомиоциты
Ангиогенез
Ишемическая болезнь сердца
ОИМ
стенокардия
ишемическая кардиомиопатия – сердечная недостаточность
Дилятационная кардиомиопатия
Поддерживающая терапия при хирургической коррекции пороков сердца
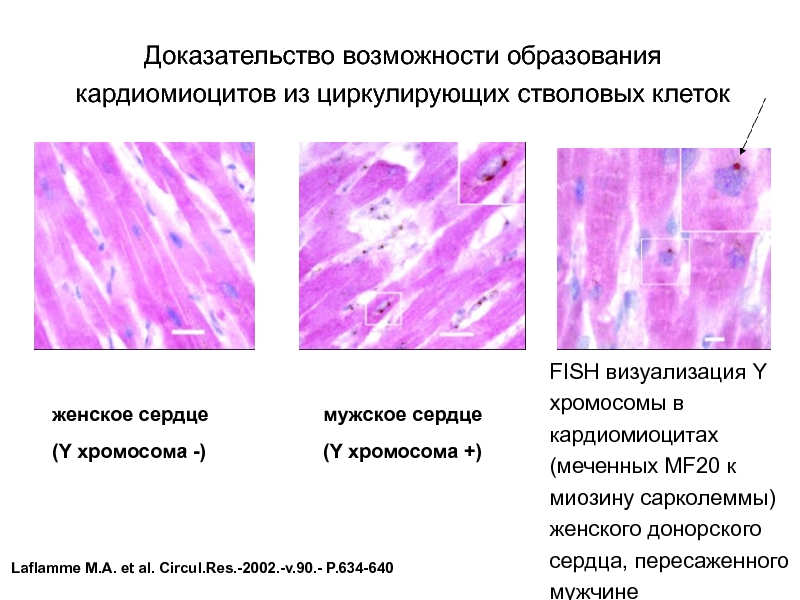
Слайд 59Доказательство возможности образования кардиомиоцитов из циркулирующих стволовых клеток
FISH визуализация Y хромосомы
женское сердце
(Y хромосома -)
мужское сердце
(Y хромосома +)
Laflamme М.А. et al. Circul.Res.-2002.-v.90.- P.634-640
Слайд 60
Методы введения стволовых клеток
в/в введение
интракоронарное введение при коронароангиографии
интрамиокардиальное катетерное введение со
интракоронарное введение при операции АКШ
интрамиокардиальное введение при операции АКШ
В настоящее время в литературе имеются ссылки о 400 пациентах, которым выполнена трансплантация стволовых клеток
Слайд 61Возможные эффекты введения стволовых клеток у больных ИБС
Снижение функционального класса стенокардии
Увеличение
Увеличение фракции выброса
Уменьшение ремоделирования миокарда после ОИМ
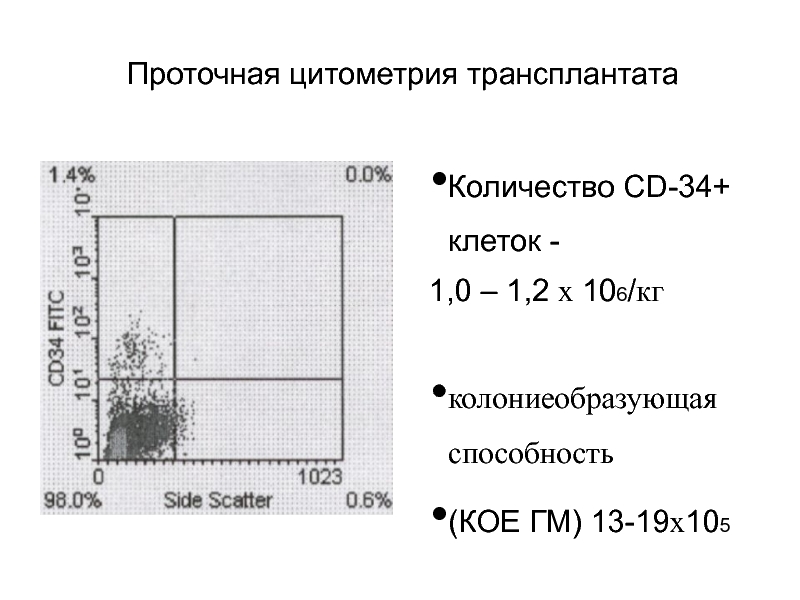
Слайд 62Проточная цитометрия трансплантата
Количество CD-34+ клеток -
1,0 – 1,2 х 106/кг
колониеобразующая способность
(КОЕ ГМ) 13-19х105
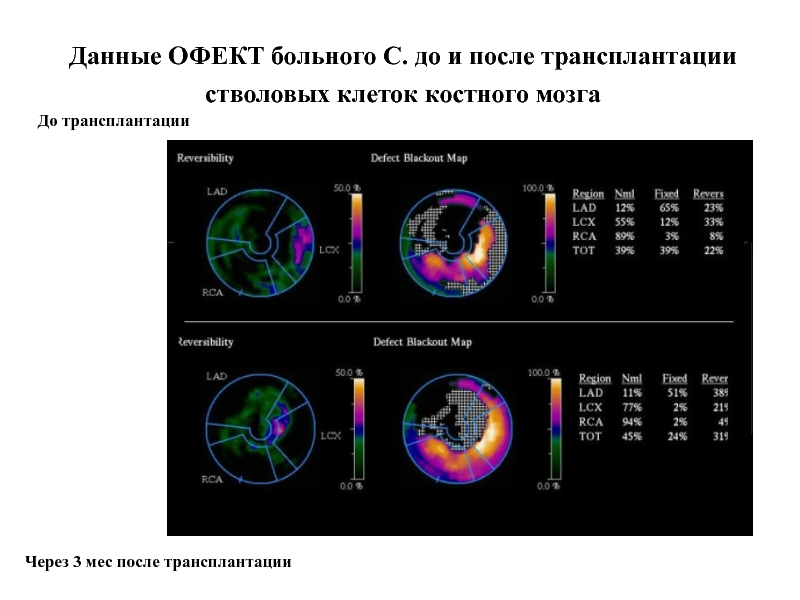
Слайд 63Данные ОФЕКТ больного С. до и после трансплантации стволовых клеток костного
До трансплантации
Через 3 мес после трансплантации