Слайд 1Системная красная волчанка
системное аутоиммунное заболевание неизвестной этиологии, характеризующееся
гиперпродукцией органоспецифических
ауто-АТ к различным компонентам клеточного ядра с
развитием иммуновоспалительного повреждения тканей и внутренних органов
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ СКВ (2014)
Слайд 2Эпидемиология
Заболеваемость от 4 до 250 случаев на 100 000 населения
В
Европейской популяции 40:100 000
Заболеваемость в 2-4 раза выше среди чернокожих, испанцев, азиатов
Преимущественно болеют женщины детородного возраста (70% в возрасте 14 - 40 лет)
Соотношение Ж:М=8-10:1.
Смертность при СКВ в 3 раза выше, чем в популяции.
~30% теряют трудоспособность в первые 5-6 лет
Высокая стоимость лечения и мониторинга: прямые расходы на лечение пациента с СКВ в год оцениваются в 13,5 - 21 тыс. долларов (США)
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ СКВ (2014)
Слайд 3Этиопатогенез
Этиология СКВ не известна, но за последние 10 лет, получены данные,
позволяющие построить рабочую модель СКВ, служащую обоснованием для современной терапии.
Взаимодействие между предрасполагающими генами и факторами внешней среды проявляется патологическим иммунным ответом, который имеет свои особенности среди разных пациентов с СКВ.
Иммунный ответ может включать:
1) сниженный клиренс ИК и апоптозных клеток;
2) активацию клеток врожденного иммунитета (дендритных, моноцитов/монофагов) эндогенными ДНК, РНК;
3) снижение порога активации и аномальную передачу сигнала в клетках приобретенного иммунитета (T и B лимфоцитах);
4) неэффективную регуляторную функцию CD4+ и CD8+ T клеток.
Слайд 4К настоящему времени обнаружено >50 генов, ассоциированных с СКВ, но их
функция остается плохо изученной.
Классификация генов, вовлеченных в СКВ (4 категории):
гены, влияющие на клиренс дебриса апоптотических клеток, хроматина и ИК;
гены, влияющие на сигналлинг в клетках врожденного иммунитета, в особенности активация NF-kB и ИФН-I сигнальный путь;
гены, влияющие на активацию лимфоцитов, В-клеток;
гены, действующие в почках и способствующие их повреждению.
Слайд 51.Обнажение ядерных антигенов
Развитие СКВ - многофакторный процесс,
внеклеточная экспозиция внутриклеточных АГ
- 1-я ступень, лежащая в основе аутоиммунного ответа.
Ядерные Аг (ДНК, гистоны и рибонуклеарные протеины) являются мишенью АТ при СКВ
Эти ядерные Аг обычно находятся в недосягаемости для иммунной системы, так как они изолированы клеточной и ядерной мембранами.
Основный источник ядерных Аг – нейтрофилы
Нейтрофилы, не погибшие в зоне воспаления, самоуничтожаются путем апоптоза (срок жизни нейтрофилов - 3 нед).
Пути уничтожения патогена: фагоцитоз, дегрануляция и образование нейтрофильных экстракапиллярных ловушек (NET) – недавно открытый эффективный способ уничтожения микроорганизмов.
Слайд 6
Дефекты апоптоза и несвоевременное удаление апоптозных тел – важная причина появления
АНА при СКВ
В N апоптоз - запрограммированная гибель дефектных, стареющих клеток. Запускается активацией иммунорецептора программной клеточной смерти (PD-1).
Синтезируются ферменты, расщепляющие геномную ДНК на нуклеосомные сегменты, окруженные кариолеммой.
На поверхности клетки образуются выпячивания цитоплазмы, содержащие фрагменты ядра, которые отшнуровываются, образуя апоптозные тела, фагоцитируемые АПК.
В АПК происходит их процессинг, и эндогенные пептиды в комплексе с молекулой HLA II класса презентируются Т-клеткам, которые в N к ним толерантны.
Апоптозные клетки вследствие разных дефектов являются важным источником ауто-Аг при СКВ (большое количество ДНК, гистонов, рибонуклеарных протеинов вне клеток)
Dieker и др. NDN 2004, 19:282)
А- норма
Б
Слайд 7
>70% компонентов NET – компоненты потенциальных ауто-Аг при СКВ и других
аутоиммунных болезнях. Возрастающая аутореактивность NET – результат чрезмерного неттоза или уменьшенного клиренса NET.
Известно, что введение ДНК-азы (вызывает деградацию NET) вызывает подавление образования NET и предупреждает воспаление сосудов, например при АНЦА-В, подтверждая роль NETs в патогенезе и новые возможности лечения аутоиммунных болезней.
Чрезмерный неттоз (NETs, neutrophil extracellular traps)– источник ауто-Аг при СКВ, АНЦА-В
Механизм высвобождения NET
А) Стимуляция рецепторов нейтрофилов триггерами ведет к их адгезии к эндотелию и B)деконденсации хроматина вследствие его расщепления нейтрофильной эластазой и МПО и цитруллинированию гистона под действием PAD4. С) В конечной фазе высвобождаются нити ДНК, образующие сеть (NETs) и захватывают патогены.
Слайд 8Опсонизация и удаление апоптотических телец, ядерного материала
В развитие СКВ, играют
роль гены, влияющие на уровень циркулирующего доступного хроматина, появляющего в результате апоптоза клеток и накапливающегося в виде ИК.
Опсонизация апоптотических телец сывороточными протеинами играет основную роль в их удалении.
Опсонин C1q (компонент комплемента) участвует в удалении NET, хроматина. C1q -дефицитные мыши образуют антиядерные АТ; у всех пациентов с дефицитом C1q развивается СКВ (у пациентов с СКВ часто находят АТ против C1q).
Другие белки системы комплемент (C2, C3, C4), опсонины, регулирующие удаление дебриса апоптотических клеток, включая MBL2 (манноза-связывающий лектин), СРБ, рецепторы к Ig, комплементу на фагоцитах (Fcγ-рецепторы) для удаления опсонированных телец из циркуляции ассоциированы с развитием СКВ
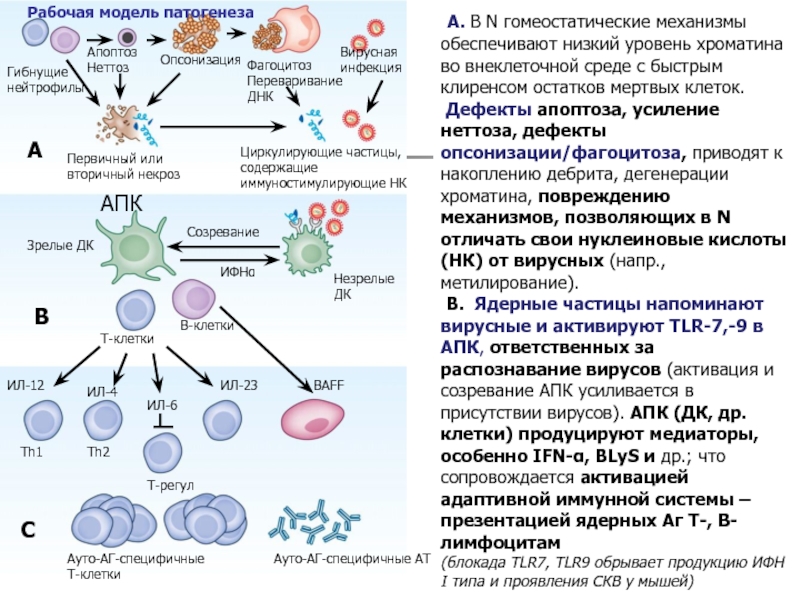
Слайд 9 А. В N гомеостатические механизмы обеспечивают низкий уровень хроматина во
внеклеточной среде c быстрым клиренсом остатков мертвых клеток.
Дефекты апоптоза, усиление неттоза, дефекты опсонизации/фагоцитоза, приводят к накоплению дебрита, дегенерации хроматина, повреждению механизмов, позволяющих в N отличать свои нуклеиновые кислоты (НК) от вирусных (напр., метилирование).
В. Ядерные частицы напоминают вирусные и активируют TLR-7,-9 в АПК, ответственных за распознавание вирусов (активация и созревание АПК усиливается в присутствии вирусов). АПК (ДК, др. клетки) продуцируют медиаторы, особенно IFN-α, BLyS и др.; что сопровождается активацией адаптивной иммунной системы –презентацией ядерных Аг Т-, В-лимфоцитам
(блокада TLR7, TLR9 обрывает продукцию ИФН I типа и проявления СКВ у мышей)
Гибнущие нейтрофилы
Апоптоз
Неттоз
Опсонизация
Фагоцитоз
Переваривание
ДНК
Вирусная
инфекция
Первичный или вторичный некроз
Циркулирующие частицы, содержащие иммуностимулирующие НК
Незрелые ДК
Созревание
ИФНα
Зрелые ДК
В-клетки
BAFF
Т-клетки
ИЛ-12
ИЛ-4
ИЛ-6
ИЛ-23
Т-регул
Th1
Th2
Ауто-АГ-специфичные АТ
Ауто-АГ-специфичные
Т-клетки
А
В
С
АПК
Рабочая модель патогенеза
Слайд 10Взаимодействия и сигнальные каскады, включающие известные гены, ассоциированные с СКВ (Fcγ-рецепторы,
TLR, молекулы системы клеточных сигналов и т.д.)
Аномальная лимфоцитарная пролиферация – ведущий признак при СКВ
гены, влияющие на активацию лимфоцитов, В-клеток;
гены, влияющие на сигналлинг врожденного иммунитета, в особенности активация NF-kB и ИФН-I сигнальный путь;
АПК
Слайд 11С. Аномальная поликлональная активация В-клеток, в которой участвуют все иммунные клетки
(ДК, Тh, В-кл, плазмоциты).
Снижение порога активации, аномальная передача сигнала в Т- и В-клетках, неэффективная регуляторная функция T клеток, активация митогенов (напр., MDM2, который специфически активируется при распознавании ДНК).
Результат взаимодействий 3-х клеточных типов - системная активация иммунитета с генерацией эффекторных Т-кл и ауто-АТ против собственных тканей и органов
Гибнущие нейтрофилы
Апоптоз
Неттоз
Опсонизация
Фагоцитоз
Переваривание
ДНК
Вирусная
инфекция
Первичный или вторичный некроз
Циркулирующие частицы, содержащие иммуностимулирующие Аг
Незрелые ДК
Созревание
ИФНα
Зрелые ДК
В-клетки
BAFF
Т-клетки
ИЛ-12
ИЛ-4
ИЛ-6
ИЛ-23
Т-регул
Th1
Th2
Ауто-АГ-специфичные АТ
Ауто-АГ-специфичные
Т-клетки
А
В
С
АПК
Рабочая модель патогенеза (продолжение)
Слайд 12BLyS, или фактор, активирующий В-лимфоциты (В-се11 activating factor, BAFF), цитокин, который
играет важную роль в селекции, созревании и выживаемости В-лимфоцитов.
Иммунные клетки (моноциты/макрофаги, дендритные клетки, Т-лимфоциты и активированные нейтрофилы), участвуют в продукции BLyS
Избыточная экспрессия BLyS ведет к гиперплазии В-лимфоцитов; увеличенная популяция аутореактивных В-лимфоцитов может привести к продукции ауто-АТ
было выявлено повышение уровней BLyS у пациентов с СКВ и другими аутоиммунными заболеваниями, а также связь между уровнем BLyS и активностью СКВ и титром АТ к ДНК
Слайд 13
УФЛ (вызывают обострение у ~70%): увеличивают нагрузку мертвыми клетками,
ядерным материалом за счет усиленной гибели кератоцитов.
Лекарства (напр., прокаинамид, гидралазин): подавление трансфераз, осуществляющих метилирование НК, что нарушает «маскировку» эндогенных НК и увеличивает активацию ими TLR7 и TLR9.
Вирусы – индуцирует высвобождение ИФН-α, активацию иммунитета
1.Гены
Внешняя среда
2. Ненормальный иммунный ответ
3. Ауто-АТ
Иммунные комплексы
4. Ауто-воспаление
5. Повреждение
Сыпь
Нефрит
Артрит
Лейкопения
Поражение ЦНС
Кардит
Тромбозы
Другое
Патогенез СКВ
Слайд 14Стандартный профиль ауто-АТ для диагностики СКВ
СКВ характеризуется широким диапазоном аутоАТ; причем,
напр., АТ к ДНК, гистонам, обнаруживаются в сыворотке пациентов за многие годы до проявления СКВ; нарастающее их накопление предшествует дебюту СКВ
Слайд 15Слева: Периферическое (краевое) свечение; ассоциируется с АТ к дсДНК (СКВ).
Справа
: Гомогенное свечение, ассоциируется с АТ к ДНК (двух и односпиральной), гистонам (СКВ, лекарственная волчанка, любые аутоиммунные ревматические заболевания (РЗ) и неревматические болезни)
Оценка результатов - с указанием максимального титра обнаружения АНФ в сыворотках, а также интенсивности и типа ИФ. Характер свечения отражает присутствие различных типов АНА, в определенной степени специфичных для ряда аутоиммунных РЗ.
Слайд 16Стандартный профиль ауто-АТ для диагностики СКВ-2
Слайд 17Стандартный профиль ауто-АТ для диагностики СКВ-3
Слайд 18Стандартный профиль ауто-АТ для диагностики СКВ-4
Слайд 19Стандартный профиль ауто-АТ для диагностики СКВ
Слайд 20Диагностика
Диагноз СКВ должен быть обоснован наличием клинических проявлений и данными лабораторных
исследований.
Для подтверждения диагноза требуется не менее 4 из 11 критериев ACR (1997)
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
www.rheumatolog.ru/experts/klinicheskierekomendacii
Утверждены 05.10.2013
Слайд 21Диагностические критерии СКВ (ACR, 1997)
Слайд 22Диагностические критерии СКВ (ACR, 1997), прод
ИТОГО: |4__|__| из 11 критериев
Слайд 23SLICC диагностические критерии СКВ (2012)
В 2012 году группой Systemic Lupus International
Collaborating Clinics (SLICC) предложены новые критерии СКВ, рекомендуемые при включения пациента в клиническое исследование. По сравнению с ACR, более стратифицированы субтипы аутоАТ, оценена важность С, допускается, что ВН может быть «единственным проявлением» СКВ.
Клинические критерии:
Острое активное поражение кожи
Хроническая кожная волчанка
Язвы слизистой ротовой/носовой полости;
Нерубцевая алопеция
Артрит
Серозит
Поражение почек
Нейропсихические проявления
Гемолитическая анемия
Лейкопения/лимфопения;
Тромбоцитопения.
Слайд 24SLICC диагностические критерии СКВ (2012) – прод.
Иммунологические критерии:
АНФ
Анти-дс-ДНК
анти-Sm
АФЛ;
Низкий комплемент (СЗ, С4);
Положительная
реакция Кумбса.
Для диагноза СКВ должно быть 4 признака, один из которых - любой иммунологический (а-ДНК, АНФ, а-SM, АТ к кардиолипину – a-KЛ, снижение C3, C4),
или,
ВН, доказанный биопсией + АНФ/анти-дсДНК.
Слайд 25Основная цель фармакотерапии СКВ
достижение ремиссии (или низкой активности);
снижение риска коморбидных заболеваний.
Основные препараты
глюкокортикоиды (ГК),
цитостатики
аминохинолиновые препараты
Белимумаб (Бенлиста,) одобрен FDA 9 марта 2011
Оценка эффекта терапии должна основываться на стандартизованных индексах (BILAG, SELENA-SLEDAI-Systemic Lupus Erythematosus Disease activity score, SRI, SFI, индекс глобальной оценки состояния пациента – PGA, и др.)
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ СКВ (2014)
Слайд 26Классификация волчаночного нефрита (ISN/RPS, 2003)
Слайд 27МОРФОЛОГИЧЕСКАЯ ОЦЕНКА
ВОЛЧАНОЧНОГО НЕФРИТА
ПРИЗНАКИ АКТИВНОСТИ
Пролиферация (сегментарная/диффузная) клеток клубочка
Лейкоцитарная инфильтрация
Кариорексис
Отложения фибрина
вдоль ГБМ (особенно свежие)
«Проволочные петли»
Гематоксилиновые тельца
Гиалиновые «тромбы» капилляров
Субэндотелиальные депозиты
Инфильтрация интерстиция лимфоидными и плазмати-ческими клетками
ПРИЗНАКИ ХРОНИЗАЦИИ
Гиалинизированные клубочки со склерозированием
Утолщенные ГБМ
Фиброзные полулуния
Перигломерулярный склероз
Атрофия канальцев
Интерстициальный фиброз
Слайд 28Гематоксилиновые тельца (длинные стрелки) описаны в 1920
Единственный морфологический патогномоничный признак SLE.
Чаще встечается в клубочках, редко – в сосудистой стенке и канальцах. Связаны с кариорексисом
Слайд 29Фибриноидный некроз
Разрывы ГБМ
Полулуния: клеточные, фиброзноклеточные
Слайд 30Субэндотелиальные депозиты, гиалиновые «тромбы»
Гиалиновый «тромб» в гломерулярном капилляре при ВН
Диффузный пролиферативный ВН. Массивные электронноплотные субэндотелиальные и небольшие эпимембранозные депозиты
Гиалиновый тромб в капилляре
Слайд 31Изменения типа проволочной петли (Klemperer, 1920-е)
Утолщенные преломляющие лучи капиллярные стенки при
H&E окраске – результат субэндокапиллярных круговых депозитов
Признаки диффузного пролиферативного ГН
Отсутствие истинного утолщения ГБМ
Слайд 32Полулуния внутри клубочков, состоящие из пролиферирующих эпителиальных клеток. Одна из причин
БПГН - волчаночный нефрит. Капиллярные петли левого клубочка значительно утолщены – симптом «проволочных петель», характерный для СКВ.
Слайд 33СКВ патология-ультраструктуры
Электронноплотные депозиты и вирусоподобные частицы (тубуло-ретикулярные структуры) в цитоплазме эндотелия
Слайд 34Тубулоретикулярные включения в эндотелиоцитах (встречаются при СКВ и ВИЧ-нефропатии).
Слайд 35Депозиты по типу «отпечатков пальцев»
Слайд 36Признаки хронизации (склероза) - 2004
Клубочковый склероз (сегментарный, глобальный)
Фиброзные спайки
Фиброзные полулуния
Слайд 37Волчаночный нефрит –
тубулоинтерстициальные изменения
Чаще акцент на изменениях в клубочках, однако
Корреляция почечной
функции и прогноза обычно с тубуло-интерстициальными изменениями
Экстрагломерулярные депозиты (стенки перитубулярных капилляров)
Слайд 38I и II кл. мезангиально-пролиферативного ВН
Класс I. Минимальный мезангиальный ВН
II. Мезангиально-пролиферативный
ВН
Признаки
Мезангиальные депозиты IF/EM
Нет СМ изменений (если нет IF/EM депозитов, то нет ВН)
Гиперклеточность мезангия
Мезангиальные иммунные депозиты (IF/EM)
Редкие мелкие депозиты в капиллярной стенке (IF/EM)
Если депозиты в капиллярной стенке определяются при СМ, то это означает более высокий класс ВН
Если склероз/рубцы, то более высокий класс ВН
ЭМ. ВН, класс II. Электронно-плотные депозиты С3 в мезангии
Слайд 39III. Очаговый (фокальный) ВН
Вовлечено
Мезангиальная пролиферация и/или депозиты
Сегментарные некрозы
A - активный: очаговый пролиферативный ВН
A/C- активный со склерозом: очаговый пролиферативный и склерозирующий ВН
C – хронический без активности – участки склероза в клубочках: фокальный склерозирующий ВН
СМ (серебрение по Джонсу). ВН класс III (А). Клубочек с сегментарной эндокапиллярной гиперклеточностью, мезангиальная гиперклеточность. Капиллярная стенка утолщена и начальный сегментарный капиллярный некроз
Слайд 40IV. Диффузный ВН
Вовлечено > 50% клубочков
Значительные субэндокапиллярные депозиты (диффузные и глобальные)
независимо от выраженности пролиферации – признак этого класса
IV-S - Диффузный сегментарный ВН
IV-G - Диффузный глобальный ВН
IV-S (A) –активный процесс: диффузный сегментарный ВН («проволочные петли»; такие индексы активности, как: некроз, полулуния, kaриорексис)
IV-S (C) диффузный сегментарный ВН склерозирующий (без активности)
IV-S (A/C) активность со склерозом (пролиферативный и склерозирующий ВН)
СМ. ВН, класс IV-S (A) Сегмент клубочка с эндокапиллярной гиперклеточностью , двойным контуром по типу проволочной петли и гиалиновым тромбом (ШИК)
ЭМ. ВН, класс IV-G (A). Массивные электронноплотные
субэндотелиальные и депозиты
ИФ. ВН, класс IV-G (A). Депозиты в мезангии и капиллярной стенке
ЭМ. ВН, класс IV-G (A). Полулуния, состоящие из пролиферирующих эпителиальных клеток. Капиллярные петли левого клубочка значительно утолщены – симптом «проволочных петель».
Слайд 41V и VI классы ВН
V. Мембранозный ВН
Субэпителиальные депозиты
Нет увеличения клеточности
A) чистый мембранозный ГН
B) ассоциированный с Мз повреждениями
C) ассоциированный с фокальными повреждениями
D) ассоциированный с диффузными повреждениями
VI. Склерозирующий (далеко зашедший) ВН
СМ (серебрение). ВН, класс V. Мембранозный ГН – массивные субэпителиальные иммунные депозиты с образованием выростов ГБМ (spike)
Более 90% клубочков склерозированы
Слайд 43WHO классификация ВН определяет выбор лечения
*Note: NIH protocol: monthly IV cyclophosphamide
for six months, plus six additional treatments at three month intervals
Source: ISA Physician Interviews and Analysis
Слайд 44
N1H — протокол Национального Института Здоровья США, Euro-Lupus - протокол Госпиталя
Св. Фомы
Все режимы включают КС: П внутрь в нач. дозе 0,5-1,0 мг/кг/сут, с постепенным снижением в теч. 6-12 мес в зависимости от клинического ответа• Метил-П в/в в начале терапии при тяжелых формах заболевания
Слайд 45Режимы инициальной терапии ВН класс III/IV (EULAR/ERA-EDTA, 2012)
Слайд 46Поддерживающая терапия при ВН
Объединенные рекомендации по ведению больных с СКВ с
поражением почек (EULAR/ERA-EDTA) взрослых и детей (2012)
Слайд 47Сопутствующая терапия у пациентов с ВН
Ингибиторы АПФ или БРА показаны пациентам
с протеинурией (соотношение белок/креатинин мочи >50 мг/ммоль) или АГ.
Снижение холестерина с помощью статинов показано при персистирующей дислипидемии (целевое значение ЛПНП 2,58 ммоль/л [100 мг/дл]).
Гидроксихлорохин рекомендуется для улучшения исходов, снижения вероятности обострений и ограничения кумулятивного почечного и СС повреждения.
Следует рассматривать возможность применения ацетилсалициловой кислоты у пациентов с антифосфолипидными АТ, а также препаратов кальция и витамина D и иммунизацию убитыми вакцинами, т.к. это может способствовать уменьшению коморбидных состояний, ассоциированных как с самим заболеванием, так и с лечением.
Следует рассматривать присоединение антикоагулянтной терапии при НС с альбумином сыворотки <20 г/л, особенно если НС персистирует или имеются антифосфолипидные АТ.
Слайд 48Волчаночный нефрит и беременность
Беременность можно планировать у пациенток со стабильным
течением ВН и соотношением белок/креатинин мочи <50 мг/ммоль в теч. последних 6 мес., желательно с СКФ >50 мл/мин.
Допустимо применение:
гидроксихлорохин,
преднизолон при необходимости в небольших дозах,
азатиоприна и/или
ингибиторов кальциневрина.
Если планируется беременность, объем терапии снижать не следует.
Рассматривать возможность применения ацетилсалициловой кислоты для снижения риска преэклампсии.
Пациенток следует наблюдать не реже 1 раза в 4 недели, желательно чтобы наблюдение осуществляли специалисты – терапевты и акушеры.
Слайд 49Выживаемость и проблемы терапии
Факторы неблагоприятного прогноза
мужской пол,
низкий социальный уровень,
низкий уровень дохода,
отсутствие образования,
проживание в сельской местности
Основные причины смерти:
развитие ВН,
ССО (атеросклероз),
инфекции
Слайд 50Причины летальности при СКВ (%) (Moss K.E. 2002)
У 50–80% больных СКВ
выявляются признаки активности и/или частые обострения, ~30% теряют трудоспособность,
10–30% - IV класса ВН с риском развития ТПН, ГД
Развитие необратимых повреждений органов в первые 5–6 лет от дебюта (течение СКВ/побочные эффекты терапии, в 1-ю очередь длительное применение высоких/средних доз ГК и ЦТ).
Слайд 51Потенциальные факторы развития сердечно-сосудистых заболеваний при СКВ
Слайд 52
Мишенями для терапии СКВ в настоящее время являются: В-клетки; взаимодействие Т-
и В-клеток, цитокины, АПК, плазмоцитоидные дендритические клетки.
Ритуксимаб Эпратузумаб, Белимумаб. Атасисепт - блокирует стимуляцию В- кл BAFF и APRIL (РКИ прекр.из-за развития побочных эффектов) Абатацепт - CTLA-4 (Cytotoxic T-lymphocyte antigen 4 – цитотоксических Т-лимфоцитов антиген 4), соединенный с Ig G. Блокирует взаимодействие между ДК и Т-лимфоцитами Абетимус – блокирует синтез и связывание анти-дсДНК АТ с их Аг. Сифалимумаб - анти-IFN-a mAb; IFNa вызывает повышенную экспрессию IFN-зависимых генов при СКВ, что предотвращается сифалимумабом. Анти -IL6R -тоцилизумаб. ИЛ-6 секретируется макрофагами и Т-клетками, иммунорегуляция при СКВ.
Биологические мишени и ГИБП при СКВ
Слайд 53Ритуксимаб (RTX) - aнти-CD20 моноклональное АТ, против CD20 и человеческого постоянного
Fc-фрагмента IgG.
РТМ разрешен для лечения в основном тяжелых больных СКВ с 2002 г. За последние 12 лет накоплен большой опыт применения РТМ у пациентов с критическим течением СКВ, поражением почек, ЦНС, генерализованным васкулитом, цитопеническим кризом.
Клиническое улучшение у больных СКВ в неконтролируемых клинических исследованиях отмечалось в 60–80% случаев и всегда сопровождалось транзиторной деплецией В-лимфоцитов.
Ритуксимаб одобрен FDA для лечения неходжкинских лимфом, ХЛЛ, РА (от умеренного до тяжелого течения), резистентного к терапии антагонистами TNF, и недавно - для лечения двух форм васкулита, ассоциированного с АНЦА (гранулематоз Вегенера и микроскопический полиангиит).
Слайд 542 крупномасштабных, рандомизированных двойных-слепых плацебоконтролируемых исследования III фазы
1. По оценке
эффективности и безопасности ритуксимаба у пациентов с тяжелой СКВ ((the Efficacy and Safety of Rituximab in Patients with Severe SLE, EXPLORER) и
2. По оценке эффективности и безопасности ритуксимаба при ВН III или IV класса (the Efficacy and Safety of Rituximab in Class III or IV Lupus Nephritis, LUNAR).
Не получено достоверных различий между ритуксимабом и плацебо при добавлении препарата к стандартной терапии пациентов с СКВ.
При более детальном анализе данных установлен значительно более выраженный эффект РТМ по сравнению с ПЛ у больных с достигнутой деплецией, высоким уровнем а-ДНК и низким уровнем комплемента.
РТМ продолжает использоваться у больных с высокой активностью СКВ, обусловленной прогрессирующим ВН, поражением ЦНС и цитопенией, в случаях неэффективности высоких доз ГК и ЦТ.
Слайд 55Важным связующим элементом между адаптивным и врожденным иммунным ответом, играющим особую
роль в патогенезе СКВ, является BLyS, также известный как фактор, активирующий В-лимфоциты (В-се11 activating factor, BAFF).
BLyS - это цитокин из семейства факторов некроза опухоли (TNF), который играет важную роль в селекции, созревании и выживаемости В-лимфоцитов.
Иммунные клетки (моноциты/макрофаги, ДК, Т-лимфоциты и активированные нейтрофилы) участвуют в продукции BLyS
Слайд 56В ходе экспериментальных исследований было доказано, что BLyS играет важную роль
в патогенезе СКВ.
Нейтрализующие BLyS моноклональные АТ (белимумаб) были разработаны с целью предотвращения связывания растворимого циркулирующего BLyS с его рецепорами на В-лимфоцитах (BR3, TACI, ВСМА).
Блокирование ключевого сигнального пути, необходимого для выживания В-лимфоцитов, на ранних стадиях их развития и снижение выживаемости аутореактивных В-лимфоцитов.
Слайд 57Белимумаб (Бенлиста,) был одобрен FDA 9 марта 2011 г. для лечения
пациентов с серопозитивной по аутоантителам [ANA и/или dsDNA)] СКВ, с сохраняющейся активностью, несмотря на прием стандартной терапии.
Рекомендованной дозой является 10 мг/кг с 2-нед. интервалом между введениями при применении первых 3-х доз и 4-нед. интервалом в последующем
Слайд 58Абатацепт представляет собой CTLA-4 (Cytotoxic T-lymphocyte antigen 4 – цитотоксических Т-лимфоцитов
антиген 4), соединенный с Ig G. Блокирует взаимодействие между ДК и Т-лимфоцитами, связывая ко-стимуляционные молекулы CD80/86, что ингибирует активацию Т-клеток. Проходит РКИ III фазы: наличие полиартрита, серозита, перикардита, эритемы (продолжается после неудачи при ВН).
Абетимус – блокирующий как синтез, так и связывание анти-дсДНК АТ с их Аг. Абетимус потенциально эффективен в предотвращении обострений нефрита среди больных с устойчивым снижением количества АТ к дс ДНК. Проходит РКИ II фазы.
Антицитокиновая терапия может стать перспективной в лечении СКВ. Мишенью в настоящее время являются ИФН-α и ИЛ-6.
У больных СКВ повышен уровень ИФН-α в сыворотке крови. Сыворотка больных СКВ индуцирует экспрессию гена IFN. ~ 60% больных имеют экспрессию гена IFN в мононуклеарных клетках периферической крови.
Модуляция ИФН-α может стать перспективной терапевтической мишенью в лечении СКВ. Подавление IFN-a выполнимо с анти-IFN-a АТ.
Анти-ИФНα-мАТ. Двойное, слепое, рандомизированное исследование Сифалимумаба - человеческого анти-IFN-a mAb, показало, IFNa вызывает повышенную экспрессию IFN-зависимых генов при СКВ, что предотвращается сифалимумабом. Полученные результаты II фазы клинических исследований - может появиться новое эффективное средство против СКВ.
-IL6R (тоцилизумаб). ИЛ-6 секретируемый преимущественно макрофагами и Т-клетками, обладает широким спектром биологического действия: опосредует иммунорегуляцию и воспаление при аутоиммунных заболеваниях, таких как СКВ.
ИЛ-6 также индуцирует окончательную дифференцировку В-лимфоцитов в плазматические клетки, синтезирующие ауто-АТ, и дифференцировку Т-лимфоцитов в эффекторные клетки.
ИЛ-6 активно экспрессируется при ВН. У экспериментальных мышей ИЛ-6 повышает активность заболевания, тогда как его блокада замедляет развитие ВН.
Тоцилизумаб («Актемра» и «Роастемра») представляет собой рекомбинантные моноклональные IgG1-АТ к человеческому IL-6-рецептору. IL-6 соединяется либо с мембраносвязанным или растворимым IL-6R, и этот комплекс, в свою очередь, связывается с 130-GP сигнальной молекулой. Этот процесс усиливает воспалительный каскад, вызывая ангиогенез и усиление активности молекул адгезии и активации остеокластов. IL-6 также отвечает за активацию как Т-, так и В-хелперов и участвует в B-клеточной дифференцировке. Таким образом, блокировка IL-6 снижает воспалительную реакцию.
Тоцилизумаб представляет собой гуманизированное моноклональное антитело, направленное против рецептора ИЛ-6 (RJ1-6R) и подавляющее передачу сигналов, индуцируемых ИЛ 6 (мембранные и растворимые рецепторы). В настоящее время проводят открытые исследования блокады ИЛ-6.
Препарат был одобрен в США для лечения РА в январе 2010 года.

Слайд 60В настоящее время известно, что иммуностимулирующие эффекты бактериальной ДНК являются результатом
присутствия неметилированных CpG-динуклеотидов в окружении конкретных оснований (CpG-мотивов), обычных в бактериальной ДНК, но метилированных и редко присутствующих в ДНК позвоночных.
Неметелированные CpG-мотивы взаимодействуют с TLR9-рецепторами иммунокомпетентных клеток (В-клетки, макрофаги, дендритные клетки и др.) и стимулируют врожденный неспецифический иммунитет человека и животных [2].
Слайд 61Продукты генов, ассоциированных с СКВ, которые могут влиять на работу адаптивной
иммунной системы. Взаимодействия и сигнальные каскады, включающие известные гены, ассоциированные с СКВ, которые потенциально влияют на функцию лимфоцитов. Эти гены разделены на 3 группы в зависимости от типа клетки, на котором они экспреммируются: АПК (ДК), Т-клетки и В-клетки. Результатом всех взаимодействий этих трех клеточных типов является продукция эффекторных клеток, включая Th 17 клеток и плазмоцитов. Черные стрелочки отражают активацию, тупиковые линии отражают ингибирование таргетного гена или процесса. Прерывистые линии отражают результат всех взаимодействий. Сокращения: TCR, T-cell receptor; TH17 cells, T‑helper 17 cells; TLR.
Слайд 62Этиопатогенез
В развитие СКВ вносят вклад ветви адаптивного и врожденного иммунитета.
Роль
адаптивного иммунитета
В-кл производят ауто-АТ (анти-ДНК и анти-нуклеосомные), а также цитокины.
Т-клетки запускают системную и внутрипочечную активацию В-клеток. Важную роль играют субпопуляции Т-кл, вкл. Тh1, Тh17, «двойные негативные» Тh
Роль врожденного иммунитета
На ранних стадиях заболевания ДК и др. миелоидные клетки продуцируют медиаторы, напр., активирующий фактор В-кл (BAFF/BLyS); эти явления приводят к активации адаптивной иммунной системы.
Системная активация иммунитета приводит к генерации эффекторных Т-кл и ауто-АТ, работающих против собственных тканей и органов.
Слайд 63Генетические аберрации при СКВ
К наст. времени обнаружено >50 генов, ассоциированных с
СКВ, но их функция остается плохо изученной.
Не установлены мутации и соответствующие молекулярные нарушения, вносящие вклад в фенотип болезни; обнаружены однонуклеотидные полиморфизмы кодирующей области, полиморфизмы, ведущие к альтернативному сплайсингу, влияющие на экспрессию генов и др.
Аллели генов, связанных с СКВ, обнаружены в главном комплексе гистосовместимости: Fcγ-рецепторы, гомологи рецепторов Ig, молекулы системы клеточных сигналов, цитокины/ хемокины, комплемент, опсонины и т.д.
Взаимодействие между предрасполагающими генами и факторами внешней среды проявляется патологическим иммунным ответом, который имеет свои особенности среди разных пациентов с СКВ.
Слайд 64Этиология и патогенез-3
Индукция антивирусного иммунитета
В N гомеостатические механизмы обеспечивают низкий
уровень хроматина во внеклеточной среде c быстрым клиренсом остатков мертвых клеток.
Показана существенная роль нейтрофилов в патогенезе СКВ. НК, гистоны, высвобождаются из нейтрофилов при апоптозе или нетозе (NET - Neutrophil Extracellular Trap). При нетозе нейтрофил проходит стадию деконденсации хроматина с последующим выбросом во внеклеточное пространство ДНК-сети, содержащей гистоны, реактивные формы О2, МПО и др.молекулы, направленные в N против патогенов.
Отсроченное удаление мертвых клеток из-за дефекта опсонизации комплементом/удаления фагоцитами ведет к дегенерации их компонентов с повреждением элементов, которые позволяют в N отличать собственные НК от вирусных НК. Напр., природой предусмотрено метилирование эндогенных ДНК и РНК как путь не допустить их узнавания TLRs, лигандами которых являются вирусные НК.
Однако для пациентов с активной СКВ характерное общее гипометили-рование НК, что обуславливает их мимикрию с вирусными НК.
Слайд 65Этиология и патогенез-4
Отмечена очень сильная связь между дефицитом С1, С4
и СКВ.
При адекватной активности комплемента клетки, подверженные апоптозу, нетозу быстро захватываются незрелыми ДК до того, как высвобождение внутриклеточного материала может их активировать, и, благодаря переработке ядерного материала незрелыми ДК развивается толерантность.
При СКВ ядерные частицы, нуклесомы, которые содержат белковый компонент (Аг), а также иммуностимулирующие НК (иммунный адъювант) активируют TLRs (3,7 и 9), специфичные для вирусных НК, и запускают (псевдо) антивирусный иммунитет через ИФН-α сигнальный путь.
Этот (псевдо) антивирусный ответ вовлекает все АПК, особенно ДК и В-кл., хотя отмечено, что только плазмоцитоидные ДК могут продуцировать количество ИНФ, необходимое для противовирусного ответа (блокада TLR7, TLR9 обрывает продукцию ИФН I типа и проявления СКВ у мышей).
Слайд 66Этиология и патогенез-5
Аномальная лимфоцитарная пролиферация
ДК, Тh, В-кл, плазмоциты – все
участвуют в аномальной поликлональной активации В-кл.
ДК: постоянная активация волчаночными Аг через TLR7 и TLR9 повышает их выживаемость
В-кл.: постоянная активация АПК меняет интерпретацию аутоАг лимфоцитами, позволяет преодолеть анергию зрелых аутореактивных В- кл.
Моноциты больных СКВ под влиянием ИФН I дифференцируются в клетки с морфологическими и функциональными свойствами ДК.
Повышение экспрессии генов, индуцированное ИФН – отличительный генетический признак клеток периф.крови при СКВ. ИФН I т. с ИЛ-6 ускоряет дифференциацию зрелых В- лимф. в плазмоциты, долгоживущие клетки. Влиянием ИФН I на ДК, В- и Т-лимф. объясняют снижение толерантности к ядер. Аг, непрерывную продукцию ауто-АТ
С др.стороны - сниженная продукция др.цитокинов: Т-кл и NK не способны продуцировать достаточно ИЛ-2 и TGF-α, чтобы индуцировать и поддерживать регуляторные CD4+ и CD8+ T кл
Слайд 67Этиология и патогенез-6
Пролиферация лимфоцитов стимулируется митогенами.
MDM2- митоген, который специфически
активируется при распознавании ДНК, играет важную роль при СКВ.
MDM2 нейтрализует р53-зависимую блокаду клеточного деления, что объясняет митогенный эффект эндогенной ДНК или вирусной ДНК на аутореактивный лимфоцитоз при СКВ.
Другие лимфоцитарные митогены, ответственные за аномальную пролиферацию В-лимфоцитов при СКВ – В- лимфоцитарный стимулятор (B lymphocyte stimulator, BlyS/BAFF) и пролиферацию индуцирующий лиганд - APRIL (a proliferation-inducing ligand).
Слайд 68Этиология и патогенез-9
АТ связываются с тканями – мишенями; при образовании
ИК активируется комплемент, что ведет к высвобождению цитокинов, хемокинов, вазоактивных пептидов, оксидантов, деструктивных энзимов.
Это сопровождается поступлением в ткани –мишени Т кл., моноцитов/макрофагов, ДК, а также активацией местных макрофагов и ДК.
В присутствии хронического воспаления, аккумуляции факторов роста и продуктов хронического окисления сопровождается необратимым тканевым повреждением, включая развитие фиброза/склероза, в почечных клубочках, артериях, головном мозге, легких и других тканях.
Слайд 69Systemic Lupus Erythematosus Disease activity score (SLEDAI)
В индекс входит 24 параметра
(16-клин. и 8 лабор.).
Каждому показателю присвоены баллы от 1 до 8 .
Более серьезные проявления СКВ, такие как: поражение НС, ВН, васкулит - имеют более высокую балльную оценку
Общий максимально возможный счет индекса SLEDAI составляет 105 баллов.
При проведении оценки активности отмечают признаки СКВ, которые присутствовали у пациента в течение 10 предшествующих дней, независимо от их степени тяжести или улучшения/ухудшения состояния.
Счет > 20 баллов встречается достаточно редко.
Повышение SLEDAI > 8 означает наличие активного заболевания.
3 модификации: SLEDAI 2000, SELENA-SLEDAI и Mex-SLEDAI.
Слайд 71Гематоксилиновые тельца – описаны в 1920
Тканевые аналоги LE-клеток - ядра, имеющие
измененный вид
Более часто – в клубочках; редко – в сосудистой стенке и канальцах
Единственный морфологический патогномоничный признак SLE
Связаны с кариорексисом
Слайд 72Например, ИК ауто-АТ с эндогенными РНК и ДНК активируют толл-подобные рецепторы
-TLR7 и TLR9 для выработки IFN-I
IFN -1 в дальнейшем может активировать адаптивный иммунитет, усиливая АГ-презентирующую функцию моноцитов и дендритных клеток, активируя В-лимфоциты и стимулируя Т-хелперы (T-helper, Th) и продукцию ими цитокинов
Другим важным связующим элементом между адаптивным и врожденным иммунным ответом, играющим особую роль в патогенезе СКВ, является BLyS, также известный как фактор, активирующий В-лимфоциты (В-се11 activating factor, BAFF).
BLyS - это цитокин из семейства факторов некроза опухоли (TNF), который играет важную роль в селекции, созревании и выживаемости В-лимфоцитов.
иммунные клетки (моноциты/макрофаги, ДК, Т-лимфоциты и активированные нейтрофилы), участвуют в продукции BLyS
Связывание BLyS/BR3 является критичным сигналом для выживаемости на ранних стадиях развития В-лимфоцитов, так как противодействует апоптозу и потенцирует дальнейшую дифференцировку В-лимфоцитов в зрелые неиммунные популяции
Слайд 73Накопление ядерного материала в клубочках
Гены, ассоциированные с СКВ, могут увеличивать количество
и доступность нуклеосомального материала доступного для накопления в гломерулярном матриксе.
Строгие экспериментальные свидетельства говорят в пользу идеи, согласно которой ядерные Аг, экспресированные в гломерулярном матриксе, могут взаимодействовать с АТ.
Гены, которые контролируют круговорот ДНК (например, DNASE1-ДНК-аза и TREX1), аутофагию, а также уровни системы комплемент могут контролировать количество ядерного материала, который откладывается в гломерулярном матриксе, наряду с последующим накоплением ИК и активацией лейкоцитов.
Слайд 74Неттоз
NETs – сеть, образованная деконденсированными нитями хроматина, усеянными антимикробными факторами, высвобожденными
из гранул. Главная функция NETs захват и уничтожение патогенов (Brinkmann et al., 2004)
NET, наравне с апоптозом, рассматриваются как основной источник ядерных Аг и других воспалительных факторов, которые могут запускать аутоиммунитет при СКВ.
У больных с СКВ NET образуются чаще, и их удаление затруднено, возможно, из-за присутствия АТ против ДНК-азы1 и NET.
NET могут стимулировать выработку ИФН-I дендритными клетками, а также вызывать прямое повреждение ткани.
ДНК-аза1 является необходимым фактором для деградации NET и, следовательно, основным фактором их удаления.
У мышей с дефицитом ДНК-аза1 развивается СКВ-подобный синдром, а у многих пациентов с СКВ активность ДНК-аза1 снижена.
Более того, генетические мутации в ДНК-аза1 ассоциированы с СКВ у пациентов.