Цикл 1 – иммунология.
Занятие № 3 а.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Система цитокинов. Классификация. Основные свойства. Механизмы действия презентация
Содержание
- 1. Система цитокинов. Классификация. Основные свойства. Механизмы действия
- 2. Цитокины Сигнальные (биорегуляторные) молекулы, управляющие
- 3. Цитокины Растворимые гликопротеины (более 1300
- 4. Цитокины и жизненный цикл клеток
- 5. Свойства цитокинов Характерен короткий период полужизни: цитокины
- 6. Плейотропность цитокинов на примере интерферона-гамма Секреция
- 8. Типы цитокиновой регуляции Паракринная регуляция (в большинстве
- 10. Представление о системе цитокинов в клинической практике
- 11. Основные типы цитокинов –общепринятые сокращения: интерлейкины В
- 12. Основные типы цитокинов –общепринятые сокращения: факторы
- 13. Основные типы цитокинов –общепринятые сокращения: Колониестимулирующие
- 14. Основные типы цитокинов –общепринятые сокращения:
- 15. Классификация цитокинов на основе их биологических эффектов
- 16. Классификация цитокинов на основе их роли в
- 17. Цитокины с регуляторной (противовоспалительной) активностью
- 18. 1. Цитокины врожденного иммунитета Основные клетки-продуценты –
- 19. РАСПОЗНАВАНИЕ ПАТОГЕНОВ РЕЦЕПТОРАМИ ВРОЖДЕННОГО
- 20. Димеры Толл-подобных рецепторов
- 21. Функциональная активность провоспалительных цитокинов в зависимости от
- 22. УРОВНИ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ В ПЛАЗМЕ КРОВИ
- 23. Роль некоторых цитокинов в патогенезе воспалительных реакций: Усиление реакций врожденного иммунного ответа
- 24. Интерлейкин-1-бета: свойства
- 25. Интерлейкин-1-бета: свойства
- 26. Биологический смысл действия цитокинов при системном воспалении
- 27. Синтез цитокинов Экспрессия молекул адгезии на эндотелиоцитах,
- 28. IL-1β и TNF-α Интерлейкин -1 – бета(IL-1
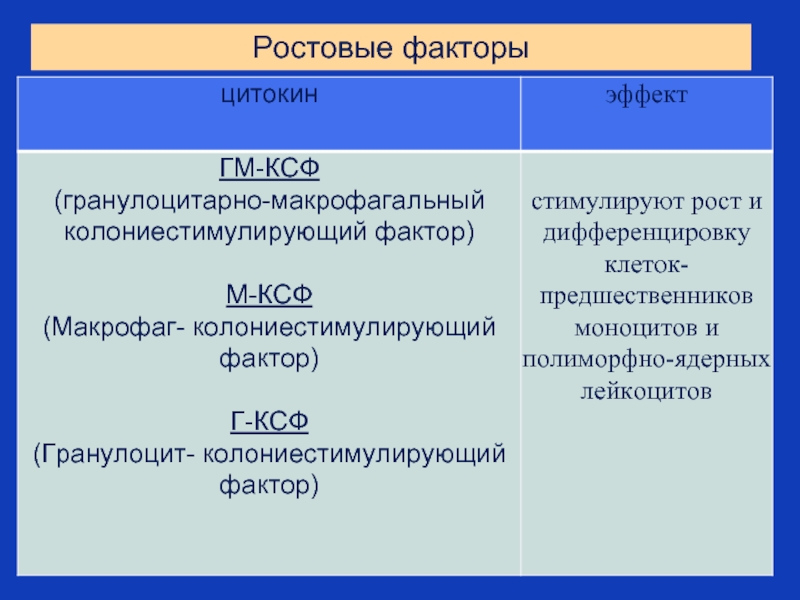
- 29. Ростовые факторы
- 31. РЕГУЛЯЦИЯ ПРИОБРЕТЕННОГО ИММУНИТЕТА Цитокины – ростовые
- 32. Цитокины адаптивного иммунного ответа Основные цитокины, определяющие
- 33. Механизм костимуляции Т клеток-роль ИЛ-2 На покоящихся
- 34. экспрессия β и γ цепей IL-2
- 35. Роль цитокинов в усилении реакций адаптивного иммунного ответа: активация, пролиферация и дифференцировка лимфоцитов
- 36. «Старая» парадигма поляризации иммунного ответа: путь Th1(клеточный
- 37. Современная концепция: роль дендритных клеток в запуске
- 38. Роль дендритных клеток в запуске и регуляции
- 39. Субпопуляции Т хелперов, дифференцирующиеся из Th0 –наивного
- 40. Цитокины ДК в регуляции функций Т-хелперов по
- 42. Активация разных эффекторных клеток цитокинами разных субпопуляций
- 43. Субпопуляции Т-хелперов Th17 Если в микроокружении наивного
- 44. Субпопуляции Т-хелперов: регуляторные клетки - T reg
- 45. Механизмы действия цитокинов На первом этапе:
- 46. Классификация цитокинов по типу рецепторов. Цитокиновые рецепторы
- 47. Основные типы цитокиновых рецепторов
- 50. JAK-STAT – киназный путь активации клетки - мишени
- 51. Цитокиновая сеть Межклеточная сигнальная сеть, в которой
- 53. Хемокины Хемокины – это цитокины, обладающие малой
- 54. БИОЛОГИЧЕСКИЕ ФУНКЦИИ ХЕМОКИНОВ ХЕМОТАКСИС ЛЕЙКОЦИТОВ ДЕГРАНУЛЯЦИЯ
- 55. Хемокины
- 56. Основные направления современной цитокиновой терапии
- 57. РАЗРЕШЕННЫЕ К ПРИМЕНЕНИЮ И РАЗРАБАТЫВАЕМЫЕ ПРЕПАРАТЫ
- 58. ОБЛАСТИ ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА(ЭПО) НЕФРОЛОГИЯ -
- 59. ЛЕЧЕБНОЕ ПРИМЕНЕНИЕ ЦИТОКИНОВ СТИМУЛЯЦИЯ КРОВЕТВОРЕНИЯ Эритропоэз –
- 60. Клиническое применение препаратов рекомбинантных интерферонов человека
- 61. Вирусы, вызывающие ОРВИ, при которых показана клиническая
- 62. Терапевтические схемы противовирусной терапии ХВГС (хронический вирусный
- 63. БИОЛОГИЧЕСКИЕ СВОЙСТВА ИЛ-1,
- 64. Препарат на основе интерлейкина-2 - Ронколейкин
- 65. Использование ИЛ-2-активированных клеток в терапии рака LAK
- 66. Адоптивная иммунотерапия рака с использованием лимфоцитов, активированных
- 68. АНТИЦИТОКИНОВАЯ ТЕРАПИЯ РЕВМАТОИДНОГО АРТРИТА
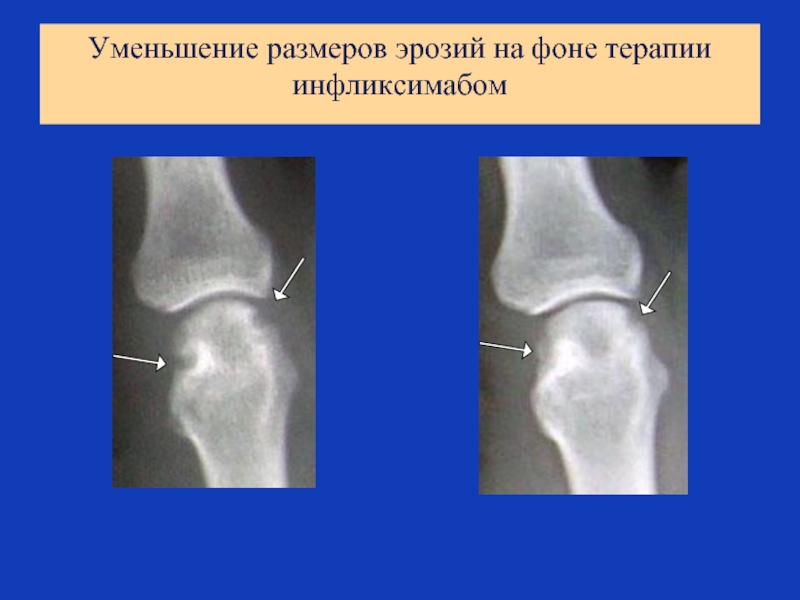
- 69. Уменьшение размеров эрозий на фоне терапии инфликсимабом
- 70. АПОПТОЗ (краткая информация (если на занятии
- 71. Апоптоз как физиологическая смерть клеток Взаимодействие
- 72. Рецептор клеточной гибели: роль TNFRI Прокаспаза-8
- 73. Механизмы запуска апоптоза Цитотоксические Т лимфоциты распознают
- 74. Каспазы и разрушение хроматина Основной механизм
- 75. Механизмы действия каспаз: фрагментация хроматина . Каспазы
- 76. Механизмы действия каспаз: разрушение структурных белков ядра
- 77. Этапы апоптоза Этапы А и В (А)
- 78. Этапы апоптоза
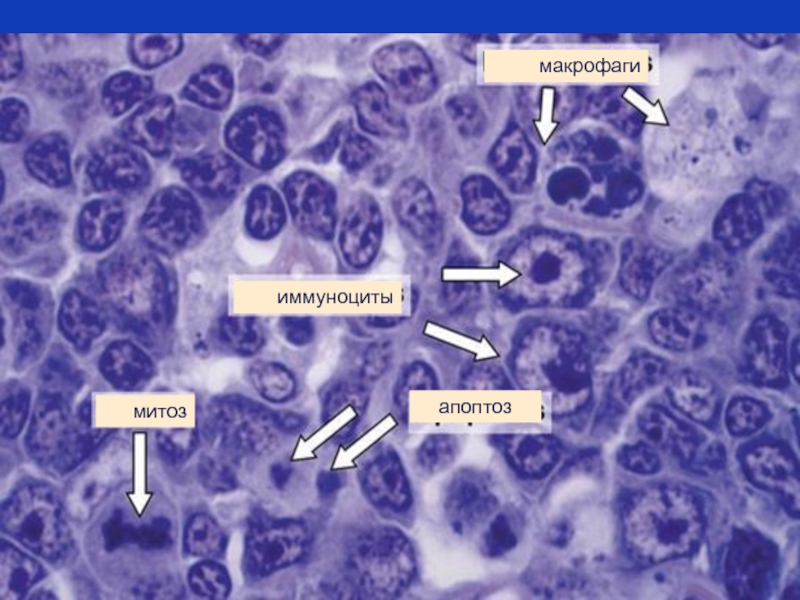
- 79. апоптоз иммуноциты митоз макрофаги
- 80. Сигналы, вызывающие запуск апоптоза Существует несколько типов
- 81. Сигналы апоптоза Рецептор клеточной гибели вирусы Сигналы
- 82. Внутренние сигналы апоптоза В других случаях апоптоз
- 83. Роль митохондрий в запуске апоптоза В
- 84. Роль Bcl-2 протеинов Семейство bcl-2 протеинов
- 85. Роль Bcl-2 протеинов Проапоптозные bcl-2 часто обнаруживаются
- 86. Формирование апоптосом Освобождение цитохрома С в цитозоль
- 87. Роль митохондрий в запуске апоптоза Сигналы
- 88. Стадии формирования апоптосомы Первая стадия формирования апоптосомы Цитохром С Присоединение прокаспазы-9 Прокаспаза-9
- 89. Вопросы к занятию № 3 а Классификация
- 90. Тестовые задания к занятию № 3
- 91. Тестовые задания к занятию № 3 Основными
- 92. Тестовые задания к занятию № 3 Основными
- 93. Тестовые задания к занятию № 3 В
- 94. Тестовые задания к занятию № 3 В
Слайд 1«Система цитокинов. Классификация. Основные свойства. Механизмы действия. Типы цитокиновой регуляции. Клетки-продуценты
Слайд 2Цитокины
Сигнальные (биорегуляторные) молекулы, управляющие практически всеми процессами в организме
Слайд 3Цитокины
Растворимые гликопротеины (более 1300 молекул, 5-50 кDa) неиммуноглобулиновой природы,
В настоящее время известно около 200 цитокинов.
Слайд 4
Цитокины и жизненный цикл клеток
Цитокины –биорегуляторные молекулы, контролирующие разные этапы жизненного
процессы дифференцировки.
процессы пролиферации.
процессы функциональной активации.
процессы гибели клеток.
Цитокины и иммунный ответ
Цитокины играют важную роль в осуществлении реакций как врожденного, так и адаптивного иммунитета.
Цитокины обеспечивают взаимосвязь врожденного и адаптивного иммунных ответов.
Слайд 5Свойства цитокинов
Характерен короткий период полужизни:
цитокины быстро инактивируются и разрушаются.
Большинство из цитокинов
Цитокинов больше, чем их рецепторов (многие цитокины используют общие субъединицы рецепторов) на клетках-мишенях для передачи сигналов в ядро клетки-мишени
Плейотропность – единственная молекула может вызывать множество эффектов путем активации различных генов в клетках-мишенях
Конвергенция функций – разные цитокиновые молекулы могут выполнять в организме сходные функции
Полисферизм – множество цитокинов могут продуцироваться одной и той же клеткой в ответ на один стимул
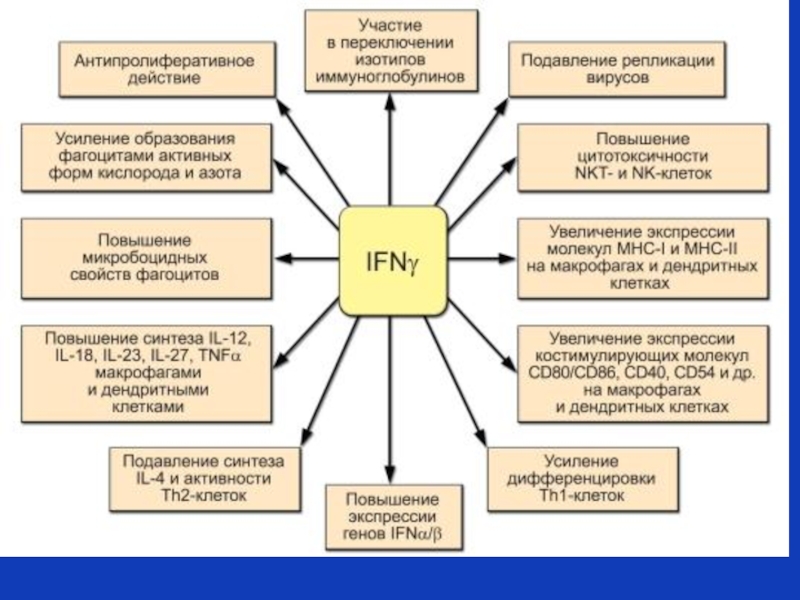
Слайд 6Плейотропность цитокинов на примере интерферона-гамма
Секреция
интерферона-
гамма
эндотелий
активация
активация
NK
гранулоциты
активация
макрофаги
активация
активация Т клеток
дифференцировка
В
многие типы клеток
многие типы клеток
индукция экспрессии
MHC I или MHCII
повышение
противовирусной
активности
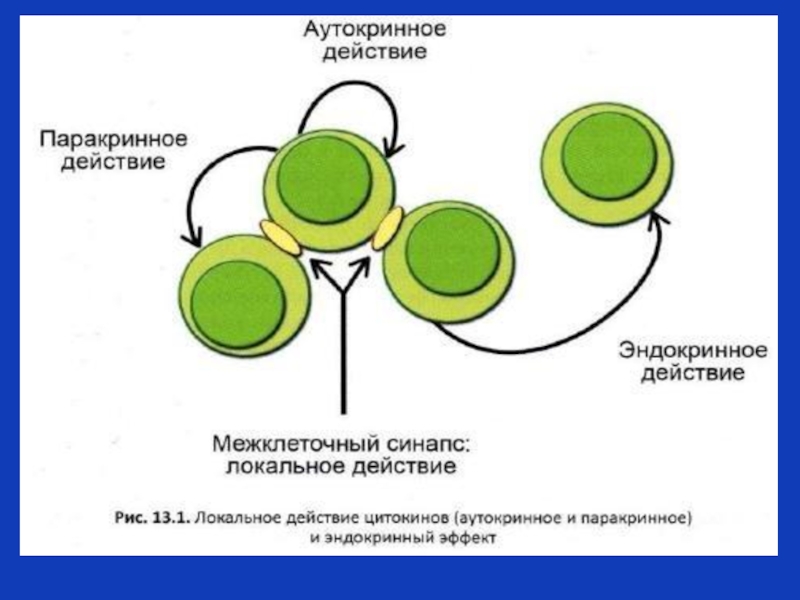
Слайд 8Типы цитокиновой регуляции
Паракринная регуляция (в большинстве случаев цитокины действуют местно, в
Аутокринная регуляция –цитокин производится клеткой, к нему клетка-производитель данного цитокина экспрессирует рецепторы, вследствие этого цитокин действует на клетку, его производящую.
Эндокринная регуляция –отставленное действие: интерлейкин 1 –бета –эндогенный пироген (действует на центр терморегуляции в головном мозге),
интерлейкин 6 действует на гепатоциты, вызывая синтез белков острой фазы, ростовые факторы действуют на костный мозг, активируют гемопоэз и т.д.
Слайд 10Представление о системе цитокинов в клинической практике
Для клинической практики важно отследить
Клетки- продуценты цитокинов.
Цитокины и их антагонисты.
Клетки-мишени, экспрессирующие рецепторы цитокинов.
Производимые цитокинами эффекты на уровне организма.
Цель: разработка и внедрение в практику новых стратегий терапии заболеваний:
цитокиновая терапия
(применение в клинике препаратов цитокинов), либо
антицитокиновая терапия (применение в клинике антагонистов цитокинов или моноклональных антител к цитокинам).
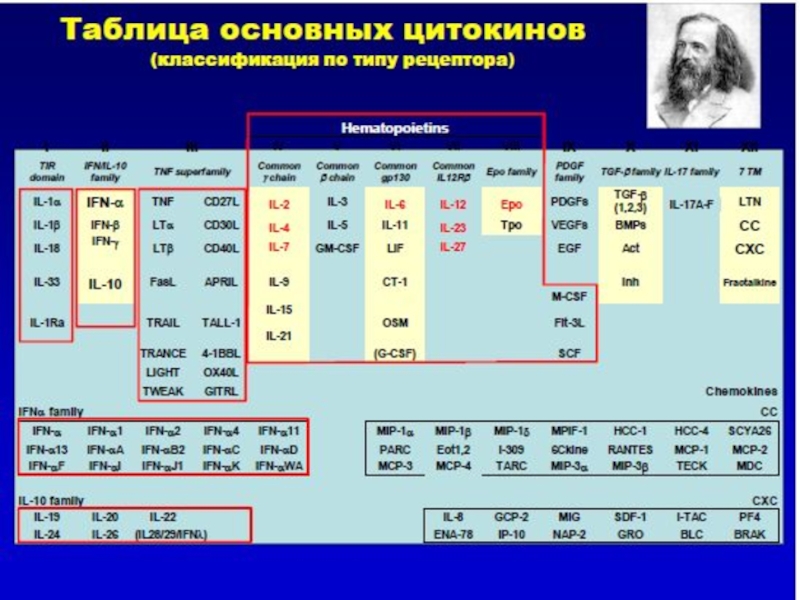
Слайд 11Основные типы цитокинов –общепринятые сокращения: интерлейкины
В более ранних классификациях цитокинов использовалось
лимфокины (цитокины, секретируемые в основном активированными Т лимфоцитами –хелперами)
и
монокины (цитокины, секретируемые клетками моноцитарно-макрофагал.ьного ряда)
Такой подход не всегда оправдан, так как для цитокинов характерно частичное перекрывание функций.
Вследствие этого был введен единый термин «интерлейкины»
IL (или ИЛ): 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17 …..35
Термин «интерлейкины» означает «молекулы, участвующие во взаимоотношениях, «беседах» между лейкоцитами».
Слайд 12Основные типы цитокинов –общепринятые сокращения:
факторы некроза опухолей (ФНО или TNF)
TNF -
TNF- β ( лимфотоксин)
Интерфероны (ИФН или IFN)
IFN α и IFN β
IFNγ
трансформирующие ростовые факторы:
Трансформирующий ростовый фактор –альфа – TGF -α
Трансформирующий ростовый фактор –бета – TGF -β
α -хемокины:
IL-8
NAP -2 (neutrophil – activating protein -2)
PF -4 (platelet factor 4)
Слайд 13Основные типы цитокинов –общепринятые сокращения:
Колониестимулирующие факторы:
G -CSF - granulocyte colony stimulating
GM - CSF – granulocyte - macrophage colony stimulating factor
M - CSF - macrophage colony stimulating factor
Multi - CSF - IL - 3
«Лимфокины» – секретируются в основном активированными Т h клетками:
MAF - macrophage activating factor
MCF - macrophage chemotactic factor
MMIF-macrophage migration inhibition factor
LMIF- leukocyte migration inhibition factor
Слайд 14Основные типы цитокинов –общепринятые сокращения:
Полипептидные ростовые факторы клеток:
a FGF –
b FGF – basic fibroblast growth factor
EGF – epidermal growth factor
NGF – nerve growth factor
PDGF – platelet - derived growth factor
VEGF – vascular endothelial growth factor
Современные отечественные книги и журналы
Слайд 15Классификация цитокинов на основе их биологических эффектов
1. Интерлейкины (ИЛ-1 ÷ ИЛ-
2. Факторы некроза опухоли - цитокины с цитотоксическим и регуляторным действием (ФНО).
3. Интерфероны –противовирусные цитокины:
1 типа –ИФН α,β и др.
2 типа –ИФН γ
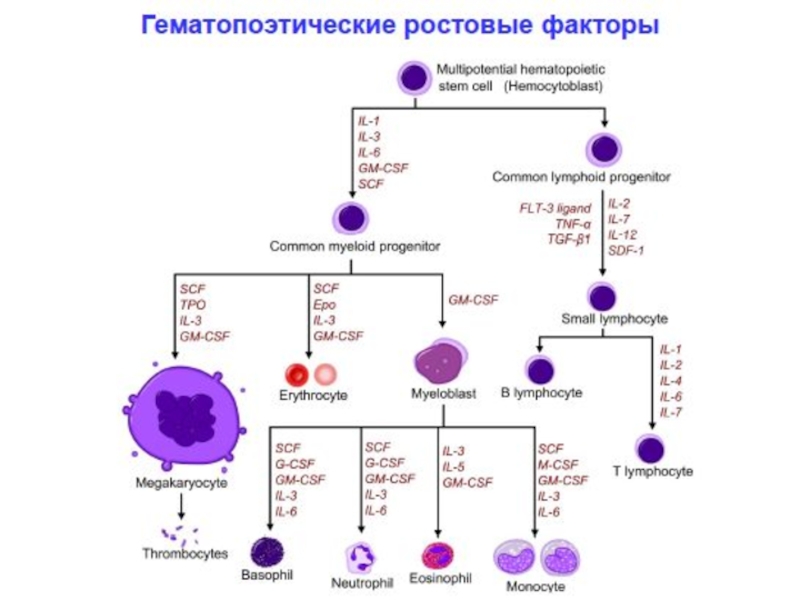
4. Факторы роста стволовых клеток (ИЛ-3, ИЛ -7, ИЛ-11, эритропоэтин, тромбопоэтин, колониестимулирующие факторы (КСФ): ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор), Г-КСФ (гранулоцитарный КСФ), М-КСФ (макрофагальный КСФ), регулирующие гемопоэз.
5. Хемокины (CC, CXC (ИЛ-8), CX3C, С) , регулирующие хемотаксис различных клеток.
6.Факторы роста клеток (фактор роста фибробластов, фактор роста эндотелиальных клеток, фактор роста эпидермиса и др.), трансформирующий ростовый фактор - участвуют в регуляции роста, дифференцировки разных клеток.
Слайд 16Классификация цитокинов на основе их роли в процессе регуляции воспаления
Провоспалительные
Синтезируются преимущественно
Провоспалительных цитокинов намного больше, чем противовоспалительных.
Противовоспалительные
В основном, Т- клеточные цитокины, снижающие активность воспаления –
ИЛ-10,
ТГФ β (трансформирующий фактор роста бета);
а также -рецепторный антагонист интерлейкина-1 (РАИЛ).
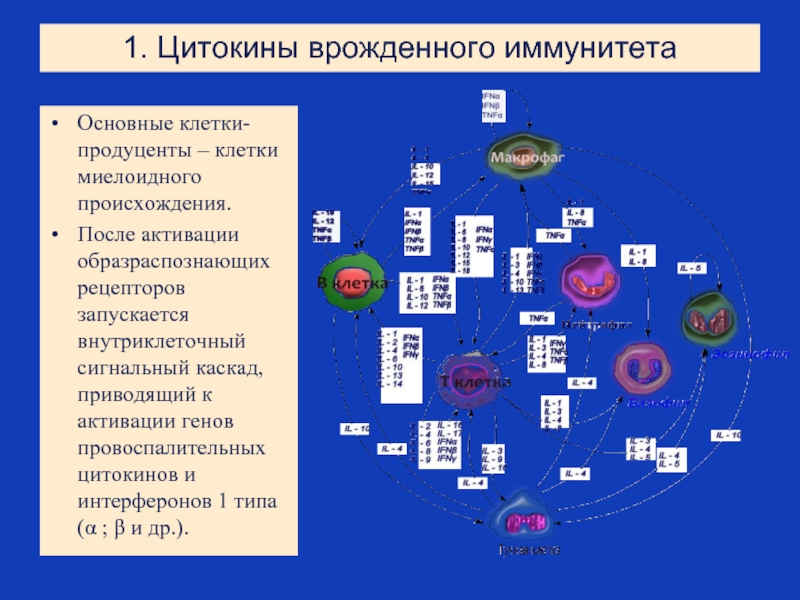
Слайд 181. Цитокины врожденного иммунитета
Основные клетки-продуценты – клетки миелоидного происхождения.
После активации образраспознающих
Слайд 19
РАСПОЗНАВАНИЕ ПАТОГЕНОВ
РЕЦЕПТОРАМИ ВРОЖДЕННОГО ИММУНИТЕТА
Патогены
Патоген-ассоциированные
молекулярные структуры или паттерны (РАМРs)
Паттерн
Растворимые (система комплемента)
Мембранные (TLRs –Толл- подобные рецепторы, CD14)
Внутриклеточные (NOD и др.).
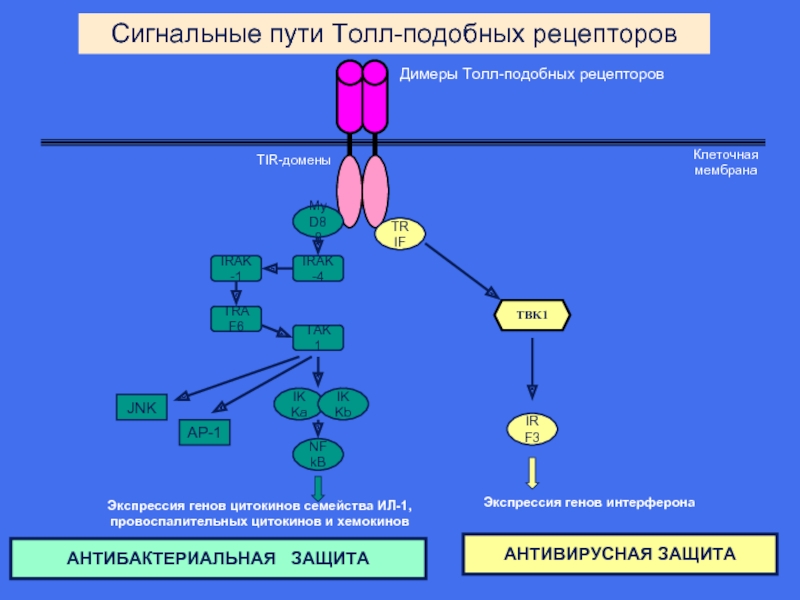
Слайд 20
Димеры Толл-подобных рецепторов
TIR-домены
Клеточная
мембрана
TBK1
IRAK-4
MyD88
TRIF
IRAK-1
TRAF6
TAK1
JNK
AP-1
IKKa
IKKb
NFkB
IRF3
Экспрессия генов цитокинов семейства ИЛ-1,
провоспалительных цитокинов и
Экспрессия генов интерферона
Сигнальные пути Толл-подобных рецепторов
АНТИБАКТЕРИАЛЬНАЯ ЗАЩИТА
АНТИВИРУСНАЯ ЗАЩИТА
Слайд 21Функциональная активность провоспалительных цитокинов в зависимости от их концентрации –местное и
На местном уровне
Самым ранним эффектом провоспалительных цитокинов является повышение адгезивных свойств эндотелия и привлечение активированных клеток в очаг воспаления из периферической крови.
Провоспалительные цитокины управляют местным воспалением с его типичными проявлениями
(отек, покраснение, появление болевого синдрома).
На системном уровне
При повышении концентрации провоспалительных цитокинов в крови ,
они действуют практически на все органы и системы, участвующие в поддержании гомеостаза
Примером зависимости эффектов провоспалительных цитокинов от их концентрации в крови может служить фактор некроза опухолей-альфа
Слайд 23Роль некоторых цитокинов в патогенезе воспалительных реакций: Усиление реакций врожденного
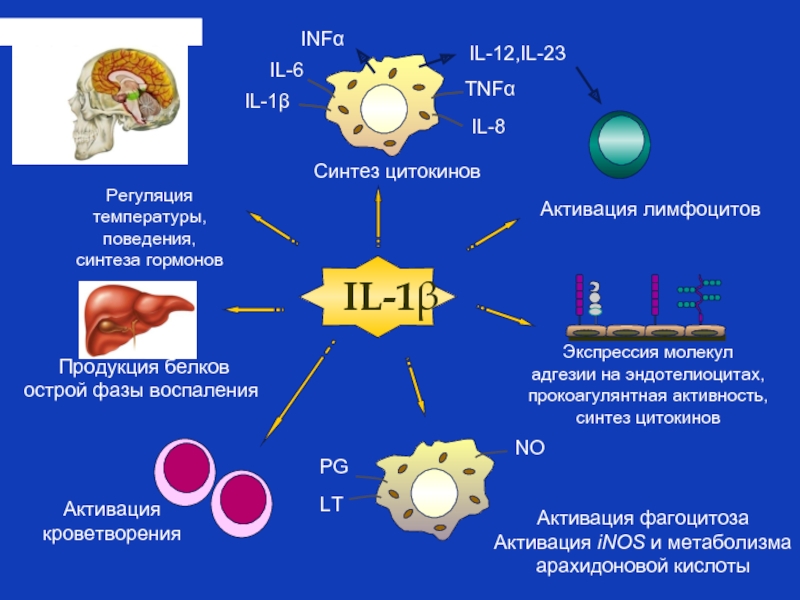
Слайд 26Биологический смысл действия цитокинов при системном воспалении
На уровне целостного организма цитокины
Цитокины обеспечивают «сигнал тревоги», означающий, что настало время включить все резервы, переключить энергетические потоки и перестроить работу всех систем для выполнения одной, но важнейшей для выживания задачи – борьбы с внедрившимся патогеном.
Примером множественности эффектов провоспалительных цитокинов
в запуске системного воспаления может служить интерлейкин 1 бета
Слайд 27Синтез цитокинов
Экспрессия молекул
адгезии на эндотелиоцитах,
прокоагулянтная активность,
синтез цитокинов
Активация лимфоцитов
Активация фагоцитоза
Активация iNOS и
арахидоновой кислоты
Регуляция
температуры,
поведения,
синтеза гормонов
Продукция белков
острой фазы воспаления
IL-12,IL-23
Активация
кроветворения
INFα
Слайд 28IL-1β и TNF-α
Интерлейкин -1 – бета(IL-1 β) и фактор некроза опухолей
.
Некоторые их таких антагонистов и моноклональных антител уже используются в клинике – например, при лечении сепсиса, ревматоидного артрита, системной красной волчанки и других заболеваний человека.
Слайд 31
РЕГУЛЯЦИЯ ПРИОБРЕТЕННОГО ИММУНИТЕТА
Цитокины – ростовые и дифференцировочные факторы всех типов Т-
Главные функции: регуляция дифференцировки Т-хелперных клонов - определение типов тканевого воспаления, Т-клеток эффекторов и классов антител
Тh1 – клеточный тип с участием макрофагов и Т-лимфоцитов (гранулема
при туберкулезе; при саркоидозе, контактном дерматите, болезни Крона)
Тh2 – аллергический тип ответа с участием гистамина и простагландинов
Т h 17 – нейтрофильное воспаление
Tfn (фолликулярные Т хелперы)- гуморальный иммунный ответ
T reg –T h регуляторный (ограничение силы всех типов иммунного ответа и воспаления)
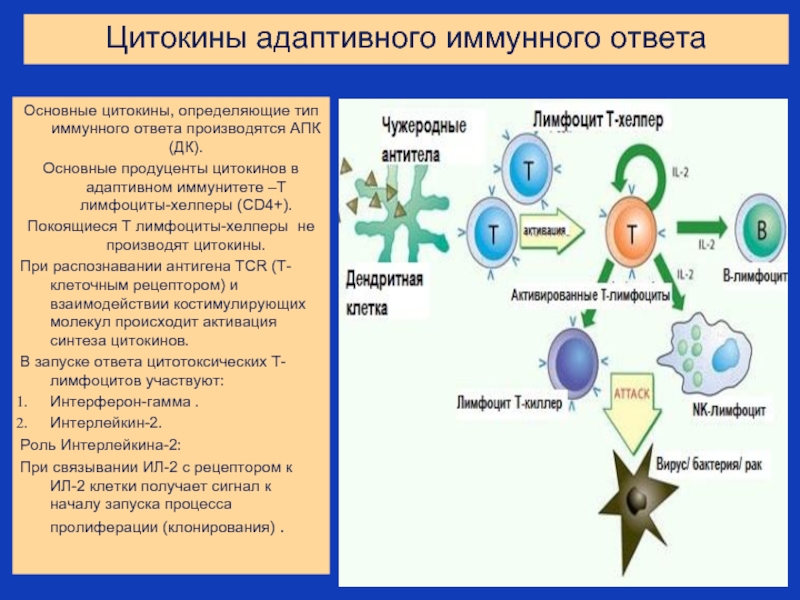
Слайд 32Цитокины адаптивного иммунного ответа
Основные цитокины, определяющие тип иммунного ответа производятся АПК
Основные продуценты цитокинов в адаптивном иммунитете –Т лимфоциты-хелперы (CD4+).
Покоящиеся Т лимфоциты-хелперы не производят цитокины.
При распознавании антигена TCR (Т-клеточным рецептором) и взаимодействии костимулирующих молекул происходит активация синтеза цитокинов.
В запуске ответа цитотоксических Т-лимфоцитов участвуют:
Интерферон-гамма .
Интерлейкин-2.
Роль Интерлейкина-2:
При связывании ИЛ-2 с рецептором к ИЛ-2 клетки получает сигнал к началу запуска процесса пролиферации (клонирования) .
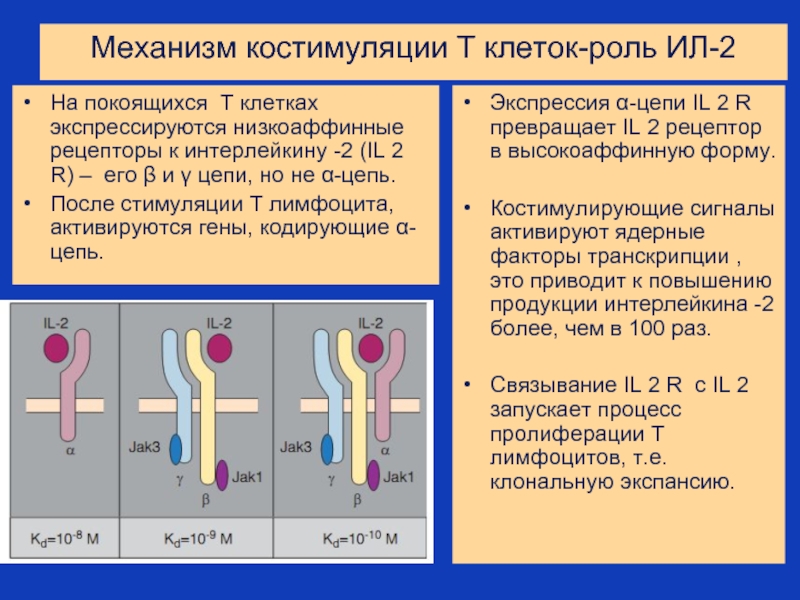
Слайд 33Механизм костимуляции Т клеток-роль ИЛ-2
На покоящихся Т клетках экспрессируются низкоаффинные рецепторы
После стимуляции Т лимфоцита, активируются гены, кодирующие α-цепь.
Экспрессия α-цепи IL 2 R превращает IL 2 рецептор в высокоаффинную форму.
Костимулирующие сигналы активируют ядерные факторы транскрипции , это приводит к повышению продукции интерлейкина -2 более, чем в 100 раз.
Связывание IL 2 R с IL 2 запускает процесс пролиферации Т лимфоцитов, т.е. клональную экспансию.
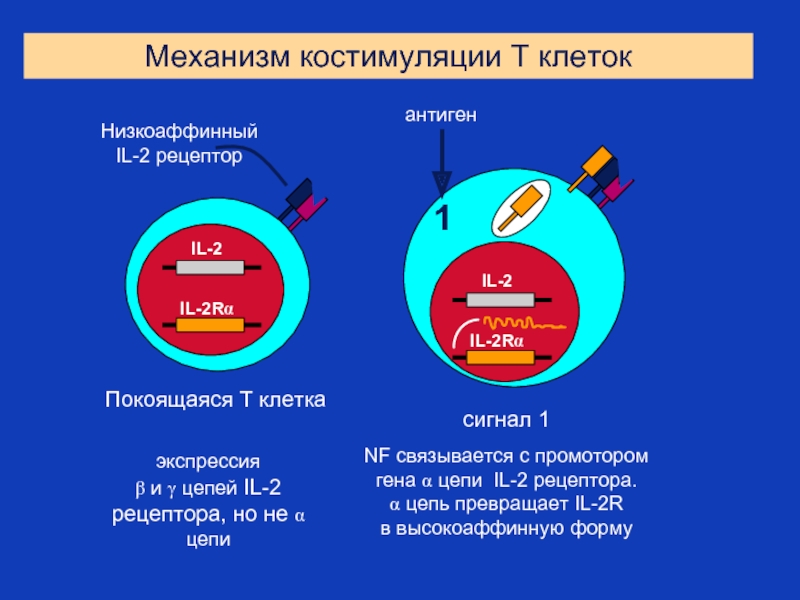
Слайд 34экспрессия
β и γ цепей IL-2 рецептора, но не α цепи
Механизм
сигнал 1
NF связывается с промотором
гена α цепи IL-2 рецептора.
α цепь превращает IL-2R
в высокоаффинную форму
Покоящаяся Т клетка
Низкоаффинный IL-2 рецептор
Слайд 35Роль цитокинов в усилении реакций адаптивного иммунного ответа: активация, пролиферация и
Слайд 36«Старая» парадигма поляризации иммунного ответа: путь Th1(клеточный ответ) или путь Th2(гуморальный
После созревания в тимусе
наивные CD 4+Т лимфоциты –хелперы (Th 0) дифференцируются на периферии
в эффекторные клетки - Th1 или Th2:
Th1запускают клеточный ответ,
Th2 –гуморальный. ответ.
«Уникальная особенность иммунологии состоит в том, что ее «сердцевина» не вполне стабилизировалась и меняется во времени в большей степени, чем основы других наук. Достаточно сказать, что на протяжении полувека парадигма иммунологии менялась по меньшей мере два раза — сначала при рождении «неинфекционной» (по преимуществу клеточной) иммунологии в 50–60-е годы ХХ века и затем — совсем недавно, при формировании новых представлений об иерархии и взаимодействии врожденного и адаптивного иммунитета.
Читатели с большим стажем знакомства с руководствами и учебниками по иммунологии, написанными в разное время, согласятся, что книги по иммунологии, опубликованные в 30-х, 60-х и 2000-х годах, порой как будто излагают основы разных наук»
А.А.Ярилин,2010 год.
Слайд 37Современная концепция: роль дендритных клеток в запуске определенного типа иммунного ответа
Предшественники
В этом состоянии они постоянно "берут на пробу" свое микроокружение путем эндоцитоза, макропиноцитоза и иногда - фагоцитоза.
Они способны протягивать свои отростки через плотные контакты между эпителиальными клетками и захватывать антиген еще до того, как он проникнет через эпителий.
Слайд 38Роль дендритных клеток в запуске и регуляции типа иммунного ответа
После миграции
Здесь они активно презентируют антиген Т-лимфоцитам в молекулах MHC I и MHC II
Таким образом осуществляется связь между врожденным и приобретенным иммунитетом.
Слайд 39Субпопуляции Т хелперов, дифференцирующиеся из Th0 –наивного Т хелпера под действием
РОЛЬ синтезируемых ДК цитокинов в формировании оптимального типа адаптивного иммунного ответа:
Разные типы цитокинов, синтезируемые ДК, направляют дифференцировку Т наивного хелпера по пути либо Th1, либо Th2, либоTh17, либоTh9, либо Th22 – в зависимости от необходимости развития наиболее оптимального для данного патогена типа иммунного ответа с целью его скорейшей элиминации из организма.
После дифференцировки Т наивного хелпера в один из перечисленных типов хелперов, строго регламентируется тип синтезируемых этими типами хелперов цитокинов.
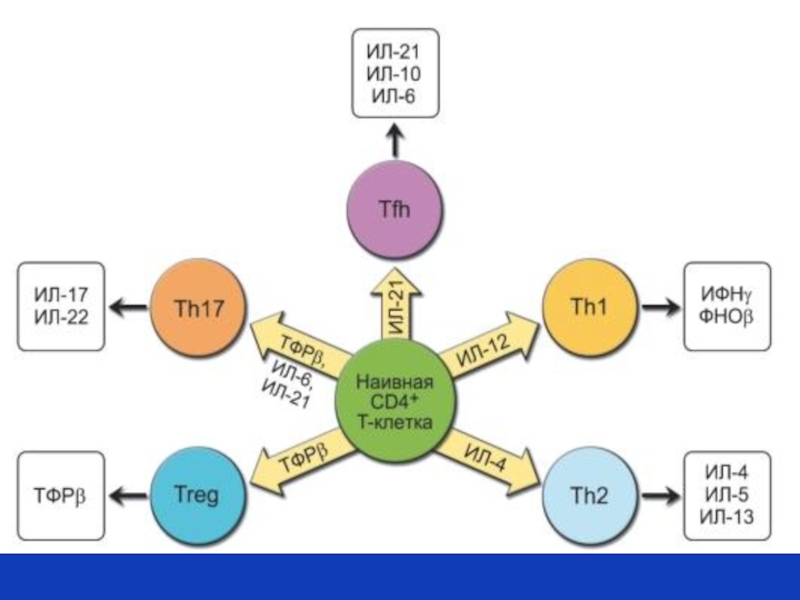
По профилю продуцируемых цитокинов выделяют следующие субпопуляции
CD 4+ лимфоцитов:
Th1, Th2, Th 17, Th fn, Th 9, Th 22, а также индуцибельные регуляторные Т-клетки (iTreg).
Биологический смысл столь сложной регуляции типов адаптивного иммунного ответа:
уникальный набор цитокинов каждого типа Т хелперов действует на разные клетки-мишени, которые обеспечивают элиминацию патогенов с разными типами паразитирования.
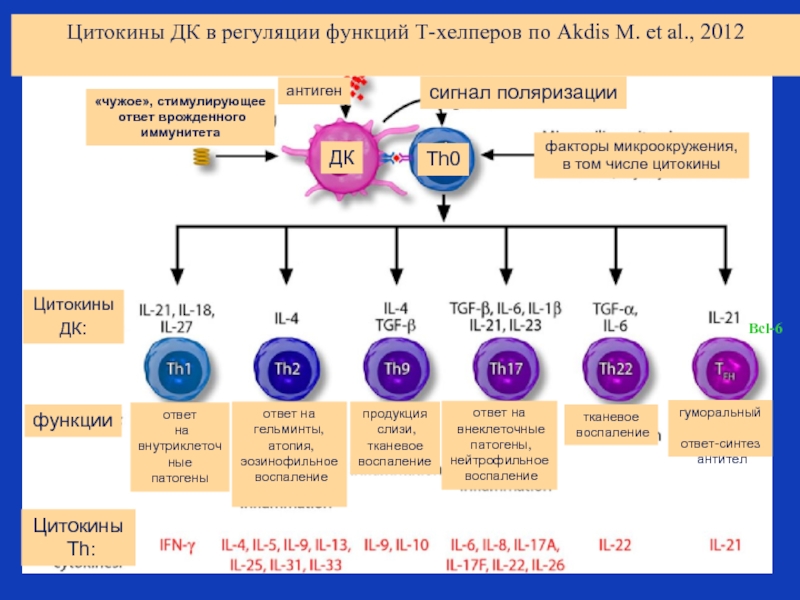
Слайд 40Цитокины ДК в регуляции функций Т-хелперов по Akdis M. et al.,
Bcl-6
сигнал поляризации
антиген
«чужое», стимулирующее
ответ врожденного
иммунитета
факторы микроокружения,
в том числе цитокины
Цитокины ДК:
ДК
Th0
функции
Цитокины
Th:
ответ
на внутриклеточные
патогены
ответ на
гельминты,
атопия,
эозинофильное
воспаление
продукция
слизи,
тканевое
воспаление
ответ на
внеклеточные
патогены,
нейтрофильное
воспаление
тканевое
воспаление
гуморальный
ответ-синтез
антител
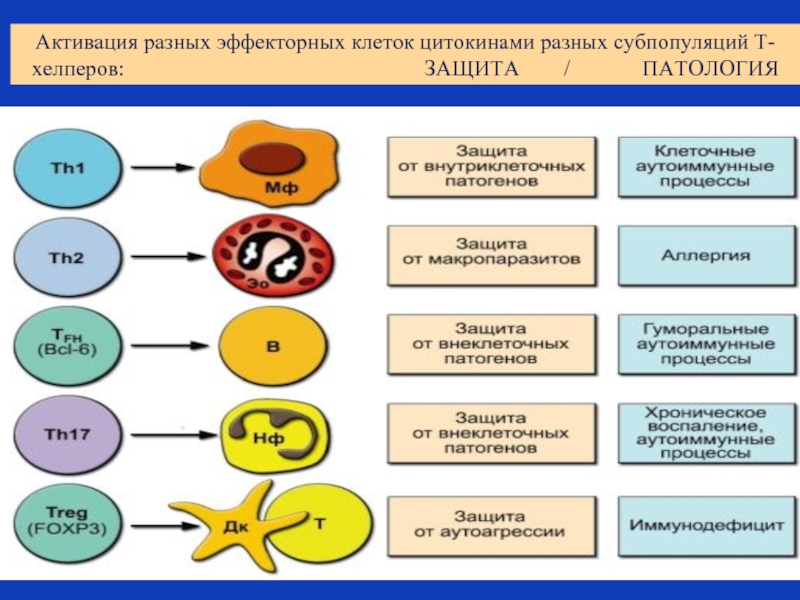
Слайд 42Активация разных эффекторных клеток цитокинами разных субпопуляций Т-хелперов:
Слайд 43Субпопуляции Т-хелперов
Th17
Если в микроокружении наивного Т хелпера присутствуют ИЛ-1β и ИЛ-23,
Th17 участвуют в развитии нейтрофильного воспаления на внеклеточные патогены, в том числе, в противогрибковом ответе, а также в развитии аутоиммунных процессов.
Th fn (T-follicular helper)
CD 4+ fn выполняют хелперную функцию в отношении В лимфоцитов.
Локализуются в В-клеточных фолликулах.
Вырабатывают хелперный цитокин ИЛ-21, стимулирующий через рецептор к ИЛ-21 на В-лимфоцитах, их активацию и дифференцировку в плазматические клетки, синтезирующие антитела.
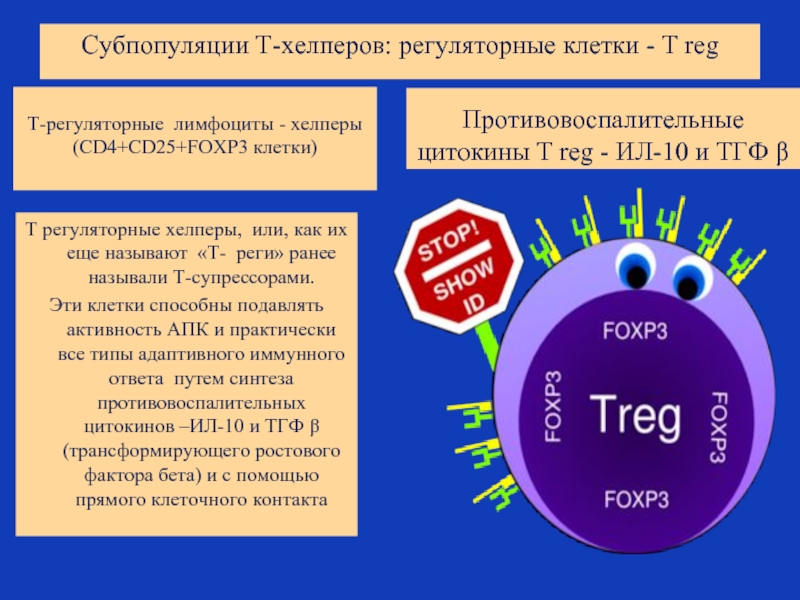
Слайд 44Субпопуляции Т-хелперов: регуляторные клетки - T reg
Т-регуляторные лимфоциты - хелперы (CD4+CD25+FOXP3
Т регуляторные хелперы, или, как их еще называют «Т- реги» ранее называли Т-супрессорами.
Эти клетки способны подавлять активность АПК и практически все типы адаптивного иммунного ответа путем синтеза противовоспалительных цитокинов –ИЛ-10 и ТГФ β (трансформирующего ростового фактора бета) и с помощью прямого клеточного контакта
Противовоспалительные цитокины T reg - ИЛ-10 и ТГФ β
Слайд 45Механизмы действия цитокинов
На первом этапе:
Цитокины взаимодействуют с высокоаффинными
Цитокиновые рецепторы –трансмембранные гликопротеины, включающие несколько цепей.
На последующих этапах:
Цитокины регулируют транскрипцию генов в клетках-мишенях с помощью вторичных сигналов.
Действие вторичных сигналов изменяет транскрипцию генов в клетках –мишенях (активирует или ингибирует), что приводит к изменению «поведения» клетки-мишени в целом.
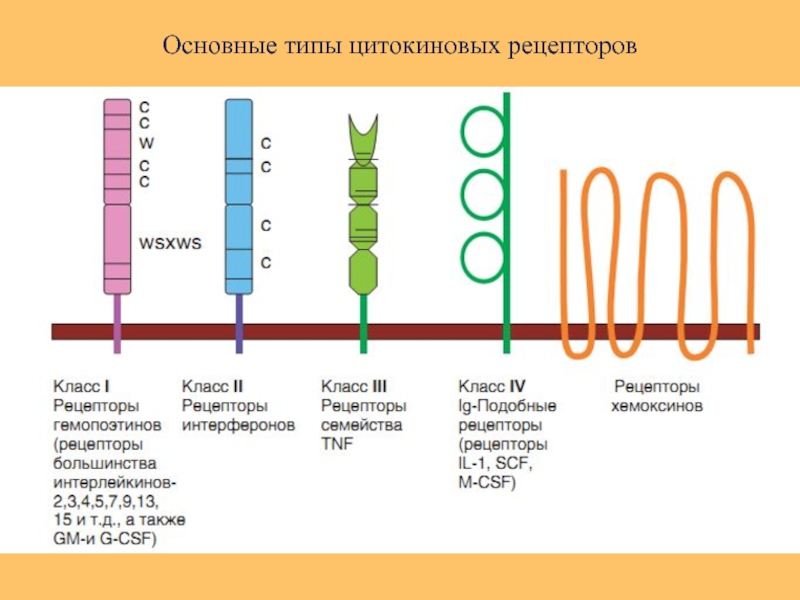
Слайд 46Классификация цитокинов по типу рецепторов. Цитокиновые рецепторы по их структуре подразделяют
Рецепторы цитокинов семейства гематопоэтинов интерлейкинов (ИЛ-2,3,4,5,7,11,15 и др.).
Рецепторы, относящиеся к суперсемейству иммуноглобулиновых молекул
(рецепторы ИЛ-1, М-КСФ, рецептор фактора роста стволовых клеток).
3. Рецепторы семейства фактора некроза опухолей (наличие домена смерти).
4. Рецепторы семейства интерферонов и ИЛ-10.
5. Рецепторы хемокинов.
Слайд 51Цитокиновая сеть
Межклеточная сигнальная сеть, в которой сигналы от отдельных цитокинов обычно
В сети реальные функции того или иного цитокина зависят от типа суммарных регуляторных воздействий на клетку-мишень , а не от отдельных свойств данного цитокина.
Цитокиновая сеть - сеть коммуникационных сигналов между клетками иммунной системы и другими органами.
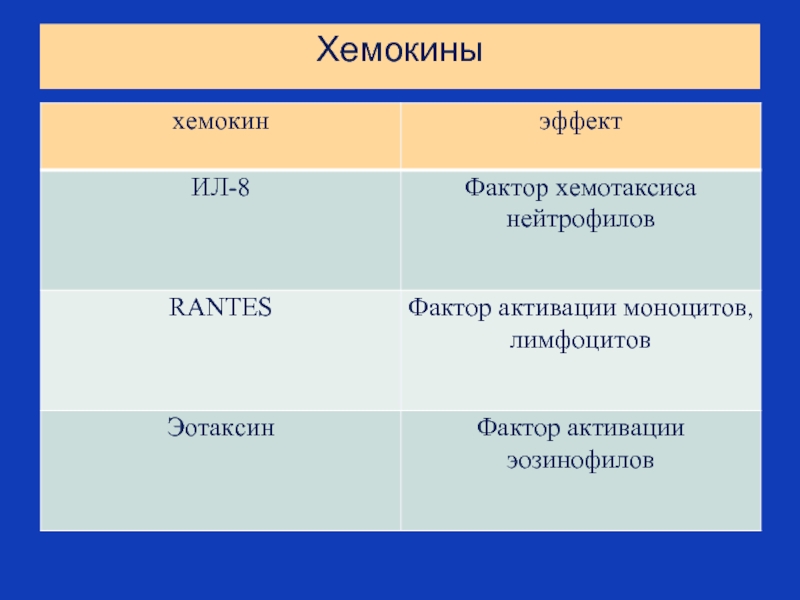
Слайд 53Хемокины
Хемокины – это цитокины, обладающие малой молекулярной массой (8-10 кДа) и
Малая молекулярная масса обеспечивает им высокую диффузионную способность и формирует градиент концентрации, уменьшающийся о мере отдаления от места их синтеза – феномен, лежащий в основе хемоаатракции.
Характеристика структуры хемокинов и их семейств:
м.м. = 5-20 kDa
катионные белки
связывают гепарин и гликозаминогликаны
имеют между собой 20-70% гомологии
содержат преимущественно четыре консервативных цистеина, связанных между собой дисульфидными связями: первый с третьим, второй с четвертым (называют их семейства –по расположению цистеина- СС, СХС и др.)
Слайд 54БИОЛОГИЧЕСКИЕ ФУНКЦИИ ХЕМОКИНОВ
ХЕМОТАКСИС ЛЕЙКОЦИТОВ
ДЕГРАНУЛЯЦИЯ ЛЕЙКОЦИТОВ
АКТИВАЦИЯ РЕСПИРАТОРНОГО ВЗРЫВА
АКТИВАЦИЯ ИНТЕГРИНОВ
Общая биологическая активность:
Хемокины привлекают:
СХС хемокины – нейтрофилы и Т-лимфоциты
СС хемокины – моноциты, базофилы и эозинофилы
Слайд 56Основные направления
современной цитокиновой терапии
Цитокиновая терапия
Использование препаратов цитокинов с целью
Заместительная терапия – восполнение недостатка эндогенных цитокинов, в т.ч. генотерапия первичных иммунодефицитов.
Иммуностимулирующее действие – при вторичных иммунодефицитных состояниях, вызванных инфекциями.
Иммуномодулирующее действие - коррекция дисбаланса эндогенных цитокинов.
Антицитокиновая терапия
Использование рецепторов цитокинов; моноклональных антител, блокирующих нежелательное действие цитокинов.
Удаление или блокирование действия эндогенных цитокинов.
Слайд 57РАЗРЕШЕННЫЕ К ПРИМЕНЕНИЮ
И РАЗРАБАТЫВАЕМЫЕ ПРЕПАРАТЫ
НА ОСНОВЕ РЕКОМБИНАНТНЫХ ЦИТОКИНОВ ЧЕЛОВЕКА
Эритропоэтин
Гранулоцитарный колониестимулирующий
Гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ)
Интерферон альфа, лямбда, в т.ч. ПЕГилированные (ИФН 1 и 3 типа)
Интерферон гамма
Интерлейкин-1 бета
Интерлейкин-2
Интерлейкин-7
Интерлейкин-10
Интерлейкин-15
Интерлейкин-17
Интерлейкин-21
Эпидермальный ростовой фактор
Bone morphogenetic proteins (BMP-2, BMP-7)
Слайд 58ОБЛАСТИ ПРИМЕНЕНИЯ
РЕКОМБИНАНТНОГО ЭРИТРОПОЭТИНА(ЭПО)
НЕФРОЛОГИЯ
- дефицит ЭПО у больных ХПН
ОНКОЛОГИЯ
- анемия
ИНФЕКЦИОННЫЕ БОЛЕЗНИ
- анемия вызванная применением ВААРТ у ВИЧ-пациентов
РЕВМАТОЛОГИЯ
- анемия у больных ревматоидным артритом
ХИРУРГИЯ
- применение ЭПО для уменьшения объема переливаемой крови
АКУШЕРСТВО
- лечение анемии беременных
ПЕДИАТРИЯ
- лечение анемии недоношенных новорожденных, нейропротекторное действие
Слайд 59ЛЕЧЕБНОЕ ПРИМЕНЕНИЕ ЦИТОКИНОВ
СТИМУЛЯЦИЯ КРОВЕТВОРЕНИЯ
Эритропоэз – эритропоэтин.
Лейкопоэз – Г-КСФ, ГМ-КСФ, ИЛ-1 бета.
Тромбопоэз
Лимфопоэз – ИЛ-7.
Слайд 61Вирусы, вызывающие ОРВИ, при которых показана клиническая эффективность применения интраназального ИФН
Риновирус ( в т.ч. тип 13, тип 39)
Вирус гриппа А (H1N1 и H3N2)
Вирус гриппа В
Вирус парагриппа
Респираторный синцитиальный вирус
Аденовирус
Коронавирус
Лекарственные формы:
Капли в нос
Спрей
Аэрозоль
Слайд 62Терапевтические схемы противовирусной терапии ХВГС (хронический вирусный гепатит С)
1. Монотерапия альфа-интерфероном
2. Комбинированная терапия ПЭГ-интерфероном в сочетании с рибавирином - 48 недель.
3. Комбинированная терапия ПЭГ-интерфероном в сочетании с рибавирином и ингибиторами вирусных протеаз - 24-48 недель.
Слайд 63
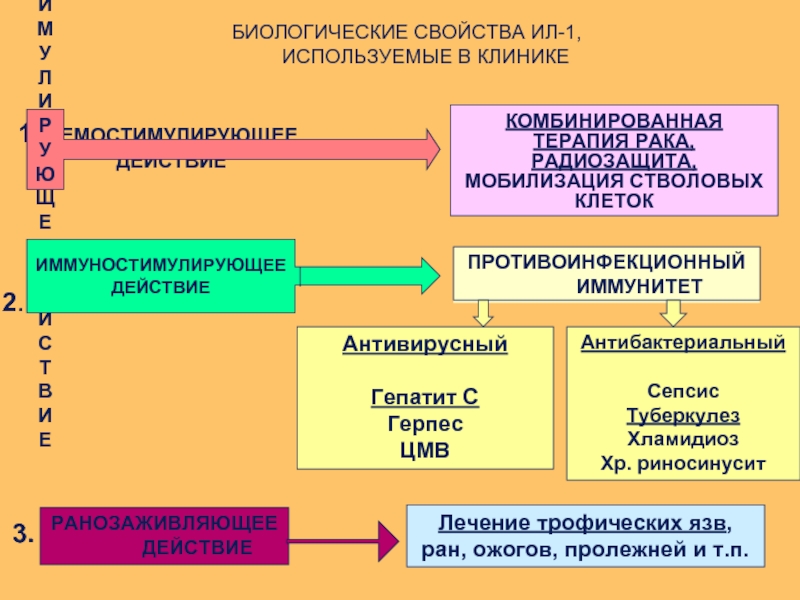
БИОЛОГИЧЕСКИЕ СВОЙСТВА ИЛ-1,
ИСПОЛЬЗУЕМЫЕ В КЛИНИКЕ
1.
ДЕЙСТВИЕ
ГЕМОСТИМУЛИРУЮЩЕЕ
ДЕЙСТВИЕ
2.
ИММУНОСТИМУЛИРУЮЩЕЕ
ДЕЙСТВИЕ
ПРОТИВОИНФЕКЦИОННЫЙ
ИММУНИТЕТ
Антивирусный
Гепатит С
Герпес
ЦМВ
Антибактериальный
Сепсис
Туберкулез
Хламидиоз
Хр. риносинусит
3.
РАНОЗАЖИВЛЯЮЩЕЕ
ДЕЙСТВИЕ
Лечение трофических язв, ран, ожогов, пролежней и т.п.
КОМБИНИРОВАННАЯ
ТЕРАПИЯ РАКА,
РАДИОЗАЩИТА,
МОБИЛИЗАЦИЯ СТВОЛОВЫХ КЛЕТОК
Слайд 64Препарат на основе интерлейкина-2 - Ронколейкин
Производитель –ООО «Биотех», СПб
Лечение вторичной иммунологической
Травмы, ожоги, сепсис, хирургическое лечения, онкология.
Основной курс :
в/в капельные инъекции 500 000МЕ на 400 мл изотонического раствора NаCl 2 раза с интервалом в 72 часа.
Ронколейкин может применяться как в виде монотерапии (в зависимости от вида патологии), так и в сочетании с препаратами интерферонов, иммуноглобулинов, макролидами, антиоксидантами.
Слайд 65Использование ИЛ-2-активированных клеток в терапии рака
LAK – лимфокин-активированные киллеры. ИЛ-2-активированные лимфоциты
TIL – тумор-инфильтрирующие лимфоциты. Лимфоциты, выделенные из удаленной опухоли и стимулированные ИЛ-2 in vitro.
CIK – цитокин-индуцированные киллеры. Лимфоциты периферической крови, активированные (ИЛ-2 + ИФНγ + а/CD3).
Применение: Меланома, рак почки, различные виды
сарком и ряд других опухолей.
Результаты: полный ответ до 50%, 5-ти летняя
выживаемость 40-72% (Morgan e.a., 2010; Phan, Rosenberg, 2013)
Слайд 66Адоптивная иммунотерапия рака с использованием лимфоцитов, активированных ИЛ-2
Опухоль-инфильтрирующие лимфоциты
Генно - модифициро-
ванные
ИЛ-2
ИЛ-2
ИЛ-2-активация
Phan & Rosenber2013
Слайд 67
Y
Y
Y
Антицитокиновая терапия:
Антагонисты цитокинов (РАИЛ –рецепторный антагонист ИЛ-1).
Моноклональные антитела (к фактору некроза
Естественные ингибиторы – рецепторный антагонист ИЛ-1 –Анакинра.
Моноклональные - антитела Infliximab, Adalimumab и др.
Растворимые рецепторы к
Fс фрагмент у Ig,
ФНО –рецептору
рецепторы-ловушки для ИЛ-6 и др.
Слайд 70АПОПТОЗ (краткая информация (если на занятии останется время), либо студенты могут
Естественный апоптоз развивается в физиологических условиях:
в периоде эмбриогенеза,
при элиминации повреждённых клеток и клеток в состоянии терминальной дифференцировки,
в процессе инволюции органов,
при дифференцировке некоторых типов клеток,
у новорождённогоу новорождённого вследствие родовогоу новорождённого вследствие родового стресса.
Основное назначение естественного апоптоза ремоделирование тканей и поддержание тканевого (структурного) гомеостаза.
Нарушение реализации естественного апоптоза приводит к развитию так называемых апоптоз-ассоциированных заболеваний (аутоиммунные болезни (аутоиммунные болезни, злокачественные опухоли и др.).
Индуцированный апоптоз обусловлен или усилен внешними факторами, не имеющими физиологического значения ( например, апоптоз клеток злокачественных опухолейнапример, апоптоз клеток злокачественных опухолей усиливается под влиянием лучевой или химиотерапии, апоптоз лимфоидных клеток развивается при дистресс-синдроме).
Формы индуцированного апоптоза:
Апоптоз дистресса
Инфекционно-токсический апоптоз
Неинфекционно-токсический апоптоз (в частности, лекарственный апоптоз)
Апоптоз ишемии
Апоптоз гиперчувствительности
Радиогенный апоптоз
Термогенный апоптоз.
Слайд 71Апоптоз как физиологическая смерть клеток
Взаимодействие Fas –рецептор ( FasR) - Fas
Fas – рецептор (CD95)- рецептор готовности клетки к апоптозу
Fas L или CD95L –лиганды Fas - рецептора.
Лигандами для таких рецепторов могут служить либо растворимые факторы, либо молекулы, экспрессирующиеся на поверхности клеток –таких, как цитотоксические Т лимфоциты.
При связывании Fas – рецептора Fas –лигандом, происходит запуск программируемой гибели клеток организма.
Лиганды для Fas – рецептора
Лиганды для Fas – рецептора (Fas L или CD95L) , запускающие апоптоз, имеют ряд сходных механизмов, но также ряд отличительных особенностей с активацией рецепторов фактора некроза опухолей - альфа (TNFα).
Связывание такого рецептора с лигандом вызывает на поверхности клетки-мишени процесс кластеризации рецепторов.
После этого адапторный протеин FADD подходит прямо к внутриклеточному домену смерти поверхностного Fas рецептора, соединяется с ним, после чего происходит запуск каскада каспаз.
Fas рецептор активирует только процесс апоптоза в клетке-мишени, и не участвует в сигналлинге TNF рецептора.
Слайд 72Рецептор клеточной гибели: роль TNFRI
Прокаспаза-8
Домен смерти
Плазматическая мембрана
Путь активации апоптоза
Путь передачи сигналов
адапторный
Слайд 73Механизмы запуска апоптоза
Цитотоксические Т лимфоциты распознают поврежденные , вирустрансформированные или малигнизированные
Цитотоксические Т лимфоциты также могут вызывать апоптоз клеток –мишеней с помощью специальных ферментов –гранзимов, которые они впрыскивают в отверстия клеточной мембраны клетки –мишени, созданные перфоринами –полимеризующимися в мембране мишени протеинами.
Гранзим B может быть введен в клетку-мишень цитотоксическим Т лимфоцитом с помощью отверстий в мембране мишени, созданных перфоринами.
Гранзим B способен прямо активировать каспазы 3, 7,8 и 10.
Митохондрия – также является ключевым регулятором каспазного каскада и апоптоза:
освобождение цитохрома C из митохондрии прямо активирует сначала каспазу 9, потом каспазу 3.
Слайд 74Каспазы и разрушение хроматина
Основной механизм запрограммированной гибели клеток – разрушение
Каспазы (ферменты с каскадным принципом действия) играют основную роль в этом процессе:
Активируют ДНКазы
Ингибируют ферменты, участвующие в репарации ДНК
Разрушают структурные протеины ядра
Слайд 75Механизмы действия каспаз: фрагментация хроматина
. Каспазы инактивируют ферменты, участвующие в репарации
Фермент поли (AДФ-рибоза)- полимераза, или PARP, один из первых белков, обнаруженных в качестве субстрата для каспаз.
PARP участвует в репарации структуры и восстановлении функций ДНК, так как осуществляет катализирование синтеза поли (AДФ-рибозы) , а также связывается с местами повреждений в ДНК и с измененными нуклеопротеинами.
Эта способность PARP к репарации поврежденной ДНК предотвращается ферментативным разрывом молекулы PARP каспазой 3.
Слайд 76Механизмы действия каспаз: разрушение структурных белков ядра и фрагментация ДНК
Каспазы разрушают
Ламины –структурные ядерные белки, которые поддерживают форму ядра и обеспечивают взаимодействие между хроматином и мембраной ядра.
Разрушения ламинов каспазой 6 приводит к конденсации хроматина и фрагментации ядра, что и является отличительной особенностью клеток, вошедших в апоптоз.
Каспазы вызывают фрагментацию ДНК
Радиоизотопные исследования показали, что процесс фрагментации ДНК до нуклеосом обеспечивается ферментом CAD ( каспазой активированная ДНКаза).
В норме CAD существует в виде неактивного комплекса с ингибитором- ICAD (ингибитор CAD).
Во время апоптоза, ICAD отрывается каспазой 3, и CAD освобождается из комплекса.
Вслед за этим происходит быстрая фрагментация ядра
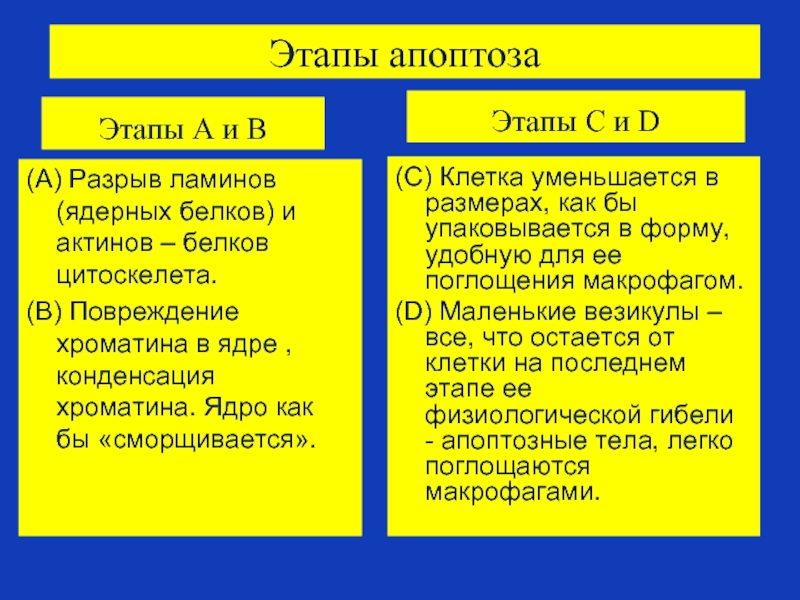
Слайд 77Этапы апоптоза
Этапы А и В
(А) Разрыв ламинов (ядерных белков) и актинов
(B) Повреждение хроматина в ядре , конденсация хроматина. Ядро как бы «сморщивается».
Этапы С и D
(C) Клетка уменьшается в размерах, как бы упаковывается в форму, удобную для ее поглощения макрофагом.
(D) Маленькие везикулы – все, что остается от клетки на последнем этапе ее физиологической гибели - апоптозные тела, легко поглощаются макрофагами.
Слайд 80Сигналы, вызывающие запуск апоптоза
Существует несколько типов сигналов, запускающих апоптоз.
Чувствительность клетки к
От экспрессии про- и противоапоптических протеинов (семейства Bcl-2 ).
От выраженности (силы) апоптозных стимулов.
От стадии клеточного цикла.
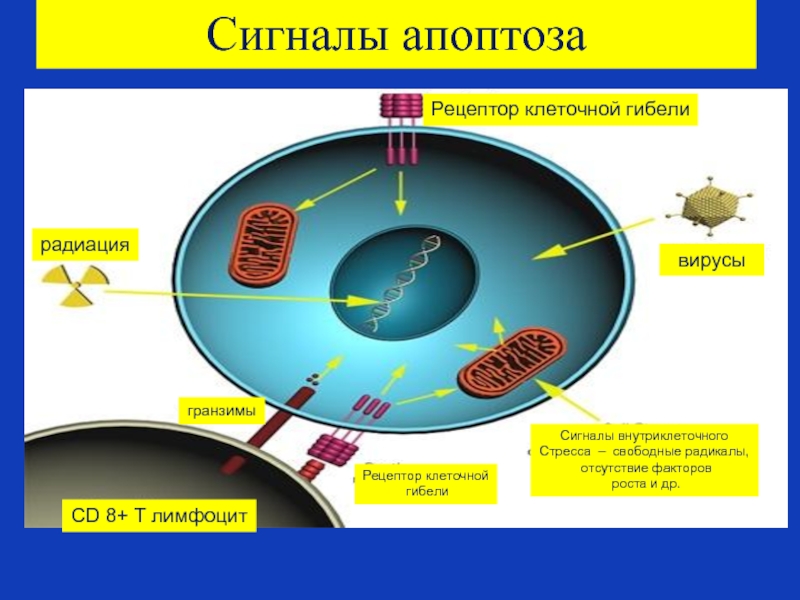
Слайд 81Сигналы апоптоза
Рецептор клеточной гибели
вирусы
Сигналы внутриклеточного
Стресса – свободные радикалы,
отсутствие факторов
Рецептор клеточной
гибели
гранзимы
радиация
CD 8+ Т лимфоцит
Слайд 82Внутренние сигналы апоптоза
В других случаях апоптоз клетки может запускаться внутренними сигналами
Клеточный стресс может вызываться при экспозиции клетки к радиации, химическим веществам, либо при вирусной инфекции.
Стресс может быть также оксидативным - в клетке скапливается слишком больное число оксидантов.
В генерацию внутренних сигналов апоптоза всегда вовлечены митохондрии.
Относительное количество антиапоптозных белков - bcl-2 - определяет, насколько интенсивность клеточного стресса достаточна для входа клетки в апоптоз.
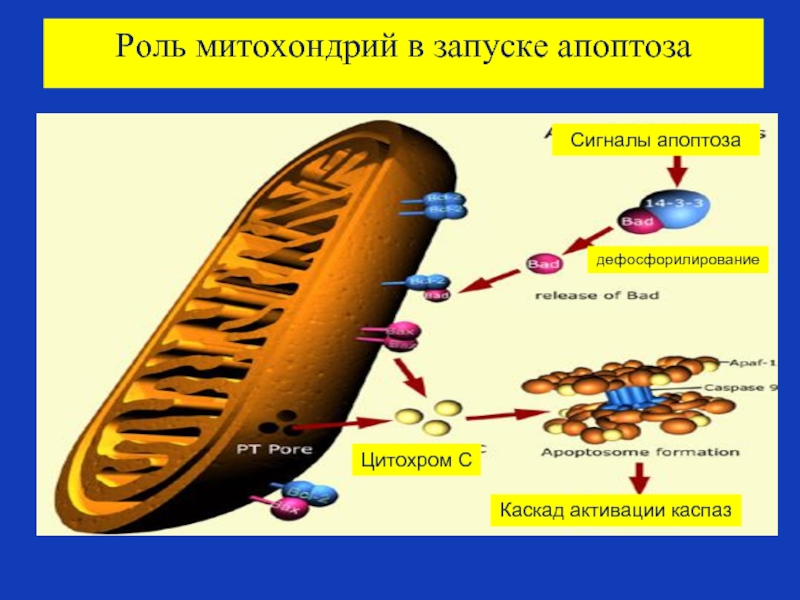
Слайд 83Роль митохондрий в запуске апоптоза
В митохондриях содержится большинство проапоптозных протеинов –таких,
Эти факторы освобождаются из митохондрий через отверстия в мембране, называемыми порами.
Эти поры образуются в мембране митохондрии в результате действия проапоптозных белков, которые активируются сигналами клеточного стресса (радиация, повреждение свободными радикалами, отсутствие положительных сигналов –ростовых факторов и т.д.).
Митохондрии также играют важную роль в усилении сигналов апоптоза , приходящих с домена смерти клеточного рецептора апоптоза, а также в привлечении каспазы 8 к этому домену смерти.
Слайд 84Роль Bcl-2 протеинов
Семейство bcl-2 протеинов участвует в ответе на апоптозные стимулы.
Некоторые
Другие члены семейства bcl-2 протеинов (такие, как Bad, Bax или Bid) являются проапоптозыми белками.
Чувствительность клетки к апоптозным стимулам зависит от баланса про- и противо- апоптозных bcl-2 протеинов: при преобладании проапоптозных белков, клетка более чувствительна к апоптозу, если преобладают противоапоптозные белки –клетка более устойчива к апоптозным стимулам.
Преобладание проапоптозных bcl-2 белков на поверхностной мембране митохондрий является сигналом для формирования пор, выхода из митохондрии цитохрома С, что служит внутренним сигналом для запуска каскада каспаз.
Слайд 85Роль Bcl-2 протеинов
Проапоптозные bcl-2 часто обнаруживаются и в цитозоле клетки, где
Вслед за развившимся клеточным стрессом они встраиваются в мембрану митохондрии, где локализуются противоапоптозные белки.
Такое взаимодействие между про- и противоапоптозными bcl-2 белками в мембране митохондрий приводит к образованию пори к освобождению цитохрома С и других проапоптозных молекул из внутримембранного пространства.
Это, в свою очередь, приводит к образованию апоптосом и активации каспазного каскада.
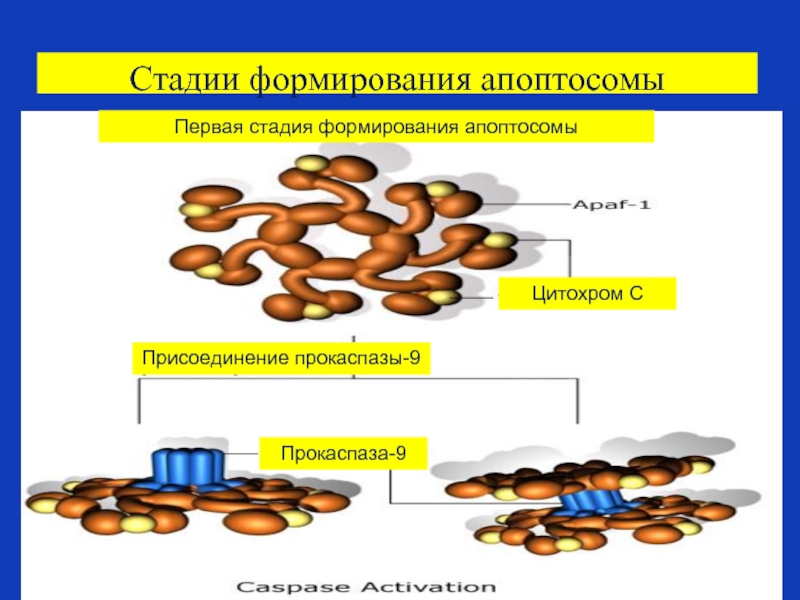
Слайд 86Формирование апоптосом
Освобождение цитохрома С в цитозоль приводит также к взаимодействию цитохрома
Это приводит к привлечению прокаспазы 9 в формирующийся многобелковый комплекс –с цитохромом С и белком Apaf-1, весь комплекс таких белков называется апоптосомой.
Формирование апоптосом приводит к активации прокаспазы 9 и к запуску апоптоза.
Слайд 87Роль митохондрий в запуске апоптоза
Сигналы апоптоза
дефосфорилирование
Цитохром С
Каскад
Слайд 88Стадии формирования апоптосомы
Первая стадия формирования апоптосомы
Цитохром С
Присоединение прокаспазы-9
Прокаспаза-9
Слайд 89Вопросы к занятию № 3 а
Классификация цитокинов.
Основные свойства цитокинов.
Понятие о цитокиновой
Характеристика клеток-продуцентов цитокинов во врожденном иммунитете.
Понятие о Т хелперах 1;2;17 типов.
Характеристика цитокинов и их антагонистов;
Семейства рецепторов цитокинов.
Цитокины и воспаление.
Системные и местные эффекты цитокинов.
Препараты на основе цитокинов и их антагонистов.
Слайд 90Тестовые задания к занятию № 3
Цитокины – это:
Цитотоксические клетки
Иммунорегуляторные пептиды
Бактериальные
Циркулирующие иммунные комплексы
Мембранные маркеры
Основными индукторами синтеза цитокинов клетками врожденного иммунитета являются:
Комплемент
Иммуноглобулины
Активация образраспознающих рецепторов
Взаимодействие адгезионных молекул
Циркулирующие иммунные комплексы
Слайд 91Тестовые задания к занятию № 3
Основными цитокинами врожденного иммунитета являются:
ИЛ-2
ИЛ-3
ИЛ-4
Интерфероны I
Провоспалительные цитокины
Цитокины воздействуют на клетку-мишень через:
Молекулы CD 3 ; CD 4
Молекулы MHC I и II класса
Цитоплазматическую мембрану
Растворимые рецепторы цитокинов
Мембранные рецепторы цитокинов
Слайд 92Тестовые задания к занятию № 3
Основными клетками-продуцентами цитокинов в реакциях врожденного
Клетки миелоидного ряда
Т-лимфоциты-хелперы
Цитотоксические Т-лимфоциты
В-лимфоциты
Плазматические клетки
Эффекты интерлейкина 1β:
Активация лимфоцитов и макрофагов
Усиление адгезионной активности лейкоцитов и эндотелия
Усиление выработки белков острой фазы
Повышение пролиферативной активности клеток
Повышение температуры тела
Слайд 93Тестовые задания к занятию № 3
В классификацию цитокинов входят:
Интерлейкины
Факторы некроза опухолей
Интерфероны
Факторы
Хемокины
Основными цитокинами Т хелперов 2 типа являются:
ИЛ-2 и ИЛ-3
ИЛ-1; ИЛ-4; ИЛ-17
ИЛ-4; ИЛ-5; ИЛ-6; ИЛ-10; ИЛ-13
ИЛ-1 и ИЛ-12
ИЛ-6 и ИЛ-8
Слайд 94Тестовые задания к занятию № 3
В запуске ответа цитотоксических Т-лимфоцитов участвуют:
ИЛ-1;
ИЛ-4; ИЛ-5; ИЛ-6; ИЛ-10; ИЛ-13
ИЛ-1 и ИЛ-12
ИЛ-6 и ИЛ-8
ИЛ-2 и интерферон-γ
К провоспалительным цитокинам не относится:
ИЛ-1
ИЛ-18
ИЛ-8
ФНО-α
ИЛ-10