- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Роль фибринолиза в системе гемостаза презентация
Содержание
- 1. Роль фибринолиза в системе гемостаза
- 2. Фибринолиз: общие сведения Фибринолиз = тромболизис (син.).
- 3. Фибринолиз: общие сведения Хотя фибринолиз начинается сразу
- 4. Фибринолиз: общие сведения Кроме удаления
- 5. Система фибринолиза: общие сведения Фибринолиз осуществляется фибринолитической
- 6. Система фибринолиза: общие сведения Активация
- 7. Схема фибринолиза Одновременно с образованием фибринового
- 8. Схема фибринолиза АП1 – антиактиватор плазминогена-1;
- 9. Схема фибринолиза Хотя
- 10. Виды фибринолиза Активный фермент плазмин принимает участие
- 11. Механизмы активации фибринолиза В некоторых отношениях структура
- 12. Фибринолиз: активация, внутренний путь Внутренний путь
- 13. Фибринолиз: активация, внешний путь Внешний путь активации
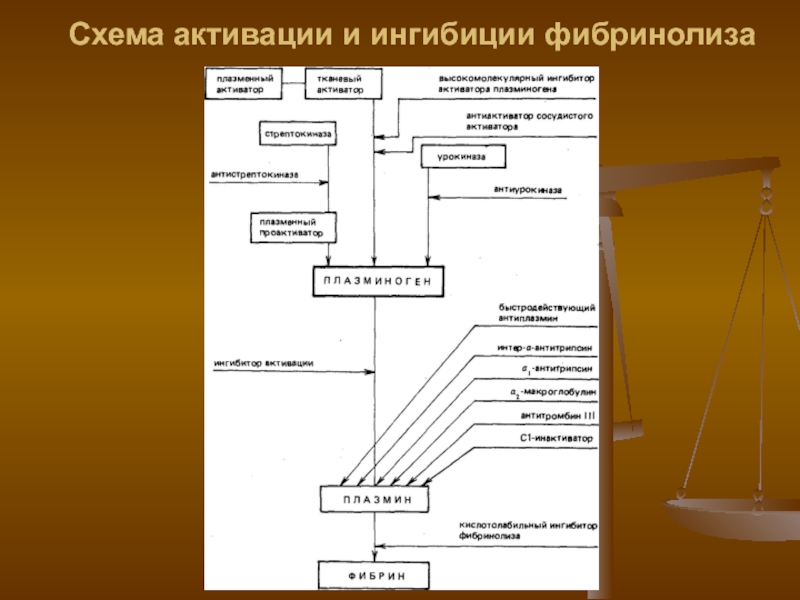
- 14. Схема активации и ингибиции фибринолиза
- 15. Плазминоген и плазмин Таким образом, фибринолитическая система
- 16. Плазминоген и плазмин Плазминоген – белок, широко
- 17. Плазминоген и плазмин Активный фермент плазмин участвует
- 18. Плазминоген и плазмин Концентрация плазминогена в крови
- 19. Диагностическое значение Определение фибринолитической активности
- 20. Нарушения фибринолиза Дефекты фибринолиза могут предрасполагать как
- 21. Диагностика нарушения фибринолиза Эуглобулиновый тест: нормальный лизис
- 22. Фибринолитики кровососущих Фибринолитические агенты, вырабатываемые слюнными железами
- 23. Фибринолитики кровососущих Принципиально новый механизм фибринолиза обнаружен
- 24. Hirudo medicinalis – пиявка медицинская
- 25. Применение фибринолитиков: эмболия легочной артерии и её
Слайд 2Фибринолиз: общие сведения
Фибринолиз = тромболизис (син.).
Фибринолиз – растворение фибрина тромбов в
результате ферментативных реакций.
Образование фибрина играет важную защитную функцию, обеспечивая посредством тромбоза остановку кровотечения в местах повреждения сосудов.
После выполнения гемостатической функции фибрин должен быть удалён для восстановления кровотока по сосуду.
Именно фибринолиз может приводить к канализации тромба и восстановлению кровотока.
Образование фибрина играет важную защитную функцию, обеспечивая посредством тромбоза остановку кровотечения в местах повреждения сосудов.
После выполнения гемостатической функции фибрин должен быть удалён для восстановления кровотока по сосуду.
Именно фибринолиз может приводить к канализации тромба и восстановлению кровотока.
Слайд 3Фибринолиз: общие сведения
Хотя фибринолиз начинается сразу же после образования фибринового тромба,
его реканализация и растворение могут занять 7-10 суток.
Известно 3 активатора фибринолиза:
фрагменты фактора XII,
урокиназа,
тканевый активатор плазминогена (ТАП).
Из них наиболее важны последние два.
Эти вещества выходят из эндотелиальных клеток и превращают преимущественно адсорбированный на нитях фибрина плазминоген в плазмин. Благодаря этому фибринолиз в норме идёт только в тромбах.
Известно 3 активатора фибринолиза:
фрагменты фактора XII,
урокиназа,
тканевый активатор плазминогена (ТАП).
Из них наиболее важны последние два.
Эти вещества выходят из эндотелиальных клеток и превращают преимущественно адсорбированный на нитях фибрина плазминоген в плазмин. Благодаря этому фибринолиз в норме идёт только в тромбах.
Слайд 4Фибринолиз: общие сведения
Кроме удаления тромбов, компоненты системы фибринолиза участвуют
в разрушении внеклеточного матрикса и могут выполнять важную функцию в регуляции таких процессов, как:
эмбриогенез,
регенерация тканей,
рост опухолей,
метастазирование опухолей.
эмбриогенез,
регенерация тканей,
рост опухолей,
метастазирование опухолей.
Слайд 5Система фибринолиза: общие сведения
Фибринолиз осуществляется фибринолитической системой.
Фибринолитическая система = система фибринолиза
крови = плазминовая система – это совокупность компонентов сосудов, крови и их взаимодействий, которая обеспечивает лизис (растворение) фибрина внутри сосудов.
Это осуществляется посредством расщепления фибриновых волокон на растворимые фрагменты небольших размеров.
Это осуществляется посредством расщепления фибриновых волокон на растворимые фрагменты небольших размеров.
Слайд 6Система фибринолиза: общие сведения
Активация фибринолитической системы достигается:
тканевыми и
плазменными активаторами
профермента плазминогена.
Ингибирование фибринолитической системы происходит на уровне:
активаторов плазминогена,
4-х ингибиторов активатора или
плазмина (преимущественно альфа-антиплазмином).
Ингибирование фибринолитической системы происходит на уровне:
активаторов плазминогена,
4-х ингибиторов активатора или
плазмина (преимущественно альфа-антиплазмином).
Слайд 7Схема фибринолиза
Одновременно с образованием фибринового сгустка, составляющего основу тромба, происходит довольно
медленный процесс фибринолиза, направленный на растворение образовавшегося фибрина.
Центральная роль в этом процессе принадлежит ферменту плазмину (сериновой протеиназе).
Неактивная форма плазмина циркулирует в крови в виде предшественника – профермента плазминогена.
Вовлеченный в фибриновый сгусток плазминоген подвергается воздействию тканевого активатора плазминогена (ТАП), секретируемого эндотелиальными клетками.
ТАП, проникнув в сгусток, превращает плазминоген в плазмин.
Плазмин расщепляет фибрин-полимер на мелкие фрагменты, которые затем поглощаются макрофагами.
Плазмин вызывает деградацию (гидролиз) фибрина до низкомолекулярный растворимых продуктов, называемых продуктами деградации фибрина (ПДФ).
ПДФ обладают способностью препятствовать формированию фибринового сгустка.
Центральная роль в этом процессе принадлежит ферменту плазмину (сериновой протеиназе).
Неактивная форма плазмина циркулирует в крови в виде предшественника – профермента плазминогена.
Вовлеченный в фибриновый сгусток плазминоген подвергается воздействию тканевого активатора плазминогена (ТАП), секретируемого эндотелиальными клетками.
ТАП, проникнув в сгусток, превращает плазминоген в плазмин.
Плазмин расщепляет фибрин-полимер на мелкие фрагменты, которые затем поглощаются макрофагами.
Плазмин вызывает деградацию (гидролиз) фибрина до низкомолекулярный растворимых продуктов, называемых продуктами деградации фибрина (ПДФ).
ПДФ обладают способностью препятствовать формированию фибринового сгустка.
Слайд 8Схема фибринолиза
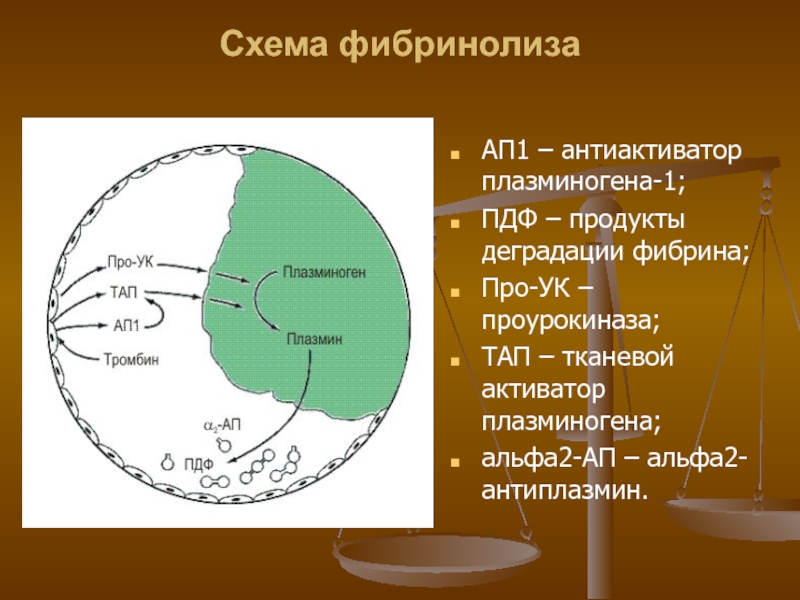
АП1 – антиактиватор плазминогена-1;
ПДФ – продукты деградации фибрина;
Про-УК
– проурокиназа;
ТАП – тканевой активатор плазминогена;
альфа2-АП – альфа2-антиплазмин.
ТАП – тканевой активатор плазминогена;
альфа2-АП – альфа2-антиплазмин.
Слайд 9Схема фибринолиза
Хотя плазмин может расщеплять не только фибрин,
но и фибриноген, в норме этот процесс всегда ограничен, поскольку:
тканевой активатор плазминогена лучше активирует плазминоген, если он адсорбирован на нитях фибрина;
при попадании плазмина в кровоток он быстро связывается и нейтрализуется альфа-2-антиплазмином (при дефиците альфа-2-антиплазмина отмечается неконтролируемый фибринолиз и кровоточивость);
эндотелиальные клетки выделяют антиактиватор плазминогена-1, который блокирует его действие.
тканевой активатор плазминогена лучше активирует плазминоген, если он адсорбирован на нитях фибрина;
при попадании плазмина в кровоток он быстро связывается и нейтрализуется альфа-2-антиплазмином (при дефиците альфа-2-антиплазмина отмечается неконтролируемый фибринолиз и кровоточивость);
эндотелиальные клетки выделяют антиактиватор плазминогена-1, который блокирует его действие.
Слайд 10Виды фибринолиза
Активный фермент плазмин принимает участие как в первичном, так и
во вторичном фибринолизе.
Таким образом, фибринолиз может быть 2-х видов:
первичный,
вторичный.
Первичный фибринолиз вызывается гиперплазминемией, наблюдающейся при поступлении в кровь больших количеств активаторов плазминогена.
Вторичный фибринолиз развивается в ответ на внутрисосудистое свёртывание крови, вызванное поступлением в кровоток тромбопластических веществ.
Таким образом, фибринолиз может быть 2-х видов:
первичный,
вторичный.
Первичный фибринолиз вызывается гиперплазминемией, наблюдающейся при поступлении в кровь больших количеств активаторов плазминогена.
Вторичный фибринолиз развивается в ответ на внутрисосудистое свёртывание крови, вызванное поступлением в кровоток тромбопластических веществ.
Слайд 11Механизмы активации фибринолиза
В некоторых отношениях структура системы фибринолиза напоминает систему свёртывания
крови.
По аналогии с системой свёртывания крови, в фибринолитической системе также различают:
внутренний путь активации фибринолиза и
внешний путь активации фибринолиза.
По аналогии с системой свёртывания крови, в фибринолитической системе также различают:
внутренний путь активации фибринолиза и
внешний путь активации фибринолиза.
Слайд 12Фибринолиз: активация, внутренний путь
Внутренний путь активации фибринолиза (Intrinsic pathway) ассоциируется с
взаимодействием субэндотелия, фактора свёртывания XII, прекалликреина и высокомолекулярного кининогена.
Таким образом, начальные этапы внутренних путей активации свёртывания крови и фибринолиза совпадают (идентичны) и сводятся к образованию фактора XIIа и калликреина.
Калликреин прямо стимулирует превращение плазминогена в плазмин,
а фактор XIIa вызывает сначала превращение проактиватора крови (идентичен прекалликреину) в активатор плазминогена.
Таким образом, начальные этапы внутренних путей активации свёртывания крови и фибринолиза совпадают (идентичны) и сводятся к образованию фактора XIIа и калликреина.
Калликреин прямо стимулирует превращение плазминогена в плазмин,
а фактор XIIa вызывает сначала превращение проактиватора крови (идентичен прекалликреину) в активатор плазминогена.
Слайд 13Фибринолиз: активация, внешний путь
Внешний путь активации фибринолиза (Extrinsic pathway) связан с
поступлением в кровоток тканевого активатора плазминогена, вырабатываемого клетками эндотелия сосудов, главным образом – малых вен.
Допускается, что имеется постоянная секреция активатора плазминогена, усиливающаяся под влиянием:
физической нагрузки,
психического воздействия и
др. стимулов.
Допускается, что имеется постоянная секреция активатора плазминогена, усиливающаяся под влиянием:
физической нагрузки,
психического воздействия и
др. стимулов.
Слайд 15Плазминоген и плазмин
Таким образом, фибринолитическая система включает 4 компонента:
плазмин,
плазминоген (неактивный предшественник
плазмина),
активатор плазминогена тканевого и/или урокиназного типа,
ингибитор плазминогена.
Главный компонент этой системы – протеолитический фермент плазмин, циркулирующий в плазме крови в виде профермента плазминогена в количестве 0,21 г/л (0,21 мг/мл).
активатор плазминогена тканевого и/или урокиназного типа,
ингибитор плазминогена.
Главный компонент этой системы – протеолитический фермент плазмин, циркулирующий в плазме крови в виде профермента плазминогена в количестве 0,21 г/л (0,21 мг/мл).
Слайд 16Плазминоген и плазмин
Плазминоген – белок, широко распространённый в организме, максимальное его
количество содержится в плазме крови в виде нескольких изоформ, различаюшихся составом и молекулярной массой (83-93 кДа).
Плазминоген ситезируется в печени как одноцепочечный белок, состоящий из 790 аминокислотных участков.
Пути активации плазминогена до плазмина:
природным тканевым активатором, который синтезируется и высвобождается эндотелиальными клетками;
внешними активаторами (стрептокиназа из гемолитического стрептококка, урокиназа – природный активатор из почек).
При активации от плазминогена отщепляется 2 пептида и образуется молекула плазмина из 2-х полипептидных цепей с молекулярной массой 76,5-85 кДа.
Плазминоген ситезируется в печени как одноцепочечный белок, состоящий из 790 аминокислотных участков.
Пути активации плазминогена до плазмина:
природным тканевым активатором, который синтезируется и высвобождается эндотелиальными клетками;
внешними активаторами (стрептокиназа из гемолитического стрептококка, урокиназа – природный активатор из почек).
При активации от плазминогена отщепляется 2 пептида и образуется молекула плазмина из 2-х полипептидных цепей с молекулярной массой 76,5-85 кДа.
Слайд 17Плазминоген и плазмин
Активный фермент плазмин участвует как в первичном, так и
во вторичной фибринолизе.
Соответственно и потребление плазминогена наблюдается и как при первичном, так и при вторичной фибринолизе.
Наиболее важная причина потребления плазминогена – вторичный фибринолиз, связанный с ДВС.
Исследование плазминогена проводится при лечении больных ДВС-синдромом, при диагностике тромбофилий, для контроля за лечением тромболитиками (при тромбозах, тромбоэмболиях, инфарктах).
Соответственно и потребление плазминогена наблюдается и как при первичном, так и при вторичной фибринолизе.
Наиболее важная причина потребления плазминогена – вторичный фибринолиз, связанный с ДВС.
Исследование плазминогена проводится при лечении больных ДВС-синдромом, при диагностике тромбофилий, для контроля за лечением тромболитиками (при тромбозах, тромбоэмболиях, инфарктах).
Слайд 18Плазминоген и плазмин
Концентрация плазминогена в крови может снижаться при заболеваниях почек,
циррозе печени, фибринолитических кровотечениях и повышаться при злокачественных новообразованиях, туберкулёзе и облучении Rg-лучами.
Антиплазминовым действием обладают антитромбин III, альфа-1-антитрипсин, альфа-2-антиплазмин, альфа-2-макроглобулин.
Ингибиторы находятся в крови в избытке и способны образовывать обратимые комплексы с плазмином.
Антиплазминовым действием обладают антитромбин III, альфа-1-антитрипсин, альфа-2-антиплазмин, альфа-2-макроглобулин.
Ингибиторы находятся в крови в избытке и способны образовывать обратимые комплексы с плазмином.
Слайд 19Диагностическое значение
Определение фибринолитической активности крови имеет диагностическое и прогностическое
значение при многих заболеваниях:
циррозе печени,
гепатите,
лейкозе,
серповидно-клеточной анемии,
тиреотоксическом зобе,
язвенной болезни желудка и 12-пёрстной кишки (локальный фибринолиз),
внутримозговых и субарахноидальных геморрагиях.
циррозе печени,
гепатите,
лейкозе,
серповидно-клеточной анемии,
тиреотоксическом зобе,
язвенной болезни желудка и 12-пёрстной кишки (локальный фибринолиз),
внутримозговых и субарахноидальных геморрагиях.
Слайд 20Нарушения фибринолиза
Дефекты фибринолиза могут предрасполагать как к кровотечениям, так и к
повторным тромбозам.
При дефиците альфа-2-антиплазмина и антиактиватора плазминогена-1 тромбы в местах травм или операций растворяются преждевременно, и кровотечение рецидивирует.
При циррозе печени нарушается элиминация тканевого активатора плазминогена.
Диффузная кровоточивость при опухолях (например, при раке предстательной железы с метастазами) иногда вызывается не ДВС-синдромом, а первичным повышенным фибринолизом. Заподозрить эту патологию можно по низкому уровню фибриногена при относительно нормальных ПВ и АЧТВ и близкому к норме уровню тромбоцитов.
Однако отличить первичный повышенный фибринолиз от вторичного (при ДВС-синдроме) бывает трудно, а иногда и невозможно.
При дефиците альфа-2-антиплазмина и антиактиватора плазминогена-1 тромбы в местах травм или операций растворяются преждевременно, и кровотечение рецидивирует.
При циррозе печени нарушается элиминация тканевого активатора плазминогена.
Диффузная кровоточивость при опухолях (например, при раке предстательной железы с метастазами) иногда вызывается не ДВС-синдромом, а первичным повышенным фибринолизом. Заподозрить эту патологию можно по низкому уровню фибриногена при относительно нормальных ПВ и АЧТВ и близкому к норме уровню тромбоцитов.
Однако отличить первичный повышенный фибринолиз от вторичного (при ДВС-синдроме) бывает трудно, а иногда и невозможно.
Слайд 21Диагностика нарушения фибринолиза
Эуглобулиновый тест: нормальный лизис эуглобулинового сгустка – 5-12 мин.,
удлиннение лизиса до 30-60 мин. вызвано:
дефицитом плазминогена,
дефицитом других факторов,
наличием ингибиторов.
Определение активности плазминогена:
норма: 80-135 %;
дефицит приводит к ИМ, лёгочной тромбоэмболии, тромбозу.
дефицитом плазминогена,
дефицитом других факторов,
наличием ингибиторов.
Определение активности плазминогена:
норма: 80-135 %;
дефицит приводит к ИМ, лёгочной тромбоэмболии, тромбозу.
Слайд 22Фибринолитики кровососущих
Фибринолитические агенты, вырабатываемые слюнными железами кровососущих, обеспечивают процесс кровоизвлечения путем
растворения кровяных сгустков. Фибринолитические вещества необходимы для обеспечения жидкого состояния крови, хранящейся в желудочно-кишечном тракте кровососущих.
Первым изученным фибриногено- и фибринолитическим ферментом является белок гирудин, выделенный из слюнных желез медицинской пиявки H.medicinalis. Его молекулярная масса 80-120 кДа. Картина расщепления фибриногена гирудином практически не отличается от таковой для плазмина.
Фибриногенолитическими свойствами гирудина объясняется его способность вызывать дезагрегацию тромбоцитов путем расщепления фибриногеновых сшивок между тромбоцитами в их агрегатах.
Первым изученным фибриногено- и фибринолитическим ферментом является белок гирудин, выделенный из слюнных желез медицинской пиявки H.medicinalis. Его молекулярная масса 80-120 кДа. Картина расщепления фибриногена гирудином практически не отличается от таковой для плазмина.
Фибриногенолитическими свойствами гирудина объясняется его способность вызывать дезагрегацию тромбоцитов путем расщепления фибриногеновых сшивок между тромбоцитами в их агрегатах.
Слайд 23Фибринолитики кровососущих
Принципиально новый механизм фибринолиза обнаружен у фермента дестабилазы, выделенного в
1985 г. из медицинской пиявки (H. medicinalis).
Фермент катализирует гидролиз только эпсилон(гамма-Glu)-Lys изопептидных связей в стабилизированном фибрине, образованных трансглутаминазой, ф. ХIIIа, в присутствии ионов Ca++.
В результате расщепления этих связей вместо исходного остатка Gln возникает остаток Glu, что резко изменяет распределение зарядов в области полимеризации фибрин-мономеров и приводит к спонтанной деполимеризации дестабилизированного фибрина.
Аминокислотная последовательность 41-ого аминокислотного остатка дестабилазы не проявляет гомологии с известными белками, что позволяет судить о ней как о новом белке.
Фермент катализирует гидролиз только эпсилон(гамма-Glu)-Lys изопептидных связей в стабилизированном фибрине, образованных трансглутаминазой, ф. ХIIIа, в присутствии ионов Ca++.
В результате расщепления этих связей вместо исходного остатка Gln возникает остаток Glu, что резко изменяет распределение зарядов в области полимеризации фибрин-мономеров и приводит к спонтанной деполимеризации дестабилизированного фибрина.
Аминокислотная последовательность 41-ого аминокислотного остатка дестабилазы не проявляет гомологии с известными белками, что позволяет судить о ней как о новом белке.
Слайд 24Hirudo medicinalis – пиявка медицинская
Сведения о структуре и механизмах
действия антикоагулянтов и фибринолитиков у кровососущих являются основанием для создания принципиально новых лекарственных препаратов (реваск, гиролог, аргатробан).
Слайд 25Применение фибринолитиков:
эмболия легочной артерии и её ветвей,
тромбоз поверхностных и глубоких вен,
острый
инфаркт миокарда (первые 12 час.),
тромбоз сосудов сетчатки глаза,
другие состояния с угрозой тромбоза или тромбоэмболии.
тромбоз сосудов сетчатки глаза,
другие состояния с угрозой тромбоза или тромбоэмболии.