- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Туберкулёз. Дифтерия презентация
Содержание
- 1. Туберкулёз. Дифтерия
- 2. Классификация возбудителя туберкулеза Семейство Mycobacteriaceae Род Mycobacterium
- 3. Характеристика возбудителя туберкулеза 21 гр. по Берджи
- 4. Главный фактор патогенности – токсический гликолипид –
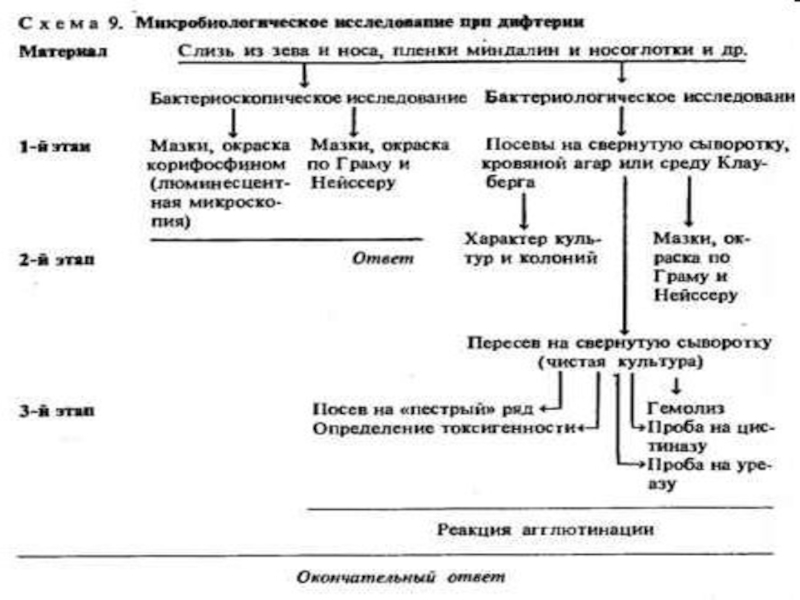
- 5. Микробиологическая диагностика Бактериоскопический Экспресс-диагностика (ПЦР, РИФ) Бактериологический – основной Биологический Метод кожно-аллергических проб
- 6. Бактериоскопический метод Нередко материал содержит мало бактерий
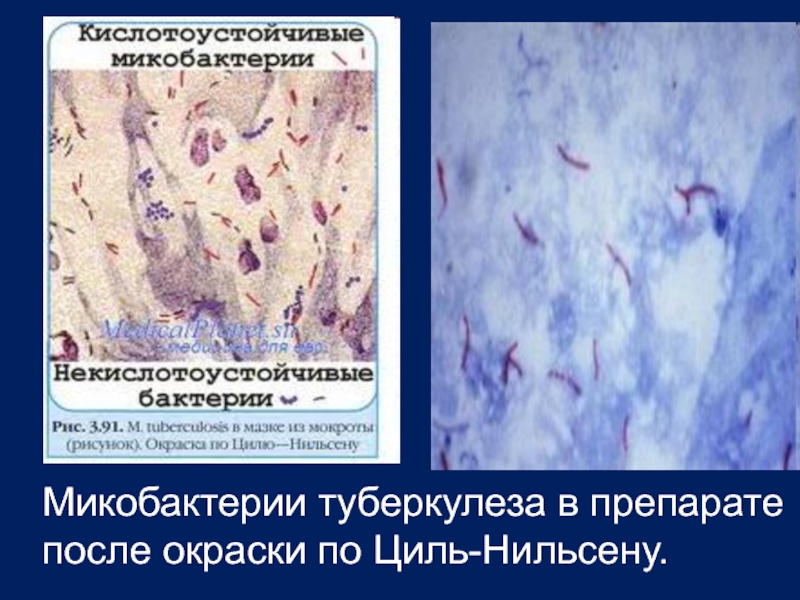
- 7. Микобактерии туберкулеза в препарате после окраски по Циль-Нильсену.
- 8. Возбудители туберкулеза в мазке мокроты. На фоне
- 9. Флуоресценция туберкулезных бактерий после окраски аурамином.
- 10. Бактериологический метод Для повышения эффективности выделения возбудителя
- 11. Один из распространённых методов выделения возбудителя туберкулеза,
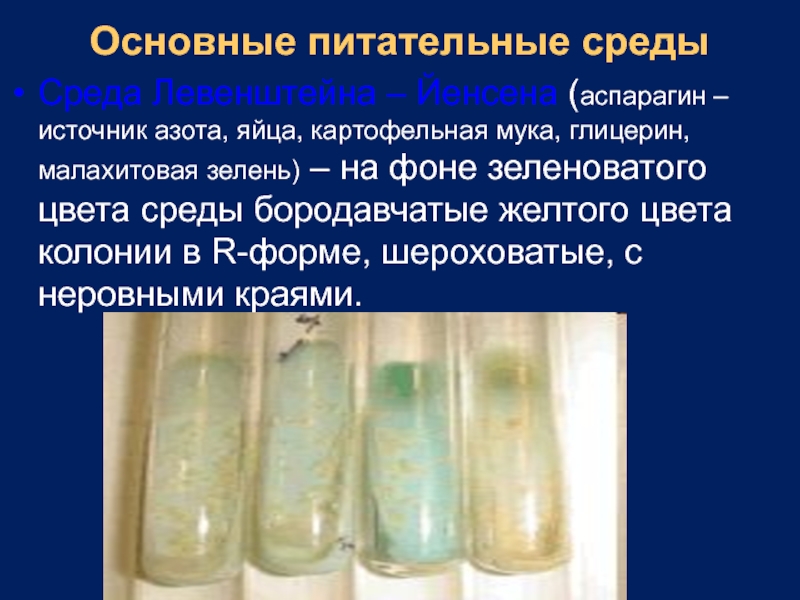
- 13. Основные питательные среды Среда Левенштейна – Йенсена
- 14. Среда Финна – глютамат натрия (источник
- 15. Идентификация Проба на каталазную активность – чистую
- 16. Биологическая проба Биологическая проба является по праву
- 17. Для выявления аллергии применяют внутрикожную пробу Манту.
- 18. Классификация и характеристика возбудителя дифтерии Род Corynebacterium
- 19. Факторы патогенности Адгезины – поверхностные структуры липидной
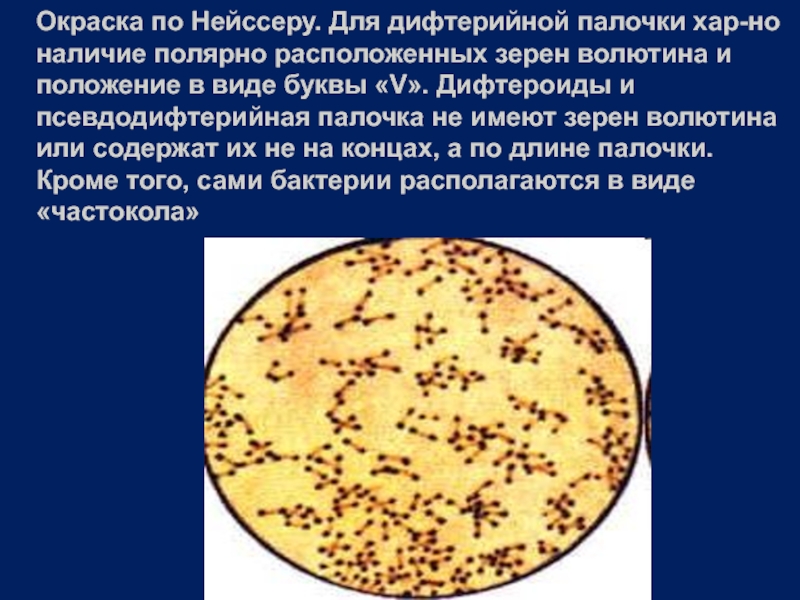
- 21. Окраска по Нейссеру. Для дифтерийной палочки хар-но
- 22. Биовары У этого возбудителя выделяют биотипы -
- 23. Теллуритовая среда Клауберга (питательный агар с теллуритом
- 24. Идентификация Способность бактерий дифтерии продуцировать токсин устанавливают
- 25. Проба ПИЗУ Для определения цистиназы в столбик
- 26. Проба Закса Для определения уреазы готовят спиртовый
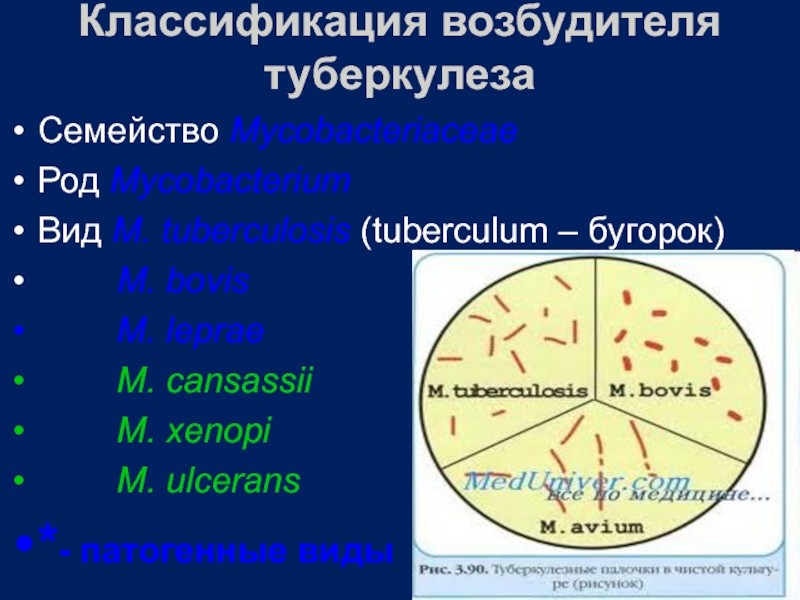
Слайд 2Классификация возбудителя туберкулеза
Семейство Mycobacteriaceae
Род Mycobacterium
Вид M. tuberculosis (tuberculum – бугорок)
M. leprae
M. cansassii
M. xenopi
M. ulcerans
*- патогенные виды
Слайд 3Характеристика возбудителя туберкулеза
21 гр. по Берджи (гр+ палочки, аэроб)
Неподвижны, спор, капсулы
В клеточной стенке большое количество липидов (миколовая кислота и липоиды – до 40% от сухого веса), что определяет следующие свойства:
Кислотоустойчивость (5-10% кислоты)
Уст-ть к щелочам и спирту
Уст-ть к высушиванию, УФ, дез. Средствам
Вызывают сенсибилизацию организма
Слайд 4Главный фактор патогенности – токсический гликолипид – Корд-фактор
Располагается на поверхности и
По химической природе – полимер: 1 мол-ла дисахарида тригалозы+ миколовая жирная к-та+миколиновая жирная кислота
Его функции:
Токсическое действие на ткани
Защита от фагоцитоза
Подавляет миграцию лейкоцитов
Слайд 5Микробиологическая диагностика
Бактериоскопический
Экспресс-диагностика (ПЦР, РИФ)
Бактериологический – основной
Биологический
Метод кожно-аллергических проб
Слайд 6Бактериоскопический метод
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности
Окраска по Циль-Нильсену - туберкулезные микобактерии визуализируются как ярко-красные, тонкие, изящные, в одиночку или группами, большей частью лежащие вне клеток палочки.
Окраска аурамином – в люмин. микроскопе – M.tub. Золтисто-оранжевого цв, атипичные формы – зеленый.
Слайд 8Возбудители туберкулеза в мазке мокроты. На фоне слизи, окрашено в синий
Слайд 10Бактериологический метод
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры
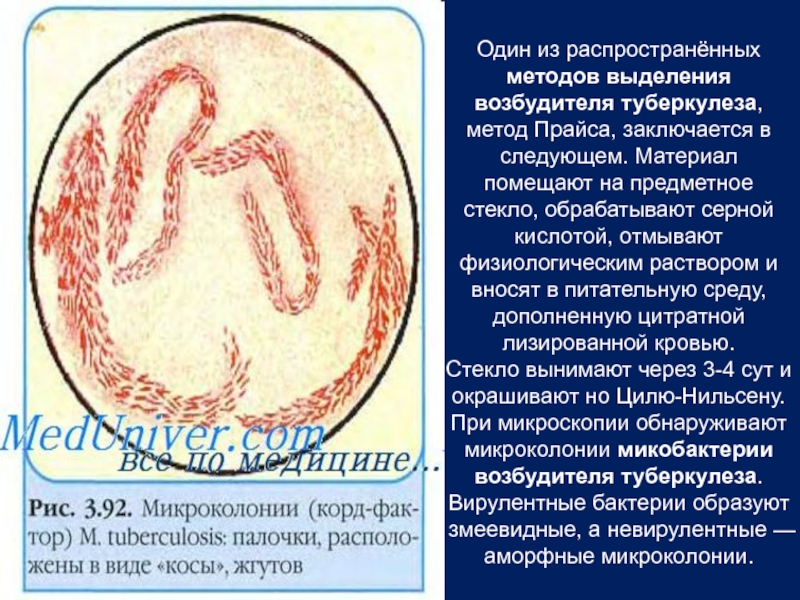
Слайд 11Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные, а невирулентные — аморфные микроколонии.
Слайд 13Основные питательные среды
Среда Левенштейна – Йенсена (аспарагин – источник азота, яйца,
Слайд 14
Среда Финна – глютамат натрия (источник азота) +малахитовая зелень
Среда Новая –
Среда Сотона – жидкая. Солевой р-р (цитрат железа + фосфат калия) + аспарагин + глицерин. Рост: поверхностная пленка со специфическим запахом.
Слайд 15Идентификация
Проба на каталазную активность – чистую культуру возбудителя прогревают 30 мин.
Ниациновый тест (проба Конно) – M.tub. Синтезирует никотин в среду Сотона. При добавлении цианистого калия к среде образуется ниацин, который при соединении с 5% хлорамином дает ярко-желтое окрашивание.
Слайд 16Биологическая проба
Биологическая проба является по праву наиболее рациональным диагностическим приемом. Материал
Слайд 17Для выявления аллергии применяют внутрикожную пробу Манту. Для постановки туберкулиновых проб
Положительные и резко положительные реакции (более 16 мм) подтверждают наличие сенсибилизации организма, а отрицательная туберкулиновая реакция (менее 5 мм) может указывать на отсутствие заболевания или на излечение. В случае тяжелого заболевания отрицательная туберкулиновая реакция может свидетельствовать об истощении защитных сил организма.
Слайд 18Классификация и характеристика возбудителя дифтерии
Род Corynebacterium (coryne – булава, bacterium –
Вид C.diphtheriae (пленка, перепонка)
Тонкие гр+ палочки, утолщенные на концах за счет зерен волютина
Неподвижна, спор не образует,
есть микрокапсула
Характерен полиморфизм
Имеются коринеформные бактерии,
не обладающие патогенностью-
дифтероиды
Слайд 19Факторы патогенности
Адгезины – поверхностные структуры липидной и белковой природы (корд-фактор, микрокапсула)
Ферменты
Дифтерийный гистотоксин – основной фактор патогенности – блокирует синтез белка в клетках, наиболее снабженных кровью (миокард, периф. и ЦНС, почки и др.)
Агрессины – подавление фагоцитоза