- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Преаналитический этап лабораторных исследований: классика и современность презентация
Содержание
- 1. Преаналитический этап лабораторных исследований: классика и современность
- 2. ЭТАПЫ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ ПРЕАНАЛИТИЧЕСКИЙ – назначение анализа,
- 3. Ошибки лабораторных исследований и их последствия M
- 4. W. Guder et al. (2001)
- 5. Факторы преаналитического этапа, способные влиять на результаты
- 6. Влияние пола пациента Уровень некоторых аналитов
- 7. Содержание ферритина в сыворотке крови в норме
- 8. Концентрация ферритина в первый месяц после
- 9. В третьем триместре беременности
- 10. W. Guder et al. (2008) Долговременно влияющие факторы : возраст пациента
- 11. Занятия спортом Масса тела и лабораторные показатели W. Guder et al. (2008)
- 12. Возрастание объема циркулирующей плазмы (при физиологической беременности
- 13. Суточные ритмы (гормоны, Fe, ферменты…) Месячные
- 14. Влияние суточных биоритмов
- 15. Физическая нагрузка и стрессы Потеря жидкости с
- 16. Пищевой фактор триглицериды АСТ билирубин глюкоза
- 17. При диете, богатой белками и нуклеотидами,
- 18. При количественном измерении уровней мочевой
- 19. Курение, прием кофе острые эффекты –
- 20. Снижение активности ангиотензин-превращающего фермента у курильщиков
- 21. Кофеин содержится во многих компонентах повседневной
- 22. Через 3 часа после приема 250
- 23. Употребление алкоголя холестерин ЛПНП ванилилминд. к-та MCV
- 24. Остро возникающие изменения ( в течение
- 25. При хронических изменениях отмечаются изменения активности
- 26. Усиление диуреза является результатом сниженного высвобождения вазопрессина вследствие повышения секреции ренина и альдостерона.
- 27. Влияние лекарственных средств на результаты анализов
- 28. Эффекты наркотиков W. Guder et al. (2008)
- 29. Влияние лекарственных средств на результаты анализов
- 30. Влияние внутривенных инфузий и трансфузий на результаты анализов
- 31. Терапевтический лекарственный мониторинг При подозрении на передозировку
- 32. Диагностические и лечебные процедуры, влияющие на результаты
- 33. Загрязнение лабораторных проб инфузионными растворами является
- 34. Пробы следует брать из другой руки.
- 35. Рекомендуется информировать лабораторию о том, когда
- 36. Положение тела пациента Стоя / сидя –
- 37. Сжатие кулака при наложенном жгуте (калий в
- 38. Лучшее место забора крови на анализы
- 39. При заборе крови из пальца возможен
- 40. Кровь – вначале капиллярную (КОС /
- 41. Спросить (!) полное имя пациента и дату
- 42. Взятие крови Для исследования аналитов в цельной
- 43. Взятие крови из вены После инфузии
- 44. Взятие крови из вены шприцем Высока
- 46. Иглы и держатели 61 % повреждений кожи
- 47. Последовательность взятия крови в вакуумные пробирки Флаконы
- 48. Каковы преимущества плазмы перед сывороткой? 1.
- 49. Каковы недостатки плазмы по отношению к сыворотке?
- 50. При использовании пробирок с разделительным гелем
- 51. Несовместимые антикоагулянты L. Thomas (2006) www.gbo.com/preanalytics
- 52. Не требуются вторичные пробирки, снижается опас-
- 53. 3 - 4 раза 8 раз
- 54. Капиллярная кровь При прохождении крови через
- 55. При транспортировке в лабораторию образцы крови надо
- 56. Хранение и транспортировка крови Исследование крови
- 57. Контроль образцов в лаборатории Наиболее частые причины
- 58. Гемолиз 6 564
- 59. Последствия гемолиза Изменения лабораторных параметров плазмы
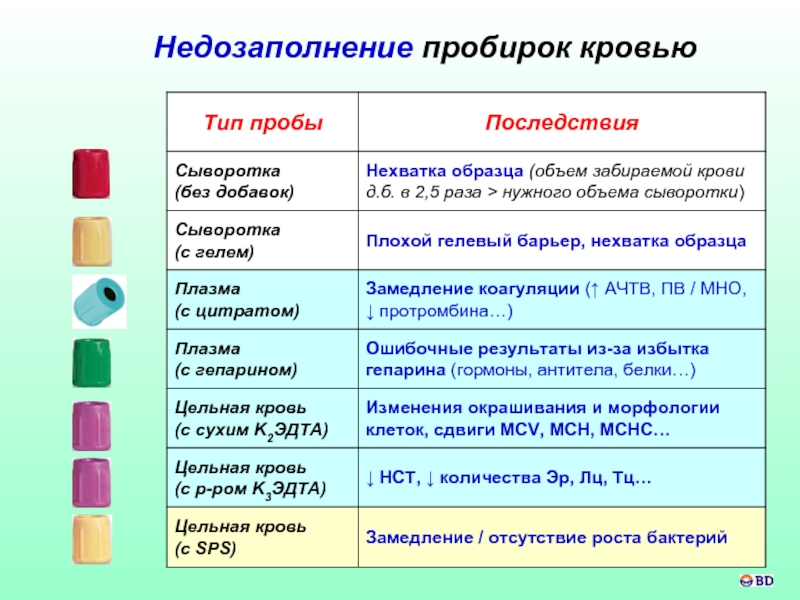
- 60. Недозаполнение пробирок кровью
- 61. Плохое перемешивание образца Неполное свертывание –
- 62. Плохая маркировка пробирок Этикетка должна быть наклеена
- 63. Центрифугирование пробирок с кровью При комнатной температуре
- 64. Возможные ошибки центрифугирования Сывороточная проба:
- 65. Обеспечение качества преаналитического этапа
- 66. Отсутствие этикетки на пробирке / шприце; Расхождение
Слайд 1ПРЕАНАЛИТИЧЕСКИЙ ЭТАП
ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ:
классика и современность
Зав. кафедрой клинической лабораторной диагностики НижГМА
Слайд 2ЭТАПЫ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ
ПРЕАНАЛИТИЧЕСКИЙ – назначение анализа, подготовка пациента к исследованию, взятие
АНАЛИТИЧЕСКИЙ
доприборный (добавление реактивов или красите-лей, химическая реакция, инкубация, перемешивание, промывание и т.д.)
приборный (фотометрия / электрометрия / радио-метрия / подсчет частиц, расчет результатов)
ПОСТАНАЛИТИЧЕСКИЙ – передача результатов лечащему врачу, интерпретация, корректировка диагноза / лечения
Слайд 3Ошибки лабораторных исследований и их последствия
M Plebani and P Carraro. Mistakes
Преаналитический этап
Аналитичес-кий этап
Постаналитический этап
Без нежелат. эффектов
Изменение терапии
Дополнительные исследования
Следствия:
6% пациентов получили неправильное
лечение,
19% пациентов были назначены
ненужные дополнительные исследования.
– Неадекв. трансфузии 2%
– Неадекв. инфузии электролитов 1%
– Неадекв. изменения дозы гепарина 2%
– Неадекв. изменения дозы дигоксина
1%
На преаналитический этап пришлось 46 - 68% всех ошибок лаборатор-ного исследования в экспресс-лаборатории.
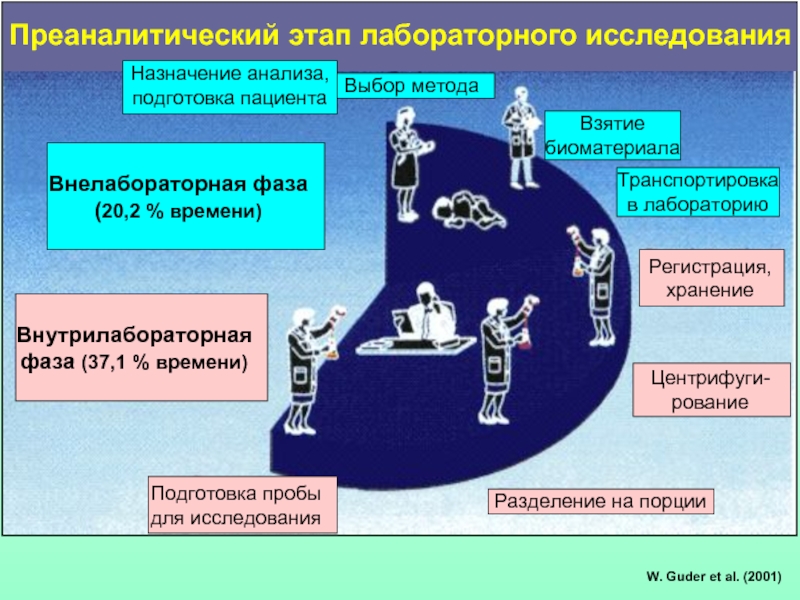
Слайд 4W. Guder et al. (2001)
Взятие
биоматериала
Транспортировка
в лабораторию
Регистрация,
хранение
Центрифуги-рование
Разделение на порции
Подготовка пробы
для исследования
Преаналитический этап лабораторного исследования
Выбор метода
Внелабораторная фаза
(20,2 % времени)
Назначение анализа,
подготовка пациента
Внутрилабораторная
фаза (37,1 % времени)
Слайд 5Факторы преаналитического этапа, способные влиять на результаты лабораторных исследований
НЕИЗМЕННЫЕ
Пол пациента
Этногеографические особенности
ДОЛГОВРЕМЕННО
Масса тела
Образ жизни, занятия спортом
Беременность
КОРОТКОДЕЙСТВУЮЩИЕ
Биоритмы организма
Физическая нагрузка, стрессы
Диета (потребление пищи)
Курение, алкоголь, наркотики
Лекарственные препараты
Слайд 6Влияние пола пациента Уровень некоторых аналитов у мужчин по отношению к
W. Guder
et al. (2008)
Слайд 7Содержание ферритина в сыворотке крови в норме (нг/мл, мкг/л )
Дети
1 месяц 200-600
6 мес.- 15 лет 30-140
Взрослые М 20-350
Ж 10-150
Беременность 1 триместр 60-90
2 триместр 25-70
3 триместр 10-15
Слайд 8
Концентрация ферритина в первый месяц после рождения повышена в связи с
У женщин репродуктивного возраста содержание ферритина в сыворотке крови меньше, чем у мужчин. Это связано с ежемесячными физиологическими кровопотерями, а также с деторождением.
Слайд 9
В третьем триместре беременности концентрация ферритина минимальна и граничит
Лактация также сопровождается повышенным расходом железа, т.к. молочная железа продуцирует белок с подобными трансферрину свойствами – лактоферрин.
В постменопаузальный период содержание железа и концентрация ферритина в организме женщин возрастают, приближаясь к показателям у мужчин.
Слайд 12Возрастание объема циркулирующей плазмы (при физиологической беременности средний объем плазмы возрастает
Разведение крови => СОЭ ↑ до 5 раз, изменения некоторых электролитов (↓Ca, Mg, Fe, ↑Cu)
Изменения синтеза половых гормонов
Увеличение синтеза белков в печени: ↑ транспортных белков (↑ оT4, кортизол, Cu), ↑ белков острой фазы (↑ фибриноген, С-РБ), ↑ липопротеинов (↑ холестерин, триглицериды), ↑ факторов свертывания (↑ D-димер, РФМК)
Увеличение интенсивности обмена веществ : ↑ активность ЩФ
У беременных:
Слайд 13Суточные ритмы
(гормоны, Fe, ферменты…)
Месячные ритмы
Ренин и альдостерон ↑ до 2
Холестерин ↓ при овуляции, фосфаты и сывор. Fe ↓ во время менструации
3. Сезонные ритмы
Т3 ↓ на 20% летом по сравн. с зимой
Уровень 25-ОН-ХКФ летом выше
Короткодействующие факторы : биологические ритмы
W. Guder et al. (2008)
Слайд 15Физическая нагрузка и стрессы
Потеря жидкости с потом => возможно ↑ осмолярности
Изменение концентрации гормонов (↑ адреналин, АКТГ, кортизол, СТГ, глюкагон, ↓ инсулин) => ↑ глюкоза.
Лейкоцитоз (до 25·109/л), м.б. временная лейкоцитурия и эритроцитурия.
Психический стресс
Изменение концентрации гормонов (↑ альдостерон, адреналин, кортизол, пролактин, ренин, м.б. инсулин).
↑ Глюкоза, фибриноген.
↑ Агрегация тромбоцитов.
Преходящий лейкоцитоз
Снижение концентрации железа
Сильное беспокойство, сопровождаемое гипервентиляцией
вызывает дисбаланс КОС с увеличением концентрации
лактата и жирных кислот в крови
Слайд 16Пищевой фактор
триглицериды
АСТ
билирубин
глюкоза
фосфаты
АЛТ
калий
мочевая кислота
общий белок
альбумин
кальций
натрий
ЩФ
холестерин
мочевина
ЛДГ
Относительная концентрация после еды /
1,78
1,25
1,16
1,15
1,15
1,055
1,052
1,027
1,018
1,018
1,016
1,004
1,004
1,000
1,000
1,000
1,0
1,5
1,25
2,0
1,75
+ пищевой лейкоцитоз !
Голодание – ↑ распад белков
и липидов, ↑ ЖК, кетоацидоз, лактатацидоз
Нельзя принимать пищу в течение 12 час перед взятием крови,
особенно для исследования :
ЛИПЕМИЯ
Слайд 17
При диете, богатой белками и нуклеотидами, наблюдается повышение уровней аммиака, мочевины
Изменения, наблюдающиеся после приема стандартного количества углеводов, используются в диагностике при определении толерантности к глюкозе.
Ранними индикаторами бедной белками диеты являются снижение концентрации преальбумина и ретинол- связывающего белка.
Слайд 18
При количественном измерении уровней мочевой экскреции предпочтительно выполнять определение показателей
Слайд 19Курение, прием кофе
острые эффекты – даже после одной сигареты, в
хронические эффекты – ↑ CO-Hb, умеренные сдвиги параметров:
КОФЕ – ↑↑ уровня кортизола до 40% после 2 чашек (200 мг кофеина)
W. Guder et al. (2008)
Перед взятием крови нельзя курить минимум 30 мин – 1 час
КУРЕНИЕ
Слайд 20
Снижение активности ангиотензин-превращающего фермента у курильщиков признается результатом деструкции клеток легочного
Степень изменений зависит от количества,вида и техники курения, связаны с возрастом и полом.
Слайд 21
Кофеин содержится во многих компонентах повседневной пищи.
Кофеин ингибирует фосфодиэстеразу и, следовательно,расщепление
Циклический АМФ усиливает гликогенолиз, тем самым увеличивая концентрацию глюкозы в крови. Кроме того, концентрация глюкозы возрастает из-за стимуляции глюконеогенеза под влиянием адреналина.
Активация триглицеридлипазы ведет к троекратному повышению этерифицированных жирных кислот
Слайд 22
Через 3 часа после приема 250 мг кофеина повышается активность ренина
Слайд 23Употребление алкоголя
холестерин ЛПНП
ванилилминд. к-та
MCV
холестерин
триглицериды
кортизол
АЛТ
эстрадиол
адреналин
норадреналин
АСТ
ГГТ
% сдвигов
«хронические» эффекты
W. Guder et al. (2008)
Слайд 24
Остро возникающие изменения ( в течение 2-4 часов) при употреблении этилового
Этанол превращается в ацетальдегид и затем в ацетат. Это повышает образование в печени мочевой кислоты. Вместе с лактатом ацетат снижает содержание бикарбоната в сыворотке, вызывая метаболический ацидоз.
Повышенный уровень лактата снижает экскрецию с мочой мочевой кислоты.
Как следствие, после острого употребления алкоголя концентрация мочевой кислоты в сыворотке возрастает.
Слайд 25
При хронических изменениях отмечаются изменения активности печеночных ферментов.
Повышение активности гамма-глютамилтрансферазы вызывается
Активность глютаматдегидрогеназы, как и аминотрансфераз, повышается вследствие прямого токсического влияния на печень.
При хроническом алкоголизме содержание сывороточных триглицеридов возрастает вследствие снижения расщепления ТГ в плазме.
Повышение MCV м.б. связано с прямым токсическим влиянием на кроветворные клетки или в связи с дефицитом фолиевой кислоты.
Слайд 26
Усиление диуреза является результатом сниженного высвобождения вазопрессина вследствие повышения секреции ренина
Слайд 27Влияние лекарственных средств
на результаты анализов
Биологическое влияние – лечебное или побочное
Цитотоксичность: бигуаниды и циклоспорин => повреждение гепатоцитов (↑ АЛТ, ↑ ЛДГ, ↑ЩФ); цисплатин и гентамицин => нефротоксический эффект (↑креатинина, ↓Na)
Индукция синтеза ферментов: противосудорожные средства (фенобарбитал и др.) => ↑ ГГТ
Конкуренция за глюкуронизацию: сульфаниламиды, некото-рые антибиотики, Rö-контрастные средства => ↑ непрямого билирубина
Блокирование функции тиреотрофов гипофиза: йодиды в больших дозах, Rö-контрастные средства => ↓ ТТГ, ↓ Т4
Слайд 29Влияние лекарственных средств
на результаты анализов
Аналитическое влияние – «вмешательство» лекарства в
Креатинин в моче: ложное повышение при лечении цефа-лоспоринами и занижение от аскорбиновой кислоты (хим.)
Глюкоза в моче: ложноположительный результат при лечении цефалоспоринами и аскорбиновой кислотой (хим.)
Кетоновые тела в моче: ложноположительный результат при лечении фталазолом (хим./биол.?)
Биологическое (in vivo)
Аналитическое (in vitro)
Слайд 31Терапевтический лекарственный мониторинг
При подозрении на передозировку или интоксикацию
время взятия крови –
Слайд 32Диагностические и лечебные процедуры, влияющие на результаты анализов
Оперативные вмешательства, эндоскопия,
Функциональные пробы ( зондирование и др.), введение контрастных веществ
Гемодиализ, гемосорбция, плазмаферез и др.
Функциональные тесты( ГТТ)
Хирургические вмешательства (послеоперационный период):
↑ Белки острой фазы: ↑ фибриноген, С-РБ; ↓ альбумин, трансферрин…
↑ Распад белка => ↑ мочевина (до 10-12 ммоль/л, особенно при кровотечениях в ЖКТ) на фоне нормального креатинина
Стресс (процедурный, предоперационный)
Выброс гормонов (адреналин, кортизол, ренин, ангиотензин, альдостерон и др.) => сдвиги углеводного, белкового, липидного и водно-минерального обмена (↑ глюкоза, лактат, фибриноген), активация тромбоцитов и т.д.
Слайд 33
Загрязнение лабораторных проб инфузионными растворами является самой обычной и часто встречаемой
Пробу крови никогда не следует брать из сосуда, расположенного проксимально месту инфузии.
Слайд 34
Пробы следует брать из другой руки. Перед тем, как производить взятие
Эмульсия жира 8 часов
Богатый углеводами р-р 1 час
Аминокислоты и гидролизаты
белков 1 час
Электролиты 1 час
Слайд 35
Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено
Слайд 36Положение тела пациента
Стоя / сидя – вода частично переходит в межклеточное
Лежа – обратные явления (↑ ОЦП на 10-15%)
Наложение жгута на руку – частич-ный переход жидкости в межклеточное пространство. Если < 1 мин – то N.
W. Guder et al. (2008)
Слайд 37Сжатие кулака при наложенном жгуте
(калий в плазме)
Калий в плазме, ммоль/л
Жгут
Кулак
Минуты
Если жгут
> 1 мин - ↑ общ. белок, альбумин
> 3 мин - ↑ АСТ (+9.5%), брб (+8.4%)
Слайд 38
Лучшее место забора крови на анализы –локтевая вена. Венозная кровь –
клеток,определение гемоглобина, гематокрита) в венозной крови.
Слайд 39
При заборе крови из пальца возможен ряд методических особенностей, которые трудно
Слайд 40 Кровь – вначале капиллярную (КОС / Ca++, гематология, TDM), потом
по возможности - между 07.00 и 09.00, если требуется – после специ- альной подготовки пациента,
не ранее чем через 12 часов после приема пищи, при воздержании от алкоголя и курения,
если анализы срочные - с отметкой о времени взятия (журнал, бланк направления),
избегать интенсивной физической нагрузки в течение 24 час; избегать физических и эмоциональных стрессов, перед взятием материала - покой 20-30 мин;
положение пациента - лежа или сидя (результаты могут различаться);
до выполнения диагностических / терапевтических процедур и введения лекарств !!!!!
Анализ пробы, взятой не вовремя, может быть
хуже, чем отсутствие анализа вообще.
Правила взятия биоматериала
Слайд 41Спросить (!) полное имя пациента и дату рождения,
сверить регистрационные номера на
сверить номер амбулаторной карты / штрих-код и имя пациента.
Идентификация пациента,
выбор типа пробирки (добавки)
Для некоторых исследований дополнительно указываются:
время взятия материала (суточные профили, функциональные тесты)
принимаемые лекарственные препараты,
витамины, гормоны,
пол, рост и вес пациента.
Нужно знать тип и объем пробы;
соответственно выбирается пробирка
(по цвету пробки и надписи на этикетке).
Слайд 42Взятие крови
Для исследования аналитов в цельной крови, сыворотке или плазме кровь
(стандартизация пробы, меньшая вероятность появления микросгустков).
Капиллярную кровь берут:
при обширных ожогах, затрагивающих
область пункции,
при флебитах и склонности к венозному
тромбозу;
у пациентов с труднодоступными венами
(при выраженном ожирении);
у новорожденных и маленьких детей,
для мониторинга уровня глюкозы, МНО и
холестерина (в т.ч. в домашних условиях).
Слайд 43
Взятие крови из вены
После инфузии / трансфузии выждать минимум 1 час.
При взятии крови из в/в катетера – промыть его физраство-ром, отбросить первые 3-5 мл крови. Не для исследования гемостаза!
В лаборатории должны знать, когда и что в/в вливалось пациенту и когда была взята кровь.
Взятую кровь сохранять в закрытой пробирке, как можно быстрее (< 45 мин) доставить в лабораторию.
Слайд 44
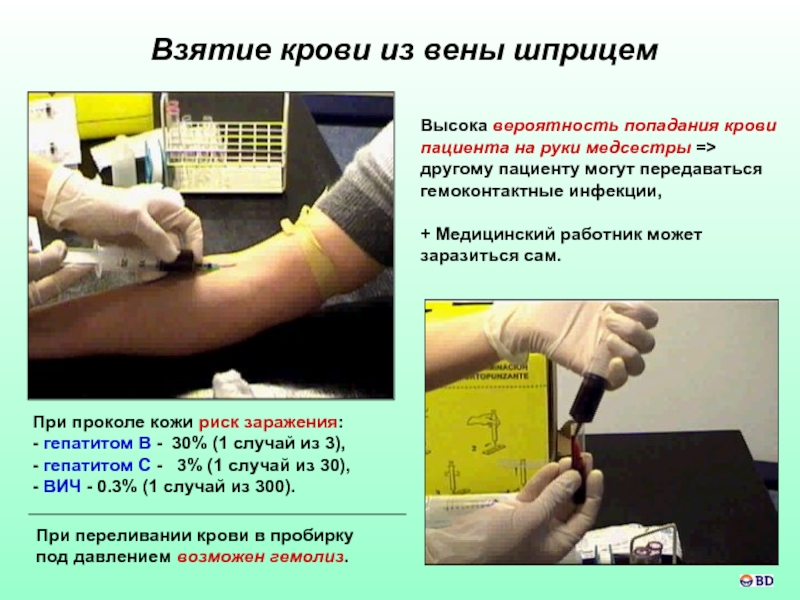
Взятие крови из вены шприцем
Высока вероятность попадания крови пациента на руки
+ Медицинский работник может заразиться сам.
При переливании крови в пробирку
под давлением возможен гемолиз.
При проколе кожи риск заражения:
- гепатитом B - 30% (1 случай из 3),
- гепатитом C - 3% (1 случай из 30),
- ВИЧ - 0.3% (1 случай из 300).
Слайд 45
Вакуумные пробирки
Предложены в 1937 г. Дж. Клейнером,
в 1949 г. – торговая марка «BD».
Вакутейнеры, вакуэтты, моноветты и др.
(для всех исследований, кроме газов крови)
ISO 6710 – международный стандарт «Вакуумные пробирки для взятия крови».
Слайд 46Иглы и держатели
61 % повреждений кожи у персонала возникают в первые
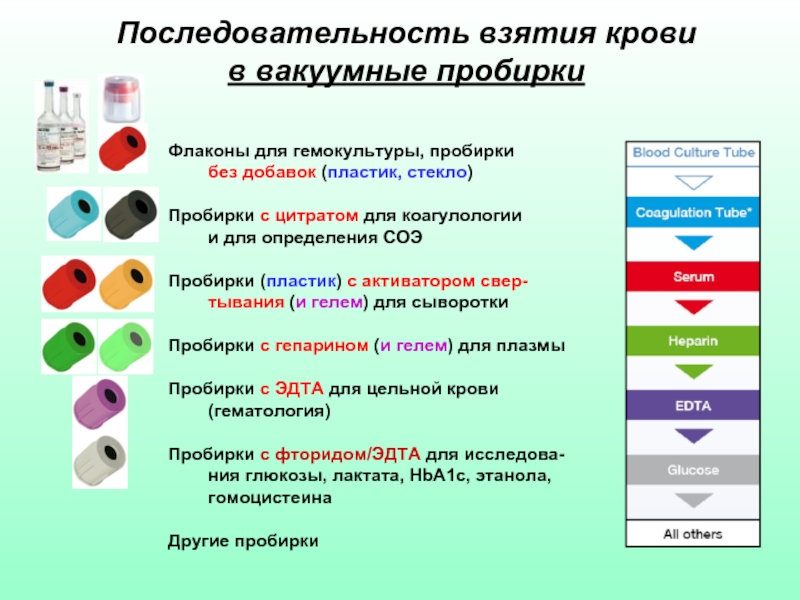
Слайд 47Последовательность взятия крови
в вакуумные пробирки
Флаконы для гемокультуры, пробирки
без добавок (пластик,
Пробирки с цитратом для коагулологии и для определения СОЭ
Пробирки (пластик) с активатором свер-тывания (и гелем) для сыворотки
Пробирки с гепарином (и гелем) для плазмы
Пробирки с ЭДТА для цельной крови (гематология)
Пробирки с фторидом/ЭДТА для исследова-ния глюкозы, лактата, HbA1c, этанола, гомоцистеина
Другие пробирки
Слайд 48Каковы преимущества плазмы перед сывороткой?
1. Экономия времени. Исключается время ожидания свертывания
2.Больший выход материала для исследования. Из цельной крови м.б. получено плазмы на 15-20% больше, чем сыворотки.
3.Практически отсутствует интерференция, связанная с последующим свертыванием. В сыворотке может произойти свертывание после центрифугирования, а в плазме нет.
4. Результаты исследования более точно отражают состояние in vivo, чем анализ сыворотки
5. Меньший риск гемолиза и тромбоцитолиза. Свободного гемоглобина в 10 раз меньше в плазме. В плазме тромбоциты остаются интактными in vitro, и , следовательно, отсутствует ложная гиперкалиемия, как в сыворотке.
Слайд 49Каковы недостатки плазмы по отношению к сыворотке?
1.Картина разделения белков при электрофорезе
2. Метод-зависимая интерференция. Поэтому каждая новая методика должна быть изучена на предмет возможности интерференции антикоагулянта.
3. Интерференция катионов.
При использовании солей гепарина может возникать интерференция лития и аммиака с методами их определения.
Слайд 50
При использовании пробирок с разделительным гелем для сыворотки или плазмы необходимо
Слайд 52 Не требуются вторичные пробирки, снижается опас- ность перепутать пробы
Повышается качество и стабильность образца при хранении и транспортировке. Выпускаются гелевые «транспортные» пробирки – со слоем геля двойной толщины.
Возможно (хотя и не рекомендуется) замораживание гелевых пробирок с сывороткой / плазмой.
Пробирки для сыворотки / плазмы с разделительным гелем
Сыво-ротка
Плазма
центрифу-гирование
Слайд 53
3 - 4 раза
8 раз (!)
5 раз
При слишком энергичном перемешивании возможны
Перемешивание пробирок
- сразу после заполнения кровью и извлечения из держателя
необязат.
Слайд 54Капиллярная кровь
При прохождении крови через поврежденную ткань активируется свертывание,
поэтому длительность
Не допускается растекание крови по коже пальца, по стенке пробирки и любой другой поверхности, так как идет контактная активация свертывания.
Выдавливание крови из пальца ведет к агрегации тромбоцитов и попаданию в пробу большого количества тканевой жидкости (тканевого фактора).
Слайд 55При транспортировке в лабораторию образцы крови надо предохранять от тряски во избежание
Температура ниже 4 0С и выше 30 0С может изменить содержание многих аналитов.
Сыворотка и бестромбоцитная плазма (в пластик. пробирках) могут быть заморожены. Оттаивание – в теплой воде, после него – тщательное перемешивание!
Стабильность аналитов
Электролиты, субстраты, большинство ферментов в сыво- ротке крови - до 4 дней при +4 0С.
Гемоглобин, эритроциты - в течение одного дня (в закрытой
пробирке); изготовление мазка крови - в течение 2 час.
Плазма крови для исследования гемостаза – до 4 час при
комнатной температуре.
Газы крови даже в закрытых пробирках нестабильны
(< 15-30 мин); в ледяной воде сохраняются до 2 час.
Слайд 56Хранение и транспортировка крови
Исследование крови на геманализаторах - либо сразу
Капиллярную кровь с ЭДТА исследуют в теч. 4 час. Изготовление мазков крови - не позднее 1-2 час после взятия.
При отсрочке анализа пробы крови хранят при 4–8о С до одних суток. Цельную кровь не замораживают!
При транспортировке пробирки должны быть в вертикальном
положении.
Перед анализом кровь нужно согреть до комнатной температуры
и тщательно перемешать!
Слайд 57Контроль образцов в лаборатории
Наиболее частые причины повторного взятия крови
ГЕМОЛИЗ (до 5
Недостаточное заполнение пробирок
Некорректная маркировка пробирок
Сгустки в образце крови
Пустая пробирка
Пробирка не обозначена
Пробирка не на льду…
Bonini PA et al. (2007)
Слайд 58Гемолиз
6
564
0,06%
5,64%
0
100
200
300
400
500
600
Случаи гемолиза
Вакуумные пробирки
Шприц
+ игла
Мультицентровое исследование (Мумбаи, Индия, 2008 г.)
Ind J
На 10000 исслед-й
Причины гемолиза in vitro
(до 3,3% всех образцов!)
ВЗЯТИЕ КРОВИ
слишком тугой турникет
место пункции не просушено
слишком тонкая игла
неаккуратная пункция (гематома, попадание тканевой жидкости)
взятие и перенос крови шприцем
энергичное встряхивание вместо аккуратного перемешивания
ТРАНСПОРТ ОБРАЗЦОВ
Слишком высокая или слишком низкая температура, случайное замораживание образца
Тряска / вибрация при перевозке
ОБРАБОТКА КРОВИ
слишком большая длительность / скорость центрифугирования
задержка отделения плазмы / сыворотки от осадка более чем на 2-3 часа
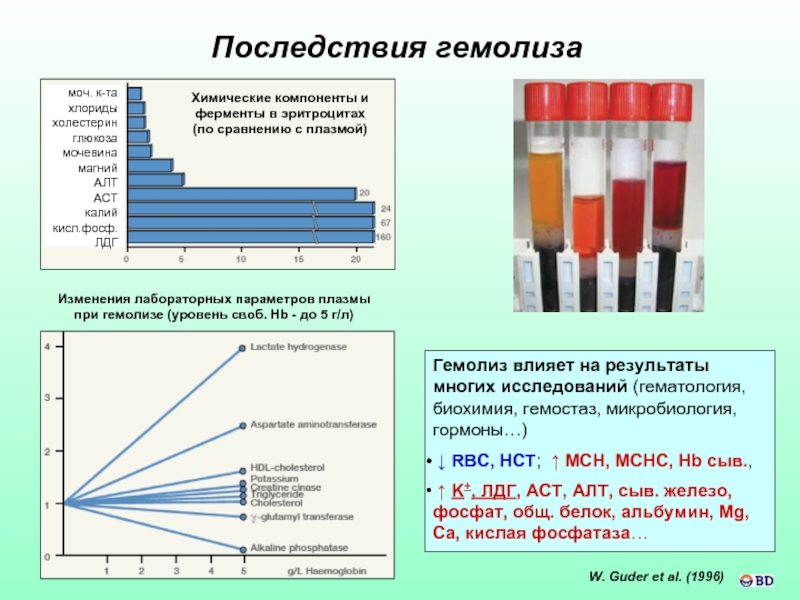
Слайд 59Последствия гемолиза
Изменения лабораторных параметров плазмы
при гемолизе (уровень своб. Hb - до
Химические компоненты и ферменты в эритроцитах
(по сравнению с плазмой)
W. Guder et al. (1996)
Гемолиз влияет на результаты многих исследований (гематология, биохимия, гемостаз, микробиология, гормоны…)
↓ RBC, HCT; ↑ MCH, MCHC, Hb сыв.,
↑ K+, ЛДГ, АСТ, АЛТ, сыв. железо, фосфат, общ. белок, альбумин, Mg, Ca, кислая фосфатаза…
моч. к-та
хлориды
холестерин
глюкоза
мочевина
магний
АЛТ
АСТ
калий
кисл.фосф.
ЛДГ
Слайд 61Плохое перемешивание образца
Неполное свертывание
– фибрин над гелем
Микросгустки –
последствия
свертывания
Сыворотка
Кровь + ЭДТА
Слайд 62Плохая маркировка пробирок
Этикетка должна быть наклеена аккуратно и в нужном месте.
При
Слайд 63Центрифугирование пробирок с кровью
При комнатной температуре ! (особенно для пробирок с
ЦФ сывороточных пробирок – после образования сгустка !!! (не менее 30 мин – 1 ч после взятия пробы).
ЗАПРЕЩЕНО повторное центрифугирование проб (особенно с гелем).
Осадок/сгусток отделять сразу после центрифугирования !
N (об/мин) = √ (100000*RCF(g) / 1,12*R(см)
Слайд 64Возможные ошибки центрифугирования
Сывороточная проба:
ЦФ сразу после взятия
(не дожидаясь
Горизонтальное поло-жение пробирки до ЦФ
(сгусток по оси пробирки)
Вертик. положение пробирки до ЦФ
(правильное)
Заниженная скорость ЦФ
(справа - норма)
Заниженное время ЦФ
(справа - норма)
ЦФ в горизонтальном
и угловом роторе
www.gbo.com
/preanalytics
Горизонтальное положение пробирки при транспорти-ровании + угловой ротор
Слайд 65Обеспечение качества преаналитического этапа
В соответствии с разделом ISO
формы заявок
руководство по взятию и сбору проб
систему идентификации - описание прослеживаемости первичных и вторичных проб к определенному пациенту
систему слежения за транспортировкой образцов
записи о получении образцов
описание процесса приема срочных анализов
принципы выбраковки непригодных для анализа образцов
в целом, клиническая лаборатория должна гарантировать выполнение «правильно и своевременно назначенного теста для нуждающегося в нем пациента»
Слайд 66Отсутствие этикетки на пробирке / шприце;
Расхождение между данными заявки и этикетки
Невозможность прочесть на заявке и/или этикетке данные пациента;
Отсутствие названия отделения, номера истории болезни, ФИО врача, подписи процедурной сестры, перечня исследований;
Гемолиз (кроме исследований, на которые он не влияет);
Взятый материал - в несоответствующей емкости (другой антикоагулянт, добавка, консервант и др.);
Сгустки в пробах с антикоагулянтом;
Недостаточное количество биоматериала для анализа;
Истекло время стабильности аналита в образце;
Материал взят в вакуумные емкости с истекшим сроком годности.
Критерии для отказа в принятии лабораторией биоматериала на исследование (пример)