- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Организация контроля качества лекарственных средств презентация
Содержание
- 1. Организация контроля качества лекарственных средств
- 2. Теоретические вопросы: Обеспечение качества ЛС как международная
- 3. Литература : Організація фармацевтичного забезпечення населення: навч.
- 4. Обеспечение качества ЛС как международная проблема
- 5. ОБРАЗОВАНИЕ ГОС. РЕГУЛИРОВАНИЕ ВРАЧИ ПРОВИЗОРЫ
- 6. Качество – это совокупность свойств, которые предоставляют
- 7. Основные понятия и термины Некачественные (субстандартные)
- 8. Масштабы проблемы
- 9. Фальсифицированные (контрафактные) ЛС І тип –
- 10. необходимость усиления работы регуляторных органов по
- 11. Факторы, способствующие фальсификации ЛС
- 12. Программа помощи национальным системам здравоохранения в борьбе
- 13. Международная целевая группа противодействия фальсификации медицинской продукции
- 14. Система сотрудничества по фармацевтическим инспекциям PIC/S Украина
- 15. PIC/S является соглашением не на уровне правительств,
- 16. МЕЖДУНАРОДНАЯ СИСТЕМА СОТРУДНИЧЕСТВА ФАРМАЦЕВТИЧЕСКИХ ИНСПЕКЦИЙ PІС/S СТРАНЫ
- 17. В США за подделку лекарств сажают в
- 18. Современная концепция обеспечения качества ЛС
- 19. Обеспечение качества – это концепция, которая охватывает
- 20. Обеспечение качества ЛС
- 21. Надлежащая лабораторная практика (GLP) – совокупность правил
- 22. Международная стандартизация проводится на международном уровне,
- 23. ISО 9000 - Управление качеством ИСО 9001:2008
- 24. Фармаконадзор – pharmacovigilance - наука и
- 25. Международная программа по мониторингу ЛС (WHO Programme
- 26. Система обеспечения качества ЛС в Украине
- 27. Модель системы обеспечения качества ЛС
- 28. ГП «Государственный экспертный центр» Ряд лабораторий, аккредитованных
- 29. Организационная структура системы контроля качества ЛС в Украине (продолжение)
- 30. Украина относится ВОЗ к странам с
- 31. Украина – 38-й член Европейской Фармакопеи 16
- 32. в 2011 г. Украина одной из
- 33. Лицензирование, регистрация и сертификация как инструменты обеспечения качества ЛС
- 34. Регистрация ЛС
- 35. Минздрав Украины может принять решение о полном или временном запрете применения ЛС в таких случаях:
- 36. В странах ЕС для размещения на рынке
- 37. Сертификация на соответствие GMP и GDP –
- 38. Резолюция по применению Системы сертификации ВОЗ
- 39. Порядок сертификации ЛС для международной торговли Предполагает получение:
- 40. Обеспечение качества ЛС во время оптовой и розничной торговли
- 41. Теоретические вопросы: Организация входного контроля ЛС. Обязанности
- 42. Литература : Організація фармацевтичного забезпечення населення: навч.
- 43. Во время оптовой и розничной реализации ЛС
- 44. Организация входного контроля ЛС. Обязанности уполномоченного лица
- 45. Уполномоченное лицо (Authorized Person) в аптеках и
- 46. Обязанности Уполномоченного лица проведение входного контроля
- 47. Входной контроль ЛС
- 48. Алгоритм проведения входного контроля
- 49. Запрет (временный
- 50. Государственный контроль качества ЛС К ПОТРЕБИТЕЛЮ
- 51. Классы несоответствий ЛС:
- 52. Действия Гослекслужбы при выявлении некачественных ЛС
- 53. Основания для временного запрета обращения ЛС:
- 54. Основания для установления запрета обращения ЛС:
- 55. Организация инспектирования аптечных учреждений
- 56. Проверки соблюдения лицензиатами Лицензионных условий Приказ
- 57. Объекты проверки учредительные документы; документы, подтверждающие
- 58. Современные технологии в обеспечении качества ЛС
- 59. Система отслеживания в обороте лекарственных средств Директива
- 60. Указанные изменения в законодательстве ЕС сделают
- 61. ЭТАПЫ ВНЕДРЕНИЯ СИСТЕМЫ автоматизированная система отслеживания
- 62. В 2013 г. в Украине стартовал
- 63. Внедрение инновационных технологий в практику аптек
- 64. ЛИЦЕНЗИРОВАНИЕ ИМПОРТА ЛС. ПОРЯДОК ВВОЗА ЛС В УКРАИНУ
- 65. Документы, которые предоставляются органу гос.контроля (Гослекслужбе) о
- 66. На время осуществления гос. контроля груз с
- 67. Межведомственная база данных "Лекарственные средства, зарегистрированные в
- 68. Проведение внутриаптечных видов контроля качества экстемпоральных ЛС (для самостоятельного изучения)
- 69. Совокупность правил по розничной торговле ЛС, их
- 70. ТЕСТ № 2 Кто отвечает за проведение
- 71. ТЕСТ № 3 Какой стаж трудовой деятельности
- 72. Дякую за увагу!
Слайд 1Национальный фармацевтический университет
Кафедра организации и экономики фармации
ОРГАНИЗАЦИЯ КОНТРОЛЯ КАЧЕСТВА
ЛЕКАРСТВЕННЫХ СРЕДСТВ
к.фарм.н. доц.
Тетерич
Владимировна
Слайд 2Теоретические вопросы:
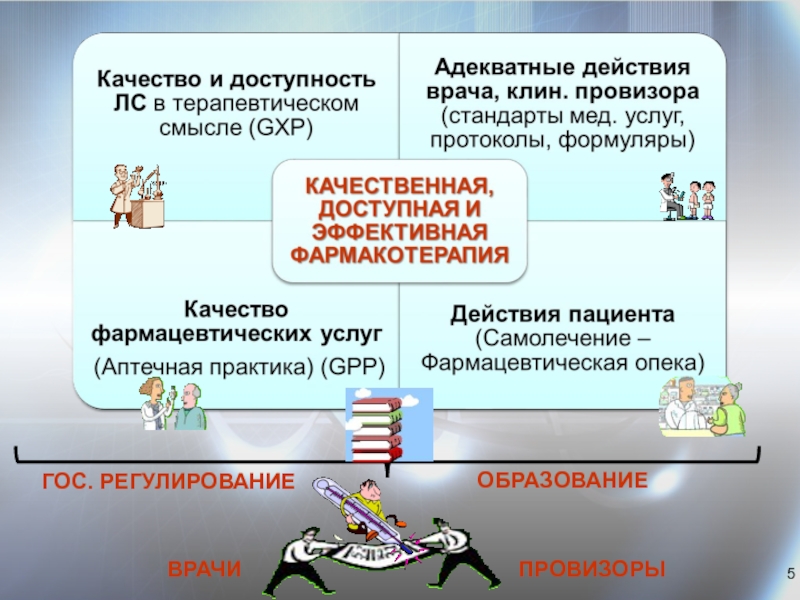
Обеспечение качества ЛС как международная проблема
Современная концепция обеспечения качества ЛС
Система
Лицензирование, регистрация и сертификация как инструменты обеспечения качества ЛС
Слайд 3Литература :
Організація фармацевтичного забезпечення населення: навч. посіб. для студ. вищ. навч.
Основы организации и экономики фармации в вопросах и ответах: Учеб.пособ. // Под ред. А.С. Немченко. – Харьков: НФаУ, 2013 – Ч.І.
Приказ МЗ Украины № 436 от 30.10.2001 г. "Об утверждении инструкции о порядке контроля качества ЛС во время оптовой и розничной торговли" http://zakon2.rada.gov.ua/laws/show/z0107-02
Приказ МЗ Украины № 809 от 22.11.2011 «Об утверждении Порядка установления запрета (временного запрета) и возобновления обращения лекарственных средств на территории Украины» http://zakon4.rada.gov.ua/laws/show/z0126-12
Приказ МЗ Украины № 812 от 7.10.2012 г. "Об утверждении Правил производства (изготовления) и контроля качества ЛС в аптеках" http://zakon2.rada.gov.ua/laws/show/z1846-12
Закон Украины от 8.09.2011 г. № 3718-VI «О внесении изменений в некоторые законодательные акты Украины относительно предупреждения фальсификации ЛС» http://zakon3.rada.gov.ua/laws/show/3718-17
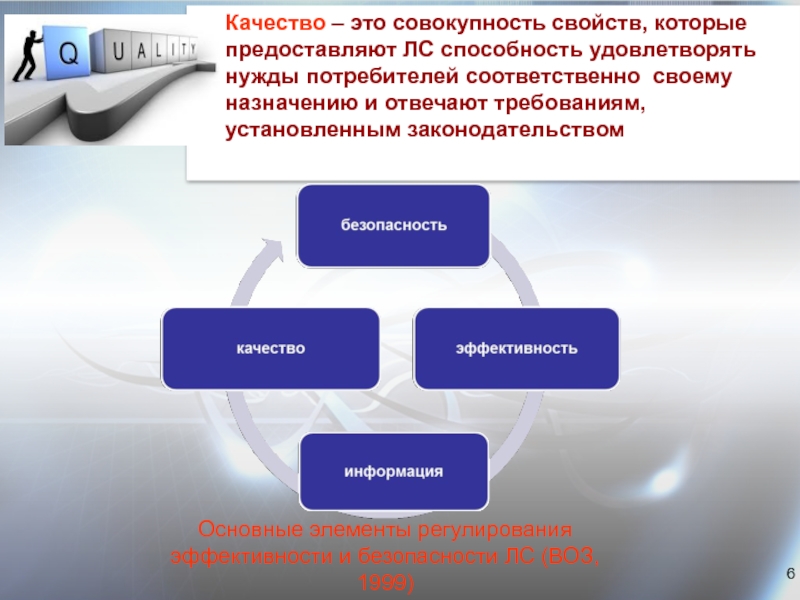
Слайд 6Качество – это совокупность свойств, которые предоставляют ЛС способность удовлетворять нужды
Основные элементы регулирования эффективности и безопасности ЛС (ВОЗ, 1999)
Слайд 7Основные понятия и термины
Некачественные (субстандартные) ЛС – ЛС, качество которых не
К некачественным также принадлежат ЛС с истекшим сроком годности, которые подверглись механическому, химическому, физическому, биологическому или др. воздействию, что делает невозможным их дальнейшее использование.
Фальсифицированные ЛС – поддельные/ложно маркированные/контрафактные – лекарственные средства с неправильной маркировкой в отношении их подлинности и/или изготовителя, нанесенной преднамеренно и в обманных целях
(ВОЗ, 2012)
Незарегистрированный препарат – препарат, который не прошел официальной процедуры государственной регистрации по занесению его в Государственный реестр ЛС
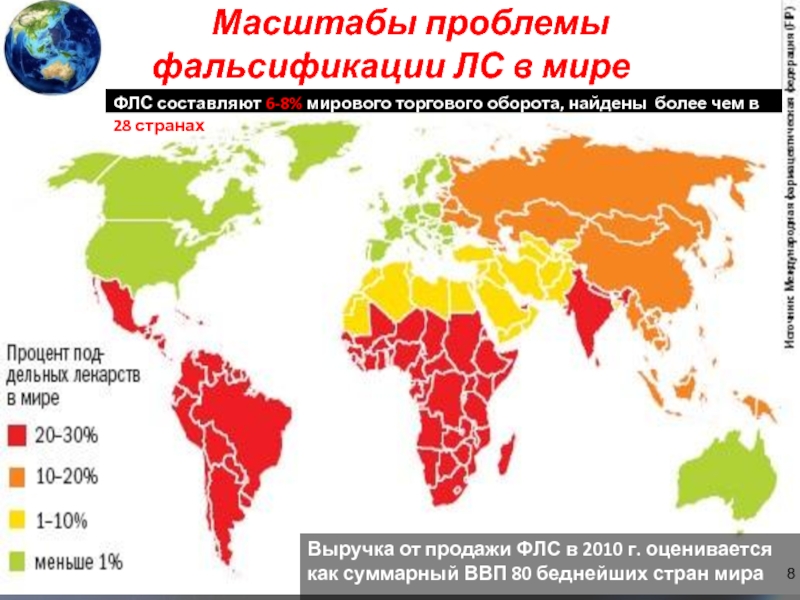
Слайд 8Масштабы проблемы
Выручка от продажи ФЛС в 2010 г. оценивается как суммарный ВВП 80 беднейших стран мира
ФЛС составляют 6-8% мирового торгового оборота, найдены более чем в 28 странах
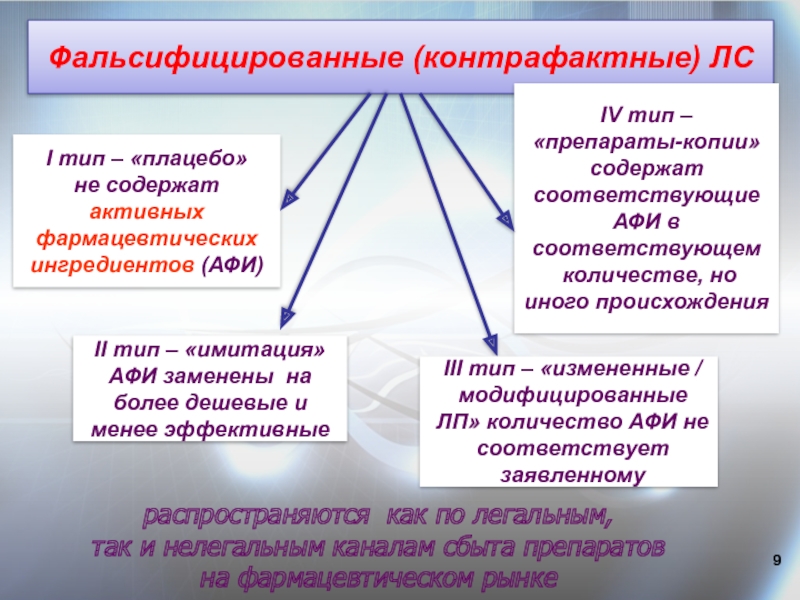
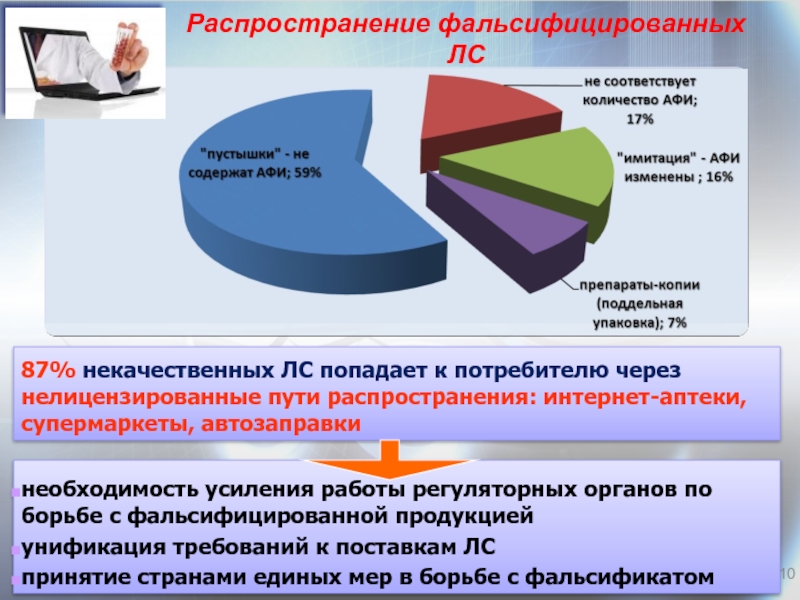
Слайд 9Фальсифицированные (контрафактные) ЛС
І тип – «плацебо»
не содержат активных
фармацевтических
ингредиентов
ІV тип –
«препараты-копии»
содержат соответствующие АФИ в соответствующем
количестве, но
иного происхождения
ІІІ тип – «измененные /
модифицированные ЛП» количество АФИ не соответствует заявленному
ІІ тип – «имитация»
АФИ заменены на более дешевые и менее эффективные
распространяются как по легальным,
так и нелегальным каналам сбыта препаратов
на фармацевтическом рынке
Слайд 10
необходимость усиления работы регуляторных органов по борьбе с фальсифицированной продукцией
унификация
принятие странами единых мер в борьбе с фальсификатом
Распространение фальсифицированных ЛС
на мировом фармрынке (данные ВОЗ)
87% некачественных ЛС попадает к потребителю через нелицензированные пути распространения: интернет-аптеки, супермаркеты, автозаправки
Слайд 12Программа помощи национальным системам здравоохранения в борьбе с некачественными и фальсифицированными
Слайд 13Международная целевая группа противодействия фальсификации медицинской продукции (IMPACT)
(создана в 2006 г.)
представители
руководящие сотрудники государственных регуляторных органов;
эксперты по мед. продукции;
представители международных и региональных организаций:
ВОЗ;
специализированных учреждений ООН;
Совета Европы;
Организации экономического сотрудничества и развития;
Европейской комиссии;
Всемирной таможенной организации;
Интерпола;
Международной фармацевтической федерации;
Международной федерации оптовых организаций в сфере фармацевтической продукции;
Международного союза организаций по защите прав пациентов
Слайд 14Система сотрудничества по фармацевтическим инспекциям PIC/S
Украина является участницей PIC/S с 2011
Конвенция о взаимном признании инспекций относительно производства ЛС (PIC) - 1970 г.
Система сотрудничества по фармацевтическим инспекциям (РIC/S)
Сегодня в PIC/S входят инспекции из 43 стран
Исполнительный комитет находится в Женеве (Швейцария)
Заседания проходят 2 раза в год
Слайд 15 PIC/S является соглашением не на уровне правительств, а на уровне регуляторных
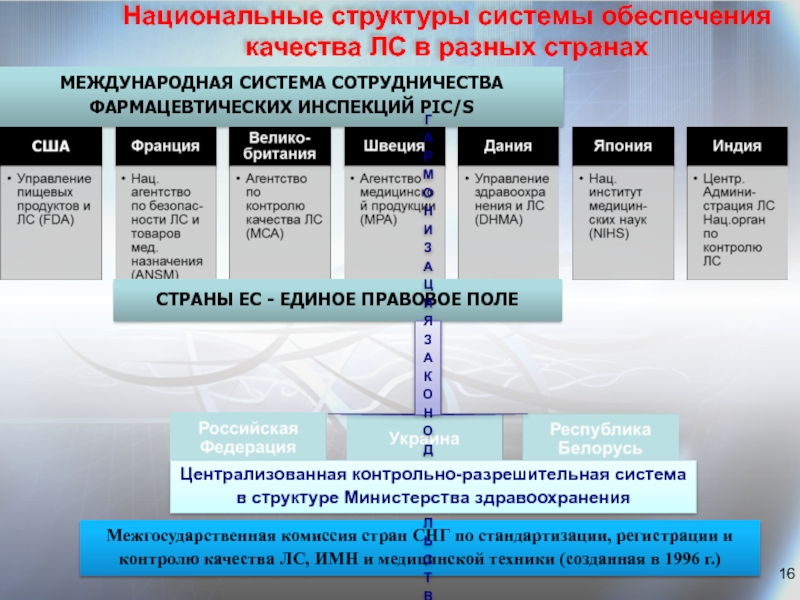
Слайд 16МЕЖДУНАРОДНАЯ СИСТЕМА СОТРУДНИЧЕСТВА ФАРМАЦЕВТИЧЕСКИХ ИНСПЕКЦИЙ PІС/S
СТРАНЫ ЕС - ЕДИНОЕ ПРАВОВОЕ ПОЛЕ
Межгосударственная
ГАРМОНИЗАЦИЯ ЗАКОНОДАТЕЛЬСТВА
Централизованная контрольно-разрешительная система в структуре Министерства здравоохранения
Национальные структуры системы обеспечения
качества ЛС в разных странах
Слайд 17В США за подделку лекарств сажают в тюрьму на 15 лет,
в Европе – в среднем на 13 лет,
в Китае - расстрел
Источник: Госинспекция по контролю качества ЛС, 2010
Ответственность за правонарушения (фальсификацию ЛС)
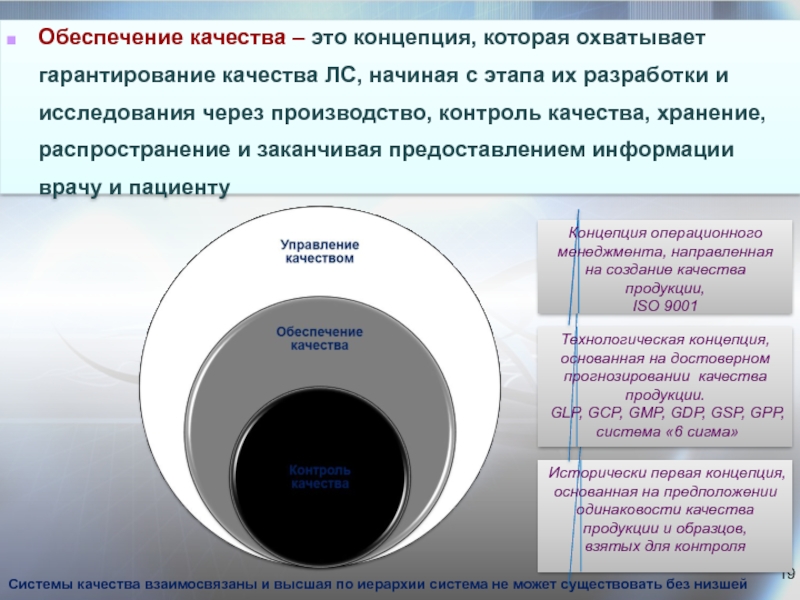
Слайд 19Обеспечение качества – это концепция, которая охватывает гарантирование качества ЛС, начиная
Исторически первая концепция,
основанная на предположении
одинаковости качества
продукции и образцов,
взятых для контроля
Технологическая концепция,
основанная на достоверном
прогнозировании качества
продукции.
GLP, GCP, GMP, GDP, GSP, GPP,
система «6 сигма»
Концепция операционного
менеджмента, направленная
на создание качества продукции,
ISO 9001
Системы качества взаимосвязаны и высшая по иерархии система не может существовать без низшей
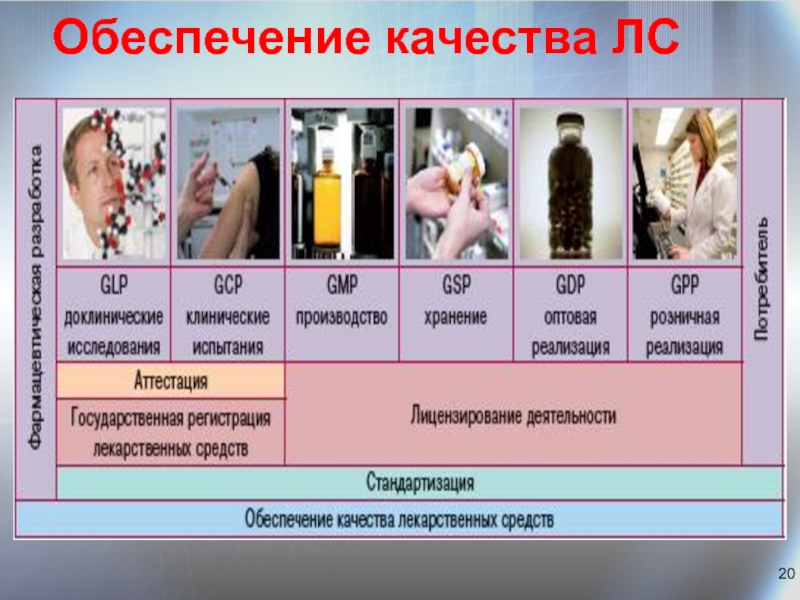
Слайд 21Надлежащая лабораторная практика (GLP) – совокупность правил и требований к организации
Надлежащая клиническая практика (GCP) – международный этический и научный стандарт качества планирования и проведения клинических испытаний ЛС для применения у человека, а также документального оформления их результатов.
Надлежащая производственная практика (GMР) – совокупность организационно-технических мероприятий, которые являются частью системы обеспечения качества и гарантирует, что продукция постоянно производится и контролируется по соответствующим ее назначению стандартами качества и в соответствии с требованиями регистрационного досье.
Надлежащая практика дистрибьюции (GDР) – совокупность правил и требований к дистрибьюции, соблюдение которых обеспечивает качество ЛС в процессе управления и организации оптовой торговли ими на всех ее этапах.
Надлежащая аптечная практика (GPP) – совокупность правил по розничной торговле ЛС, их хранению, контролю качества, изготовлению в условиях аптеки, отпуска, соблюдение которых обеспечит качество ЛС на этапах их закупки, изготовления, хранения и розничной торговли.
Слайд 22Международная стандартизация проводится на международном уровне, участие в ней открыто для
Национальная стандартизация проводится на уровне одной страны; национальные стандарты – это госстандарты , принятые центральным органом исполнительной власти по вопросам стандартизации (Госстандарт)
Стандартизация ЛС – деятельность по установлению правил, норм и характеристик для общего и многократного использования относительно реально существующих или потенциальных заданий с целью достижения оптимальной степени упорядоченности в сфере создания, производства, контроля качества, регистрации и реализации ЛС
Слайд 23ISО 9000 - Управление качеством
ИСО 9001:2008 -требования к системе менеджмента качества
ИСО
ИСО 9004 - как сделать систему управления качеством более эффективной и работоспособной.
ИСО 19011 - руководство по проведению внутреннего и внешнего аудитов систем менеджмента качества.
Серия стандартов ИСО 9000 затрагивает различные аспекты управления качеством
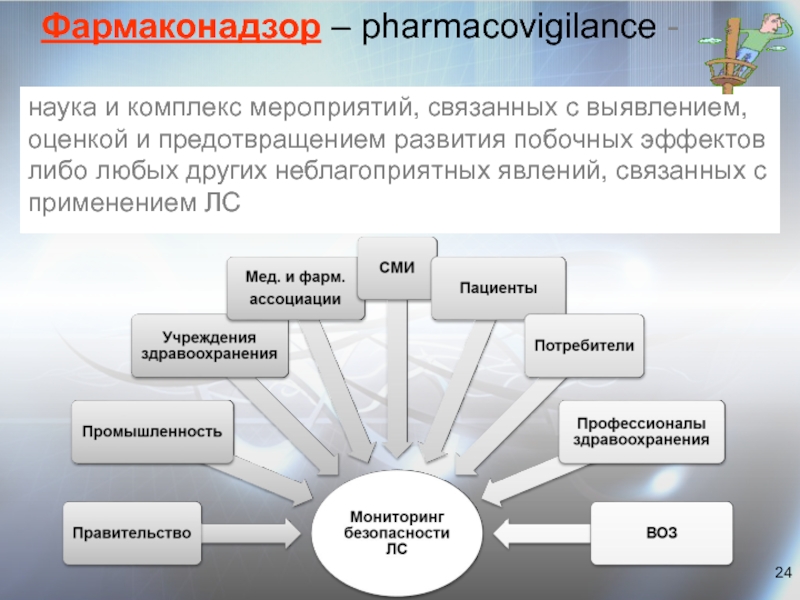
Слайд 24Фармаконадзор – pharmacovigilance -
наука и комплекс мероприятий, связанных с выявлением,
Слайд 25Международная программа по мониторингу ЛС
(WHO Programme on International Drug Monitoring)
действует
глобальная информационная сеть, состоящая из 104 национальных центров фармаконадзора, координируемых Мониторинговым центром ВОЗ
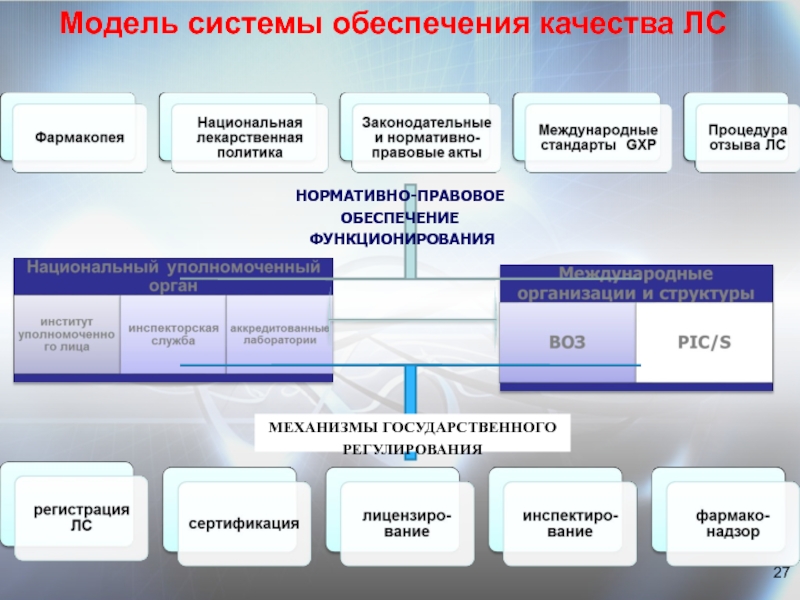
Слайд 27Модель системы обеспечения качества ЛС
НОРМАТИВНО-ПРАВОВОЕ ОБЕСПЕЧЕНИЕ
ФУНКЦИОНИРОВАНИЯ
МЕХАНИЗМЫ ГОСУДАРСТВЕННОГО РЕГУЛИРОВАНИЯ
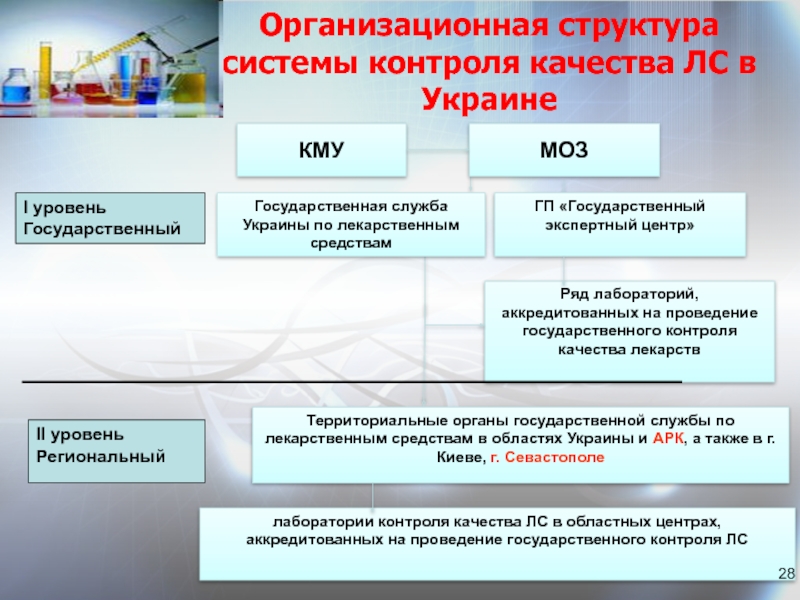
Слайд 28ГП «Государственный экспертный центр»
Ряд лабораторий, аккредитованных на проведение государственного контроля качества
Государственная служба Украины по лекарственным средствам
II уровень
Региональный
Территориальные органы государственной службы по лекарственным средствам в областях Украины и АРК, а также в г. Киеве, г. Севастополе
лаборатории контроля качества ЛС в областных центрах, аккредитованных на проведение государственного контроля ЛС
Организационная структура системы контроля качества ЛС в Украине
МОЗ
КМУ
I уровень
Государственный
Слайд 30
Украина относится ВОЗ к странам с жесткой регуляторной политикой в сфере
За 6 мес 2013 г. Гослекслужбой Украины выдано 34 распоряжения о полном запрете 47 серий 25 наименований фальсифицированных ЛС.
в 2012 г. – 67 распоряжений (67 серий 41 наименования ЛС)
проект изменений к Закону «Об основных принципах гос. надзора (контроля) в сфере хоз.деятельности» - исключение нормы о необходимости предупреждения субъекта хозяйствования о проведении проверки качества ЛС за 10 дней
чаще всего подделывают ЛС, которые активно рекламируются: препараты для лечения ЖКТ, обезболивающие ЛС
противовирусные
Слайд 31Украина – 38-й член Европейской Фармакопеи
16 октября 2012 г. принят ЗАКОН
Гослекслужба Украины, 2013 www.diklz.gov.ua
Слайд 32
в 2011 г. Украина одной из первых подписала Конвенцию Совета Европы
принят ряд законодательных актов, направленных на выполнение норм Конвенции MEDICRIME
введена уголовная ответственность за совершение преступлений, связанных с фальсификацией ЛС (лишение свободы на срок от 3 лет до пожизненного заключения)
Слайд 35Минздрав Украины может принять решение о полном или временном запрете применения
Слайд 36В странах ЕС для размещения на рынке ЛС необходимо получить торговую
Директива 2001/83/ЕС Европейского Парламента и Совета ЕС от 6.11.2001 г. "О кодексе Сообщества относительно медицинских препаратов для человека"
Слайд 37Сертификация на соответствие GMP и GDP – обязательное условие лицензирования производства
В основу сертификации качества ЛС положены принципы соответствия:
производства ЛС – нормам и требованиям GMP;
характеристик препарата – условиям его регистрации;
образцов серий ЛС – стандарту качества
Слайд 38Резолюция по применению Системы сертификации ВОЗ (Ассамблея ВОЗ, май 1992 г. WHA
Меры по сертификации:
лицензирование производителей, оптовых фирм-поставщиков в соответствии с требованиями и нормами GMP, GDP ;
регистрация ЛС (заявление о лицензионном статусе ЛС);
инспектирование производителей с целью оценки выполнения требований GMP, GDP ;
выдача сертификатов;
расследование рекламаций и сообщений соответствующих органов о дефектах качества ЛС и связанной с его использованием потенциальной угрозой
Слайд 41Теоретические вопросы:
Организация входного контроля ЛС. Обязанности Уполномоченного лица
Запрет (временный запрет) обращения
Организация инспектирования аптечных учреждений
Современные технологии в обеспечении качества ЛС
Лицензирование импорта ЛС. Порядок ввоза ЛС в Украину
Проведение внутриаптечных видов контроля качества экстемпоральных ЛС (самостоятельное изучение)
Слайд 42Литература :
Організація фармацевтичного забезпечення населення: навч. посіб. для студ. вищ. навч.
Основы организации и экономики фармации в вопросах и ответах: Учеб.пособ. // Под ред. А.С. Немченко. – Харьков: НФаУ, 2013 – Ч.І.
Приказ МЗ Украины № 436 от 30.10.2001 г. "Об утверждении инструкции о порядке контроля качества ЛС во время оптовой и розничной торговли" http://zakon2.rada.gov.ua/laws/show/z0107-02
Приказ МЗ Украины № 809 от 22.11.2011 «Об утверждении Порядка установления запрета (временного запрета) и возобновления обращения лекарственных средств на территории Украины» http://zakon4.rada.gov.ua/laws/show/z0126-12
Приказ МЗ Украины № 812 от 7.10.2012 г. "Об утверждении Правил производства (изготовления) и контроля качества ЛС в аптеках" http://zakon2.rada.gov.ua/laws/show/z1846-12
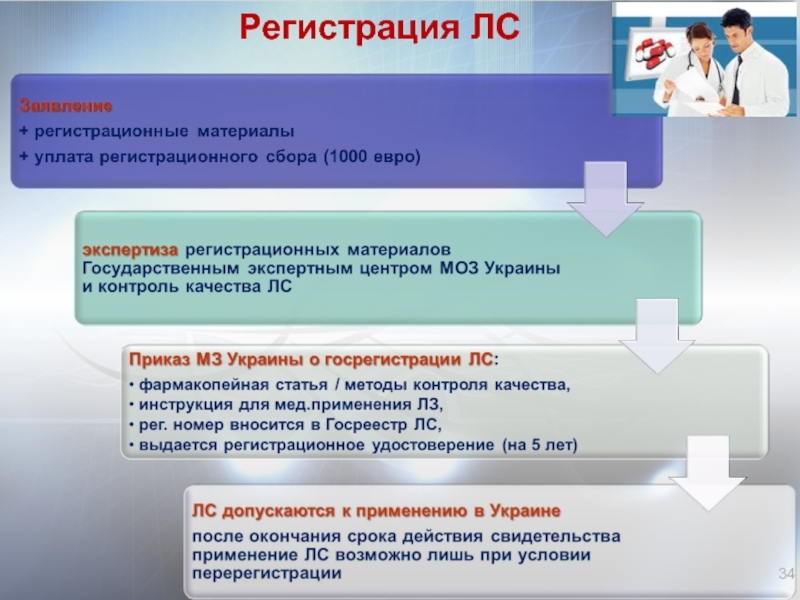
Слайд 43Во время оптовой и розничной реализации ЛС и ИМН осуществляется:
входной контроль
выборочный государственный контроль качества ЛС (при инспектировании субъектов хозяйствования органами Гослекслужбы)
Приказ МОЗ Украины № 436 от 30.10.2001 г.
"Об утверждении инструкции о порядке контроля качества ЛС во время оптовой и розничной торговли"
Слайд 45Уполномоченное лицо
(Authorized Person)
в аптеках и оптовых фирмах – специалист с высшим
на заводах, фабриках – специалист с высшим фармацевтическим, химическим, биологическим или биотехнологическим образованием и стажем работы не менее 2 лет, на которого возложены обязанности по функционированию системы обеспечения качества ЛС при их производстве и выдача разрешения на выпуск (реализацию) ЛС
Слайд 46Обязанности Уполномоченного лица
проведение входного контроля качества ЛС и оформление вывода
ведение реестра ЛС, которые поступили к субъекту хоз. деятельности (позволяет отследить источник получения каждой партии ЛС);
проверка наличия некачественных и фальсифицированных серий ЛС согласно информации Гослекслужбы;
предоставление территориальному органу Гослекужбы сведений о выявленных ЛС сомнительного качества;
изъятие из оборота и размещение в карантинной зоне ЛС;
согласование внутреннего порядка обращения ЛС.
Слайд 47 Входной контроль ЛС
с помощью визуальных методов
сопроводительные документы,
сертификаты качества и анализа,
№ серии,
регистрацию,
состояние упаковки,
маркировку,
внешний вид ЛС
По результатам контроля заполняется
«Реестр лекарственных средств, которые поступили к субъекту хозяйственной деятельности»
Слайд 49
Запрет (временный запрет) обращения ЛС
Приказ МЗ Украины № 809 от
Слайд 50Государственный контроль качества ЛС
К ПОТРЕБИТЕЛЮ НЕ ДОПУЩЕНО
2009 – 230 тыс.
2010 – 2,6 млн. упаковок на сумму 2,5 млн. $
2011 – 3,5 млн. упаковок на суму 4,4 млн. $
2012 – 1,5 млн. упаковок на суму 6,9 млн. $
Гослекслужба Украины, 2013 www.diklz.gov.ua
За период с 2010 по 2013 гг. к потребителю не допущено более 7,6 млн. упаковок некачественных и фальсифицированных ЛС на сумму более 13,8 млн. долл. США
Слайд 52Действия Гослекслужбы при выявлении некачественных ЛС
распоряжение об установлении запрета обращения ЛС
информирует
При выявлении несоответствий 2 класса –
распоряжение дается в течение 1-2 суток
срочное сообщение о дефекте качества (отзыв ЛС) уполномоченным органам государств - импортеров данной серии ЛС
При выявлении несоответствий 1 класса –
распоряжение дается в течение суток –
срочное сообщение о дефекте качества (отзыв ЛС) уполномоченным органам ЕС, государств, которые входят в PIC/S, и др. государств;
Слайд 56Проверки соблюдения лицензиатами Лицензионных условий
Приказ МЗУ от 31.10.2011 N 724 «Об
Слайд 57Объекты проверки
учредительные документы;
документы, подтверждающие право собственности или пользования помещением;
соответствие материально-технической
оригинал и копии лицензии;
положение об аптечном учреждении, должностные инструкции;
штатное расписание, трудовые книжки и др. кадровая документация;
соответствие персонала единым квалиф. требованиям (образование, повышение квалификации, личные мед. книжки;)
наличие копий (бумажных или на эл. носителях) НПА; регулирующих перечней ЛС;
наличие сертификатов качества и сертификатов анализа;
наличие тех. паспортов приборов, график поверки средств измерения;
журналы регистрации температуры и относ. влажности в помещении;
наличие журналов проведения входного контроля качества ЛС;
оформление журнала (книги) учета ЛС, подлежащих ПКУ;
акты проверок
Слайд 59Система отслеживания в обороте лекарственных средств
Директива № 2011/62/EU - направлена на
Директива № 2011/62/EU предусматривает, что производитель должен промаркировать уникальным идентификатором все рецептурные препараты, зарегистрированные в стране
Слайд 60Указанные изменения в законодательстве ЕС сделают
невозможным обращение фальсифицированных ЛС и
потенциально приведут к выталкиванию таких ЛС на
менее контролируемые рынки. Наиболее привлекательными
для перебрасывания фальсифицированных лекарств по
ряду признаков (географическое положение, объем рынка
страны) является украинский рынок.
С целью внедрения в Украине соответствующей
Системы специалистами Гослекслужбы Украины
была осуществлена масштабная подготовительная
работа.
Разработка и внедрение Системы на территории Украины осуществляется Гослекслужбой Украины в тесном сотрудничестве с Европейским директоратом по качеству лекарственных средств и здравоохранения Совета Европы (EDQM). EDQM отвечает за реализацию аналогичного проекта в Европе. Гослекслужба Украины и EDQM подписали соответствующий Меморандум о сотрудничестве.
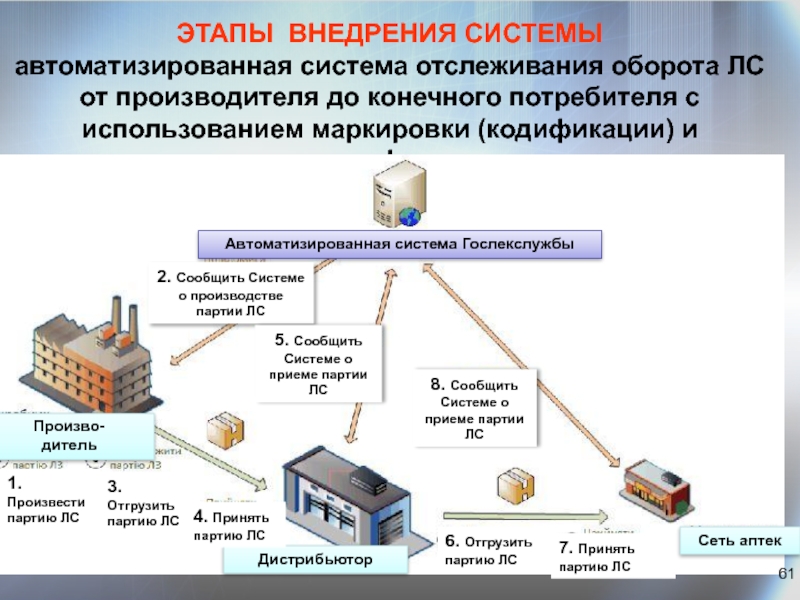
Слайд 61ЭТАПЫ ВНЕДРЕНИЯ СИСТЕМЫ автоматизированная система отслеживания оборота ЛС от производителя до
Автоматизированная система Гослекслужбы
Произво-
дитель
Дистрибьютор
Сеть аптек
1.Произвести партию ЛС
3. Отгрузить партию ЛС
4. Принять партию ЛС
2. Сообщить Системе о производстве партии ЛС
5. Сообщить Системе о приеме партии ЛС
8. Сообщить Системе о приеме партии ЛС
6. Отгрузить партию ЛС
7. Принять партию ЛС
Слайд 62
В 2013 г. в Украине стартовал пилотный проект по внедрению индивидуальной
СТРУКТУРА МАРКИРОВКИ
В данном проекте принимают участие компании «ФФ«Дарница», «Нобель Фарма» в Украине, «Альба Украина», Киевское КП «Фармация»
ДВУХМЕРНЫЙ КОД GS1 ECC200
13 цифр - код GTIN (код производителя)
(21) 20 цифр - уникальный идентификатор упаковки – случайно сгенерированная последовательность цифр (используются случайные непоследовательные номера для невозможности подделки)
(17) 6 цифр – срок годности в формате ГГММДД (год-месяц-день)
(10) Номер серии ЛС
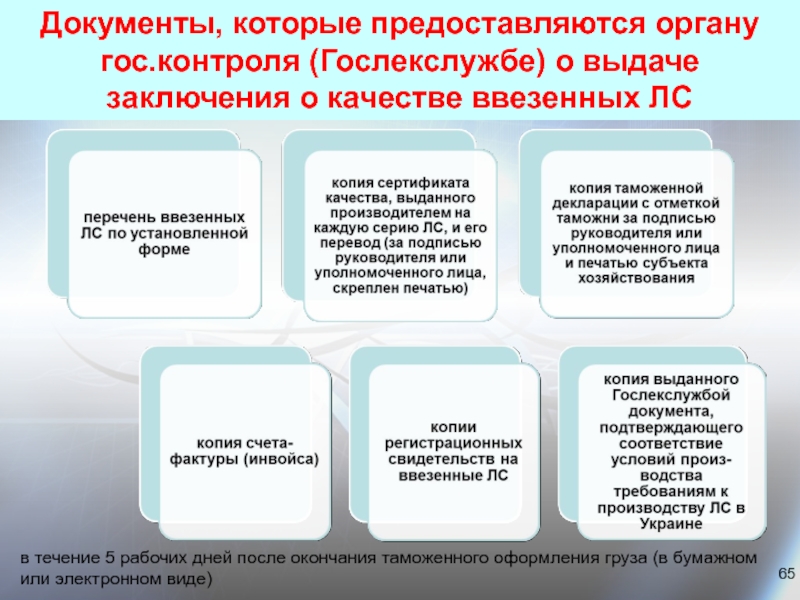
Слайд 65Документы, которые предоставляются органу гос.контроля (Гослекслужбе) о выдаче заключения о качестве
в течение 5 рабочих дней после окончания таможенного оформления груза (в бумажном или электронном виде)
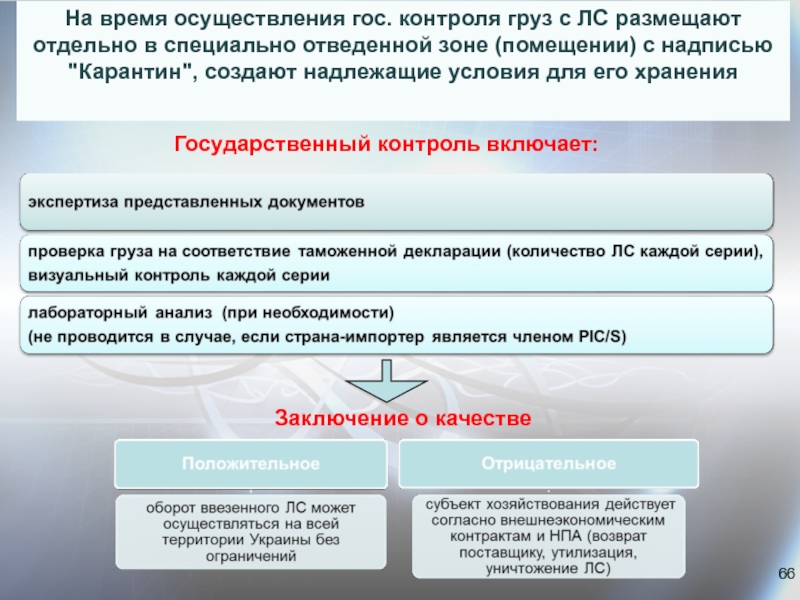
Слайд 66На время осуществления гос. контроля груз с ЛС размещают отдельно в
Государственный контроль включает:
Заключение о качестве
Слайд 67Межведомственная база данных "Лекарственные средства, зарегистрированные в Украине"
содержит сведения о
ведется МОЗ Украины (на основе данных Госреестра ЛС) в электронном виде в режиме реального времени
используется при ввозе ЛС на территорию Украины и таможенном оформлении ЛС (отсутствие в базе данных является основанием для отказа в перемещении через таможенную границу Украины и в таможенном оформлении)
Согласно п. 197.1.27 ст. 197 Налогового кодекса Украины освобождаются от налогообложения операции по поставке ЛС, разрешенных для производства и применения в Украине и внесенных в Госреестр ЛС, а также ИМН по перечню, утвержденному КМУ
Слайд 68Проведение внутриаптечных видов контроля качества экстемпоральных ЛС
(для самостоятельного изучения)
Слайд 69Совокупность правил по розничной торговле ЛС, их хранению,
контролю качества, изготовлению в
соблюдение которых обеспечит качество ЛС на этапах их
закупки, изготовления, хранения и розничной торговли –
это надлежащая практика.
А) GLP
Б) GСP
В) GMP
Г) GDP
Д) GPP*
ТЕСТ №1
Слайд 70ТЕСТ № 2
Кто отвечает за проведение входного контроля качества в аптеке?
А)
Б) заместитель заведующего
В) уполномоченное лицо*
Г) бухгалтер
Д) провизор-аналитик
Слайд 71ТЕСТ № 3
Какой стаж трудовой деятельности должен быть у уполномоченного лица,
А) 5 лет и более
Б) 4 года и более
В) не менее 2 лет*
Г) не менее 3 лет
Д) не менее 1 года