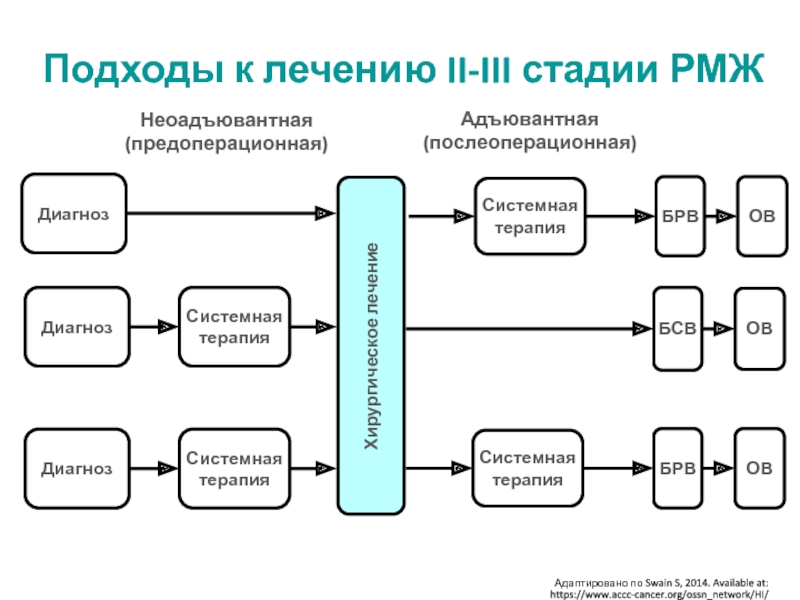
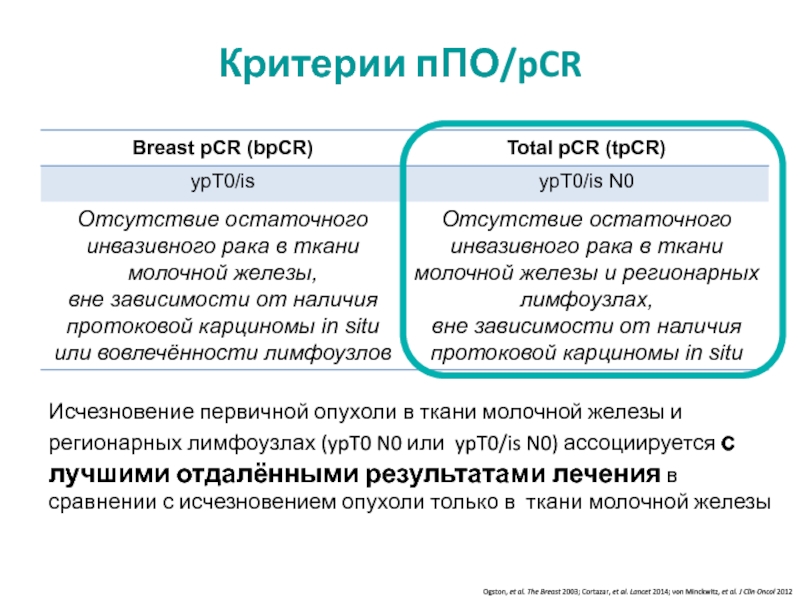
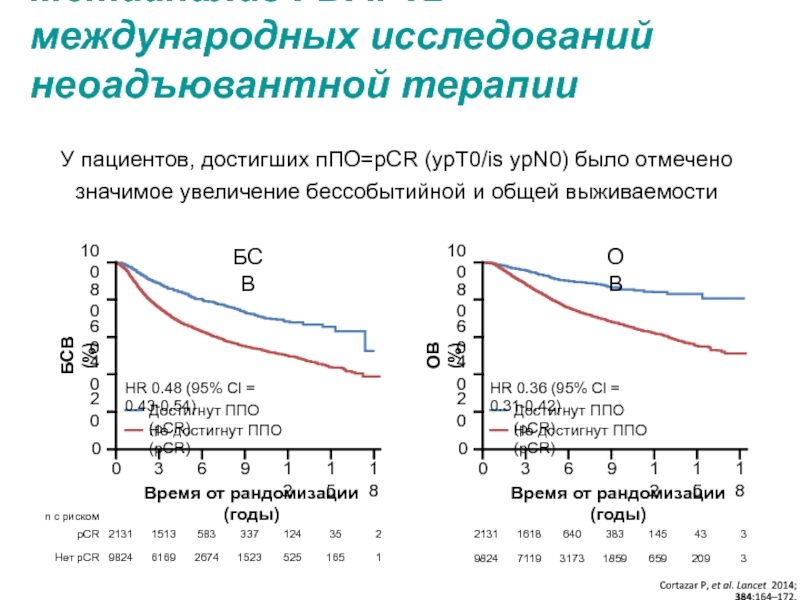
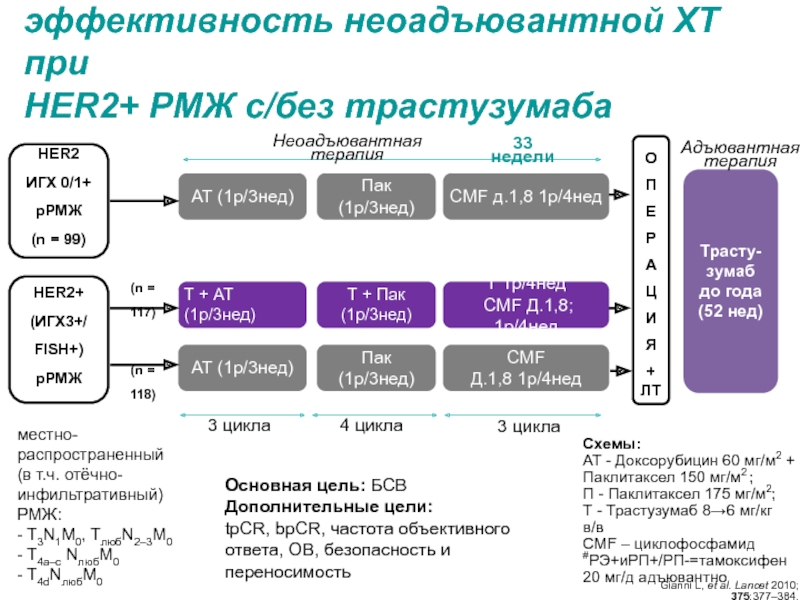
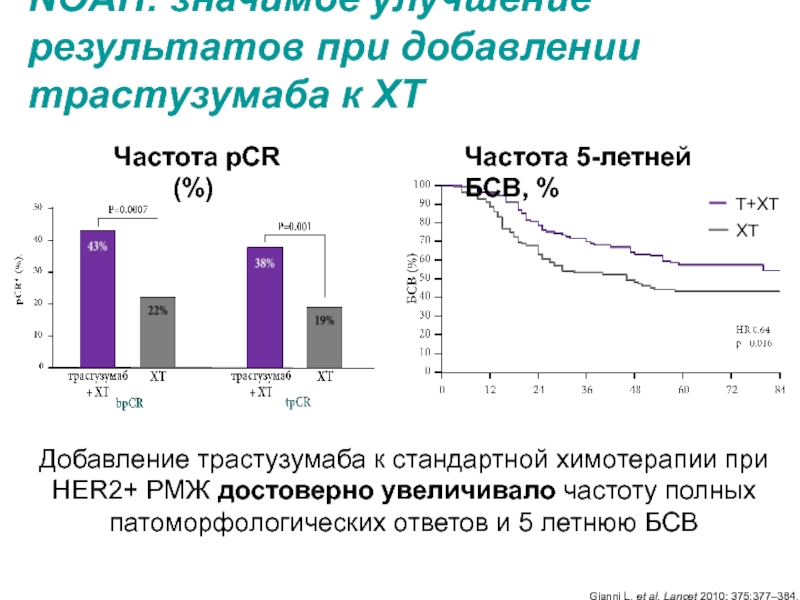
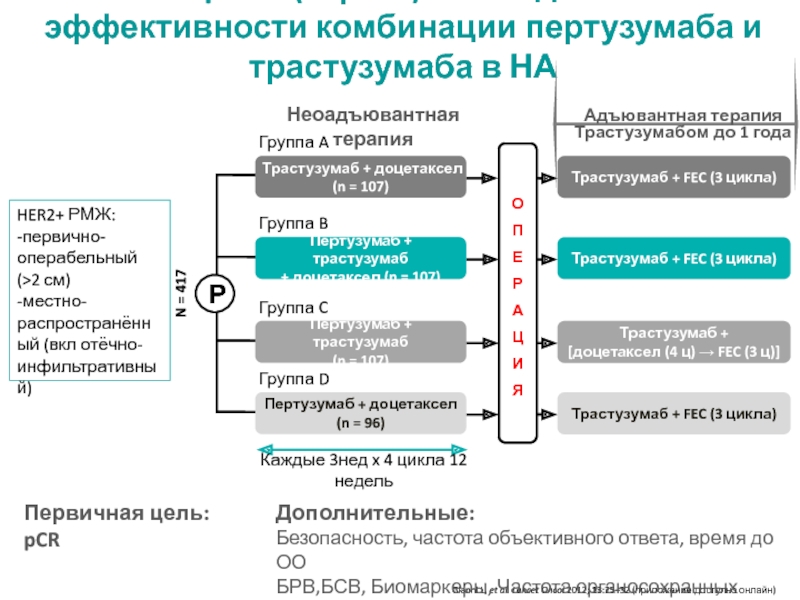
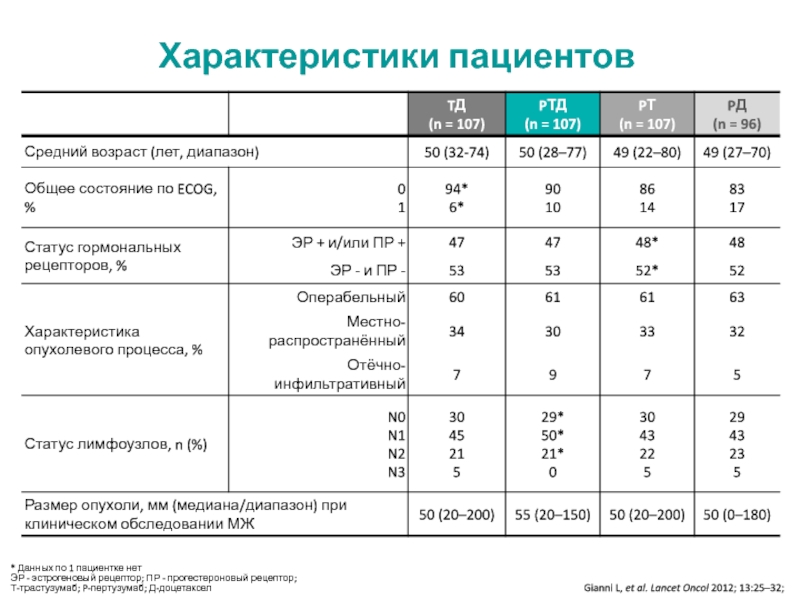
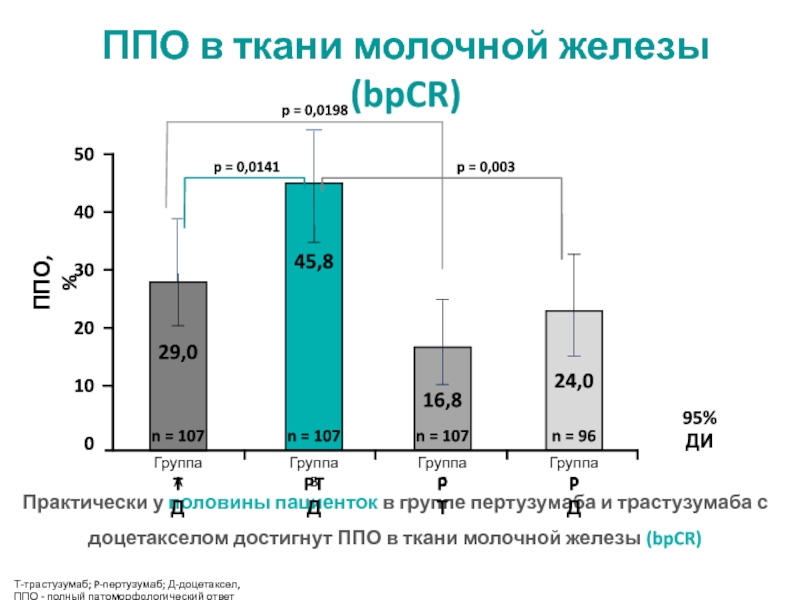
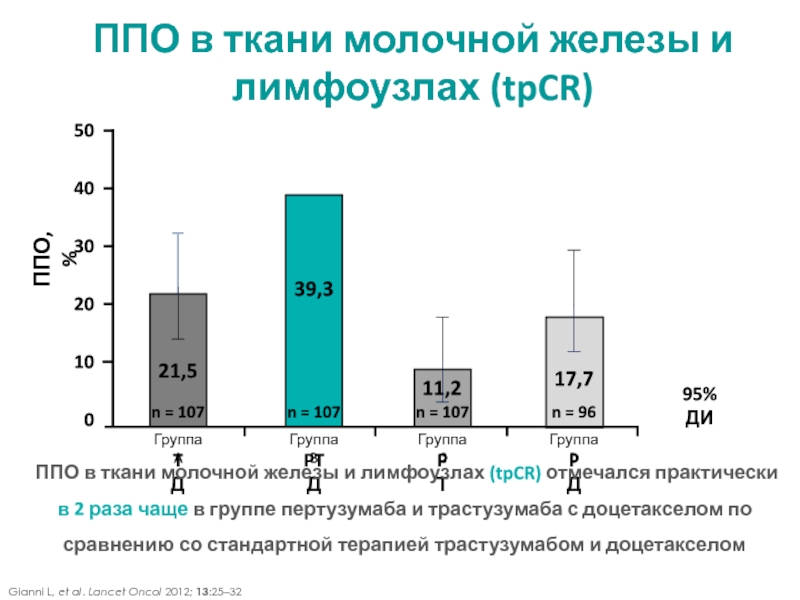
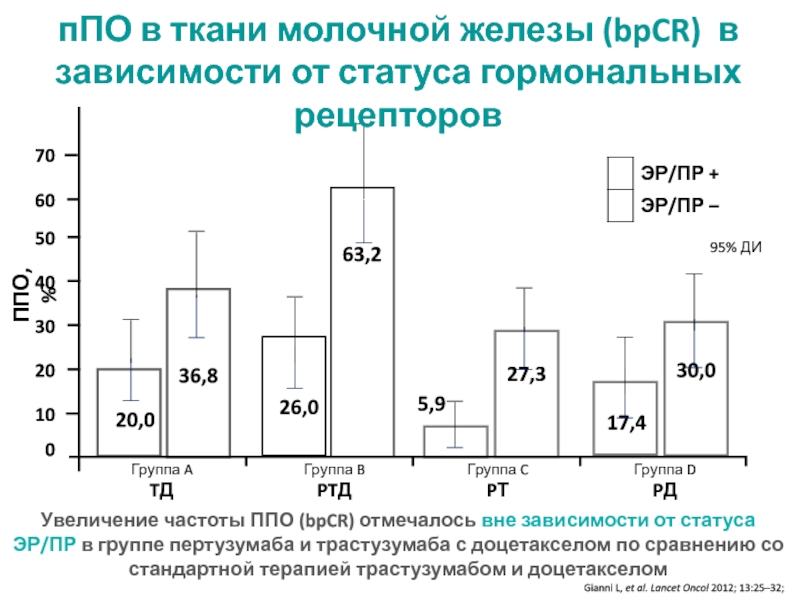
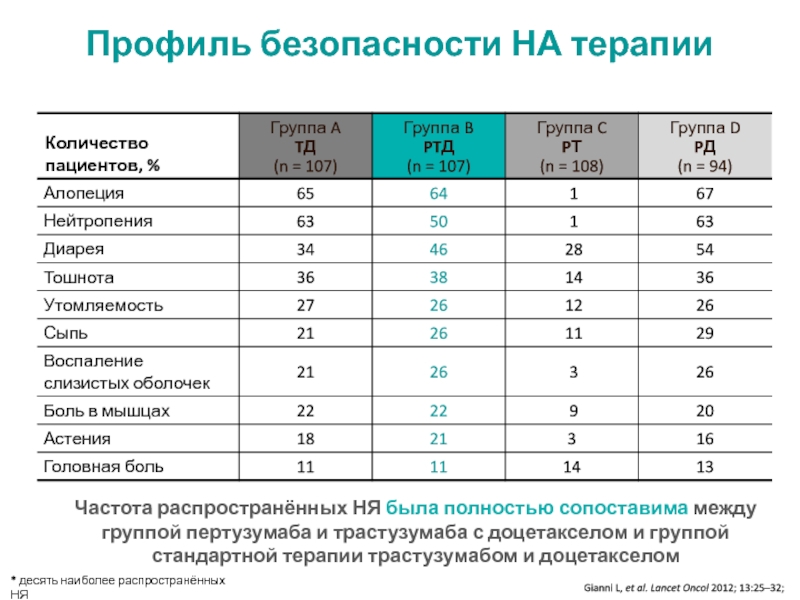
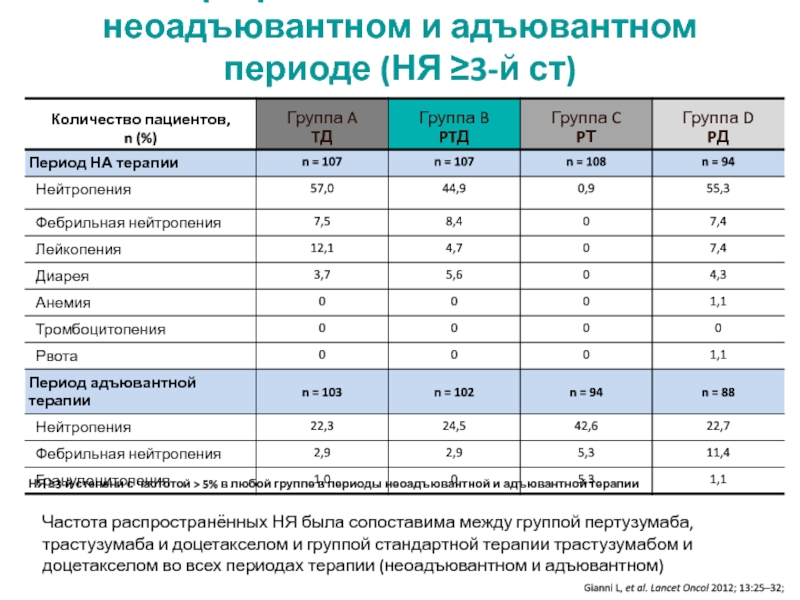
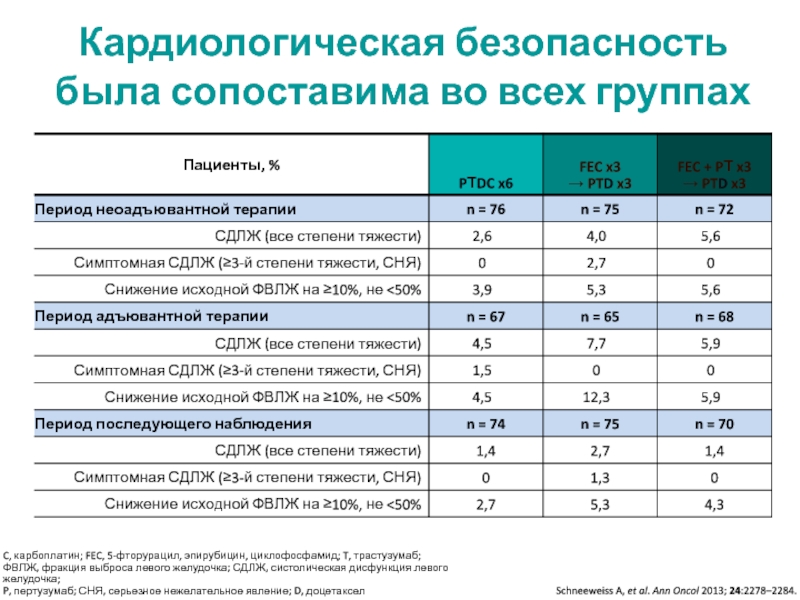
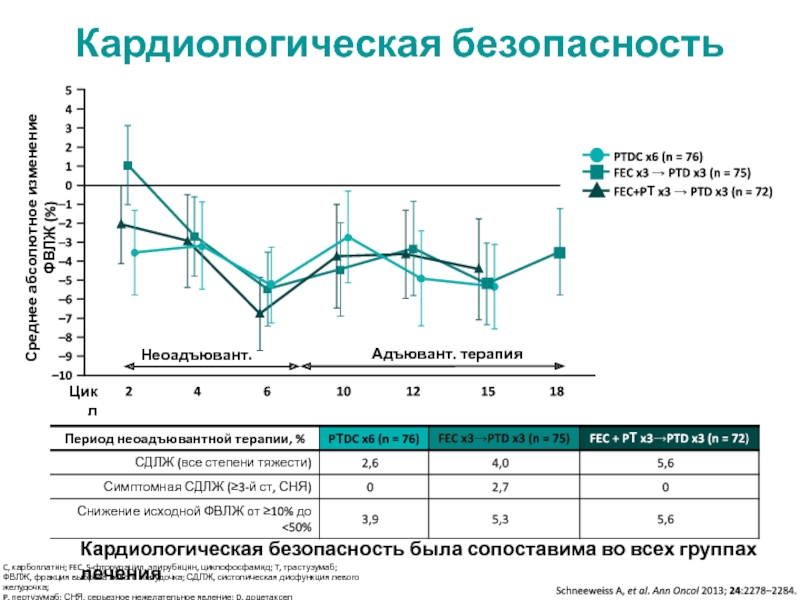
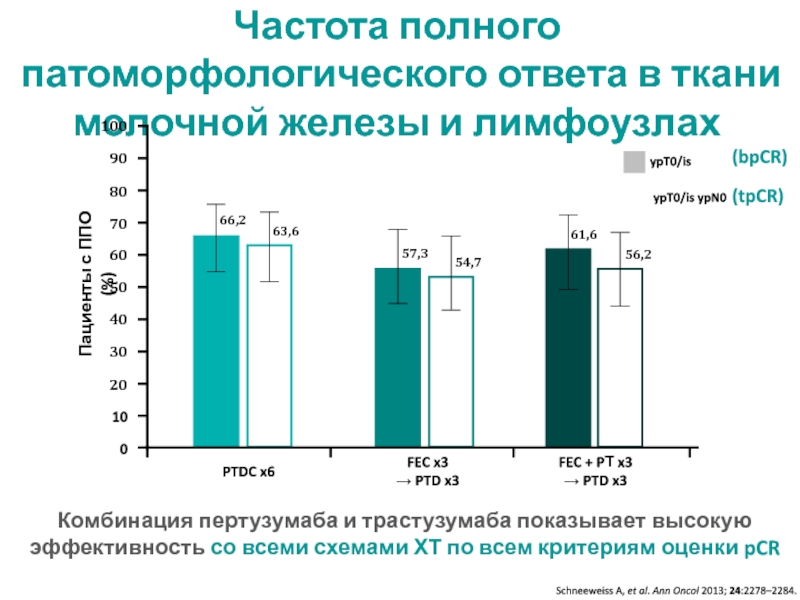
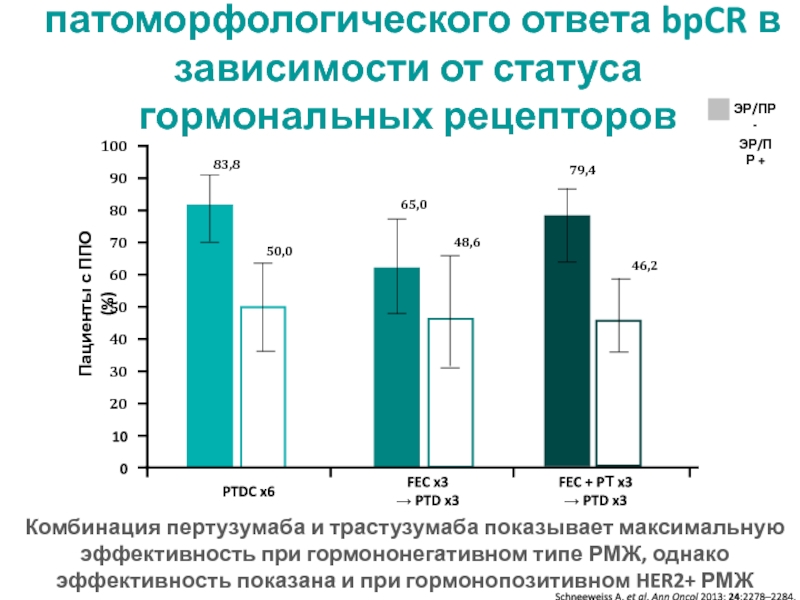
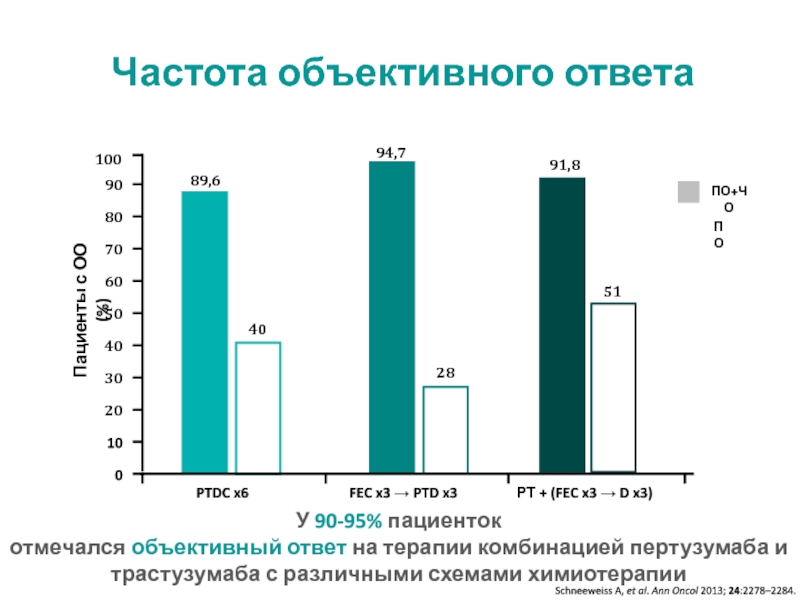
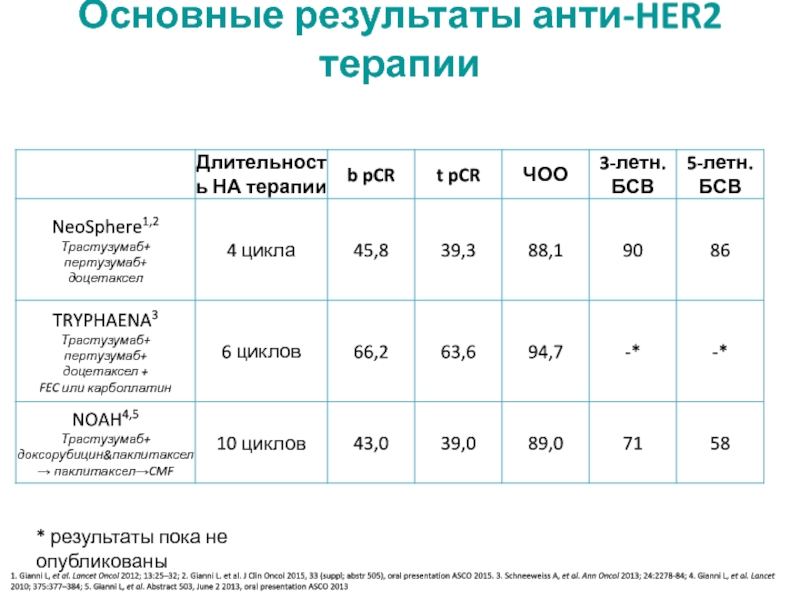
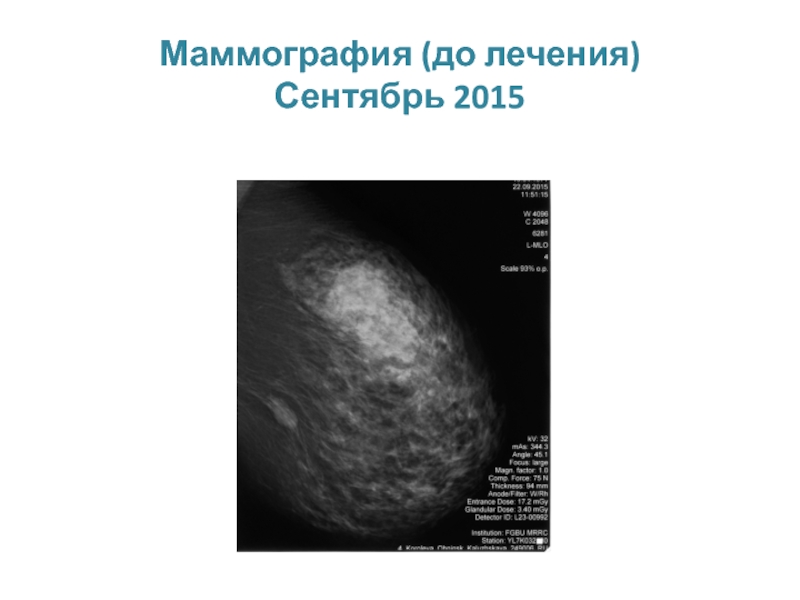
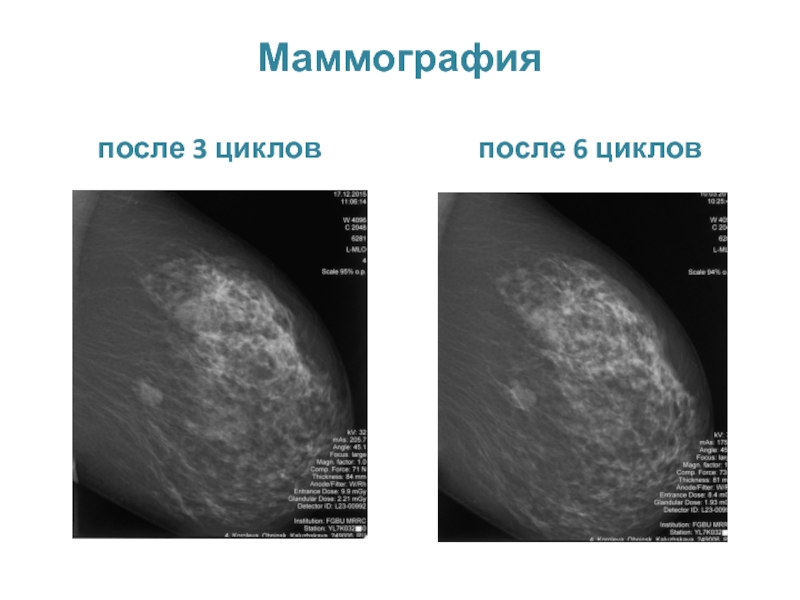
МРНЦ им. А.Ф. Цыба –
филиал ФГБУ «НМИРЦ» Минздрава России
Отделение лучевого и хирургического лечения
заболеваний торакальной области
г. ОБНИНСК
Спонсором выступления (научной деятельности) является ЗАО «Рош-Москва», официальный дистрибьютор «Ф. Хоффманн-Ля Рош Лтд.» (Швейцария)
RU/FAHE/1610/0001