факультета
Солнцева Алина Витальевна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лечение опухолей пищевода: лучевая и химиотерапия презентация
Содержание
- 1. Лечение опухолей пищевода: лучевая и химиотерапия
- 2. Основные методы лечения: 1. Хирургический 2. Лучевой
- 3. Варианты лечения в зависимости от стадии:
- 4. Лучевая терапия Дистанционный метод. Облучение производят на
- 5. Лучевая терапия Рекомендованные периоды использования: до
- 6. Лучевая терапия Показания: 1. Наличие противопоказаний к
- 7. Лучевая терапия Противопоказания: наличие фистулы; распад
- 8. Шкала Карновского – общая оценка функционального статуса больного.
- 9. Шкала ECOG - пятибалльная шкала оценки общего состояния онкологического больного
- 10. Лучевая терапия Противопоказания: обширное поражение раком; раковый
- 11. Лучевая терапия: плюсы и минусы Плюсы: раковые
- 12. Лучевая терапия Побочные эффекты: При дистанционном методе
- 13. Область облучения Параэзофагеальные
- 14. Предоперационная лучевая терапия: Оказывает бластостатический эффект Расширяет
- 15. Схемы лучевой терапии РОД – разовая очаговая
- 16. Классическое фракционирование дозы 5 сеансов лучевой терапии
- 21. Внутриполостное облучение - брахитерапия Аппарат АГАТ ВУ (тонкий зонд + радиоактивный кобальт)
- 22. Брахитерапия Противопоказания: протяженность опухоли по пищеводу
- 23. Брахитерапия В исследовании Е. Левченко и соавт.
- 24. Брахитерапия Осложнения неоадъювантной терапии (36%): Эзофагит (9%);
- 25. Сочетанная лучевая терапия При отсутствии противопоказаний к
- 26. Электромагнитная гипертермия В исследовании Борисова В.А. и
- 27. Химиотерапия Показания: Выход клеток за пределы видимых
- 28. Применение химиопрепаратов в зависимости от экспрессии генов
- 29. Классификация основных химиотерапевтических препаратов, использующихся в лечении
- 30. Противоопухолевые алкилирущие средства: Препараты платины Механизм действия:
- 31. Торговые названия препаратов
- 32. Противоопухолевые средства, ингибиторы ДНК-топоизомераз Механизм действия:
- 33. Торговые названия препаратов
- 34. Противоопухолевые средства, антиметаболиты: произв. фторпиримидинов
- 35. Противоопухолевые средства, антиметаболиты: произв. фторпиримидинов
- 36. Торговые названия препаратов
- 37. Противоопухолевые средства, нарушающие митоз Механизм
- 38. Торговые названия препаратов
- 39. Противоопухолевые антибиотики: Механизм действия: Встраивание в
- 40. Торговые названия препаратов
- 41. Противоопухолевые препараты. Моноклональные антитела Механизм действия:
- 42. Торговые названия препаратов
- 43. Предоперационная (неоадъювантная) химиотерапия Показана при аденокарциноме.
- 44. Послеоперационная (адъювантная) химиотерапия При плоскоклеточном раке
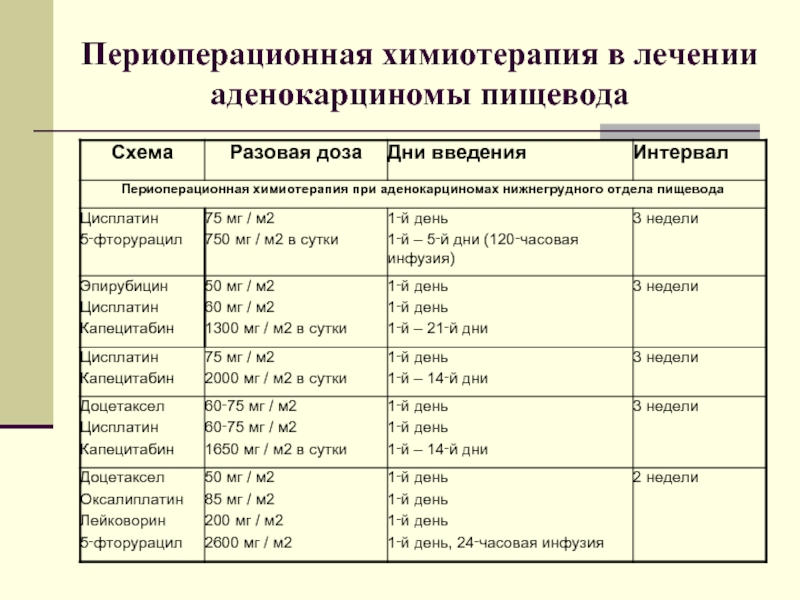
- 45. Периоперационная химиотерапия в лечении аденокарциномы пищевода
- 46. Комбинированное лечение Впервые предложено А. С. Мамонтовым
- 47. Одновременная химиолучевая терапия. Предоперационная химиолучевая терапия Лечение:
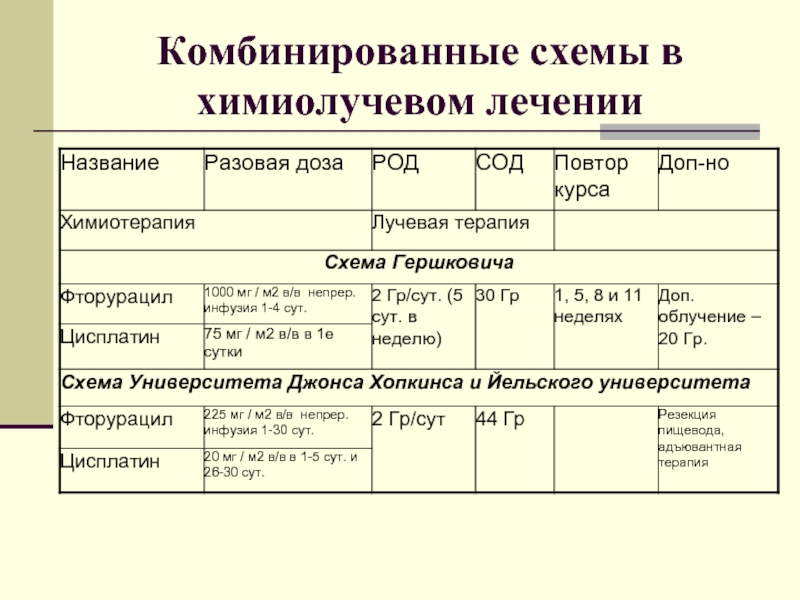
- 48. Комбинированные схемы в химиолучевом лечении В исследовании
- 49. Послеоперационная химиолучевая терапия Послеоперационная химиолучевая терапия
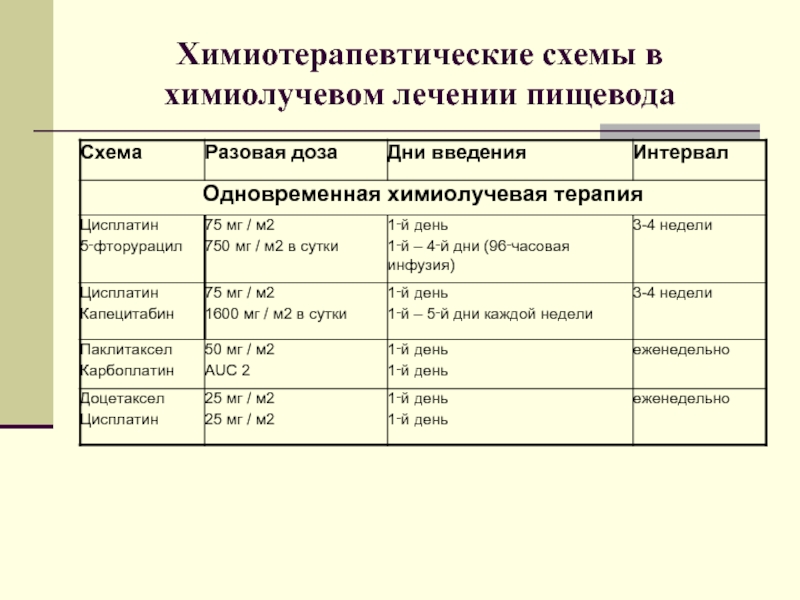
- 50. Химиотерапевтические схемы в химиолучевом лечении пищевода
- 51. Комбинированные схемы в химиолучевом лечении
- 52. Самостоятельная химиолучевая терапия Лечение: РОД =
- 53. НЕРЕЗЕКТАБЕЛЬНЫЙ МЕСТНО-РАСПРОСТРАНЕННЫЙ РАК ПИЩЕВОДА Стадия III: Т4
- 54. IV стадия Основными задачами лечения пациентов
- 55. IV стадия При плоскоклеточных раках: комбинация
- 56. Паллиативное лечение Наиболее частым симптомом является
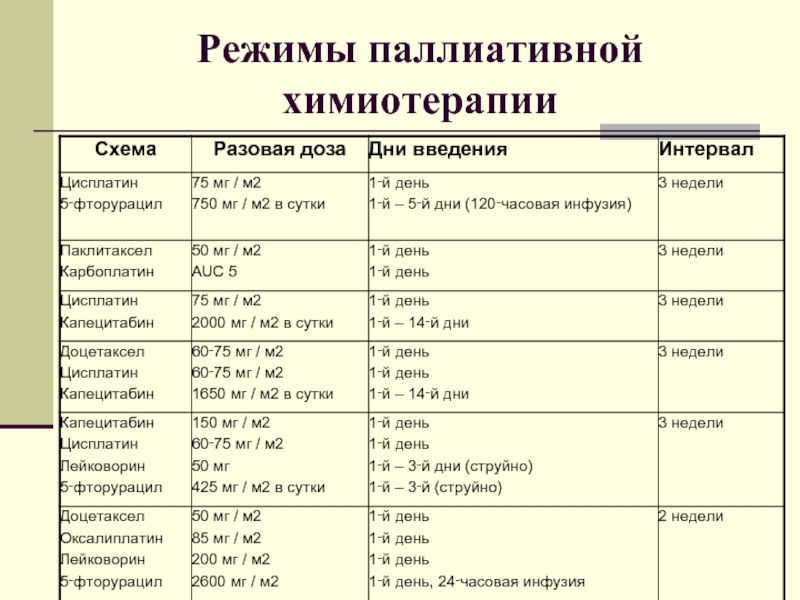
- 57. Режимы паллиативной химиотерапии
- 58. Спасибо за внимание!
- 59. Список литературы: Практические рекомендации по лечению злокачественных
Слайд 1Лечение опухолей пищевода: лучевая и химиотерапия
Подготовила
студентка 28 группы 4 курса
лечебного
Слайд 2Основные методы лечения:
1. Хирургический
2. Лучевой
3. Комбинированный: лучевой и хирургический
4. Комплексный: хирургический,
лучевой и
лекарственный (химиотерапевтический)
лекарственный (химиотерапевтический)
Слайд 4Лучевая терапия
Дистанционный метод. Облучение производят на некотором расстоянии от поверхности кожного
покрова.
Контактный метод. Аппарат с радиоактивным источником располагают непосредственно на коже.
Внутриполостной метод. Устройство вводят в поврежденный раком орган (матку, прямую кишку, пищевод и т.п.).
Внутритканевой метод. Источник радиоактивных лучей помещают в опухоль.
Внутреннее облучение. Воздействие радионуклидами, которые избирательно накапливаются в каком-либо органе.
Контактный метод. Аппарат с радиоактивным источником располагают непосредственно на коже.
Внутриполостной метод. Устройство вводят в поврежденный раком орган (матку, прямую кишку, пищевод и т.п.).
Внутритканевой метод. Источник радиоактивных лучей помещают в опухоль.
Внутреннее облучение. Воздействие радионуклидами, которые избирательно накапливаются в каком-либо органе.
Слайд 5Лучевая терапия
Рекомендованные периоды использования:
до операции (чтобы уменьшить размеры опухоли);
после операции (чтобы
убить оставшиеся раковые клетки);
до и после операции;
при рецидивах рака через длительное время;
при метастазировании опухоли в кости и лимфатические узлы.
до и после операции;
при рецидивах рака через длительное время;
при метастазировании опухоли в кости и лимфатические узлы.
Слайд 6Лучевая терапия
Показания:
1. Наличие противопоказаний к хирургическому лечению:
Сопутствующая патология (СС, дыхательной и
др. систем)
Преклонный возраст больных
Отказ от операции
2. в комплексе с другими методами лечения
3. паллиативное лечение
Преклонный возраст больных
Отказ от операции
2. в комплексе с другими методами лечения
3. паллиативное лечение
Слайд 7Лучевая терапия
Противопоказания:
наличие фистулы;
распад опухоли с кровотечением;
прорастание всех слоев стенки
трахеи, главных бронхов и аорты;
активная форма туберкулеза легких;
анемия (Hb < 80 г/л), лейкопения (Л < 2,0 × 10,9 л), тромбоцитопения (Тр < 75 × 10,9 л);
перенесенный инфаркт миокарда и инсульт (по ВК);
психические расстройства в период обострения;
некупируемое состояние больного по шкале Карновского 40% и менее (шкала ECOG > 2).
выраженные явления интоксикации; тяжелое состояние пациента;
лихорадка;
кахексия;
активная форма туберкулеза легких;
анемия (Hb < 80 г/л), лейкопения (Л < 2,0 × 10,9 л), тромбоцитопения (Тр < 75 × 10,9 л);
перенесенный инфаркт миокарда и инсульт (по ВК);
психические расстройства в период обострения;
некупируемое состояние больного по шкале Карновского 40% и менее (шкала ECOG > 2).
выраженные явления интоксикации; тяжелое состояние пациента;
лихорадка;
кахексия;
Слайд 10Лучевая терапия
Противопоказания:
обширное поражение раком;
раковый плеврит;
множественные метастазы;
лучевая болезнь;
сопутствующие заболевания в тяжелой форме
(по решению ВК):
инфаркт миокарда,
болезни почек,
дыхательная недостаточность,
активный туберкулез легких,
третья степень сердечно-сосудистой недостаточности,
декомпенсированный диабет и др.
инфаркт миокарда,
болезни почек,
дыхательная недостаточность,
активный туберкулез легких,
третья степень сердечно-сосудистой недостаточности,
декомпенсированный диабет и др.
Слайд 11Лучевая терапия: плюсы и минусы
Плюсы:
раковые клетки перестают делиться, часть их гибнет;
опухоль уменьшается;
сосуды, питающие рак, частично зарастают;
Минусы:
гиперчувствительность к облучению кроветворной системы и эпителия кишечника;
много побочных реакций, возникающих во время лечения.
сосуды, питающие рак, частично зарастают;
Минусы:
гиперчувствительность к облучению кроветворной системы и эпителия кишечника;
много побочных реакций, возникающих во время лечения.
Слайд 12Лучевая терапия
Побочные эффекты:
При дистанционном методе лечения появляется зуд, шелушение кожи, сухость,
краснота, мелкие пузырьки.
При облучении шеи может появиться першение в горле, сухость, боль при глотании, осиплость голоса. Нарушается аппетит.
При воздействии на органы грудной полости может появиться сухой кашель, боль в горле при глотании, одышка, болезненность мышц.
При облучении шеи может появиться першение в горле, сухость, боль при глотании, осиплость голоса. Нарушается аппетит.
При воздействии на органы грудной полости может появиться сухой кашель, боль в горле при глотании, одышка, болезненность мышц.
Слайд 13
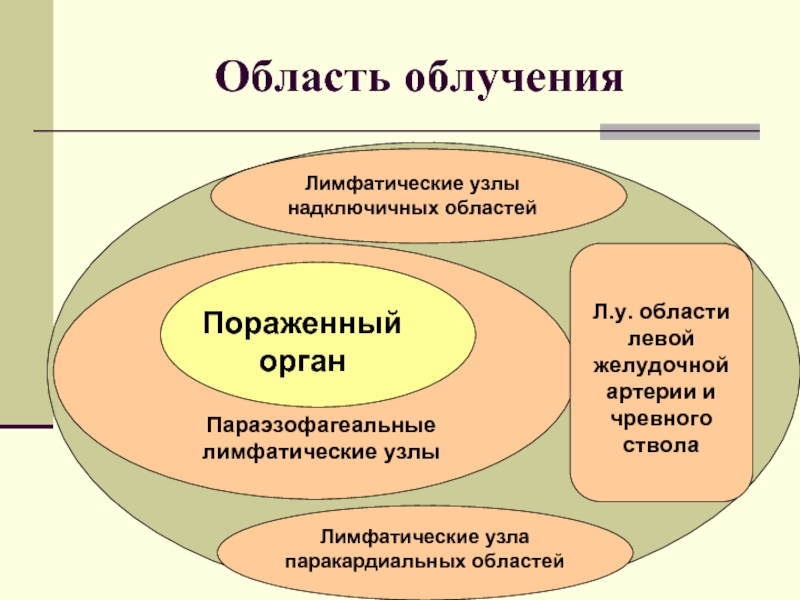
Область облучения
Параэзофагеальные лимфатические узлы
Пораженный орган
Л.у. области левой желудочной артерии и чревного
ствола
Лимфатические узлы надключичных областей
Лимфатические узла паракардиальных областей
Слайд 14Предоперационная лучевая терапия:
Оказывает бластостатический эффект
Расширяет резектабельность
Уменьшает количество местных рецидивов и
метастазов
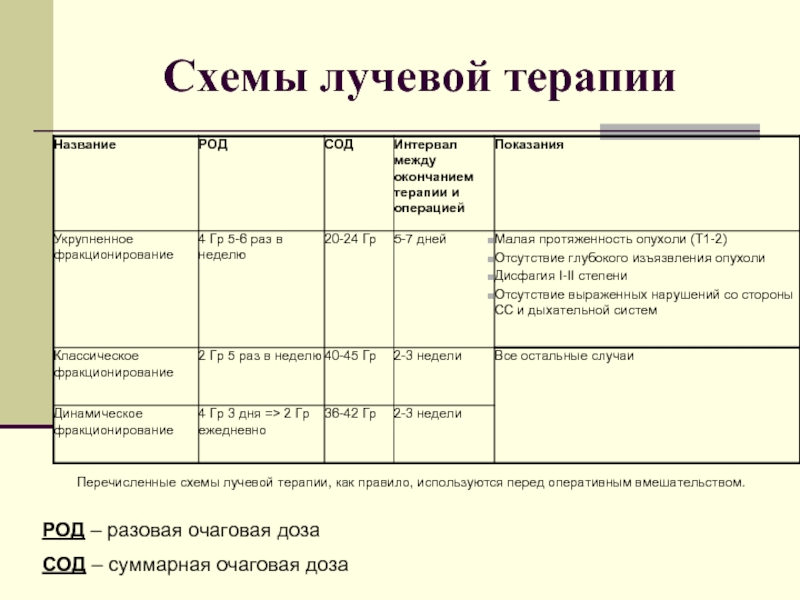
Слайд 15Схемы лучевой терапии
РОД – разовая очаговая доза
СОД – суммарная очаговая доза
Перечисленные
схемы лучевой терапии, как правило, используются перед оперативным вмешательством.
Слайд 16Классическое фракционирование дозы
5 сеансов лучевой терапии в неделю в разовой очаговой
дозе 1,5 – 2 Гр
Цель: создание в области облучаемого органа терапевтической дозы в 60-70 Гр
Слайд 21Внутриполостное облучение - брахитерапия
Аппарат АГАТ ВУ (тонкий зонд + радиоактивный кобальт)
Слайд 22Брахитерапия
Противопоказания:
протяженность опухоли по пищеводу более 10 см;
наличие отдаленных метастазов;
прорастание опухолью всех слоев трахеи и главных бронхов.
Слайд 23Брахитерапия
В исследовании Е. Левченко и соавт. (XVI Российский онкологический конгресс) была
показана эффективность брахитерапии в комплексном лечении рака пищевода совместно с химиолучевой терапией.
Данный метод лечений позволил в 30% случаев достигнуть полного местного регресса опухоли.
Данный метод лечений позволил в 30% случаев достигнуть полного местного регресса опухоли.
Слайд 24Брахитерапия
Осложнения неоадъювантной терапии (36%):
Эзофагит (9%);
Гематологические осложнения (15%);
Постлучевой рубцовый стеноз (6%);
Внутрибольничная аспирационная
пневмония (3%);
Кровотечение из хронической язвы желудка (3%).
Кровотечение из хронической язвы желудка (3%).
Слайд 25Сочетанная лучевая терапия
При отсутствии противопоказаний к проведению брахитерапии
I этап – дистанционная
лучевая терапия в дозе СОД 50 Гр по 2 Гр 5 раз в неделю непрерывным курсом в течение 5 недель;
II этап – брахитерапия через 2–3 недели после дистанционной лучевой терапии в 3 сеанса по 5 Гр с интервалом 7 дней.
II этап – брахитерапия через 2–3 недели после дистанционной лучевой терапии в 3 сеанса по 5 Гр с интервалом 7 дней.
Слайд 26Электромагнитная гипертермия
В исследовании Борисова В.А. и соавт. приводятся данные об использовании
электромагнитной гипертермии в комплексном лечении с лучевой и химиолучевой терапией. Согласно полученным данным, применение гипертермии уменьшает продолжительность жизни пациентов, однако при этом наблюдается улучшение качества жизни пациентов.(10)
Слайд 27Химиотерапия
Показания:
Выход клеток за пределы видимых границ опухоли
Высокая биологическая активность клеток в
ложе опухоли
Низкодифференцированные формы рака пищевода
Мелкоклеточный рак пищевода
Нерадикальное удаление опухоли
Наличие отдаленных метастазов
Низкодифференцированные формы рака пищевода
Мелкоклеточный рак пищевода
Нерадикальное удаление опухоли
Наличие отдаленных метастазов
Слайд 28Применение химиопрепаратов в зависимости от экспрессии генов
ERCC-1 – участвует в восстановлении
повреждений ДНК, индуцируемых алкилирующими агентами (препараты платины), путем эксцизионной репарации нуклеотидов.
Her-2/neu (c-erbB2) – онкоген семейства рецепторов эпидермального фактора роста. Her-2/neu определяет резистентность к химиотерапевтическим препаратам таким, как таксаны, цисплатин и фторпиримидины. Гиперэкспрессия c-erbB2 вне зависимости от проведения химиотерапии коррелирует с низкой безрецидивной (p=0,0474) и общей выживаемостью (p=0,0310) больных после резекции.
Ki-67 – ген, свойственный для пролиферирующих клеток, характеризует агрессивность, злокачественность течения опухолевого процесса и вероятность ответа на проводимую терапию. Результаты исследований этого гена, тем не менее, неоднозначны.
Her-2/neu (c-erbB2) – онкоген семейства рецепторов эпидермального фактора роста. Her-2/neu определяет резистентность к химиотерапевтическим препаратам таким, как таксаны, цисплатин и фторпиримидины. Гиперэкспрессия c-erbB2 вне зависимости от проведения химиотерапии коррелирует с низкой безрецидивной (p=0,0474) и общей выживаемостью (p=0,0310) больных после резекции.
Ki-67 – ген, свойственный для пролиферирующих клеток, характеризует агрессивность, злокачественность течения опухолевого процесса и вероятность ответа на проводимую терапию. Результаты исследований этого гена, тем не менее, неоднозначны.
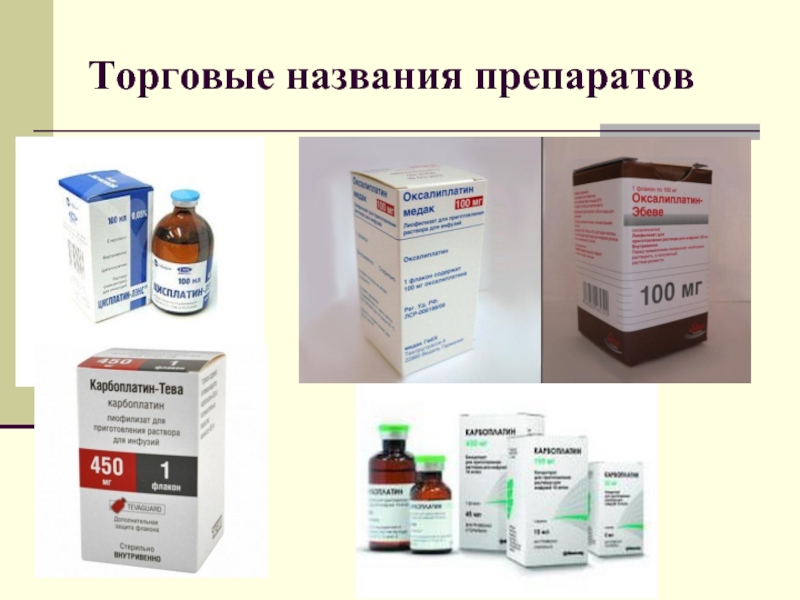
Слайд 29Классификация основных химиотерапевтических препаратов, использующихся в лечении ЗНО пищевода:
1. Противоопухолевые алкилирущие
средства:
Препараты платины:
- Цисплатин
- Оксалиплатин
- Карбоплатин
2. Противоопухолевые средства, ингибиторы ДНК-топоизомераз:
- Иринотекан
3. Противоопухолевые средства, антиметаболиты:
произв. фторпиримидины:
- 5‑фторурацил
- Капецитабин
4. Противоопухолевые средства, нарушающие митоз:
- Доцетаксел
- Паклитаксел
5. Противоопухолевые антибиотики:
Антрациклины:
+ прозв. доксорубицина:
- Эпирубицин
6. Моноклональные антитела:
- Трастузумаб
Препараты платины:
- Цисплатин
- Оксалиплатин
- Карбоплатин
2. Противоопухолевые средства, ингибиторы ДНК-топоизомераз:
- Иринотекан
3. Противоопухолевые средства, антиметаболиты:
произв. фторпиримидины:
- 5‑фторурацил
- Капецитабин
4. Противоопухолевые средства, нарушающие митоз:
- Доцетаксел
- Паклитаксел
5. Противоопухолевые антибиотики:
Антрациклины:
+ прозв. доксорубицина:
- Эпирубицин
6. Моноклональные антитела:
- Трастузумаб
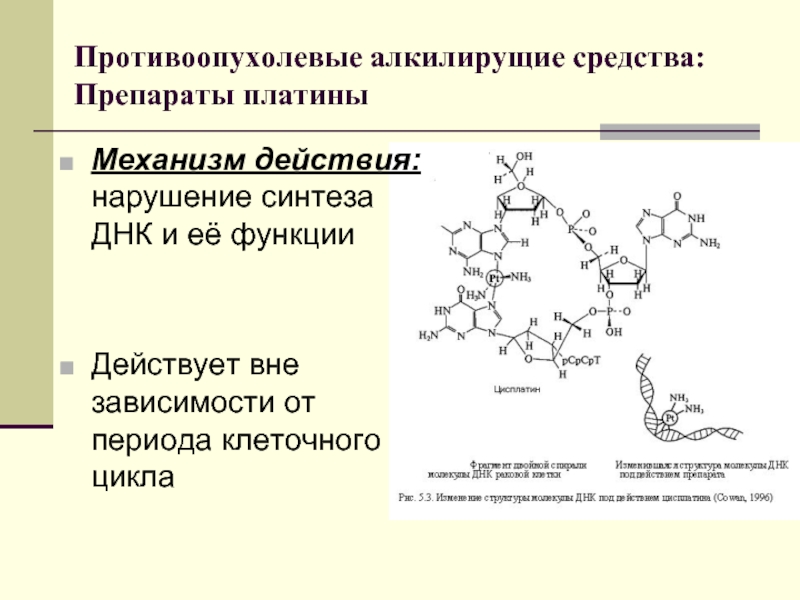
Слайд 30Противоопухолевые алкилирущие средства:
Препараты платины
Механизм действия: нарушение синтеза ДНК и её функции
Действует
вне зависимости от периода клеточного цикла
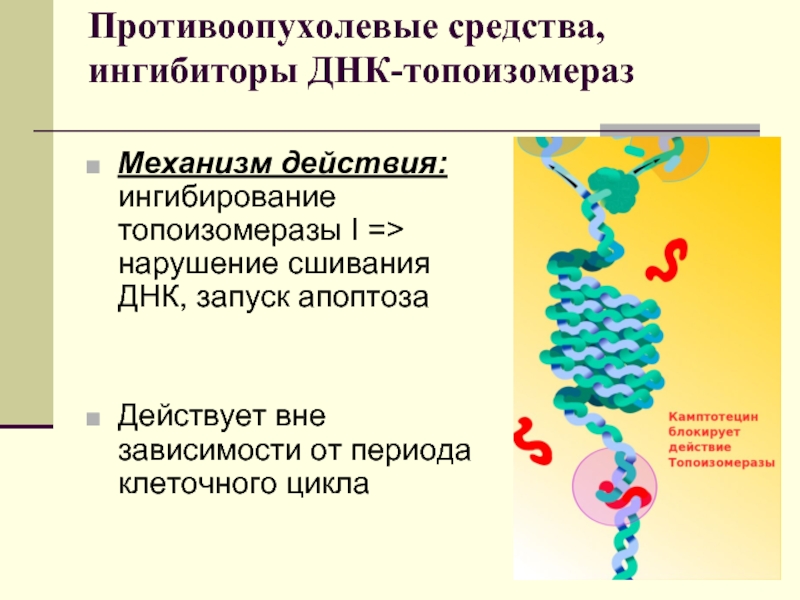
Слайд 32Противоопухолевые средства, ингибиторы ДНК-топоизомераз
Механизм действия: ингибирование топоизомеразы I => нарушение сшивания
ДНК, запуск апоптоза
Действует вне зависимости от периода клеточного цикла
Действует вне зависимости от периода клеточного цикла
Слайд 34Противоопухолевые средства, антиметаболиты:
произв. фторпиримидинов
Механизм действия:
1. Фтордезокси-УМФ – тимидилатсинтетазу => накопление
дезокси-УМФ => нарушение репликации и функции ДНК:
Слайд 35Противоопухолевые средства, антиметаболиты:
произв. фторпиримидинов
Механизм действия:
2. Фтор-УТФ – встраивается в РНК
=> нарушение процессинга и трансляции.
3. Фтордезокси-УТФ – встраивается в ДНК => нарушение репликации и функции ДНК.
Наиболее активен в периоде S.
3. Фтордезокси-УТФ – встраивается в ДНК => нарушение репликации и функции ДНК.
Наиболее активен в периоде S.
Слайд 37Противоопухолевые средства, нарушающие митоз
Механизм действия: связывание с микротрубочками => их
полимеризация => нарушение работы митотического веретена => препятствие делению клетки.
Наиболее активен в митозе.
Наиболее активен в митозе.
Слайд 39Противоопухолевые антибиотики:
Механизм действия:
Встраивание в ДНК => нарушение репликации и функций
ДНК.
Ингибирование РНК-полимеразы => подавление транскрипции.
Ингибирование топоизомеразы II => разрыв цепи ДНК.
Ингибирование РНК-полимеразы => подавление транскрипции.
Ингибирование топоизомеразы II => разрыв цепи ДНК.
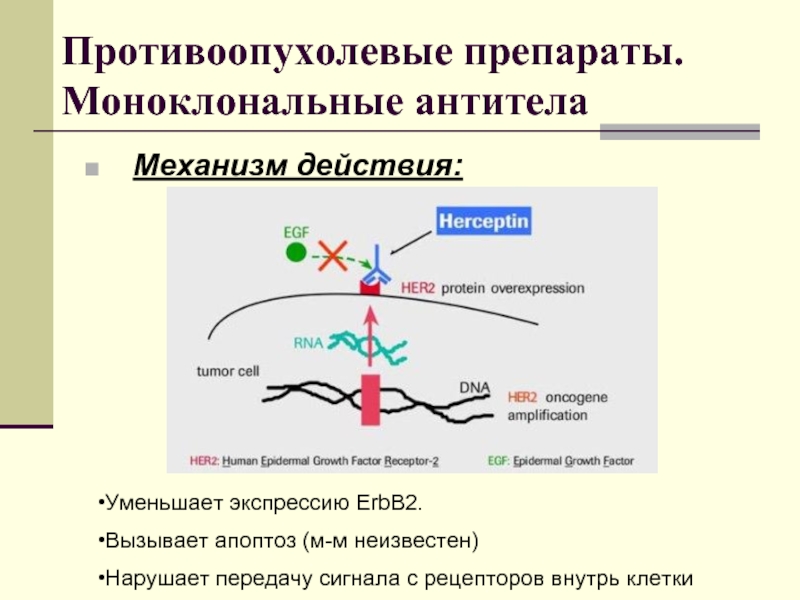
Слайд 41Противоопухолевые препараты. Моноклональные антитела
Механизм действия:
Уменьшает экспрессию ErbB2.
Вызывает апоптоз (м-м неизвестен)
Нарушает
передачу сигнала с рецепторов внутрь клетки
Слайд 43Предоперационная (неоадъювантная) химиотерапия
Показана при аденокарциноме.
При аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного
перехода наиболее оправдано проведение периоперационной химиотерапии: 2‑3 курса химиотерапии назначаются до операции, а 3‑4 курса – после нее.
При выявлении гиперэкспрессии HER 2 neu в режимы терапии включается трастузумаб в стандартных дозах.
При плоскоклеточном раке эффективность минимальна.
При выявлении гиперэкспрессии HER 2 neu в режимы терапии включается трастузумаб в стандартных дозах.
При плоскоклеточном раке эффективность минимальна.
Слайд 44Послеоперационная (адъювантная) химиотерапия
При плоскоклеточном раке пищевода ее проведение не показано.
При
аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного перехода послеоперационная химиотерапия показана, если она проводилась и предоперационно.
Адъювантная химиотерапия в самостоятельном виде при аденокарциноме пищевода в настоящее время не рекомендуется.
Адъювантная химиотерапия в самостоятельном виде при аденокарциноме пищевода в настоящее время не рекомендуется.
Слайд 46Комбинированное лечение
Впервые предложено А. С. Мамонтовым в 1979 г.
Рекомендуется для лечения
больных, у которых локализация опухоли в среднегрудном отделе пищевода
Слайд 47Одновременная химиолучевая терапия. Предоперационная химиолучевая терапия
Лечение: РОД 1,8‑2 Гр, СОД –
до 44‑45 Гр., химиотерапия на основе цисплатина или карбоплатина.
При выраженной дисфагии перед началом облучения – эндоскопическую электрореканализацию / аргонно-плазменную реканализацию пищевода или пункционную гастростомию.
Хирургическое вмешательство обычно производится через 6‑8 недель после завершения химиолучевой терапии.
Оптимальным режимом химиолучевой терапии представляется еженедельное введение паклитаксела и карбоплатина на фоне 5 недель лучевой терапии.
При выраженной дисфагии перед началом облучения – эндоскопическую электрореканализацию / аргонно-плазменную реканализацию пищевода или пункционную гастростомию.
Хирургическое вмешательство обычно производится через 6‑8 недель после завершения химиолучевой терапии.
Оптимальным режимом химиолучевой терапии представляется еженедельное введение паклитаксела и карбоплатина на фоне 5 недель лучевой терапии.
Слайд 48Комбинированные схемы в химиолучевом лечении
В исследовании эффективности комбинированного метода лечения по
сравнению с хирургическим методом отмечается увеличение двухлетней общей выживаемости с 63,2% до 87% (p<0,05).
Также в этом эксперименте выявлена высокая эффективность химиотерапии по схеме гентамицин/цисплатин как в комбинации с хирургическим методом, так и без него (38,9%).(6)
В эксперименте Юсупова А.М. и соавт. на фоне проводимой химиотерапии (доцетаксел+цисплатин) были изменены критерии операбельности опухоли. В связи с этим было рекомендовано комбинированное лечение (операция + лучевая терапия), которое позволило снизить частоту местных рецидивов и повысить трехлетнюю выживаемость больных. (7)
Также в этом эксперименте выявлена высокая эффективность химиотерапии по схеме гентамицин/цисплатин как в комбинации с хирургическим методом, так и без него (38,9%).(6)
В эксперименте Юсупова А.М. и соавт. на фоне проводимой химиотерапии (доцетаксел+цисплатин) были изменены критерии операбельности опухоли. В связи с этим было рекомендовано комбинированное лечение (операция + лучевая терапия), которое позволило снизить частоту местных рецидивов и повысить трехлетнюю выживаемость больных. (7)
Слайд 49Послеоперационная химиолучевая терапия
Послеоперационная химиолучевая терапия может быть проведена пациентам в удовлетворительном
состоянии при наличии микро- или макроскопической резидуальной опухоли (после R1- или R2‑резекции).
Режимы и дозы аналогичные предоперационным.
Эффетивность пред- и послеоперационной лучевой и химиотерапии в своем исследовании отмечают А.В. Тобохов и соавт. (8)
В другом эксперименте (Е.Ш. Абзалбек) отмечается увеличение выживаемости в отдаленном периоде при проведении мультимодальной терапии больным с местно-распространенными формами рака. (9)
Режимы и дозы аналогичные предоперационным.
Эффетивность пред- и послеоперационной лучевой и химиотерапии в своем исследовании отмечают А.В. Тобохов и соавт. (8)
В другом эксперименте (Е.Ш. Абзалбек) отмечается увеличение выживаемости в отдаленном периоде при проведении мультимодальной терапии больным с местно-распространенными формами рака. (9)
Слайд 52Самостоятельная химиолучевая терапия
Лечение: РОД = 1,8‑2 Гр, СОД – до 50‑55
Гр., химиотерапия на основе цисплатина и 5‑фторурацила.
При наличии выраженной дисфагии перед началом облучения производят эндоскопическую электрореканализацию пищевода или пункционную микрогастростомию.
Выбор между самостоятельной химиолучевой терапией или с хирургическим лечением (с предоперационной химиолучевой терапией или без нее) зависит от локализации первичной опухоли, функционального состояния больного и опыта хирурга.
При наличии выраженной дисфагии перед началом облучения производят эндоскопическую электрореканализацию пищевода или пункционную микрогастростомию.
Выбор между самостоятельной химиолучевой терапией или с хирургическим лечением (с предоперационной химиолучевой терапией или без нее) зависит от локализации первичной опухоли, функционального состояния больного и опыта хирурга.
Слайд 53НЕРЕЗЕКТАБЕЛЬНЫЙ МЕСТНО-РАСПРОСТРАНЕННЫЙ РАК ПИЩЕВОДА
Стадия III: Т4 - единичные или множественные метастазы
в регионарные лимфоузлы средостения
Основной метод лечения – самостоятельная химиолучевая терапия (режим как при операбельных опухолях).
При злокачественной пищеводной фистуле (пищеводно-медиастинальные, пищеводно-легочные и пищеводно-бронхиальные свищи), делающей невозможным проведение химиолучевой терапии, допустимо выполнение комбинированных операций.
Основной метод лечения – самостоятельная химиолучевая терапия (режим как при операбельных опухолях).
При злокачественной пищеводной фистуле (пищеводно-медиастинальные, пищеводно-легочные и пищеводно-бронхиальные свищи), делающей невозможным проведение химиолучевой терапии, допустимо выполнение комбинированных операций.
Слайд 54IV стадия
Основными задачами лечения пациентов с метастатическим раком пищевода:
устранение болезненных
симптомов,
увеличение продолжительности жизни.
Проведение химиотерапии рекомендуется:
пациентам в удовлетворительном состоянии (ECOG PS 0‑2)
отсутствием выраженной дисфагии (III‑IV) , затрудняющей адекватное питание пациента.
В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация).
Наиболее активными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны.
Кроме того, при аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER-2 neu).
увеличение продолжительности жизни.
Проведение химиотерапии рекомендуется:
пациентам в удовлетворительном состоянии (ECOG PS 0‑2)
отсутствием выраженной дисфагии (III‑IV) , затрудняющей адекватное питание пациента.
В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация).
Наиболее активными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны.
Кроме того, при аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER-2 neu).
Слайд 55IV стадия
При плоскоклеточных раках: комбинация цисплатина с инфузией 5‑фторурацила/капецитабином.
Применение таксанов
возможно в виде как двухкомпонентных схем с цисплатином, так и трехкомпонентных – с цисплатином и фторпиримидинами.
Оптимальная продолжительность первой линии химиотерапии неизвестна. Не существует стандартной второй линии терапии.
Обычно проводится 4 курса в случае стабилизации и 6 курсов – при достижении объективного ответа.
Оптимальная продолжительность первой линии химиотерапии неизвестна. Не существует стандартной второй линии терапии.
Обычно проводится 4 курса в случае стабилизации и 6 курсов – при достижении объективного ответа.
Слайд 56Паллиативное лечение
Наиболее частым симптомом является дисфагия. Устранение ее достигается различными подходами:
эндоскопическими
процедурами (баллонная дилатация, электро-, аргонно-плазменная или лазерная деструкция, фотодинамическая терапия),
дистанционной или брахитерапией,
постановкой внутрипросветных стентов.
Эндоскопические процедуры дают быстрый, но кратковременный эффект и подходят в случаях, когда в ближайшее время будет начато эффективное лечение.
Если излечение больного невозможно, то оптимально проведение брахитерапия, стентирования пищевода или дистанционной лучевой терапии.
В случае развития пищеводно-бронхиальных или медиастинальных свищей постановка покрытых стентов позволяет купировать данные осложнения у 70‑100 % больных.
дистанционной или брахитерапией,
постановкой внутрипросветных стентов.
Эндоскопические процедуры дают быстрый, но кратковременный эффект и подходят в случаях, когда в ближайшее время будет начато эффективное лечение.
Если излечение больного невозможно, то оптимально проведение брахитерапия, стентирования пищевода или дистанционной лучевой терапии.
В случае развития пищеводно-бронхиальных или медиастинальных свищей постановка покрытых стентов позволяет купировать данные осложнения у 70‑100 % больных.
Слайд 59Список литературы:
Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии.
Версия 2015
Онкология: Учебник для студентов медицинских вузов. – 2-е изд.; испр. и доп. – М.: ООО «Медицинское информационное агенство», 2006. – 488 с.: ил.
«Химиотерапия злокачественной новообразований» Пер. с англ. – М., «Практика», 2009. – 455 с.
Приказ Минздрава РБ от 11.03.2012 № 258 утверждены «Алгоритмы диагностики и лечения злокачественных новообразований». Ганцев Ш.Х.
Левченко Е.В. и соавт. Опыт использования внутрипросветной брахитерапии в комплексном лечении рака пищевода. Ж. «Злокачественные новообразования» XVI Российский онкологический конгресс.
Рудык Ю.В. И соавт. Эффективность комбинированного лечения больных раком пищевода с применением неоадъювантной химиотерапей. Сибирский онкологический журнал. 2013. №4 (58).
Юсупов А.М., Арыбжанов Д.Т., Колдыбаева Ш.А. Предоперационная регионарная химиотерапия в комплексном лечении больных раком пищевода. Тюменский медицинский журнал № 3-4, 2011.
Тобохов А.В., Слепцов К.Н., Неустроев П.А., Николаев В.Н. Комплексный подход в лечении рака пищевода. Бюллетень ВСНЦ СО РАМН, 2012, №4 (86), Часть 1.
Е.Ш. Абзалбек. Отдаленные результаты мультимодальной терапии рака пищевода. Вестник КРСУ. 2013. Том 13. № 12.
Борисов В.А., Шинкарев С.А., Ильин Н.В., Флоровская Н.А. Лучевая терапия рака пищевода на основе применения электромагнитной гипертермии. Медицинская радиология и радиационная безопасность, 2010, Том 55, № 5.
Луд А.Н. Значение молекулярно-биологических маркеров при раке желудка и пищевода. Российский биотерапевтический журнал. №3. Том 6. 2007
Онкология: Учебник для студентов медицинских вузов. – 2-е изд.; испр. и доп. – М.: ООО «Медицинское информационное агенство», 2006. – 488 с.: ил.
«Химиотерапия злокачественной новообразований» Пер. с англ. – М., «Практика», 2009. – 455 с.
Приказ Минздрава РБ от 11.03.2012 № 258 утверждены «Алгоритмы диагностики и лечения злокачественных новообразований». Ганцев Ш.Х.
Левченко Е.В. и соавт. Опыт использования внутрипросветной брахитерапии в комплексном лечении рака пищевода. Ж. «Злокачественные новообразования» XVI Российский онкологический конгресс.
Рудык Ю.В. И соавт. Эффективность комбинированного лечения больных раком пищевода с применением неоадъювантной химиотерапей. Сибирский онкологический журнал. 2013. №4 (58).
Юсупов А.М., Арыбжанов Д.Т., Колдыбаева Ш.А. Предоперационная регионарная химиотерапия в комплексном лечении больных раком пищевода. Тюменский медицинский журнал № 3-4, 2011.
Тобохов А.В., Слепцов К.Н., Неустроев П.А., Николаев В.Н. Комплексный подход в лечении рака пищевода. Бюллетень ВСНЦ СО РАМН, 2012, №4 (86), Часть 1.
Е.Ш. Абзалбек. Отдаленные результаты мультимодальной терапии рака пищевода. Вестник КРСУ. 2013. Том 13. № 12.
Борисов В.А., Шинкарев С.А., Ильин Н.В., Флоровская Н.А. Лучевая терапия рака пищевода на основе применения электромагнитной гипертермии. Медицинская радиология и радиационная безопасность, 2010, Том 55, № 5.
Луд А.Н. Значение молекулярно-биологических маркеров при раке желудка и пищевода. Российский биотерапевтический журнал. №3. Том 6. 2007