- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Испытания на подлинность препаратов органической природы презентация
Содержание
- 1. Испытания на подлинность препаратов органической природы
- 2. Общие химические реакции Реакции нитрования
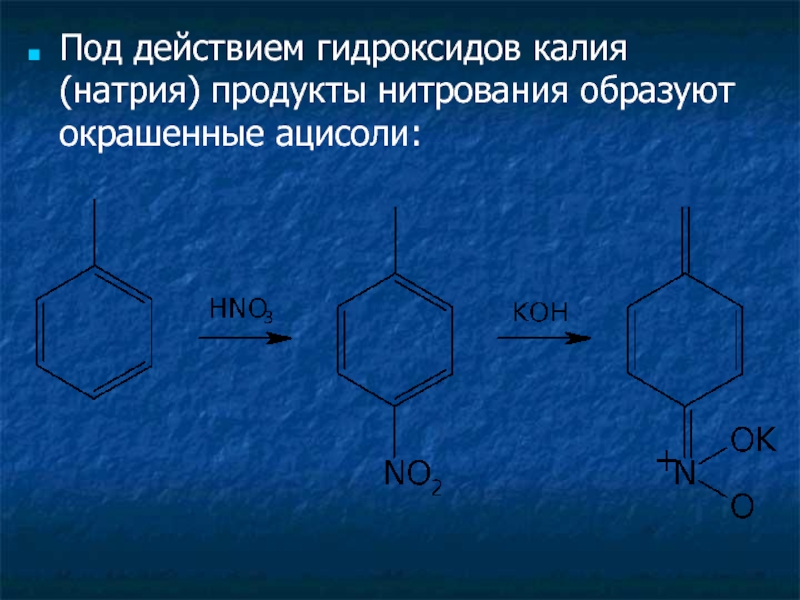
- 3. Под действием гидроксидов калия (натрия) продукты нитрования образуют окрашенные ацисоли:
- 4. Реакции нитрозирования приводят к образованию окрашенных, флюоресцирующих или имеющих стабильную температуру плавления нитрозосоединений:
- 5. Фенолы образуют нитрозосоединения, бесцветные или окрашенные в
- 6. Реакции диазотирования и азосочетания используют для идентификации
- 7. Азосочетание с фенолами (нафтолами) происходит в
- 8. Реакцию азосочетания используют также для идентификации сложных
- 9. Реакции галогенирования (бромирования и иодирования) по типу
- 11. Аналогично происходит процесс образования трииодпроизводных. При наличии
- 12. Реакции дегалогенирования можно выполнять без предварительной минерализации
- 13. Реакции конденсации альдегидов и кетонов с первичными
- 14. Кетопроизводные образуют гидразоны: >C=O + H2N–NH–R →
- 15. Реакции окислительной конденсации с участием альдегидов лежат
- 17. Реакции этерификации, ацилирования и гидролиза. Для подтверждения
- 18. Образовавшиеся в результате этерификации, ацилирования, гидролиза продукты
- 19. Общим способом испытаний ЛВ, содержащих в молекуле
- 21. Реакции разложения амидов происходят при нагревании в
- 22. Указанные химические реакции используют для испытания подлинности
- 23. Реакции окисления-восстановления Процесс гидрирования осуществляют, как
- 24. Широко используются в фармацевтическом анализе реакции окисления.
- 25. Реакция окисления альдегидов лежит в основе использования
- 26. Реакции образования солей и комплексных соединений
- 27. Нерастворимые в воде или окрашенные соли, и
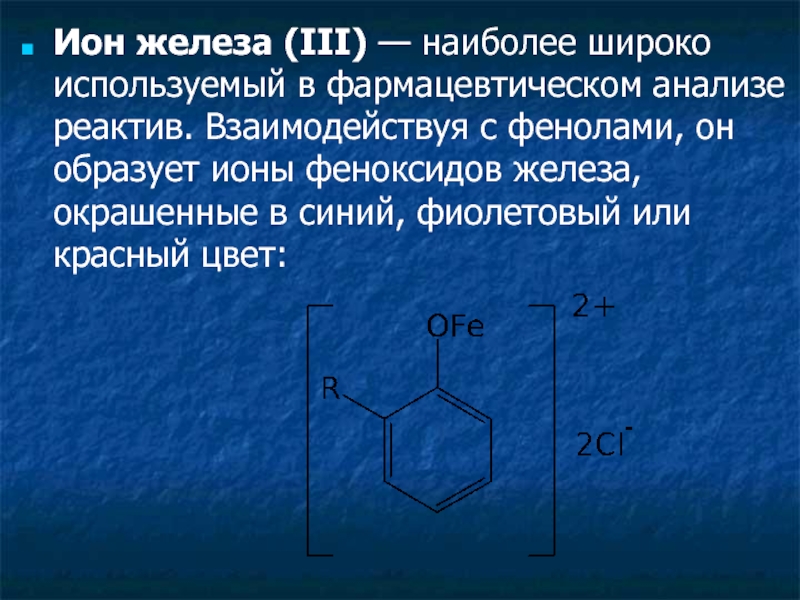
- 28. Ион железа (III) — наиболее широко используемый
- 29. Окрашенные комплексы с ионами железа (III) образуют
- 30. (рН
- 31. Ионы железа (III) образуют окрашенные в красный
- 32. Окрашенные комплексные соли образуют с ионами железа
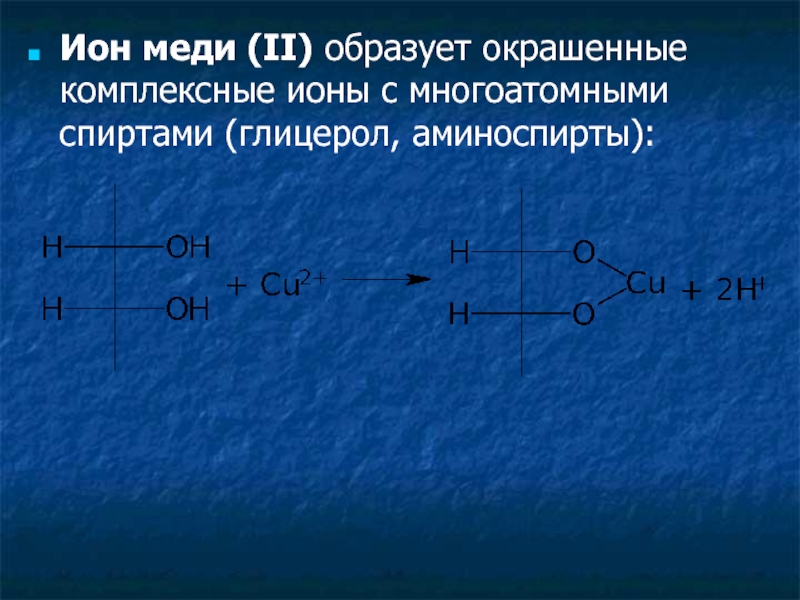
- 33. Ион меди (II) образует окрашенные комплексные ионы с многоатомными спиртами (глицерол, аминоспирты):
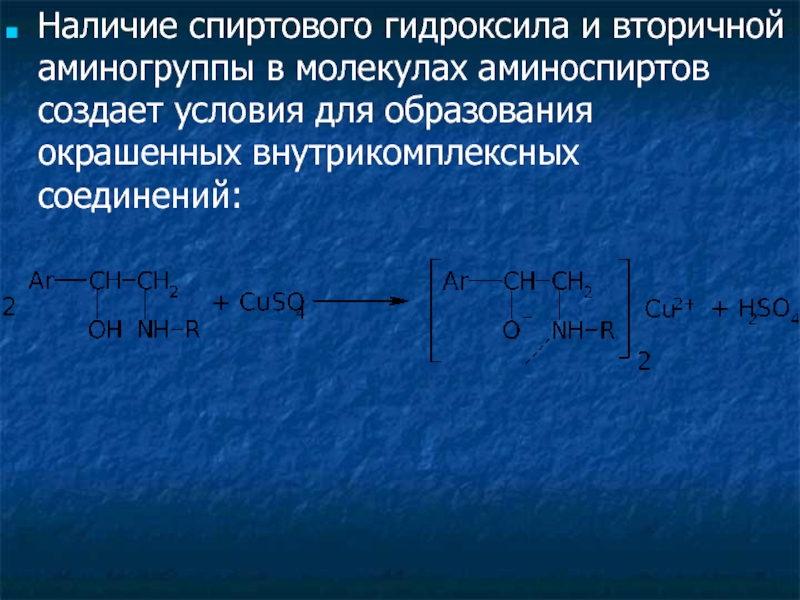
- 34. Наличие спиртового гидроксила и вторичной аминогруппы в
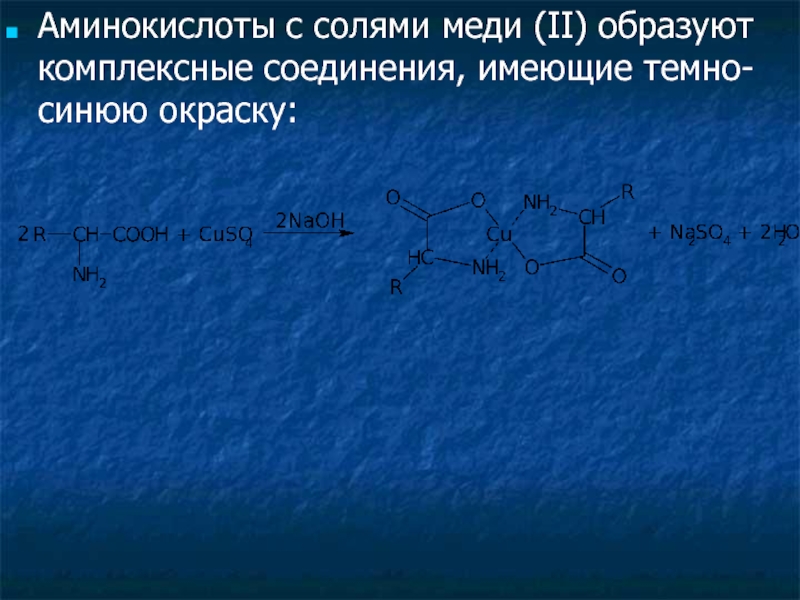
- 35. Аминокислоты с солями меди (II) образуют комплексные соединения, имеющие темно-синюю окраску:
- 36. Идентификация органических оснований и их солей
- 37. Органические азотсодержащие основания и их соли, в
- 38. Для идентификации органических оснований и их солей
- 39. Идентификация элементорганических лекарственных веществ Поскольку атомы
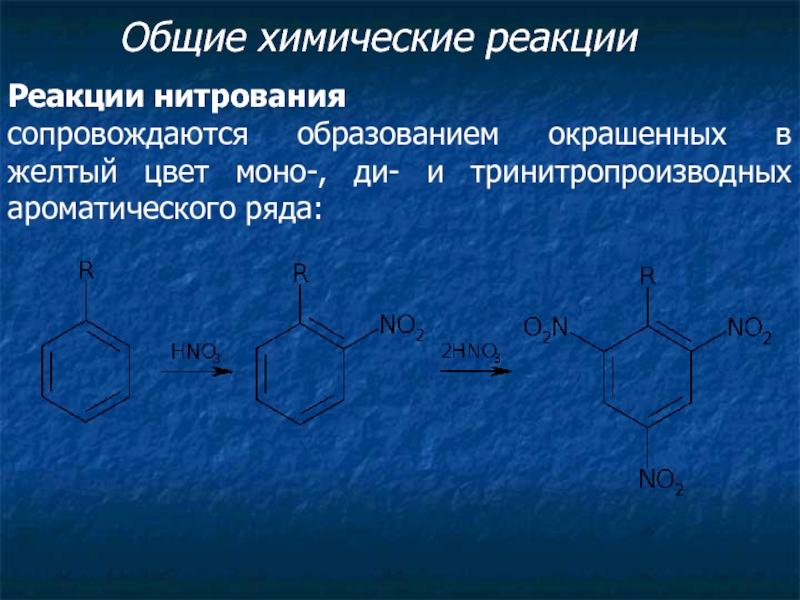
Слайд 2Общие химические реакции
Реакции нитрования
сопровождаются образованием окрашенных в желтый цвет моно-,
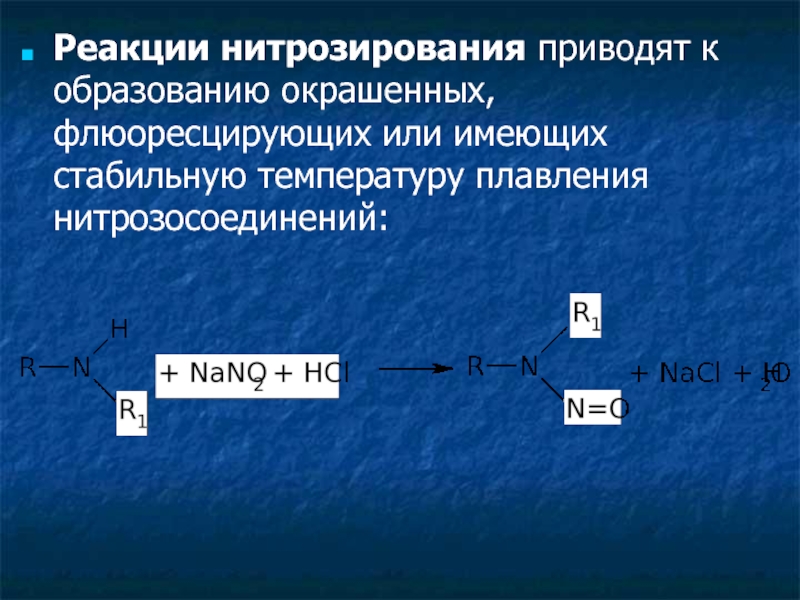
Слайд 4Реакции нитрозирования приводят к образованию окрашенных, флюоресцирующих или имеющих стабильную температуру
Слайд 5Фенолы образуют нитрозосоединения, бесцветные или окрашенные в сине-зеленый (фенол), сине-фиолетовый (резорцин)
Слайд 6Реакции диазотирования и азосочетания используют для идентификации производных первичных ароматических аминов
1. Диазотирование (получение соли диазония):
Ar — NH2 + NaNO2 + 2HCl → [Ar — N+≡N]Cl– + NaCl + 2H2O
2. Азосочетание (взаимодействие соли диазония с фенолом или ароматическим амином). Сочетание происходит в орто- или пара-положениях по отношению к гидроксильной или аминогруппе, но идет легче в пара-положении:
Слайд 7
Азосочетание с фенолами (нафтолами) происходит в слабощелочной (pH 9,0-10,0), а с
Слайд 8Реакцию азосочетания используют также для идентификации сложных эфиров фенолов, ацилированных первичных
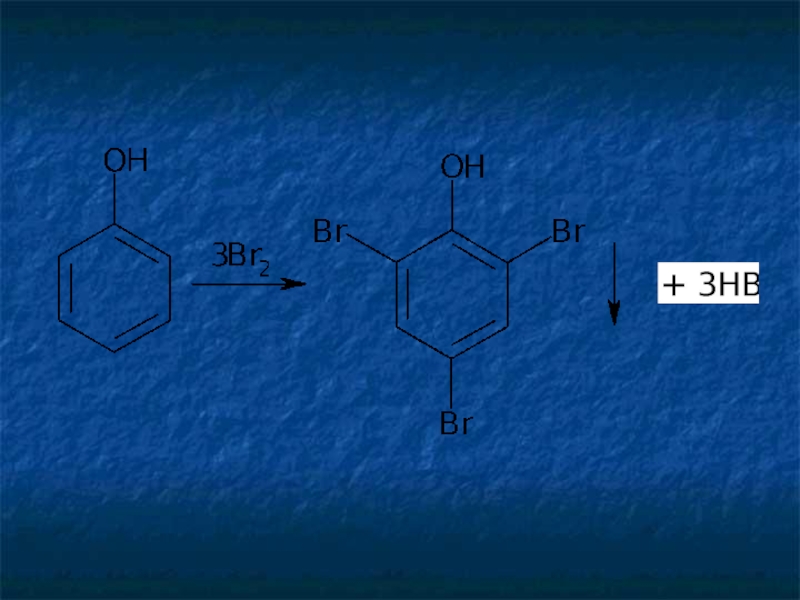
Слайд 9Реакции галогенирования (бромирования и иодирования) по типу реакции электрофильного замещения используют
Слайд 11Аналогично происходит процесс образования трииодпроизводных. При наличии в молекулах фенола и
Слайд 12Реакции дегалогенирования можно выполнять без предварительной минерализации (если галогены связаны с
R–CH2–Hal + AgNO3 → AgHal↓ + R–CH2–ONO2
Дегалогенируют также, используя щелочное отщепление, путем нагревания галогенпроизводного в присутствии цинковой пыли (бромкамфора) или в спиртовом растворе гидроксида натрия:
R–CH2Hal + NaOH → NaHal + R–CH2OH
Затем обнаруживают галогенид-ион.
Слайд 13Реакции конденсации альдегидов и кетонов с первичными аминами, гидроксиламином, гидразинами используются
R–CОН + H2N–R1 → R–CH=N-R1 + H2O
Альдегиды, конденсируясь с первичными аминами, образуют окрашенные в желтый, красный или оранжевый цвет соли оснований Шиффа:
R1–CОН + [H3N+–R2]Cl– → [R1–CH=N+H–R2] Cl– + H2O
Эта реакция лежит в основе лигниновой пробы на первичные ароматические амины, которые взаимодействуют с лигнинами, содержащимися в бумаге.
Слайд 14 Кетопроизводные образуют гидразоны:
>C=O + H2N–NH–R → >C=N–NH–R↓ + H2O
и кетоксимы:
>C=O +
Гидразоны и кетоксимы — белые или окрашенные нерастворимые в воде соединения со стабильной температурой плавления. По этим признакам можно идентифицировать исходные для их получения соединения.
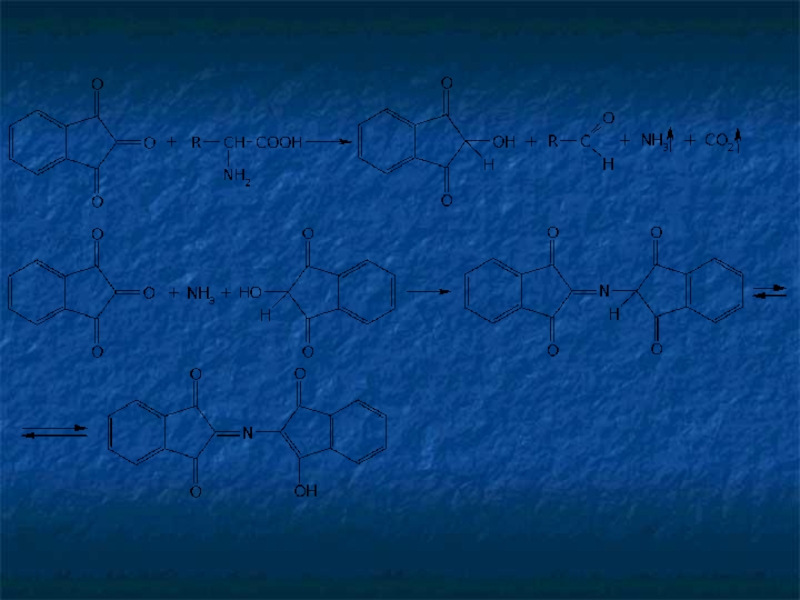
Слайд 15Реакции окислительной конденсации с участием альдегидов лежат в основе таких широко
Нингидриновая реакция является общей для α-аминокислот, иминокислот, полипептидов. Нингидрин (1,2,3-трикетогидринденгидрат) образует с аммиаком, выделившимся из этих соединений, продукт конденсации — ион дикетогидриндилидендикетогидрамина, имеющий сине-фиолетовое окрашивание:
Слайд 17Реакции этерификации, ацилирования и гидролиза. Для подтверждения подлинности спиртов и карбоновых
R1–OH + R2–COOH ⇄ R2–COOR1 + H2O
Этерификацию проводят в присутствии дегидратирующих веществ (концентрированная серная кислота), а гидролиз — в кислой или щелочной среде.
Сходен с этерификацией процесс ацилирования (особенно ацетилирования) аминопроизводных:
R1–NH2 + R2–COOH ⇄ R1–NH–CO–R2 + H2O
а также обратный процесс — гидролиз ацильных производных.
Слайд 18Образовавшиеся в результате этерификации, ацилирования, гидролиза продукты идентифицируют по аналитическому эффекту
Очень широко используют, например, реакцию образования этилацетата, имеющего своеобразный фруктовый запах. Этилацетат образуют органические соединения, выделяющие при гидролизе этанол и уксусную кислоту.
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
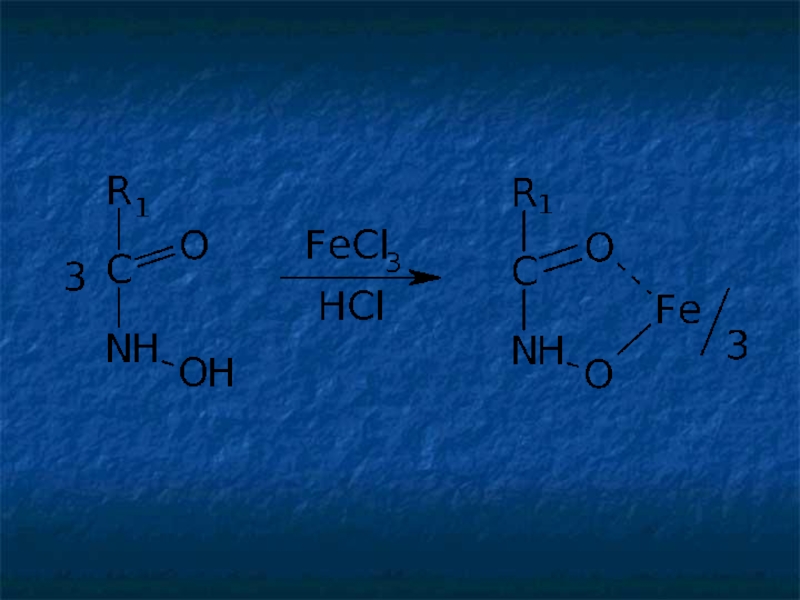
Слайд 19Общим способом испытаний ЛВ, содержащих в молекуле сложноэфирную, лактонную, лактамную, амидную,
R1–COO–R2 + NH2OH → R1–CO–NH–OH + R2–OH
Гидроксамовые кислоты, взаимодействуя с ионами железа (III) или меди (II), образуют окрашенные соли:
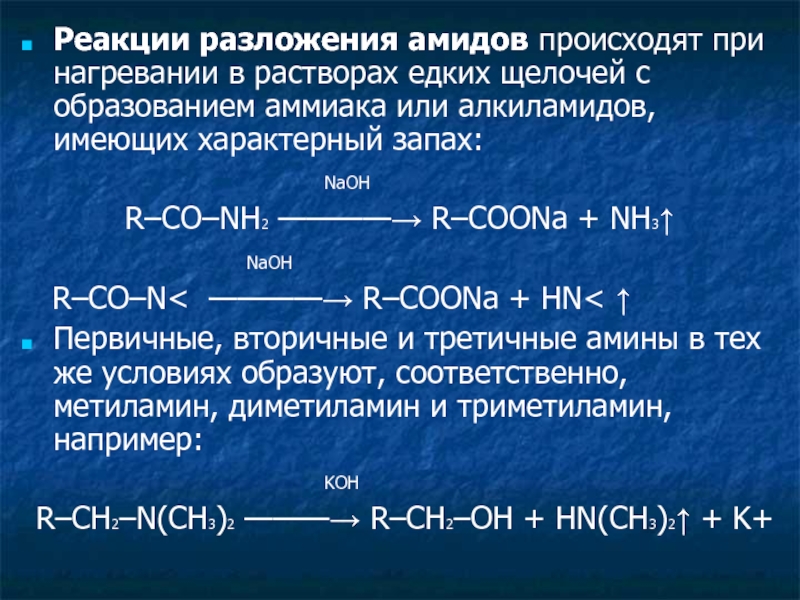
Слайд 21Реакции разложения амидов происходят при нагревании в растворах едких щелочей с
NaOH
R–CO–NH2 ————→ R–COONa + NH3↑
NaOH
R–CO–N< ————→ R–COONa + HN< ↑
Первичные, вторичные и третичные амины в тех же условиях образуют, соответственно, метиламин, диметиламин и триметиламин, например:
KOH
R–CH2–N(CH3)2 ———→ R–CH2–OH + HN(CH3)2↑ + K+
Слайд 22Указанные химические реакции используют для испытания подлинности солей первичных аммониевых оснований,
Ациклические и циклические уреиды, алкилуреиды сульфокислот, производные гуанидина и семикарбазона, имеющие в молекуле уреидную группу, гидролизуются в щелочной среде с образованием аммиака. Например, уреиды:
3NaOH
R–CO–NH–CO–NH2 ————→ 2NH3↑ + Na2CO3 + R–COONa
Слайд 23Реакции окисления-восстановления
Процесс гидрирования осуществляют, как правило, водородом в момент выделения
[H] [H]
–СН=СН– → –СН2–СН2– ; R–NO2 ⎯→ R–NH2
Слайд 24Широко используются в фармацевтическом анализе реакции окисления. Первичные спирты идентифицируют последовательно
[O] [O]
R–CH2OH ⎯→ R–COH ⎯→ R–COOH
Так, например, восстановительные свойства альдегидов устанавливают с помощью реакции образования «серебряного зеркала»:
R–CОН + 2[Ag(NH3)2]OH → 2Ag↓ + RCOOH + 4NH3↑ + H2O
Этот же процесс лежит в основе взаимодействия реактива Несслера с альдегидами:
R–CОН + K2HgI4 + 3KOH → R–COOK + 4KI + Hg↓ + 2H2O
Слайд 25Реакция окисления альдегидов лежит в основе использования реактива Фелинга, представляющего собой
Слайд 26Реакции образования солей и комплексных соединений
Соли органических кислот идентифицируют по наличию
Широко пользуются при испытаниях на подлинность реакцией нейтрализации натриевых (калиевых) солей органических кислот (бензойной, салициловой и др.):
R–COONa + HCl → R–COOH↓ + NaCl
Нерастворимые в воде кислоты при этом осаждаются, и их идентифицируют по температуре плавления.
Слайд 27Нерастворимые в воде или окрашенные соли, и комплексные соединения образуют с
Меркаптаны с солями этих металлов (М) образуют меркаптиды:
R–SH + MX → R–SM + HX
Слайд 28Ион железа (III) — наиболее широко используемый в фармацевтическом анализе реактив.
Слайд 29Окрашенные комплексы с ионами железа (III) образуют практически все органические соединения,
Различную окраску в зависимости от pH среды имеют комплексные соединения иона железа (III) и салицилат-иона:
Слайд 30
(рН 1) (рН 2.5) (рН
фиолетовая красная желтая
Структура этих комплексов обусловлена наличием у салицилат-иона не только фенольного гидроксила, но и карбоксильной группы.
Слайд 31Ионы железа (III) образуют окрашенные в красный цвет соли с ацетат-ионом:
3FeCl3
а с бензоат-ионом — бензоат железа (розовато-желтый осадок):
Слайд 32Окрашенные комплексные соли образуют с ионами железа (III) также глюконат-, аминосалицилат-ионы,
Слайд 33Ион меди (II) образует окрашенные комплексные ионы с многоатомными спиртами (глицерол,
Слайд 34Наличие спиртового гидроксила и вторичной аминогруппы в молекулах аминоспиртов создает условия
Слайд 35Аминокислоты с солями меди (II) образуют комплексные соединения, имеющие темно-синюю окраску:
Слайд 36Идентификация органических оснований и их солей
Общим испытанием на соли органических оснований
[R≡N]HA + NaOH → R≡N↓ + NaA + H2O
Затем основание можно идентифицировать по температуре плавления или с помощью цветных реакций.
























![Идентификация органических оснований и их солей Общим испытанием на соли органических оснований [R≡N]HA с неорганическими](/img/tmb/2/150544/f73b126a0387bfa17334511c8839bf60-800x.jpg)