- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Свойства, строение, медико-биологическая значимость презентация
Содержание
- 1. Ферменты. Свойства, строение, медико-биологическая значимость
- 2. История вопроса о ферментах Термин фермент предложен в XVII
- 3. История вопроса о ферментах Через два года
- 4. История вопроса о ферментах Каталитическая активность РНК
- 5. Ферменты или энзимы (от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или
- 6. Наука о ферментах называется энзимологией, а
- 7. Классификация ферментов По типу катализируемых реакций ферменты
- 8. КФ1: Оксидоредуктазы, катализируют перенос электронов, то есть
- 9. КФ 2: Трансферазы Катализируют перенос химических групп с
- 10. КФ 3: Гидролазы Катализируют гидролиз химических связей. Это класс ферментов,
- 11. КФ 4: Лиазы Отдельный класс ферментов, катализирующих реакции негидролитического
- 12. КФ 5: Изомеразы Ферменты, катализирующие структурные превращения изомеров (рацемизация или эпимеризация).
- 13. КФ 5: Изомеразы Если рассматривать все подклассы, то изомеразы
- 14. КФ 6: Лигазы Ферменты, катализирующие соединение двух молекул с образованием
- 15. Лигазы в генной инженерии Иными словами, ДНК-лигазы
- 16. Информация о ферментах в сети Internet
- 17. Информация о ферментах в сети Internet
- 18. Информация о ферментах в сети Internet
- 19. Информация о ферментах в сети Internet
- 20. Лактатдегидрогеназа (ЛДГ) Лактатдегидрогеназа (ЛДГ; L-лактат-НАД-оксидоредуктаза, КФ 1.1.1.27)
- 21. Значимость в диагностике Клиническое значение определения активности
- 22. .Креатинкиназа (КК) Креатинкиназа-АТФ: креатин-1,4-фосфотрансфераза (КФ 2.7.3.2) —
- 23. у-Глутамилтранспептидаза ГГТ; у-глутамил-транспептидазы, КФ 2.3.2.2). ГГТ
- 24. Значение в диагностике Наиболее частая причина повышения
- 25. Амилаза Клиническое значение определения активности
Слайд 2История вопроса о ферментах
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В
кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей. Эта точка зрения господствовала в науке в течение длительного времени[3] и шла вразрез с господствовавшей тогда теорией брожения Ю. Либиха, согласно которой все процессы брожения представлялись чисто химическими явлениями каталитического характера (будто бы спиртовое брожение происходит вследствие того, что молекулярные колебания разлагающихся частиц дрожжей передаются сахару и сахар начинает распадаться на спирт и углекислый газ; таким образом дрожжи вызывают брожение не при жизни, а только после своей смерти)[4].
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей. Эта точка зрения господствовала в науке в течение длительного времени[3] и шла вразрез с господствовавшей тогда теорией брожения Ю. Либиха, согласно которой все процессы брожения представлялись чисто химическими явлениями каталитического характера (будто бы спиртовое брожение происходит вследствие того, что молекулярные колебания разлагающихся частиц дрожжей передаются сахару и сахар начинает распадаться на спирт и углекислый газ; таким образом дрожжи вызывают брожение не при жизни, а только после своей смерти)[4].
Слайд 3История вопроса о ферментах
Через два года после смерти Л. Пастера в 1897
году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Слайд 4История вопроса о ферментах
Каталитическая активность РНК впервые была обнаружена в 1980-е
годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК
Слайд 5Ферменты или энзимы
(от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические
реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (например, АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Слайд 6
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни
слов латинского и греческого языков).
Слайд 7Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно
иерархической классификации ферментов (КФ, EC — Enzyme Comission code).
Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза
Второе число в наименовании фермента отражает подкласс, третье — подподкласс, а четвёртая — порядковый номер фермента в его подподклассе.
Все ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза
Второе число в наименовании фермента отражает подкласс, третье — подподкласс, а четвёртая — порядковый номер фермента в его подподклассе.
Все ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Слайд 8КФ1: Оксидоредуктазы, катализируют перенос электронов, то есть окисление или восстановление.
Систематические
названия ферментов класса образуются по схеме «донор:акцептор + оксидоредуктаза».
Однако широко используются и другие схемы именования. Когда возможно, ферменты называют в виде «донор + дегидрогеназа», например глицеральдегид-3-фосфатдегидрогеназа, алкогольдегидрогеназа
Иногда название записывается как «акцептор + редуктаза», например НАД+-редуктаза.
В частном случае, когда окислителем является кислород, название может быть в виде «донор + оксидаза».
Однако широко используются и другие схемы именования. Когда возможно, ферменты называют в виде «донор + дегидрогеназа», например глицеральдегид-3-фосфатдегидрогеназа, алкогольдегидрогеназа
Иногда название записывается как «акцептор + редуктаза», например НАД+-редуктаза.
В частном случае, когда окислителем является кислород, название может быть в виде «донор + оксидаза».
Слайд 9КФ 2: Трансферазы
Катализируют перенос химических групп с одной молекулы субстрата на другую.
Среди трансфераз
особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
Примеры:
Карнитин-О-пальмитоилтрансфераза (КФ 2.3.1.21) -катализирует перенос ацильной группы с молекулы ацил-КоА на молекулу карнитина (с образованием ацилированного карнитина — карнитин-СOR (где R — остаток жирных кислот, в частности пальмитоил) и молекула кофермента А (КоА-SH)) и обратно.
Относится к интегральным белкам, располагается на внешней стороне внешней мембраны (на цитоплазматической стороне) и внутренней стороне внутренней мембраны митохондрий (на стороне матрикса). Является неотъемлемой частью карнитиновой транспортной системы. Имеет несколько различных форм. Участвует в деградации жирных кислот
Примеры:
Карнитин-О-пальмитоилтрансфераза (КФ 2.3.1.21) -катализирует перенос ацильной группы с молекулы ацил-КоА на молекулу карнитина (с образованием ацилированного карнитина — карнитин-СOR (где R — остаток жирных кислот, в частности пальмитоил) и молекула кофермента А (КоА-SH)) и обратно.
Относится к интегральным белкам, располагается на внешней стороне внешней мембраны (на цитоплазматической стороне) и внутренней стороне внутренней мембраны митохондрий (на стороне матрикса). Является неотъемлемой частью карнитиновой транспортной системы. Имеет несколько различных форм. Участвует в деградации жирных кислот
Слайд 10КФ 3: Гидролазы
Катализируют гидролиз химических связей.
Это класс ферментов, катализирующий гидролиз ковалентной связи. Общий вид реакции, катализируемой гидролазой
выглядит следующим образом:
A–B + H2O → A–OH + B–H
Пример, Уреаза (от греч. ούρον — моча и -аза — стандартный аффикс биохимической номенклатуры, указывающий на принадлежность вещества к классу ферментов) — гидролитический фермент из группы амидаз, обладающий специфическим свойством катализировать гидролиз мочевины до диоксида углерода и аммиака:
CO(NH2)2 + H2O → CO2 + 2NH3
Уреаза обнаружена в бактериях (например, у уробактерий), дрожжах, растениях (особенно много её содержится в семенах сои), а также у ряда беспозвоночных; в клетках животных, у которых в качестве основного продукта азотистого обмена образуется мочевина, уреаза отсутствует. В организме человека и животных уреаза образуется бактериальной флорой.
В 1926 году американский биохимик Джеймс Самнер доказал, что уреаза это белок.
A–B + H2O → A–OH + B–H
Пример, Уреаза (от греч. ούρον — моча и -аза — стандартный аффикс биохимической номенклатуры, указывающий на принадлежность вещества к классу ферментов) — гидролитический фермент из группы амидаз, обладающий специфическим свойством катализировать гидролиз мочевины до диоксида углерода и аммиака:
CO(NH2)2 + H2O → CO2 + 2NH3
Уреаза обнаружена в бактериях (например, у уробактерий), дрожжах, растениях (особенно много её содержится в семенах сои), а также у ряда беспозвоночных; в клетках животных, у которых в качестве основного продукта азотистого обмена образуется мочевина, уреаза отсутствует. В организме человека и животных уреаза образуется бактериальной флорой.
В 1926 году американский биохимик Джеймс Самнер доказал, что уреаза это белок.
Молекулярная модель уреазы бактерии Helicobacter pylori
Слайд 11КФ 4: Лиазы
Отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических
связей (C—C, C—O, C—N, C—S, P—O и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.
Пример, ферменты, расщепляющие фосфор-кислородные связи, например, аденилатциклаза.
Этот фермент (КФ 4.6.1.1) — катализирует превращение АТФ в 3',5'-цАМФ (циклическую форму АМФ) с образованием пирофосфата.
Пример, ферменты, расщепляющие фосфор-кислородные связи, например, аденилатциклаза.
Этот фермент (КФ 4.6.1.1) — катализирует превращение АТФ в 3',5'-цАМФ (циклическую форму АМФ) с образованием пирофосфата.
Слайд 12КФ 5: Изомеразы
Ферменты, катализирующие структурные превращения изомеров (рацемизация или эпимеризация).
Изомеразы – ферменты, катализирующие изомерные превращения
в пределах одной молекулы.
Изомеразы – сложные ферменты
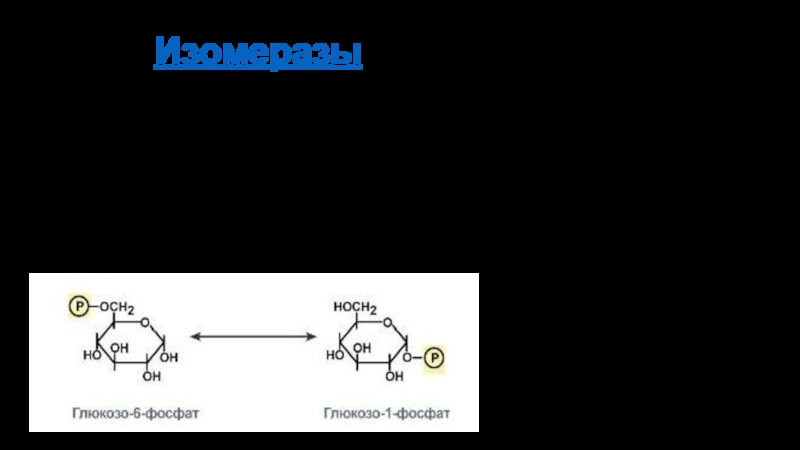
Пример, α-D-глюкозо-1,6-фосфомутаза
Изомеразы – сложные ферменты
Пример, α-D-глюкозо-1,6-фосфомутаза
Слайд 13КФ 5: Изомеразы
Если рассматривать все подклассы, то изомеразы делятся по типу изомеризации на:
рацемазы и эпимеразы.
Рацемазы отвечают за взаимопревращения L- и D-изомеров, S- и R-изомеров.
Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение α- и β-изомеров, превращения рибулоза↔ксилулоза, галактоза↔глюкоза, манноза↔галактоза; цис-транс изомеразы; внутримолекулярные оксидоредуктазы; внутримолекулярные трансферазы – мутазы; внутримолекулярные лиазы.
Рацемазы отвечают за взаимопревращения L- и D-изомеров, S- и R-изомеров.
Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение α- и β-изомеров, превращения рибулоза↔ксилулоза, галактоза↔глюкоза, манноза↔галактоза; цис-транс изомеразы; внутримолекулярные оксидоредуктазы; внутримолекулярные трансферазы – мутазы; внутримолекулярные лиазы.
Слайд 14КФ 6: Лигазы
Ферменты, катализирующие соединение двух молекул с образованием новой химической связи (лигирование).
При
этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
Пример, ДНК-лигазы — ферменты (EC 6.5.1.1), катализирующие ковалентное сшивание цепей ДНК в дуплексе при репликации, репарации и рекомбинации.
Они образуют фосфодиэфирные мостики между 5'-фосфорильной и 3'-гидроксильной группами соседних дезоксинуклеотидов в местах разрыва ДНК или между двумя молекулами ДНК.
Для образования этих мостиков лигазы используют энергию гидролиза пирофосфорильной связи АТФ.
Один из самых распространённых коммерчески доступных ферментов — ДНК-лигаза бактериофага Т4.
Пример, ДНК-лигазы — ферменты (EC 6.5.1.1), катализирующие ковалентное сшивание цепей ДНК в дуплексе при репликации, репарации и рекомбинации.
Они образуют фосфодиэфирные мостики между 5'-фосфорильной и 3'-гидроксильной группами соседних дезоксинуклеотидов в местах разрыва ДНК или между двумя молекулами ДНК.
Для образования этих мостиков лигазы используют энергию гидролиза пирофосфорильной связи АТФ.
Один из самых распространённых коммерчески доступных ферментов — ДНК-лигаза бактериофага Т4.
Слайд 15Лигазы в генной инженерии
Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя
связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК.
В генной инженерии используются 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+.
Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
В генной инженерии используются 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+.
Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
Слайд 20Лактатдегидрогеназа (ЛДГ)
Лактатдегидрогеназа (ЛДГ; L-лактат-НАД-оксидоредуктаза, КФ 1.1.1.27) - цинксодержаший фермент, катализирует обратимую
реакцию восстановления пировиноградной кислоты в молочную кислоту при участии НАД-Н2.
Фермент в кристаллической форме был получен из мышцы сердца. Подобным же образом были получены кристаллические ферментные препараты из скелетных мышц и печени. При рН 7,0 равновесие реакции смещено в сторону образования лактата, в щелочной среде реакция проходит в обратном направлении. ЛДГ может также реагировать с НАДФ в качестве кофермента, но значительно медленнее, чем с НАД.
Слайд 21Значимость в диагностике
Клиническое значение определения активности ЛДГ
Активность ЛДГ в сыворотке крови
повышается при многих патологических состояниях, поэтому для дифференциальной диагностики заболеваний более целесообразно исследовать изменения спектра изоферментов ЛДГ.
В настоящее время накоплено большое количество данных о распределении изоферментов ЛДГ в тканях и об изменении спектра изоферментов ЛДГ в сыворотке крови при различных заболеваниях. Изоферментный спектр скелетной мускулатуры показывает преобладание ЛДГ5.
При мышечной дистрофии отмечены увеличение более подвижных изоферментов ЛДГ и снижение активности ЛДГ5, что характерно и для многих нейромышечных заболеваний.
В настоящее время накоплено большое количество данных о распределении изоферментов ЛДГ в тканях и об изменении спектра изоферментов ЛДГ в сыворотке крови при различных заболеваниях. Изоферментный спектр скелетной мускулатуры показывает преобладание ЛДГ5.
При мышечной дистрофии отмечены увеличение более подвижных изоферментов ЛДГ и снижение активности ЛДГ5, что характерно и для многих нейромышечных заболеваний.
Слайд 22.Креатинкиназа (КК)
Креатинкиназа-АТФ: креатин-1,4-фосфотрансфераза (КФ 2.7.3.2) — катализирует обратимый перенос фосфатного остатка
между АТФ и креатином с образованием АДФ и креатинфосфата. Общепринято сокращенное название фермента — креатинкиназа (КК). КК — цитозольный и митохондриальный фермент, который функционирует в клетках многих тканей. Продукт реакции фосфокреатин - макроэргическое соединение, обеспечивающее энергией сокращение мышцы, ее расслабление и транспорт метаболитов в миоцит. В первое время активность КК в крови интересовала клинических химиков как тест для выявления поражения поперечнополосатой мускулатуры.
В настоящее время активность КК — ведущий тест в диагностике инфаркта миокарда
В настоящее время активность КК — ведущий тест в диагностике инфаркта миокарда
Слайд 23у-Глутамилтранспептидаза
ГГТ; у-глутамил-транспептидазы, КФ 2.3.2.2).
ГГТ катализирует перенос у-глутамила на аминокислоту или пептид,
на другую молекулу субстрата или воду. ГГТ - белок, состоящий из одной полипептидной цепи с молекулярной массой 90 кДа. Фермент содержит гидрофильный и гидрофобный фрагменты. Активный центр расположен на гидрофильном участке полипептидной цепи. Гидрофобная область — часть цепи, которой фермент прикреплен к мембране. Если экстракцию фермента из тканей провести с использованием в качестве детергента желчных кислот или тритона \ Х-100, ГГТ вместе с гидрофобным участком может быть переведена в раствор. Если в экстрагирующую смесь включены только протеазы (папаин или трипсин), гидрофобный фрагмент ГГТ остается на мембране, а в растворе оказывается гидрофильная часть полипептида ГГТ.
Слайд 24Значение в диагностике
Наиболее частая причина повышения активности ГГТ в сыворотке крови
— патология печени. Слабое токсическое воздействие на печень, вызывающее жировую инфильтрацию, прием алкоголя и лекарственных препаратов сопровождаются умеренным увеличением активности ГГТ. Более выраженное повышение активности фермента связано с внепеченочной и внутрипеченочной обструкцией, вторичным вовлечением печени в онкологические процессы организма путем метастазирования. Самая высокая активность ГГТ в сыворотке крови отмечена при закупорке желчного протока или злокачественных опухолях, прямо или опосредованно поражающих печень.
Слайд 25Амилаза
Клиническое значение определения активности амилазы в сыворотке крови.
Определение активности альфа-амилазы в
сыворотке крови - наиболее распространенный тест диагностики острого панкреатита. При остром панкреатите активность фермента в сыворотке крови возрастает через 3-12 ч после болевого приступа, достигает максимума через 20—30 ч и возвращается к норме при благоприятном течении в пределах четырех дней. Активность ?-амилазы (диастазы) в моче возрастает через 6-10 ч после подъема активности в сыворотке и возвращается к норме чаще всего через три дня после подъема.
В настоящее время широко известно, что увеличение обшей активности ?-амилазы неспецифично для панкреатита и других заболеваний поджелудочной железы.