- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дифтерия и коклюш презентация
Содержание
- 1. Дифтерия и коклюш
- 2. Дифтерия Дифтерия (diphtheria; греч. diphthera кожа, пленка)
- 3. Этиология дифтерии Семейство: Corynebacteriaceae Род: Corynebacterium
- 4. Резистентность Выделяясь в окружающую
- 5. Морфология Грамм + Прямые или слегка изогнутые
- 6. По грамму C.
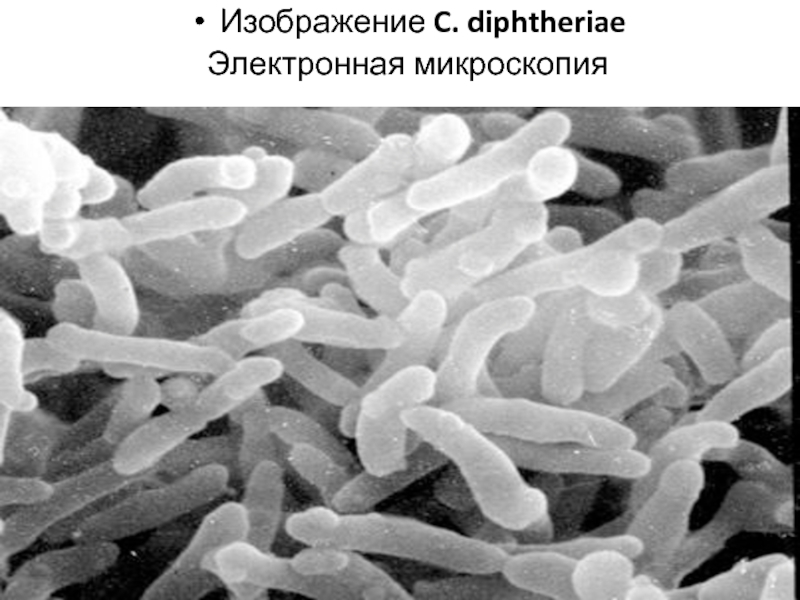
- 7. Изображение C. diphtheriae Электронная микроскопия
- 8. Факультативные анаэробы Хемоорганогетеротрофы К питательным средам требовательны:
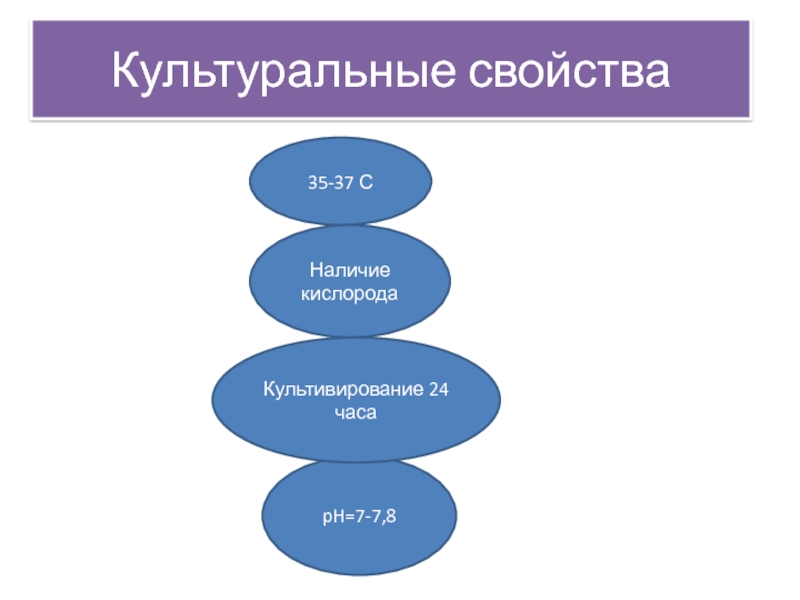
- 9. Культуральные свойства 35-37 С Наличие кислорода pH=7-7,8 Культивирование 24 часа
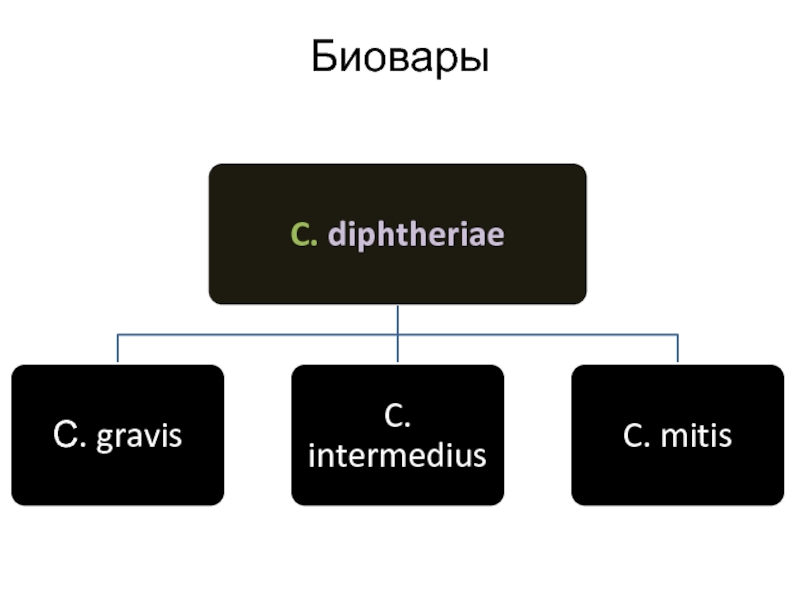
- 10. Биовары
- 12. mitis gravis intermedius
- 13. Культуральные свойства Рост на скошенном сывороточном
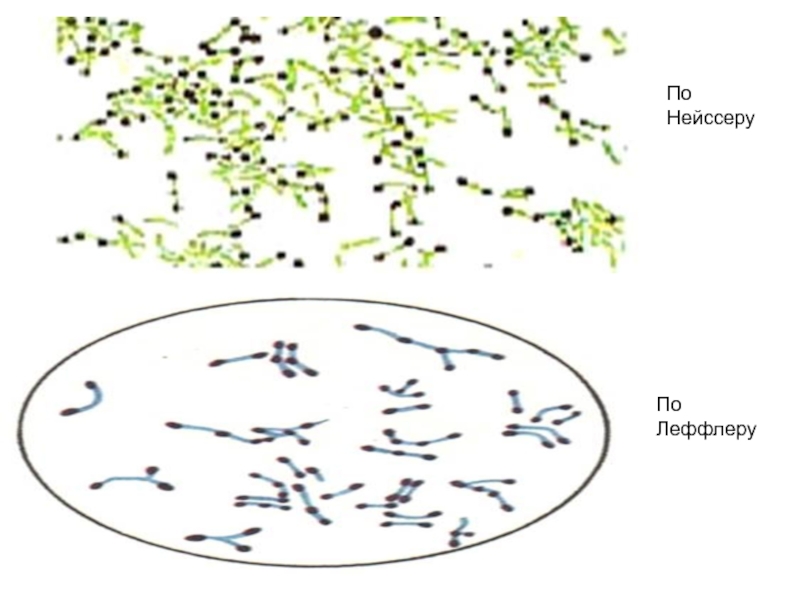
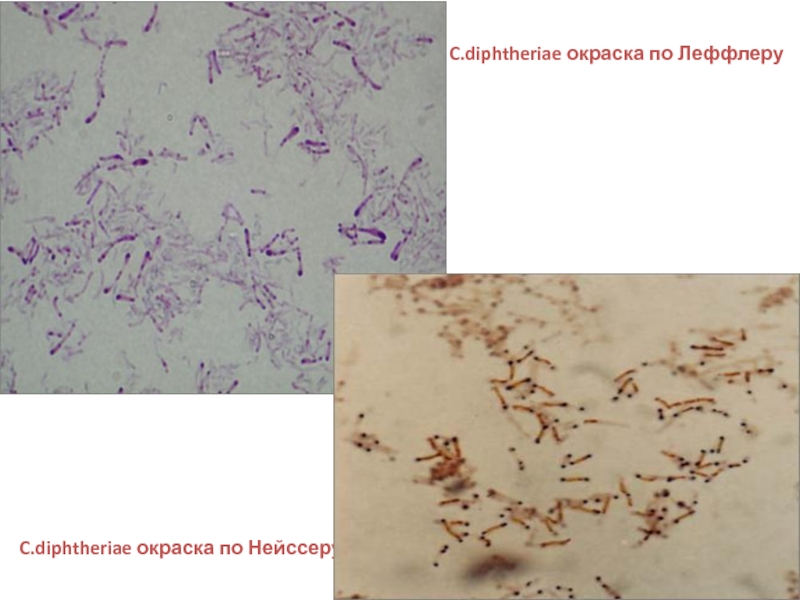
- 14. По Нейссеру По Леффлеру
- 15. C.diphtheriae окраска по Леффлеру C.diphtheriae окраска по Нейссеру
- 16. Основным фактором патогенности является экзотоксин, поражающий мышцу
- 17. Основное свойство— токсигенность — способность секретировать гистотоксин,
- 18. Биохимические свойства. Расщепляет углеводы до кислоты (глюкоза,
- 19. Антигены. С. diphtheriae имеют
- 21. Возбудитель Corinebacterium diphtheirae Входные ворота: слизистые оболочки
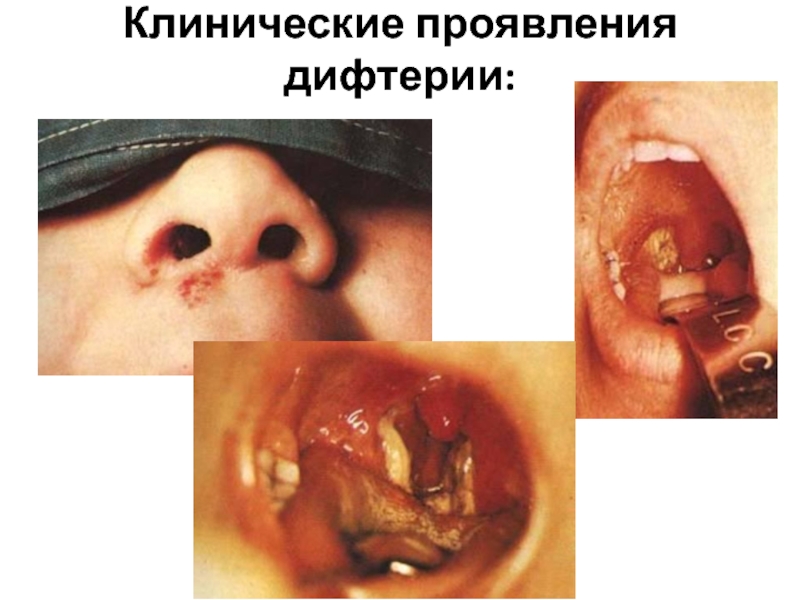
- 23. Клинические проявления дифтерии:
- 24. Источник инфекции больной человек
- 25. Путь передачи - воздушно-капельный.
- 26. Клиническая диагностика: -По наличию
- 27. Взятие и доставка материала в лабораторию.
- 28. Исследуемый материал из ротоглотки и носа берут
- 29. Лабораторная диагностика дифтерии производится с целью:
- 30. Лабораторная диагностика дифтерии Клинический материал: мазок из
- 31. Бактериологический метод 1 этап: посев клинического материала
- 32. Посев на дифтерию производят следующим образом: зев нос
- 33. Токсигенные биовары: gravis, mitis, intermedius. Нетоксигенные биовары
- 35. Биохимическая активность возбудителя дифтерии достаточно высока.
- 36. Экспресс-метод. С целью ранней диагностики используют латекс-агглютинацию,
- 37. Серологическая диагностика. Забор крови на исследования в
- 38. Иммунитет. Наиболее восприимчивыми к дифтерии являются
- 39. Действующее начало
- 40. Лечение Нейтрализация токсина путем введения противодифтерийной сыворотки
- 41. . КОКЛЮШ
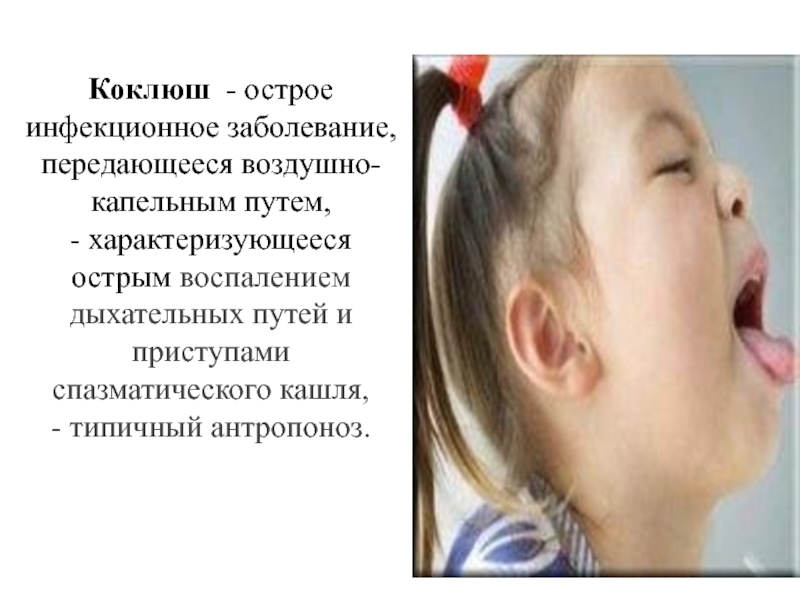
- 42. Коклюш - острое инфекционное заболевание, передающееся воздушно-капельным
- 43. Род BORDETELLA Вид BORDETELLA PERTUSSIS
- 44. Морфология Мелкая, овоидная, грам (-) палочка с
- 45. Культуральные свойства - Оптимальная t культивирования
- 46. . Тип дыхания – строгие аэробы. Биохимические
- 47. АНТИГЕНЫ В антигенном отношении неоднородна.
- 48. Патогенез коклюша контакт, внедрение, распространение. Заболевания
- 49. Коклюш - высококонтагиозное заболевание, к которому очень
- 51. Период спазматического кашля (судорожный период) развивается
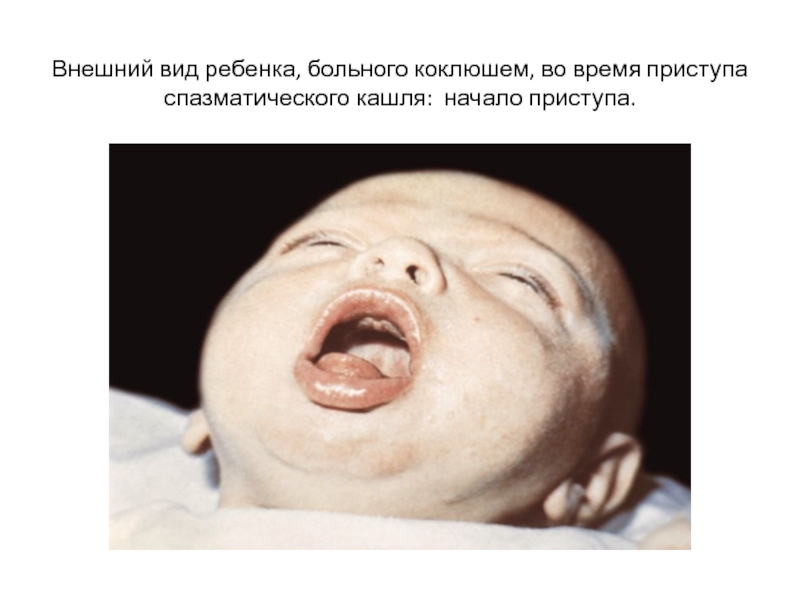
- 52. Внешний вид ребенка, больного коклюшем, во время приступа спазматического кашля: начало приступа.
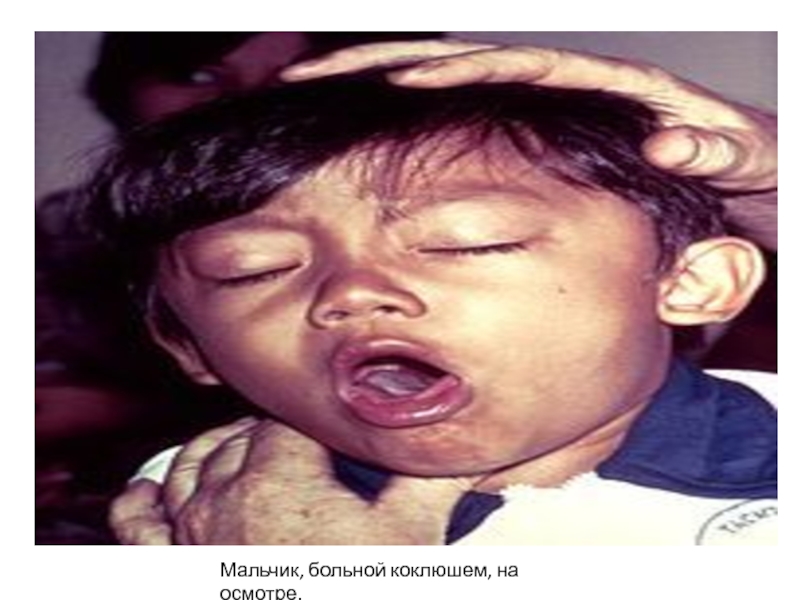
- 53. Мальчик, больной коклюшем, на осмотре.
- 54. Лабораторная диагностика коклюша Основные методы лабораторной диагностики коклюша бактериологический и серологический
- 55. Бактериологический метод Клинический материал собирают
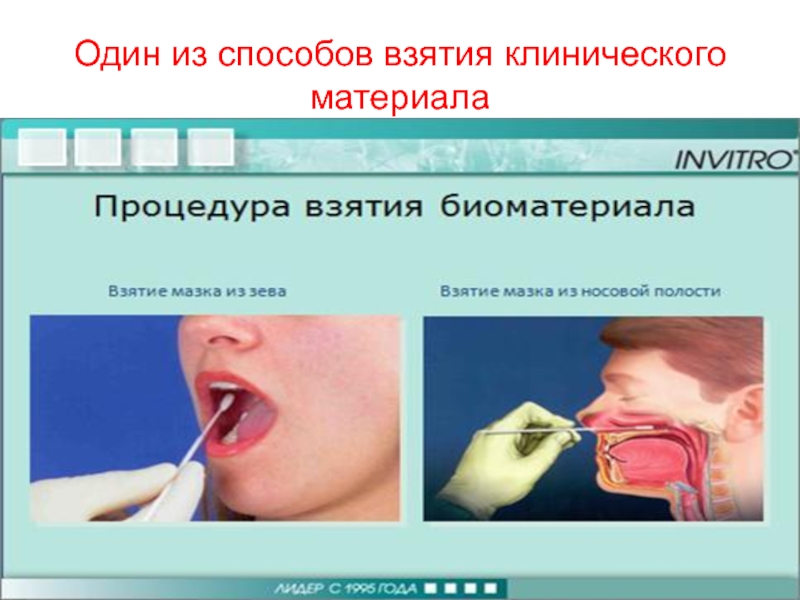
- 56. Один из способов взятия клинического материала
- 57. Основным методом лабораторного
- 58. Цель бактериологического исследования: Выделение чистой культуры и
- 59. 3 этап: Серологиеская идентификация бордетелл Используют образцы
- 60. Серологический метод диагностики коклюша ИФА используют
- 62. Плановая профилактика коклюша Комбинированная вакцина АКДС
- 63. Благодарю за внимание!
Слайд 2Дифтерия
Дифтерия (diphtheria; греч. diphthera кожа, пленка) - острая инфекционная болезнь, вызываемая
передаётся воздушно-капельным путем;
характеризуется, в результате действия специфического токсина, крупозным или дифтеритическим воспалением слизистых оболочек зева, носа, гортани, трахеи, реже — других органов (сердечно-сосудистой, нервной и мочевыделительной систем) с образованием фибринозных пленок и общей интоксикацией.
Слайд 3Этиология дифтерии
Семейство: Corynebacteriaceae
Род: Corynebacterium
Вид: Corynebacterium diphtheriae
С. diphtheriae обнаружен в 1883
Слайд 4Резистентность
Выделяясь в окружающую среду сохраняют жизнеспособность в течение
Эти микроорганизмы хорошо переносят высушивание
В пыли могут не погибать в течение 5 мес.
К дезинфицирующим растворам чувствительны: 5 % раствор карболовой кислоты губит их в течение 1 мин, 1 % раствор фенола — за 10 мин.
Коринебактерии чувствительны к пенициллину, тетрациклинам, эритромицину.
Слайд 5Морфология
Грамм +
Прямые или слегка изогнутые палочки
На полюсах локализуются зёрна волютина, придавая
Жгутиков, спор нет
Есть капсула
Имеются фимбрии
Слайд 6
По грамму
C. diphtheriae
В препаратах располагают под углом друг к другу в
и в виде свалявшейся шерсти (в толстом мазке).
Расположение
Слайд 8Факультативные анаэробы
Хемоорганогетеротрофы
К питательным средам требовательны: не способны утилизировать азот из аммонийных
Этим потребностям удовлетворяют питательные среды, полученные на основе ферментативного расщепления белка (казеина, дрожжей) с добавлением крови или сыворотки.
Культуральные свойства
Слайд 13Культуральные свойства
Рост на скошенном сывороточном агаре сравнивают с шагреневой кожей —
Зерна волютина., расположенные на концах палочек, выявляются при окраске синькой Леффлера или по методу Нейссера.
Слайд 16 Основным фактором патогенности является экзотоксин, поражающий мышцу сердца, надпочечники, почки, нервные
Способность вырабатывать токсин связана с наличием в клетке профага, несущего ген tox, ответственный за образование токсина.
Кроме того, Corynebacterium diphteriae продуцирует ферменты агрессии:
- гиалуронидазу, которая разрушает гиалуроновую кислоту стенки капилляров и повышает их проницаемость, что приводит к усугублению тканевого отека.
- гемолизин,
- некротизирующий и диффузионный факторы.
- нейраминидазу-отщепляет сиаловую кислоту от мукоглико-протеида в составе муцина , что способствует разжижению слизи и облегчает доступ возбудителя к эпителию.
- корд-фактор- устойчивость к фагоцитозу.
Факторы патогенности
Слайд 17Основное свойство— токсигенность — способность секретировать гистотоксин, действие которого проявляется :
локально
в общей интоксикации организма,
поражении особенно чувствительных к нему надпочечников, миокарда, нервной системы.
Токсин, блокируя ферменты синтеза белка в клетках хозяина, приводит их к гибели, что обусловливает некроз и летальный исход.
Слайд 18Биохимические свойства.
Расщепляет углеводы до кислоты (глюкоза, гликоген, крахмал, мальтоза)
Разжижает желатин
Индол не
Сахарозу не расщепляет
Мочевину не ферментирует
Слайд 19Антигены.
С. diphtheriae имеют белковую поверхностную структуру — микрокапсулу,
Определение этого антигена позволяет установить серовар (их более 10).
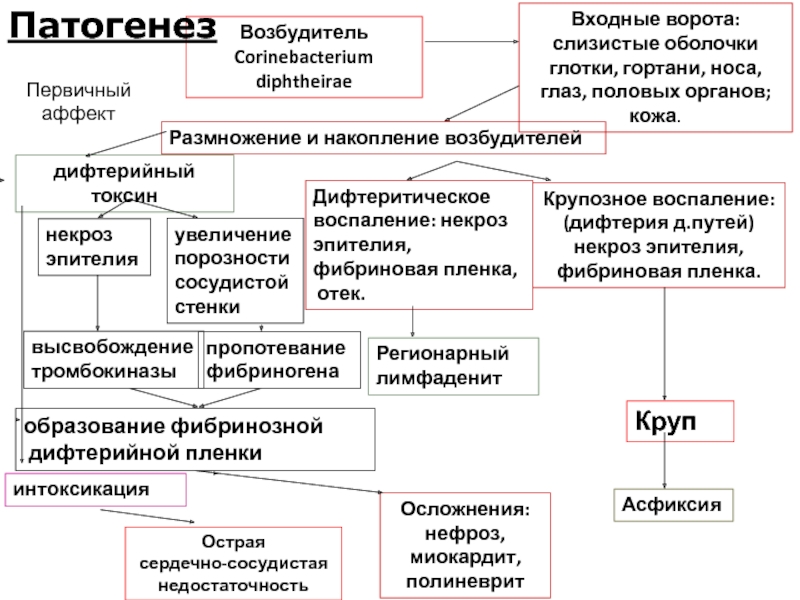
Слайд 20 Патогенез и
Входными воротами для возбудителя могут быть слизистые оболочки ротоглотки, носа, гортани, реже глаз, половых органов, поврежденные участки кожи.
Колонизации (заселению) слизистых оболочек или кожи возбудителем способствует снижение механизмов местной защиты, в т.ч. дефицит секреторных иммуноглобулинов и специфических антимикробных антител.
Заболевание возникает только при отсутствии в организме дифтерийного антитоксина, способного нейтрализовать вырабатываемый токсигенными штаммами коринебактерий дифтерии экзотоксин.
В этом случае происходит накопление токсина в месте внедрения возбудителя, затем под действием трипсина тканей экзотоксин расщепляется на две фракции, и легкая его фракция проникает внутрь клеток.
Являясь внутриклеточным ядом, ингибирующим синтез белков, дифтерийный экзотоксин вызывает гибель клеток.
Слайд 21Возбудитель
Corinebacterium diphtheirae
Входные ворота: слизистые оболочки глотки, гортани, носа, глаз, половых органов;
Размножение и накопление возбудителей
дифтерийный токсин
интоксикация
Асфиксия
Острая
сердечно-сосудистая
недостаточность
Осложнения:
нефроз,
миокардит,
полиневрит
Круп
Крупозное воспаление:
(дифтерия д.путей)
некроз эпителия,
фибриновая пленка.
Регионарный
лимфаденит
Дифтеритическое
воспаление: некроз
эпителия,
фибриновая пленка,
отек.
Первичный аффект
некроз
эпителия
увеличение
порозности
сосудистой
стенки
высвобождение
тромбокиназы
пропотевание
фибриногена
образование фибринозной
дифтерийной пленки
Патогенез
Слайд 24Источник инфекции
больной человек или носитель токсигенных штаммов.
Большую опасность для окружающих представляют бактерионосители, выделяющие возбудитель из носоглотки.
Слайд 25Путь передачи - воздушно-капельный.
Иногда факторами передачи могут
Дифтерия кожи, глаз и половых органов возникает при переносе возбудителя через контаминированные руки.
Также известны пищевые вспышки дифтерии, обусловленные размножением возбудителя в молоке, кондитерских кремах и др.
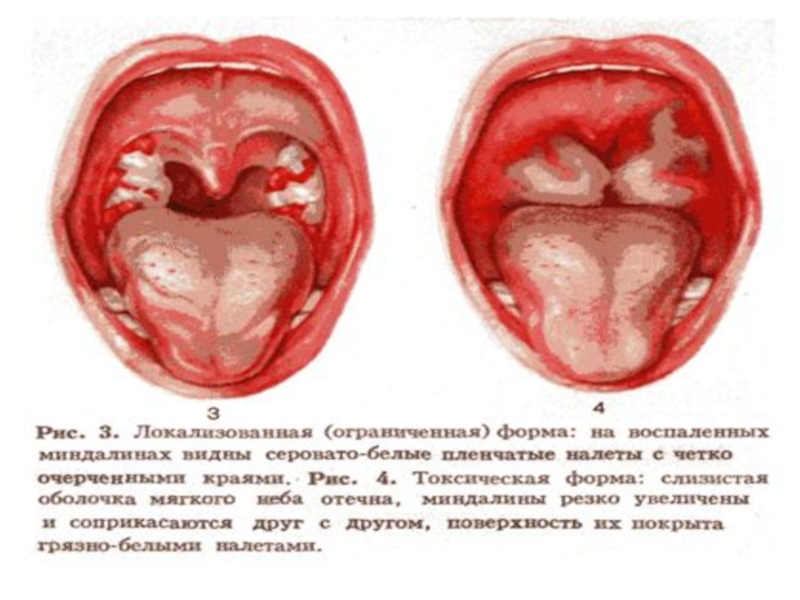
Слайд 26Клиническая диагностика:
-По наличию пленки (трудно снимающейся и не растирающейся между предметными
-Увеличение лимфатических узлов соответствует величине налета (кроме распространенной формы).
-Высота температуры в начале болезни соответствует тяжести заболевания.
-Величина отека на шее соответствует величине налета и симптомам общей интоксикации.
-Кроме клинической картины и прививочного анамнеза нужно учитывать эпидемиологическую ситуацию.
Слайд 27 Взятие и доставка материала в лабораторию.
Материалом для исследования является
Материал нужно брать к началу этиотропного лечения натощак или через 2 часа после приема еды.
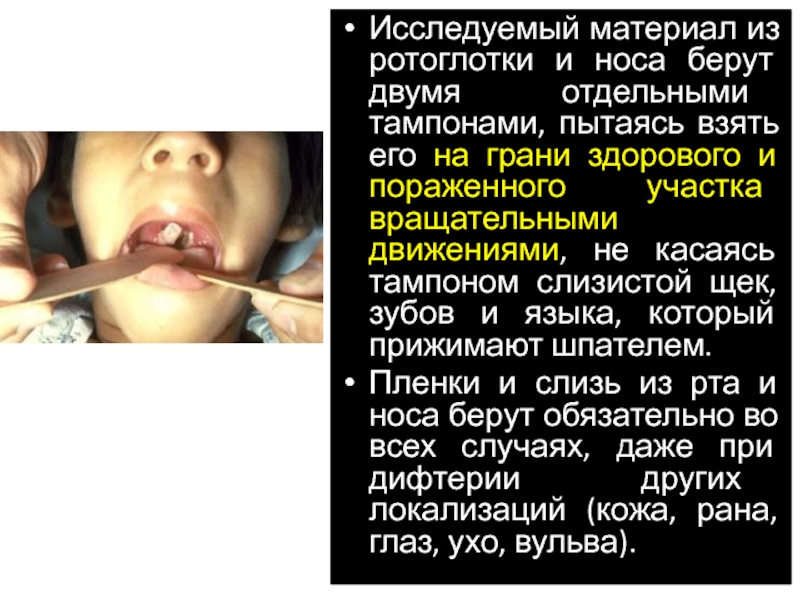
Слайд 28Исследуемый материал из ротоглотки и носа берут двумя отдельными тампонами, пытаясь
Пленки и слизь из рта и носа берут обязательно во всех случаях, даже при дифтерии других локализаций (кожа, рана, глаз, ухо, вульва).
Слайд 29 Лабораторная диагностика дифтерии производится с целью:
• постановки диагноза острого заболевания;
•
• определения вирулентности (токсичности) дифтерийных палочек.
Материал для исследования (чаще всего мазок из носа) берут стерильным ватным тампоном. Не следует брать материал после приема пищи или полоскания дезинфицирующими растворами.
Посев необходимо произвести сразу после взятия материала (не позже 5—6 ч) в пробирку со свернутой кровяной сывороткой и сывороткой Леффлера, а затем поставить в термостат при 37 °С.
Слайд 30Лабораторная диагностика дифтерии
Клинический материал: мазок из зева, слизь из носоглотки и
Методы:
Бактериоскопический (окраска мазка по Леффлеру и Нейссеру – предварительный)
Бактериологический (культуральный) - основной
Серологический (ИФА, латексагглютинация, реакция нейтрализации антител, РНГА) для обнаружения антител и/или токсина в сыворотке крови.
Проба Шика – реакция нейтрализации токсина in vivo
Слайд 31Бактериологический метод
1 этап: посев клинического материала на кровяной теллуритовый агар (среда
2 этап: макроскопическое изучение колоний, мазок по Леффлеру или Нейссеру; отсев типичной колонии на среды Ру или Леффлера
3 этап: Идентификация по совокупности свойств: культуральных, морфологических, тинкториальных, биохимических, обязательно определение токсигенности методом Оухтерлони;
4 чувствительности к антибиотикам.
Слайд 35Биохимическая активность возбудителя дифтерии достаточно высока.
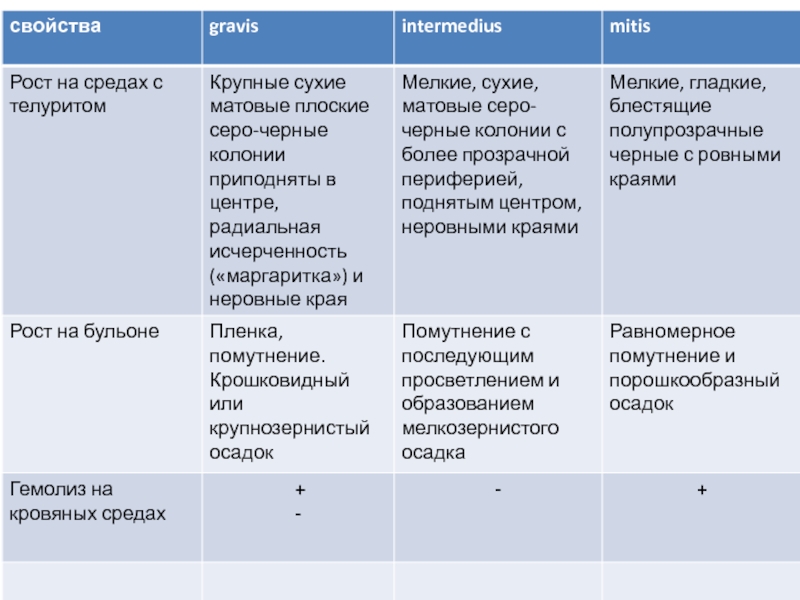
Биовары gravis разлагают глюкозу, мальтозу,
Бактерии биовара mitis разлагает лишь глюкозу и мальтозу.
Биовары intermedius разлагают глюкозу, мальтозу, декстрин, крахмал не разлагает.
Все не разлагают мочевину.
Редуцируют нитраты до нитритов.
Наряду с другими ферментами он обладает цистиназой, которая отсутствует у других коринебактерий ( проба Пизу)
Ферментативная активность
Слайд 36Экспресс-метод.
С целью ранней диагностики используют латекс-агглютинацию, позволяющую обнаружить токсин в сыворотке
Слайд 37Серологическая диагностика.
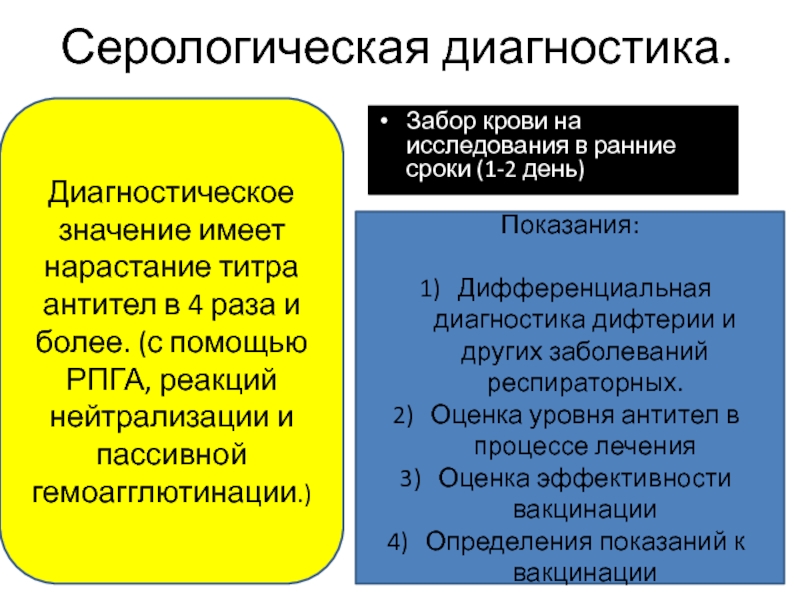
Забор крови на исследования в ранние сроки (1-2 день)
Показания:
Дифференциальная диагностика
Оценка уровня антител в процессе лечения
Оценка эффективности вакцинации
Определения показаний к вакцинации
Диагностическое значение имеет нарастание титра антител в 4 раза и более. (с помощью РПГА, реакций нейтрализации и пассивной гемоагглютинации.)
Слайд 38Иммунитет.
Наиболее восприимчивыми к дифтерии являются дети в возрасте 1—4 лет.
Невосприимчивость к дифтерии зависит главным образом от содержания антитоксина в крови.
Однако антимикробные антитела также имеют значение в становлении иммунитета.
Уровень антитоксического иммунитета можно установить, определяя в крови антитела в РНГА с эритроцитарным диагностикумом — эритроциты нагружены дифтерийным анатоксином. Титры 1 :20 и выше свидетельствуют об иммунности обследуемого лица.
С этой же целью применяется реакция Шика: внутрикожно вводят дифтерийный токсин, который вызывает местную воспалительную реакцию у неиммунных людей, а при наличии антитоксина такая реакция не возникает.
Слайд 39 Действующее начало всех вакцин – дифтерийный
АД – адсорбированный дифтерийный анатоксин
АДС – адсорбированный дифтерийно-столбнячный анатоксин
АДС-М анатоксин -вакцина для профилактики дифтерии и столбняка с уменьшенным содержанием антигенов
АД-М анатоксин вакцина для профилактики дифтерии с уменьшенным содержанием антигенов
Имовакс Д.Т. Адюльт вакцина для профилактики дифтерии и столбняка, аналог АДС-М (Aventis Pasteur, Франция)
ДТ Вакс вакцина для профилактики
дифтерии и столбняка, аналог АДС (Aventis Pasteur, Франция)
Специфическая профилактика
Слайд 40Лечение
Нейтрализация токсина путем введения противодифтерийной сыворотки антитоксической (донорской или лошадиной)
Антибиотикотерапия: пенициллины,
Слайд 42Коклюш - острое инфекционное заболевание, передающееся воздушно-капельным путем, - характеризующееся острым
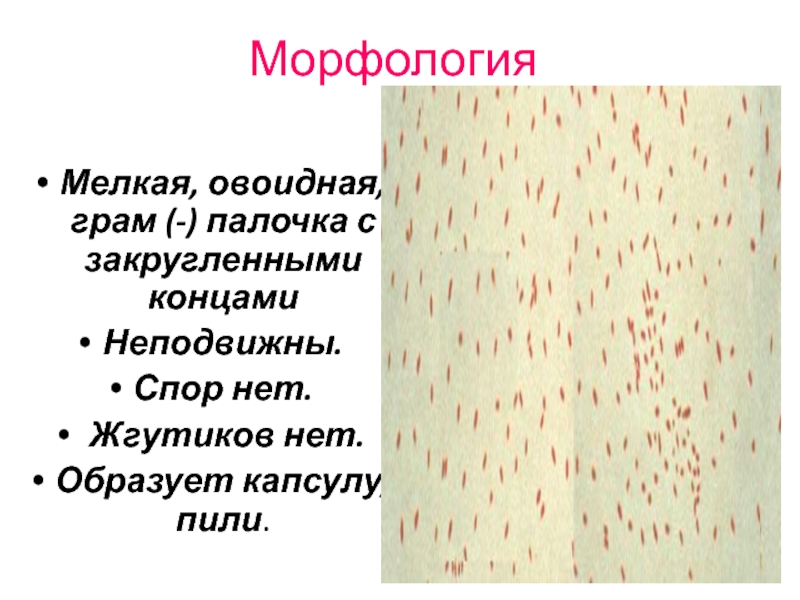
Слайд 44Морфология
Мелкая, овоидная, грам (-) палочка с закругленными концами
Неподвижны.
Спор нет.
Образует капсулу, пили.
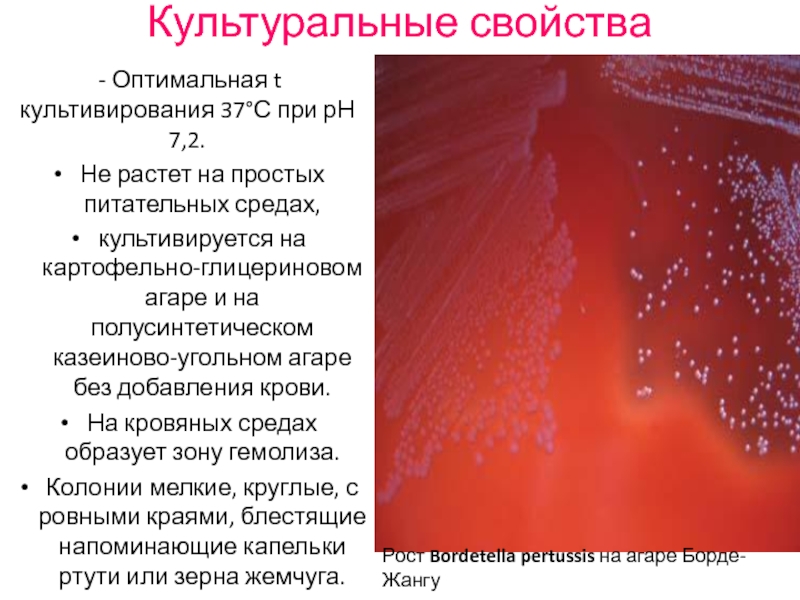
Слайд 45Культуральные свойства
- Оптимальная t культивирования 37°С при рН 7,2.
Не
культивируется на картофельно-глицериновом агаре и на полусинтетическом казеиново-угольном агаре без добавления крови.
На кровяных средах образует зону гемолиза.
Колонии мелкие, круглые, с ровными краями, блестящие напоминающие капельки ртути или зерна жемчуга.
Рост Bordetella pertussis на агаре Борде-Жангу
Слайд 46.
Тип дыхания – строгие аэробы.
Биохимические свойства:
- Хемоорганотрофы;
- Метаболизм только окислительный;
- Ферментативно
Не ферментируют углеводы;
Нет протеолитической активности;
Не восстанавливают нитраты
Слайд 47АНТИГЕНЫ
В антигенном отношении неоднородна.
Антиген, который обусловливает образование агглютининов (агглютиноген), состоит
Они названы факторами и обозначаются цифрами от 1 до 14.
Фактор 7 является родовым,
Фактор 1 содержит В. pertussis,
Фактор 14 — В. parapertussis,
Фактор 12- В. Bronchoseptica.
Остальные встречаются в разных комбинациях; для возбудителя коклюша это факторы 2, 3, 4, 5, 6, для паракоклюша — 8, 9, 10.
Реакция агглютинации с адсорбированными факторными сыворотками позволяет дифференцировать виды бордетелл и определять их антигенные варианты.
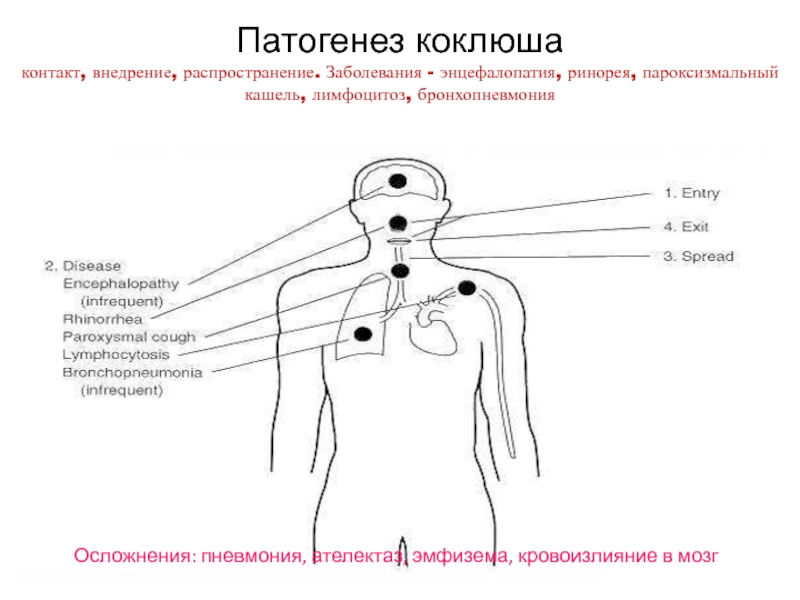
Слайд 48Патогенез коклюша контакт, внедрение, распространение. Заболевания - энцефалопатия, ринорея, пароксизмальный кашель,
Осложнения: пневмония, ателектаз, эмфизема, кровоизлияние в мозг
Слайд 49Коклюш - высококонтагиозное заболевание, к которому очень восприимчивы дети (у взрослых
Источник инфекции – больной (заразен до 25-30дн) или бактерионоситель
Путь передачи - воздушно-капельный
Периоды заболевания:
инкубационный(5-8дн, до14)
катаральный (5-14дней)
Судорожный (пароксизмальный) (2-8 недель)
период разрешения (2-4 недели)
ЛЕЧЕНИЕ: симптоматическое; антибиотикотерапия показана до пароксизмального периода; Ig
Слайд 50
Инкубационный период варьирует в пределах 3-14 дней, в большинстве случаев он длится около недели.
В течении заболевания отмечают последовательную смену трёх периодов: катарального, периода спазматического кашля и периода разрешения (выздоровления).
Катаральный период развивается постепенно, проявляется умеренно выраженными катаральными явлениями в виде сухого кашля и насморка (у детей довольно обильного) с вязким слизистым отделяемым.
Температура тела может оставаться нормальной, но чаще повышается до субфебрильных величин.
Самочувствие и общее состояние больного остаются удовлетворительными.
Постепенно кашель усиливается, становится упорным. Уже в конце этого периода он может проявляться в виде приступов, особенно в ночное время.
У больных развиваются раздражительность, беспокойство.
Катаральный период длится от нескольких дней до 2 недель, у взрослых он более продолжительный, чем у детей.
Слайд 51
Период спазматического кашля (судорожный период) развивается постепенно. Кашель становится приступообразным и
Во время приступа у больного набухают шейные вены, лицо становится одутловатым, гиперемированным, нередко цианотичным, на лице появляется выражение испуга, рот раскрыт, язык максимально высовывается.
Количество приступов в течение суток и длительность каждого из них прямо пропорциональны тяжести заболевания. В результате повторных приступов лицо больного становится одутловатым, веки припухшими, могут появиться кровоизлияния на конъюнктиве глаз, мелкие кровоизлияния на коже и слизистых оболочках.
Вне приступов кашля общее состояние больных почти не нарушается. Температура тела в период спазматического кашля становится нормальной у большинства больных, выраженная лихорадка всегда привлекает внимание врача, указывая на возможность развития осложнений.
При осмотре больных часто выслушивают сухие хрипы в лёгких, иногда определяют расширение перкуторных границ сердца, повышение артериального давления. Судорожный период продолжается 3-4 недели и более, количество приступов постепенно уменьшается, интенсивность их ослабевает.
Слайд 52Внешний вид ребенка, больного коклюшем, во время приступа спазматического кашля: начало
Слайд 54Лабораторная диагностика коклюша
Основные методы лабораторной диагностики коклюша
бактериологический
и серологический
Слайд 55Бактериологический метод
Клинический материал собирают
- сухим тампоном с
- методом кашлевых пластинок
Материал целесообразно получать до начала антимикробной терапии
Необходимо соблюдение асептики, не следует допускать контаминации посторонней микрофлорой
Слайд 57 Основным методом лабораторного подтверждения диагноза является -
Частота выделения зависит от сроков взятия материала; на 1-й неделе заболевания положительные результаты удается получить у 95% больных, на 4-й — лишь у 50%, а начиная с 5-й недели, микроб выделить уже не удается.
Материал из носоглотки берут сухим тампоном с немедленным посевом на чашки с селективной питательной средой.
Используют также метод «кашлевых пластинок», при котором чашка Петри с питательной средой устанавливается перед ртом кашляющего ребенка (на расстоянии около 10 см), удерживается в таком положении несколько секунд, чтобы уловить 5—6 кашлевых толчков. Чашку с посевом быстро закрывают крышкой и помещают в термостат.
Однако по частоте выделения возбудителей коклюша метод «кашлевых пластинок» значительно уступает взятию материала тампоном.
Слайд 58Цель бактериологического исследования:
Выделение чистой культуры и идентификация возбудителя коклюша
Дифференциальный анализ культуральных
1 этап:
Посев на следующие питательные среды:
картофельно-глицериновый агар Борде,
казеиновый-угольный агар, кровяной агар
2 этап:
Палочки коклюша через 48-72ч роста образуют мелкие блестящие колонии серого цвета
Паракоклюшные палочки через 24-48ч роста образуют колонии несколько крупнее
Бактериологический метод
Слайд 593 этап: Серологиеская идентификация бордетелл
Используют образцы антигенов - с 1 по
Антиген 7 определяет род Bordetella,
Антиген 1 определяет Bordetella pertussis,
Антиген 14 – B.parapertussis
В реакции агглютинации в пробирках
Слайд 60Серологический метод диагностики коклюша
ИФА используют для определения sIgA в носоглоточной слизи,
РНГА используют при анализе сывороток через 10-14 дней, диагностический титр 1:80, у здоровых детей 1:20
РСК в парных сыворотках
Слайд 61 Серологические методы можно использовать
Можно использовать РПГА, реакцию агглютинации. Диагностическим считается нарастание титров антител в 4 раза и более, а также высокие титры антител (1:80 и выше).
Используют иммуноферментный метод для обнаружения антител в сыворотке (иммуноглобулины класса М) и в носоглоточной слизи (иммуноглобулины класса А).
Эти антитела появляются со 2-3-й недели болезни и сохраняются в течение 3 мес.
Дифференцируют в катаральном периоде болезни от ОРЗ, в период спазматического кашля от других заболеваний, сопровождающихся упорным кашлем при нормальной температуре тела и отсутствии признаков обшей интоксикации.
Слайд 62 Плановая профилактика коклюша
Комбинированная вакцина АКДС (адсорбированная коклюшно –дифтерийно – столбнячная
дифтерийный и столбнячный анатоксины,
а также убитые цельные микроорганизмы - возбудители коклюша