- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Быстропрогрессирующий гломерулонефрит презентация
Содержание
- 2. БЫСТРОПРОГРЕССИРУЮЩИЙ ГЛОМЕРУЛОНЕФРИТ
- 3. БЫСТРОПРОГРЕССИРУЮЩИЙ НЕФРИТИЧЕСКИЙ СИНДРОМ – клинико-морфологический синдром, вариант
- 4. БЫСТРОПРОГРЕССИРУЮЩИЙ НЕФРИТИЧЕСКИЙ СИНДРОМ Характеризуется: Быстронарастающей почечной
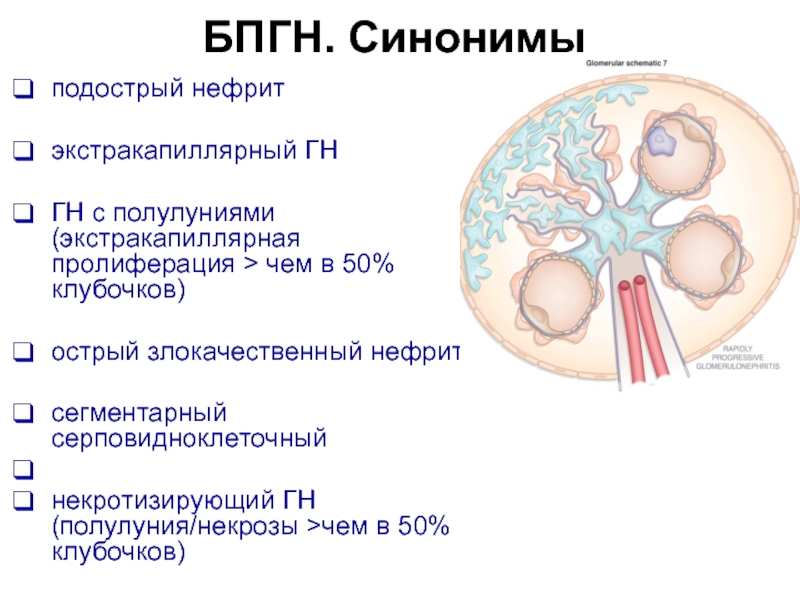
- 5. БПГН. Синонимы подострый нефрит экстракапиллярный
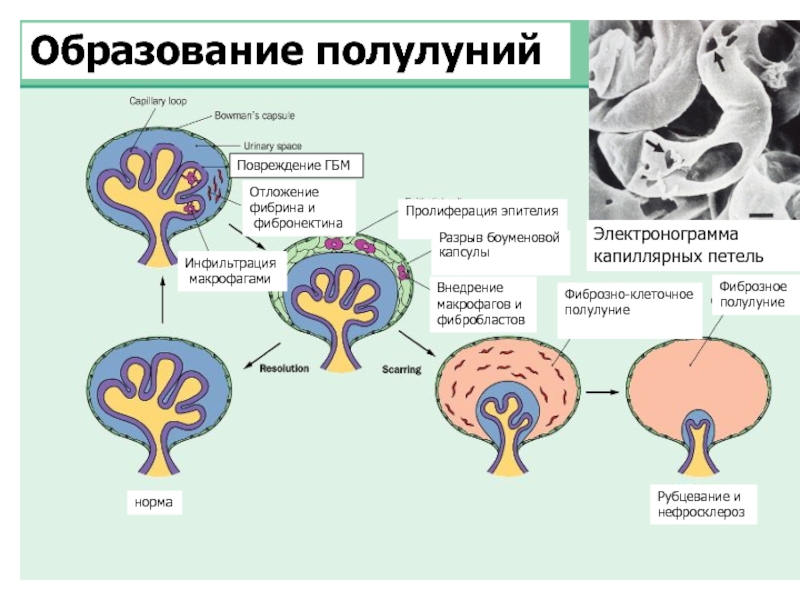
- 6. Образование полулуний Повреждение ГБМ Инфильтрация
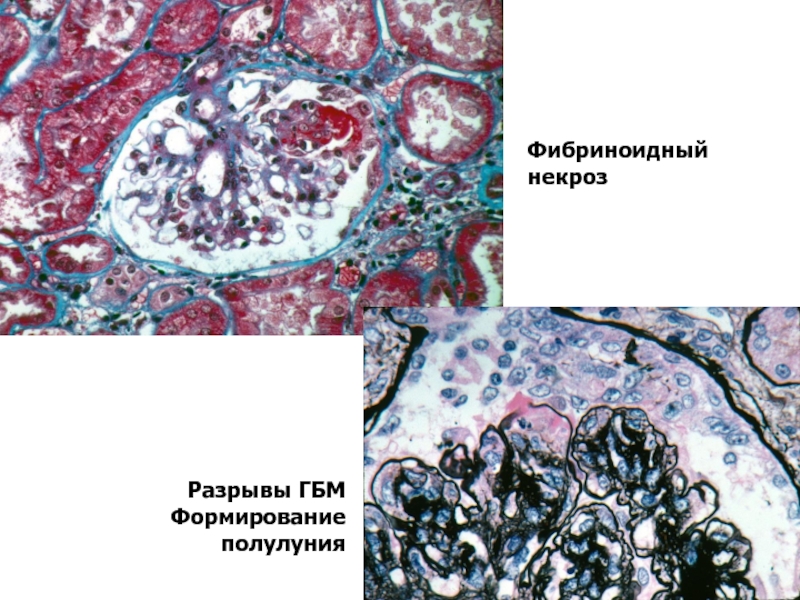
- 7. Фибриноидный некроз Разрывы ГБМ Формирование полулуния
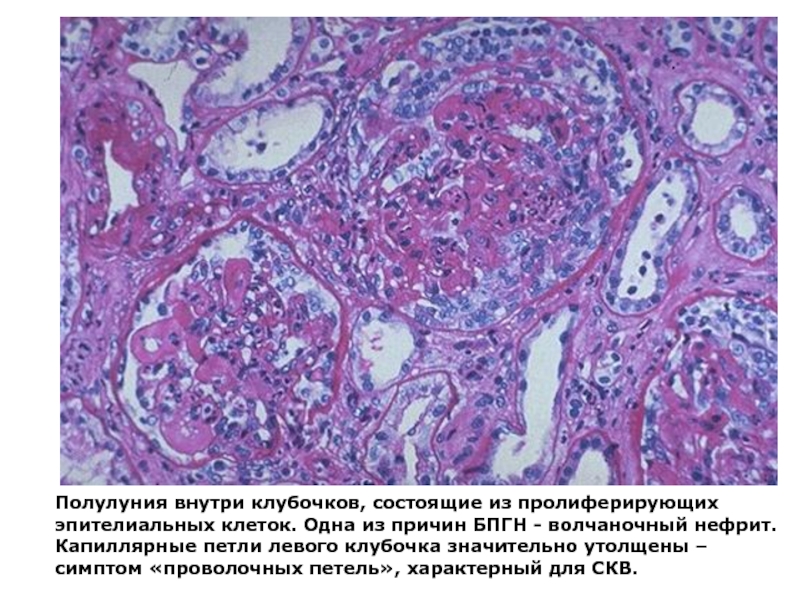
- 8. Полулуния внутри клубочков, состоящие из пролиферирующих эпителиальных
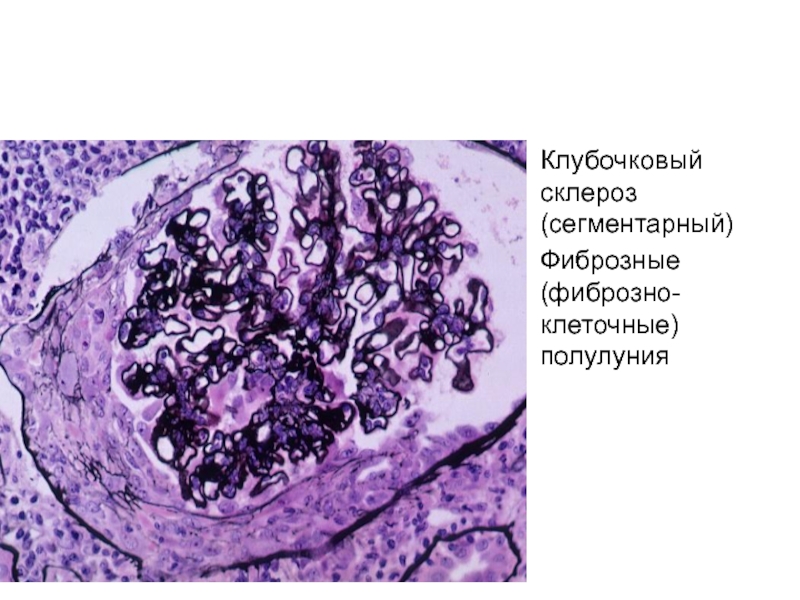
- 9. Клубочковый склероз (сегментарный) Фиброзные (фиброзно-клеточные) полулуния
- 10. Экстракапиллярный гломерулонефрит: фиброзированные полулуния, фрагментированные остатки клубочка. (PAS)
- 11. Классификация (Glassock, 1997) Тип I («анти-ГБМ нефрит»)
- 12. Быстропрогрессирующий ГН Тип I (анти-ГБМ-нефрит)
- 13. Международная обновленная Chapel Hill Consensus Conference Номенклатура
- 14. Анти-ГБМ болезнь – васкулит, поражающий клубочковые или
- 15. Ernest Goodpasture (1886 –1960) В 1919
- 16. Анти-ГБМ болезнь – аутоиммунная болезнь,
- 17. Патогенез Связывание анти-ГБМ АТ с Аг ГБМ
- 18. Анти-ГБМ болезнь Частота 1:1 млн населения/год
- 19. Клиника -1 Кровохарканье – 1-й симптом
- 20. Клиника-2 Начало с олигоурии ассоциируется с плохим исходом Протеинурия обычно
- 21. Диагностика анти-ГБМ болезни Диагноз устанавливается при
- 22. Почки у больных быстропрогрессирующим гломерулонефритом
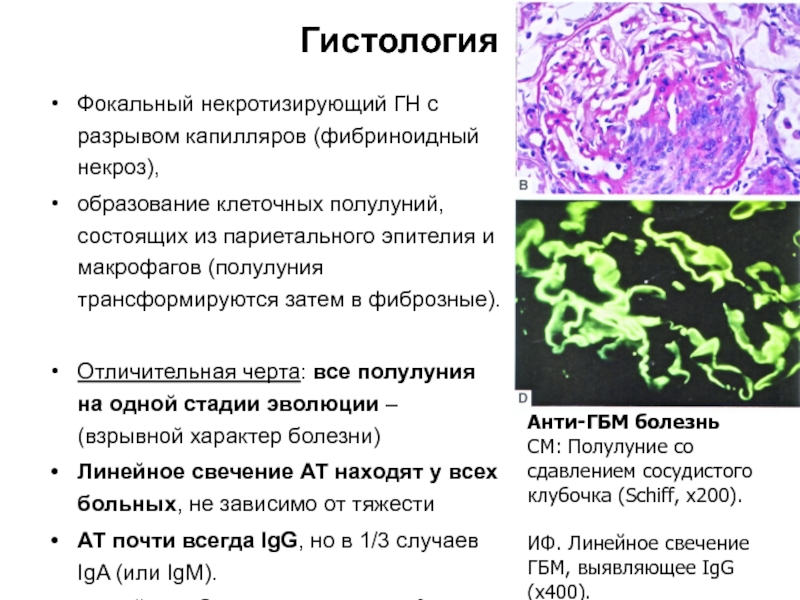
- 23. Гистология Фокальный некротизирующий ГН с разрывом капилляров
- 24. Дифференциальный диагноз проводят между заболеваниями, способными вызвать
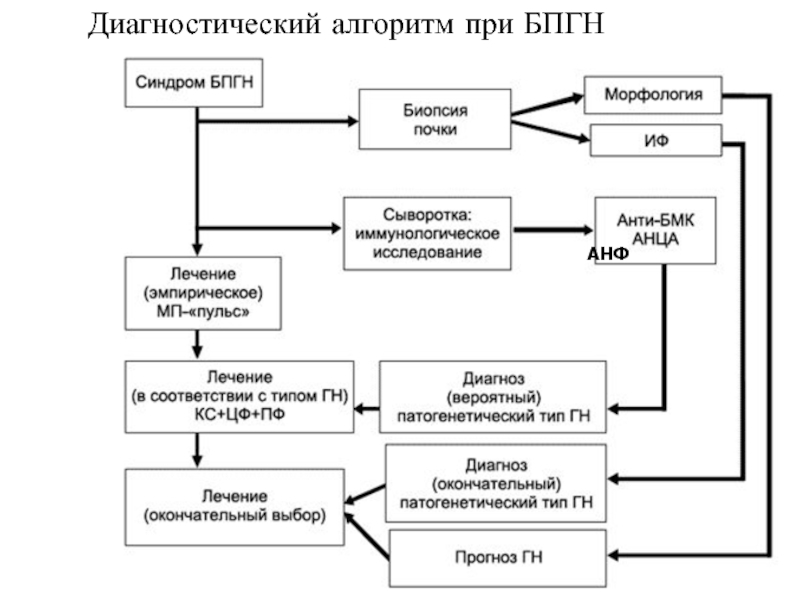
- 25. Диагностический алгоритм при БПГН АНФ
- 26. Лечение анти-ГБМ ГН Всем пациентам
- 27. Поддерживающая иммуносупрессивная терапия при анти-ГБМ ГН
- 28. Прогноз плохой, если в нефробиоптате >50% фиброзных
- 29. Иммуно-морфологическая дифдиагностика МБПГН При БПД только
- 30. Дифференциальный диагноз Болезни, протекающие с ОПП и
- 31. Этиология и патогенез С3- гломерулопатии (прод.)
- 32. Этиология иммуноглобулин- и С3-негативного МБПГН заключается в
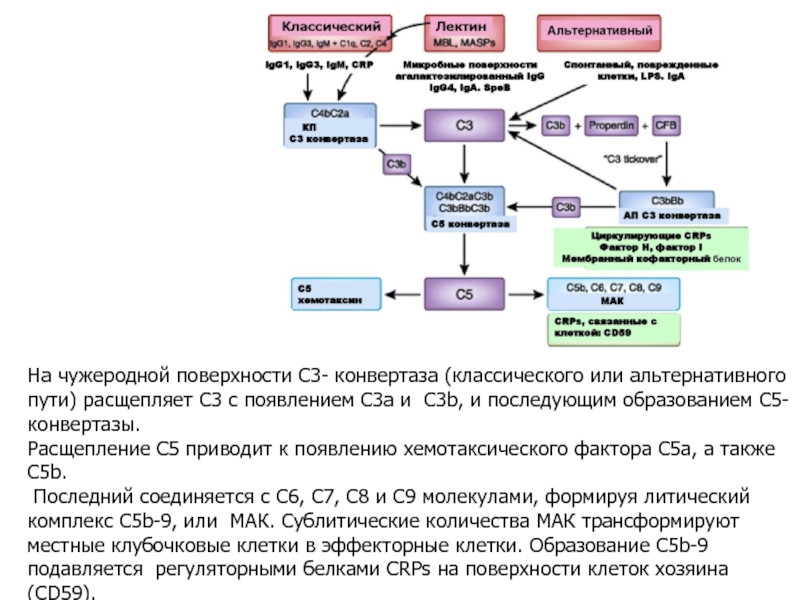
- 33. На чужеродной поверхности С3- конвертаза (классического или
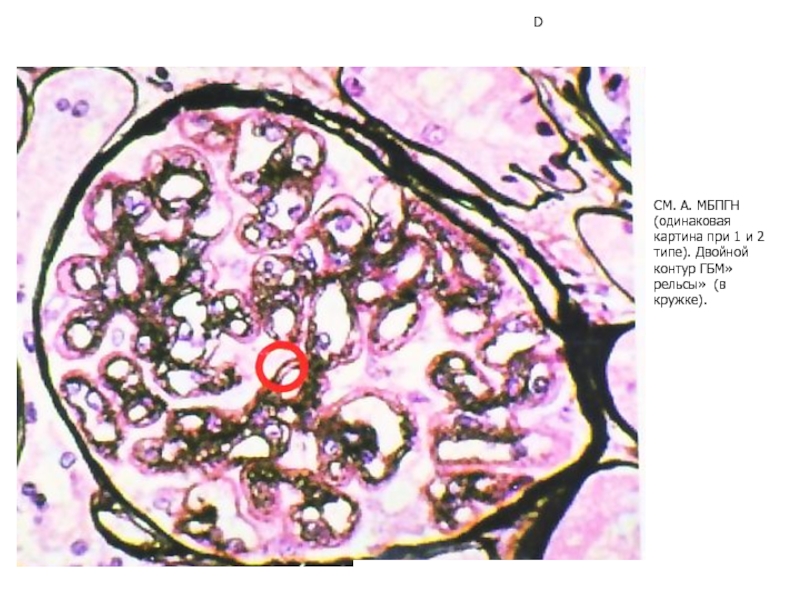
- 34. D СМ. А. МБПГН (одинаковая картина
- 35. IgG ИФ: Большие сливные депозиты в расширенном
- 36. Трансплантационная гломерулопатия занимает особое место. Долгое
- 37. СМ клубочка с преимущественно мезангиальной гиперклеточностью и
- 38. Схема классического и альтернативного пути активации комплемента
- 39. Хроническая ТМА Иммунокомплекс-ный МБПГН С3-нефропатия
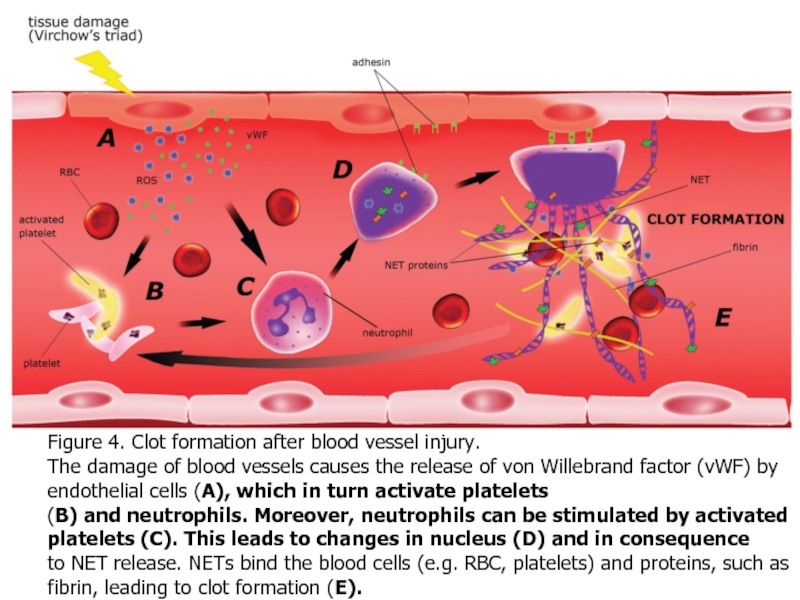
- 40. Figure 4. Clot formation after blood vessel
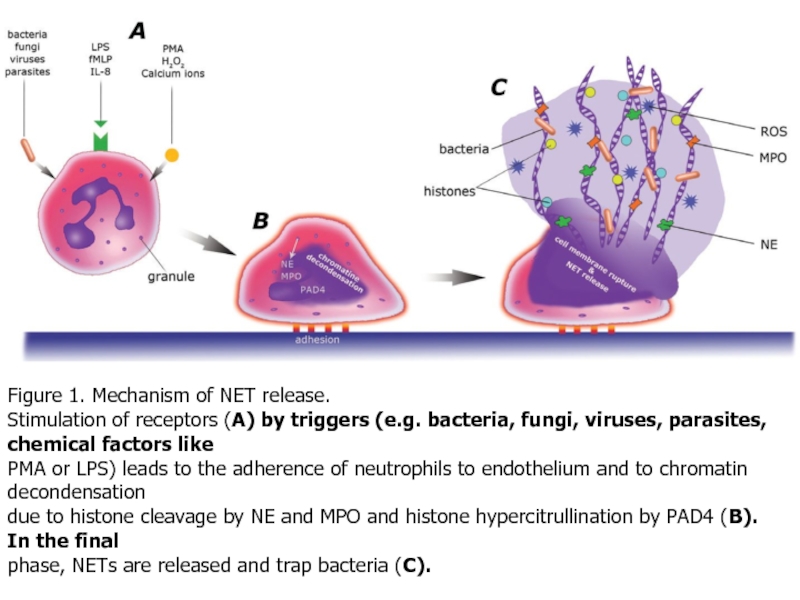
- 41. Figure 1. Mechanism of NET release. Stimulation
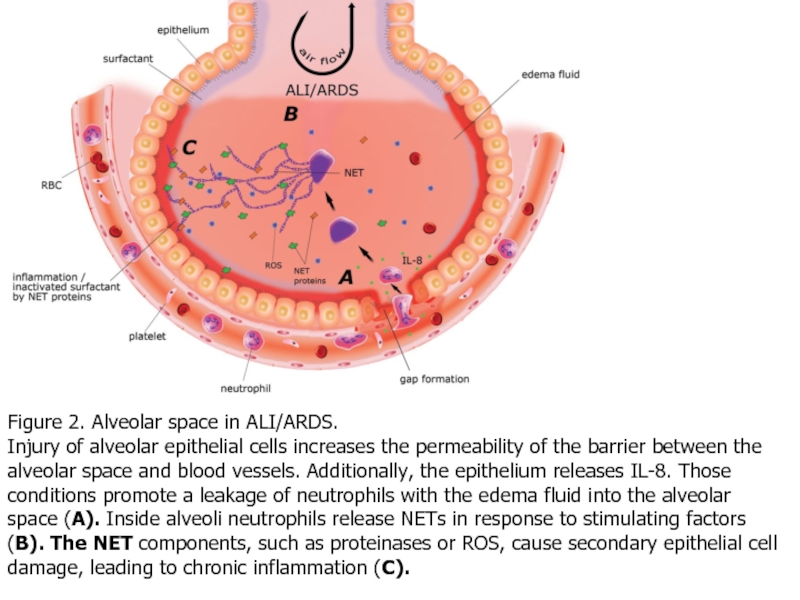
- 42. Figure 2. Alveolar space in ALI/ARDS. Injury
Слайд 3БЫСТРОПРОГРЕССИРУЮЩИЙ НЕФРИТИЧЕСКИЙ СИНДРОМ – клинико-морфологический синдром, вариант течения различных ГН с
БЫСТРОПРОГРЕССИРУЮЩИЙ
ГЛОМЕРУЛОНЕФРИТ
Слайд 4БЫСТРОПРОГРЕССИРУЮЩИЙ НЕФРИТИЧЕСКИЙ СИНДРОМ
Характеризуется:
Быстронарастающей почечной недостаточностью (увеличение sCr в ≥2 раз
В анализах мочи - протеинурия (обычно субнефротического уровня) c «богатым» мочевым осадком (часто как трансформация ОНС в БПНС)
Морфологическая основа – гломерулонефрит с полуниями в более чем 50% клубочков
При отсутствии лечения - ТПН у 90% в течение 1 года
Слайд 5БПГН. Синонимы
подострый нефрит
экстракапиллярный ГН
ГН с полулуниями (экстракапиллярная пролиферация > чем
острый злокачественный нефрит
сегментарный серповидноклеточный
некротизирующий ГН (полулуния/некрозы >чем в 50% клубочков)
Слайд 6
Образование полулуний
Повреждение ГБМ
Инфильтрация
макрофагами
Отложение
фибрина и
фибронектина
Пролиферация эпителия
Разрыв боуменовой
капсулы
Внедрение
макрофагов и
фибробластов
Рубцевание и
нефросклероз
норма
Фиброзно-клеточное
полулуние
Фиброзное
полулуние
Электронограмма
капиллярных петель
Слайд 8Полулуния внутри клубочков, состоящие из пролиферирующих эпителиальных клеток. Одна из причин
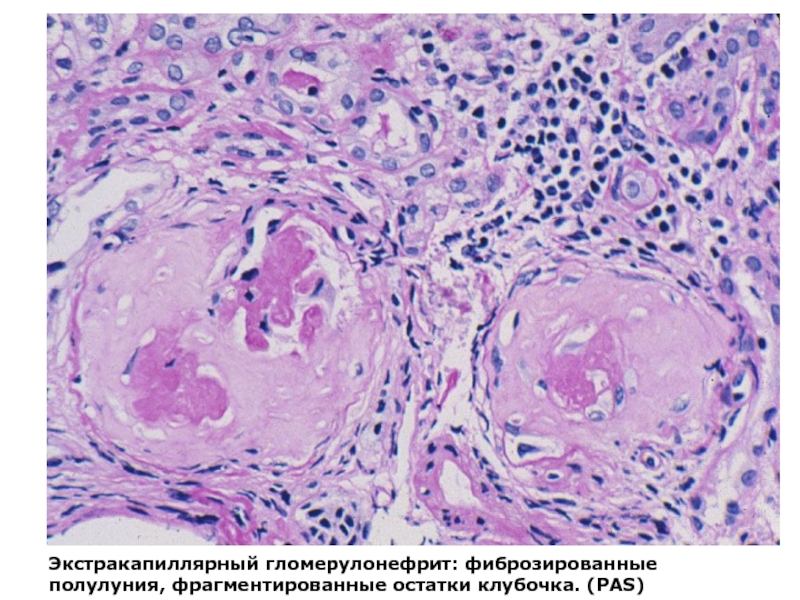
Слайд 10Экстракапиллярный гломерулонефрит: фиброзированные полулуния, фрагментированные остатки клубочка. (PAS)
Слайд 11Классификация (Glassock, 1997)
Тип I («анти-ГБМ нефрит») появление АТ к ГБМ.
Тип II («иммунокомплексный») – иммунные депозиты в мезангии и капиллярной стенке
В почечном биоптате - «гранулярный» тип свечения, у многих больных снижен уровень комплемента (анти-ГБМ-АТ и АНЦА отсутствуют в сыворотке). Наиболее характерен для БПГН, связанных с инфекциями (инфекционный эндокардит), криоглобулинемический ГН, люпус-нефрит класс 4.
Тип III («малоиммунный») – повреждение вызывается нейтрофилами и моноцитами, активированными АНЦА. Свечение Ig и комплемента в биоптате отсутствует (pauci-immune, «малоиммунный» ГН), в сыворотке выявляются АНЦА, направленные к протеиназе-3 (анти-ПР3) или миелопероксидазе (анти-МПО). Этот тип почечного поражения является проявлением АНЦА- ассоциированных васкулитов мелких сосудов.
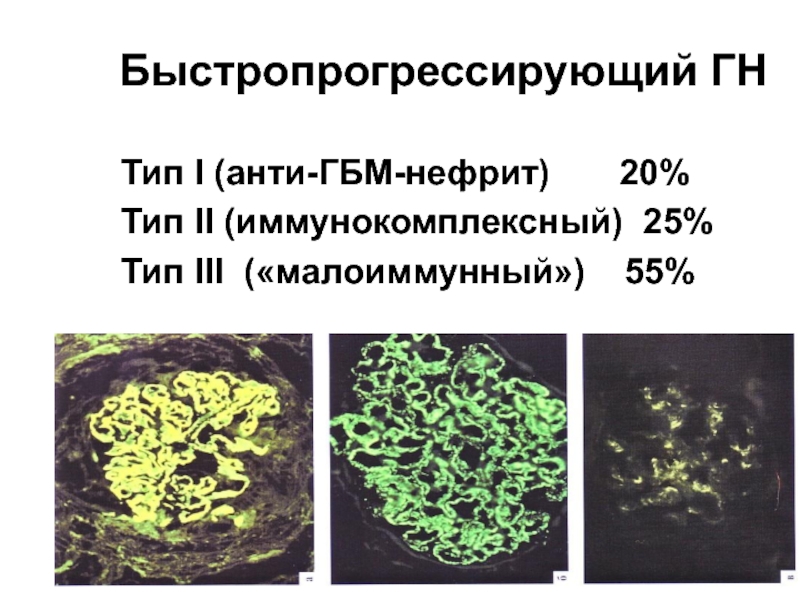
Слайд 12Быстропрогрессирующий ГН
Тип I (анти-ГБМ-нефрит) 20%
Тип II (иммунокомплексный)
Тип III («малоиммунный») 55%
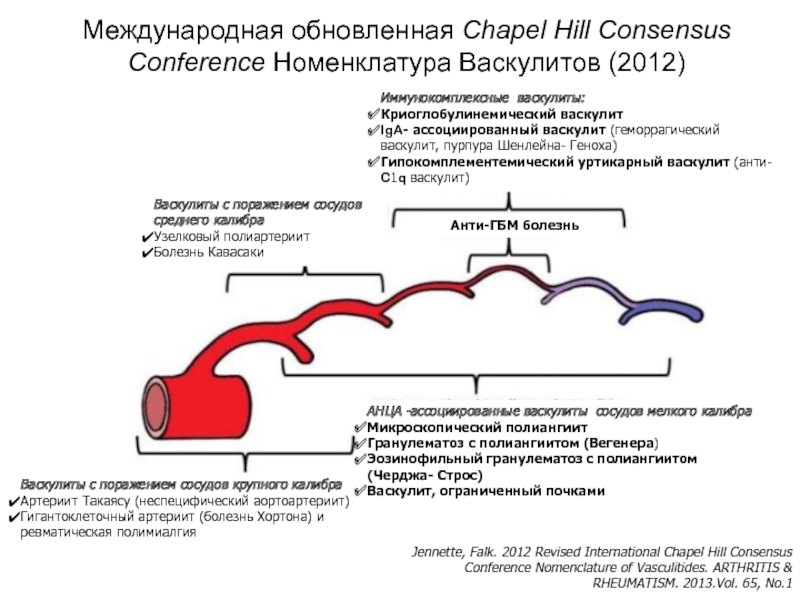
Слайд 13Международная обновленная Chapel Hill Consensus Conference Номенклатура Васкулитов (2012)
Jennette, Falk. 2012
Васкулиты с поражением сосудов крупного калибра
Артериит Такаясу (неспецифический аортоартериит)
Гигантоклеточный артериит (болезнь Хортона) и ревматическая полимиалгия
Васкулиты с поражением сосудов среднего калибра
Узелковый полиартериит
Болезнь Кавасаки
Иммунокомплексные васкулиты:
Криоглобулинемический васкулит
IgA- ассоциированный васкулит (геморрагический васкулит, пурпура Шенлейна- Геноха)
Гипокомплементемический уртикарный васкулит (анти- C1q васкулит)
Анти-ГБМ болезнь
АНЦА -ассоциированные васкулиты сосудов мелкого калибра
Микроскопический полиангиит
Гранулематоз с полиангиитом (Вегенера)
Эозинофильный гранулематоз с полиангиитом (Черджа- Строс)
Васкулит, ограниченный почками
Слайд 14Анти-ГБМ болезнь
– васкулит, поражающий клубочковые или легочные капилляры, или те и
с депозитами ауто-АТ к базальной мембране.
Поражение легких вызывает кровохарканье, почек - ГН с некрозами и полулуниями (CHCC2012).
J. Jennette, R. Falk et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. ARTHRITIS & RHEUMATISM Vol. 65, No.1, 2013, pp 1–11
Достигнут консенсус относительно названия «Анти-ГБМ болезнь» при пересмотре номенклатуры
Термин «Синдром Гудпасчура” использовался ранее для обозначения анти-ГБМ болезни с с почечно-легочным поражением
Слайд 15Ernest Goodpasture
(1886 –1960)
В 1919 – опубликовал аутопсийные данные 18-летнего больного,
В середине 1960-х годов у части больных БПГН, сочетающимся с легочным кровотечением, были обнаружены анти-ГБМ АТ и доказана их патогенность (анти-ГБМ нефрит)
Слайд 16Анти-ГБМ болезнь
– аутоиммунная болезнь, связанная с образованием ауто-АТ к
2 нефритогенных эпитопа известны как EA и EB.
Эпитопы обычно спрятаны в гексамере NC1 доменов и, как считают, обнажаются после воздействия токсинов (напр., табака, летучих углеводородов) или инфекции, известных как триггеры развития болезни.
Генетические факторы участвуют в развитии болезни: HLA аллели DR15 и DR4 предрасполагают к болезни, а DR7 и DR1 - защищают от нее
Коллаген IV типа состоит из 6 цепей (a1 –а6), которые собираются в тройные спиральные конфигурации – протомеры. Каждая спираль состоит из 3 доменов:
7S домен на N-конце,
коллагеновый - в центре,
неколлагеновый домен (NC1) на С-конце.
NC1 и 7S домены спиралей соединяются, образуя сеть.
Эпитопы EA и EB, встроенные внутри NCI домена цепи аЗ являются антигенной мишенью для АТ при анти-ГБМ болезни
Слайд 17Патогенез
Связывание анти-ГБМ АТ с Аг ГБМ вызывает активацию комплемента с развитием
Полулуния - следствие разрывов ГБМ и проникновения плазменных белков и воспалительных клеток в пространство капсулы Шумлянского-Боумена.
Клеточный состав полулуний представлен пролиферирующим париетальным эпителием и макрофагами (МФ).
Эволюция полулуний – обратное развитие или фиброз - зависит от степени накопления МФ в пространстве капсулы и ее структурной целостности.
Преобладание в клеточных полулуниях МФ сопровождается разрывом капсулы, последующим поступлением из интерстиция фибробластов и миофибробластов, синтезом ими матриксных белков – коллагенов I и III типов, фибронектина, что ведет к необратимому фиброзу полулуний.
Слайд 18Анти-ГБМ болезнь
Частота 1:1 млн населения/год
Развивается в любом возрасте, пик –
У молодых обычно возникает внезапно с кровохарканья, резкого падения Hb (не зависит от выраженности кровохарканья), лихорадки, одышки и гематурии.
Иногда провоцируется инфекцией или токсическим агентом.
Основные симптомы – кровохарканье или проявления почечной недостаточности
Кровохарканья в основном бывает у курильщиков, сейчас наблюдается в ~ 50%;
начало с кровохарканья ассоциируется с лучшим исходом (более раннее выявление).
Слайд 19Клиника -1
Кровохарканье – 1-й симптом болезни почти в 50-70%, как
Начало легочного поражения может быть острым, включая массивное кровотечение, удушье и смерть, или симптомы - кровохарканье, одышка, кашель, лихорадка, тахикардия и слабость - возникают повторно на протяжении недель и месяцев прежде, чем будет установлен диагноз.
БПГН дебютирует с ОНС (эволюция от N функции до появления ОПП у может составлять <12 ч) с переходом в БПНС, развитием ТПН в пределах года.
Фатальная потеря функции может развиться за 1-2 нед
Редко - постепенное, бессимптомное, медленно прогрессирующее течение, пока не появятся уремические симптомы.
Слайд 20Клиника-2
Начало с олигоурии ассоциируется с плохим исходом
Протеинурия обычно
Без лечения анти-ГБМ болезнь почти всегда прогрессирует до ТПН
и в настоящее время смертность в остром периоде болезни варьирует от 10 до 40%
Синтез анти-ГБМ АТ временный, часто длится <2 мес.
Рецидивы анти –ГБМ – редко
трансплантацию выполняют, когда АТ уже не определяются (минимум через 6 мес после исчезновения АТ)
Слайд 21Диагностика анти-ГБМ болезни
Диагноз устанавливается при
выявлении АТ (к α3NC1 домену коллагена
данных нефробиопсии
Имеется корреляция между титром анти-ГБМ АТ и тяжестью почечного поражения (???);
степень поражения легких не зависит от титра АТ
Другие показатели неспецифичны
У 10 -15% пациентов также находят АНЦА АТ направленные против МПО (эта подгруппа больных с АНЦА -ассоциированным вариантом имеет лучший!! прогноз при лечении)
Rg легких – N или альвеолярное затенение (признаки появляются и исчезают быстрее, чем при инфекции)
Слайд 22Почки у больных быстропрогрессирующим гломерулонефритом чаще бывают увеличены в размерах (иногда
Слайд 23Гистология
Фокальный некротизирующий ГН с разрывом капилляров (фибриноидный некроз),
образование клеточных полулуний,
Отличительная черта: все полулуния на одной стадии эволюции – (взрывной характер болезни)
Линейное свечение АТ находят у всех больных, не зависимо от тяжести
АТ почти всегда IgG, но в 1/3 случаев IgA (или IgM).
Линейные C3 депозиты - 60-70%
Анти-ГБМ болезнь
СМ: Полулуние со сдавлением сосудистого клубочка (Schiff, x200).
ИФ. Линейное свечение ГБМ, выявляющее IgG (x400).
Слайд 24Дифференциальный диагноз
проводят между заболеваниями, способными вызвать ОНС с БПНС, особенно при
АНЦА-ассоциированные васкулиты (гранулематозный полиангиит, или Вегенера, микроскопический полиангиит),
криоглобулинемический ГН,
инфекция -ассоциированные ГН (ОПСГН, при инфекционный эндокардит),
люпус-нефрит,
пурпурой Шенлейн-Геноха, БЛЦ,
острым тубулоинтерстциальным нефритом, канальцевым некрозом.
Выявление анти-ГБМ АТ делает диагноз очень вероятным, но их также находят у небольшой части больных с АНЦА-васкулитами
АНЦА чаще анти-МПО, титр обычно ниже, а анти-ГБМ АТ у них легче подавляются. Почечная функция может восстановиться, даже если ОПП была очень тяжелой при выявлении
Слайд 26
Лечение анти-ГБМ ГН
Всем пациентам
ЦФ+ КС + плазмаферез (е/дневно в течение 14
Исключение:
Диализ-зависимые пациенты на момент диагноза, 100% полулуний и без легочных кровотечений.
Лечение следует начинать безотлагательно, как только диагноз подтвержден.
Если имеется высокий индекс подозрения, целесообразно начать лечение высокими дозами КС и плазмаферезом и проводить его пока диагноз не будет подтвержден
Поддерживающая иммуносупрессивная терапия при анти-ГБМ ГН не проводится. (ID)
Трансплантацию почки следует отложить на 6 мес после исчезновения анти-ГБМ АТ в сыворотке
Слайд 27
Поддерживающая иммуносупрессивная терапия при анти-ГБМ ГН более 6 мес не проводится
KDIGO,2012
Слайд 28Прогноз плохой, если
в нефробиоптате >50% фиброзных полулуний,
sСr >0,6 ммоль/л,
Олигоурия
При наличии этих факторов большинство никогда не восстанавливают функцию при терапии КС и плазаферезом.
Пациенты с тяжелой ПН и кровохарканьем нуждаются в продолжении лечения, т.к. угрожающие легочные кровотечения отвечают на лечение плазаферезом.
Обострения синдрома Гудпасчера после успешного лечения первого эпизода бывают крайне редко
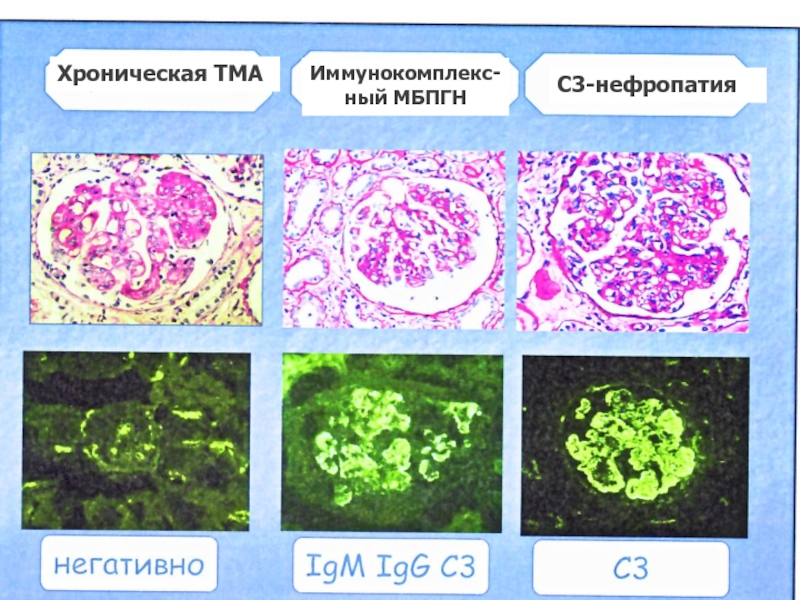
Слайд 29Иммуно-морфологическая дифдиагностика МБПГН
При БПД только в 25% случаев при СМ
в 44% диагностируется МЗПГН,
в 17% ГН с полулуниями, в
11% - о. экссудативно-пролиферативный ГН, а в
3% морфологические признаки не поддаются классификации.
Поэтому в основу современной классификации МБПГН положены сведения об иммунопатогенезе, о которых можно судить по данным ИФ.
На основании анализа депозитов Ig и фракций комплемента выделяют МБПГН Ig+ и МБПГН Ig-, далее С3 + и С3 (-)
Слайд 30Дифференциальный диагноз
Болезни, протекающие с ОПП и острой легочной недостаточностью
Отек легких, вторичный
Тяжелая СН с легочной гипоперфузией и легочным отеком
Тяжелая пневмония (напр., Legionello) , ассоциированная с ОТН
Системные васкулиты- ГПА, МПА, ЧСС
Вторичные васкулиты – СКВ, РА, Бехчета, криоглобулинемии
Почечный венозный тромбоз с ТЭЛА
Отравление гербицидами
Тромботическая микроангиопатия (гемолитико-уремический синдром) с острым легочным синдромом.
Выявление анти-ГБМ АТ делает диагноз очень вероятным, но их также находят у небольшой части больных с АНЦА-васкулитами
АНЦА чаще анти-МПО, титр обычно ниже, а анти-ГБМ АТ у них легче подавляются. Почечная функция может восстановиться, даже если ОПП была очень тяжелой при выявлении
Слайд 31Этиология и патогенез С3- гломерулопатии (прод.)
Причина того факта, что в
При моноклональных гаммапатиях, при которых обычно формируется иммуноглобулин-позитивный МБПГН (для которого характерен классический путь активации комплемента), недавно был открыт иной путь патогенеза.
Оказалось, что моноклональный Ig может действовать как АТ к фактору Н и к другим регуляторным протеинам, приводя к дисрегуляции альтернативного пути комплемента и к формированию С3-позитивной гломерулопатии.
Слайд 32Этиология иммуноглобулин- и С3-негативного МБПГН
заключается в первичном поражении эндотелиоцитов (тромботическая микроангиопатия,
При ЭМ в этих случаях не выявляются электронноплотные депозиты, а следовательно, установить тип МБПГН не представляется возможным
Слайд 33На чужеродной поверхности С3- конвертаза (классического или альтернативного пути) расщепляет С3
Расщепление С5 приводит к появлению хемотаксического фактора C5a, а также C5b.
Последний соединяется с C6, C7, C8 и C9 молекулами, формируя литический комплекс C5b-9, или МАК. Сублитические количества МАК трансформируют местные клубочковые клетки в эффекторные клетки. Образование C5b-9 подавляется регуляторными белками CRPs на поверхности клеток хозяина (CD59).
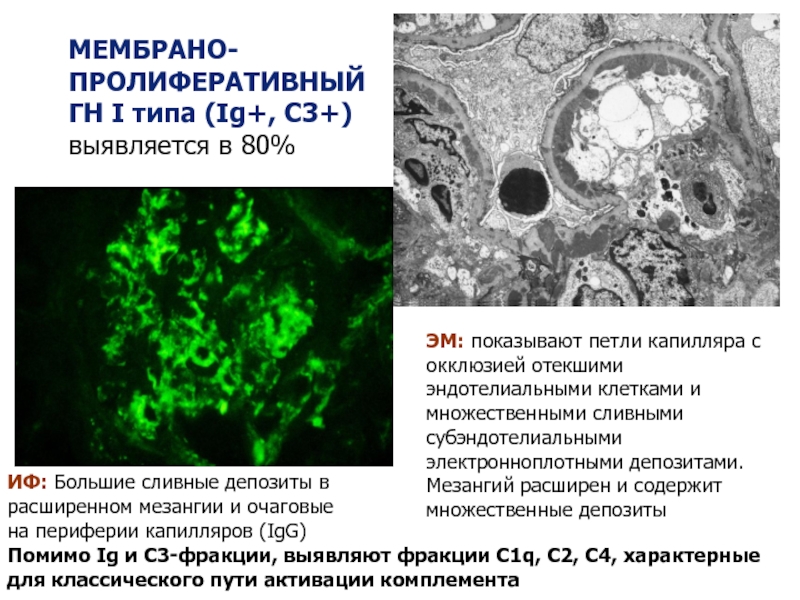
Слайд 35IgG
ИФ: Большие сливные депозиты в расширенном мезангии и очаговые на периферии
МЕМБРАНО-ПРОЛИФЕРАТИВНЫЙ ГН I типа (Ig+, C3+) выявляется в 80%
ЭМ: показывают петли капилляра с окклюзией отекшими эндотелиальными клетками и множественными сливными субэндотелиальными электронноплотными депозитами. Мезангий расширен и содержит множественные депозиты
Помимо Ig и С3-фракции, выявляют фракции С1q, С2, С4, характерные для классического пути активации комплемента
Слайд 36Трансплантационная гломерулопатия
занимает особое место.
Долгое время ее рассматривали с точки зрения
Теперь выделяют в самостоятельную нозологическую единицу с иммунным патогенезом.
Первоначально - повреждение эндотелиоцитов ауто-АТ к антигенам HLA- II класса, которые присутствуют на наружной клеточной мембране эндотелиальных клеток.
В острой фазе развивается, т.н., гломерулит, характеризующийся повреждением капилляров мигрирующими из крови, мононуклеарами и нейтрофилами.
Острую, экссудативную реакцию в клубочке (гломерулит) сменяет репаративная фаза, в которую происходит пролиферация и экспансия Мз матрикса, развивается дупликация ГБМ, и морфологическая картина при СМ становится аналогичной МБПГН Ig+.
При ИФ регистрируется отложение вдоль петель капилляров клубочка С4d - продукта активации комплемента по классическому пути
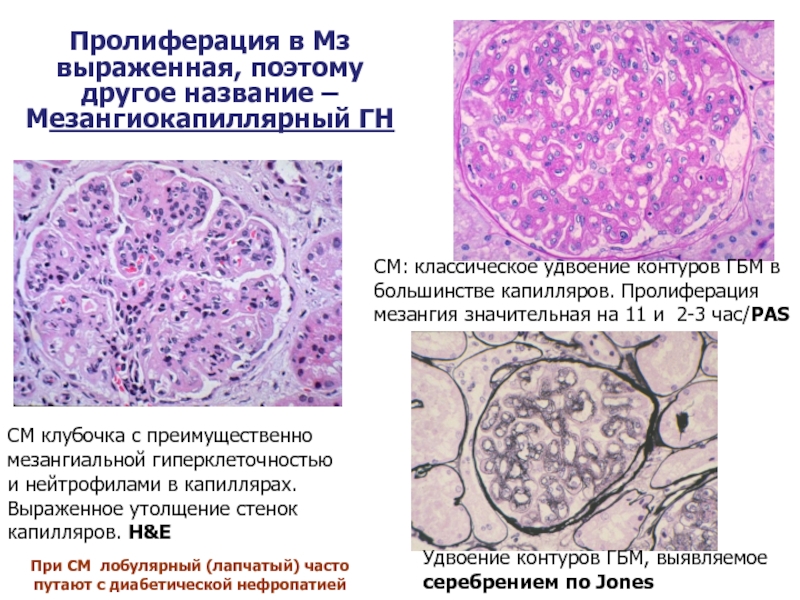
Слайд 37СМ клубочка с преимущественно мезангиальной гиперклеточностью и нейтрофилами в капиллярах. Выраженное
СМ: классическое удвоение контуров ГБМ в большинстве капилляров. Пролиферация мезангия значительная на 11 и 2-3 час/PAS
Удвоение контуров ГБМ, выявляемое серебрением по Jones
Пролиферация в Мз выраженная, поэтому другое название – Мезангиокапиллярный ГН
При СМ лобулярный (лапчатый) часто путают с диабетической нефропатией
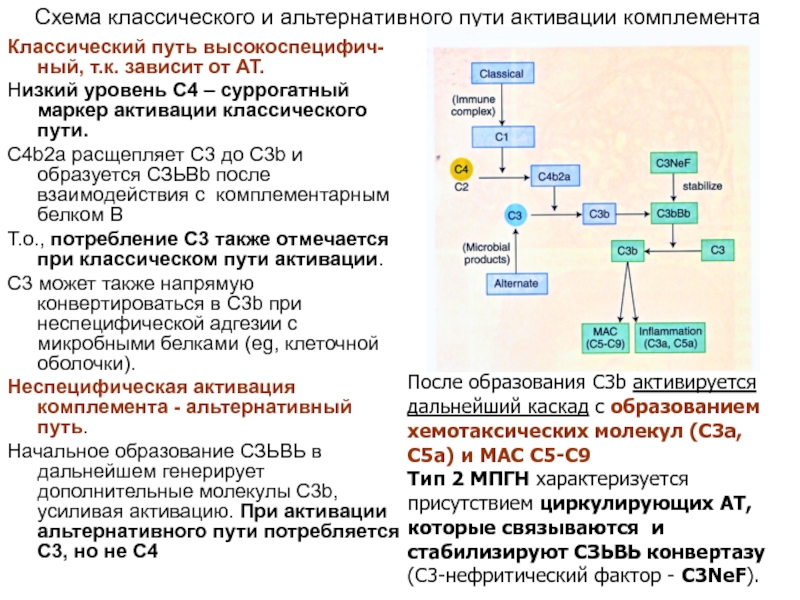
Слайд 38Схема классического и альтернативного пути активации комплемента
Классический путь высокоспецифич-ный, т.к. зависит
Низкий уровень C4 – суррогатный маркер активации классического пути.
C4b2a расщепляет C3 до C3b и образуется СЗЬВb после взаимодействия с комплементарным белком В
Т.о., потребление С3 также отмечается при классическом пути активации.
C3 может также напрямую конвертироваться в C3b при неспецифической адгезии с микробными белками (eg, клеточной оболочки).
Неспецифическая активация комплемента - альтернативный путь.
Начальное образование СЗЬВЬ в дальнейшем генерирует дополнительные молекулы C3b, усиливая активацию. При активации альтернативного пути потребляется C3, но не С4
После образования C3b активируется дальнейший каскад с образованием хемотаксических молекул (C3a, C5a) и MAC C5-C9
Тип 2 МПГН характеризуется присутствием циркулирующих АТ, которые связываются и стабилизируют СЗЬВЬ конвертазу (С3-нефритический фактор - C3NeF).
Слайд 40Figure 4. Clot formation after blood vessel injury.
The damage of blood
(B) and neutrophils. Moreover, neutrophils can be stimulated by activated platelets (C). This leads to changes in nucleus (D) and in consequence
to NET release. NETs bind the blood cells (e.g. RBC, platelets) and proteins, such as fibrin, leading to clot formation (E).
Слайд 41Figure 1. Mechanism of NET release.
Stimulation of receptors (A) by triggers
PMA or LPS) leads to the adherence of neutrophils to endothelium and to chromatin decondensation
due to histone cleavage by NE and MPO and histone hypercitrullination by PAD4 (B). In the final
phase, NETs are released and trap bacteria (C).