- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биомедицинские эксперименты: медико-социальные и этико-правовые аспекты презентация
Содержание
- 1. Биомедицинские эксперименты: медико-социальные и этико-правовые аспекты
- 2. Биомедицинские эксперименты: медико-социальные и этико-правовые аспекты. Понятие и сущность медицинского эксперимента Этико-правовые аспекты биомедицинских экспериментов
- 3. Становясь более могущественным, человек все больше обременяет
- 4. Медицинский эксперимент Это доклиническое или первое клиническое
- 5. Медицинский эксперимент Современный интерес к этико-правовым аспектам
- 6. Медицинский эксперимент В настоящее время темп разработок
- 7. Проведение клинического эксперимента возможно при соблюдении следующих
- 8. Правомерным медицинский эксперимент делает соблюдение следующих условий:
- 9. Эксперименты на человеке по характеру, по целям
- 10. Биомедицинские эксперименты включают исследования, направленные, прежде всего,
- 11. Права испытуемых. Этико-юридические аспекты биомедицинских экспериментов
- 12. Последние десятилетия привнесли в практику биомедицинских исследований
- 13. Документы, регламентирующие этические нормы проведения биомедицинских исследований
- 14. Документы, регламентирующие этические нормы проведения биомедицинских исследований
- 15. Самый последний документ, появившийся в этой области
- 16. Протокол содержит весьма жёсткие правовые нормы по
- 17. Что касается отечественного законодательства в данной области,
- 18. Кроме того, ст. 29 "Основ законодательства РФ
- 19. Проведение биомедицинских исследований сегодня фактически стало целой
- 20. Информированное согласие Основополагающим документом, определяющим этические
- 21. Информированное согласие Говоря об ИС, хотелось бы
- 22. Правильно составленное ИС должно содержать в себе
- 23. Информированное согласие Процесс получения ИС достаточно сложен,
- 24. Информированное согласие Особое внимание хотелось бы обратить
- 25. Этические проблемы экспериментов на беременных женщинах Исследования
- 26. Этические проблемы экспериментов на беременных женщинах
- 27. Юридические аспекты Кроме этических
- 28. Так в статье 40
- 29. Этические проблемы экспериментов на душевнобольных При проведении
- 30. Этические проблемы экспериментов на душевнобольных Исследования с
- 31. Этические проблемы экспериментов на детях Педиатры, чаще
- 32. Клиническое исследование на детях может рассматриваться как
- 33. ЮРИДИЧЕСКИЕ АСПЕКТЫ Кроме этических существуют
- 34. Этические проблемы экспериментов на детях
- 35. Этические проблемы экспериментов на детях Не следует
- 36. Этические проблемы экспериментов на детях ВМА (1964)
- 37. Этические проблемы экспериментов на детях В некоторых
- 38. Этические проблемы экспериментов на детях
- 39. Рекомендации Освещение различных сторон рассматриваемого вопроса позволяет
- 40. Литература Введение в биоэтику./ Под ред. Б.Г.
- 41. ТЕСТОВЫЕ ЗАДАНИЯ 1.Какой из перечисленных законодательных
- 42. ТЕСТОВЫЕ ЗАДАНИЯ 5. К лицам, не способным
- 43. Ситуационные задачи Задача№1 С позиций биоэтики не
- 44. Ключ к тестам г б, в, г
- 45. Ключ к задачам 1. Да, если исследование
Слайд 2Биомедицинские эксперименты: медико-социальные и этико-правовые аспекты.
Понятие и сущность медицинского эксперимента
Этико-правовые аспекты
Слайд 3Становясь более могущественным, человек все больше обременяет свою совесть.
Вторая половина ХХ-го
Слайд 4Медицинский эксперимент
Это доклиническое или первое клиническое проведение научно обоснованного метода диагностики,
Слайд 5Медицинский эксперимент
Современный интерес к этико-правовым аспектам биомедицинских исследований с участием человека
Слайд 6Медицинский эксперимент
В настоящее время темп разработок в биомедицинских исследованиях и информационных
К ним привлекается всё большее число специалистов, организаций, пациентов и добровольцев.
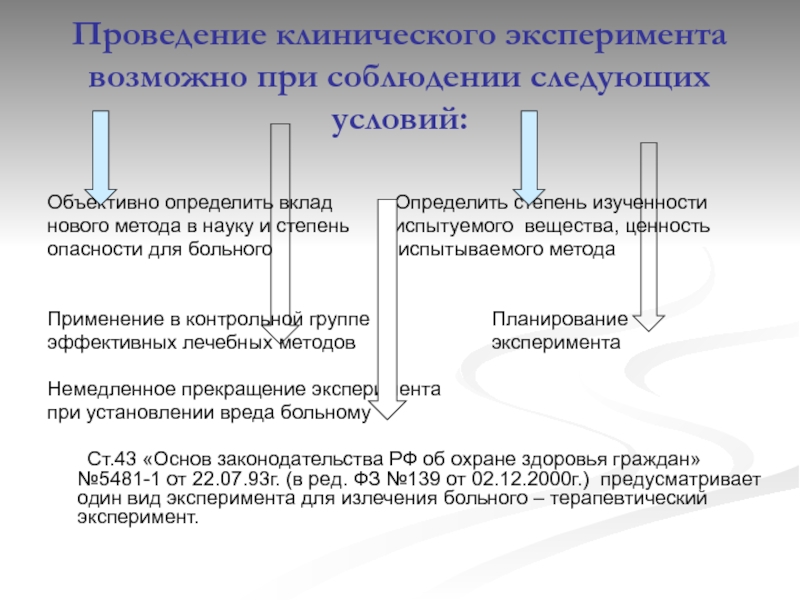
Слайд 7Проведение клинического эксперимента возможно при соблюдении следующих условий:
Объективно определить вклад
нового метода в науку и степень испытуемого вещества, ценность
опасности для больного испытываемого метода
Применение в контрольной группе Планирование
эффективных лечебных методов эксперимента
Немедленное прекращение эксперимента
при установлении вреда больному
Ст.43 «Основ законодательства РФ об охране здоровья граждан» №5481-1 от 22.07.93г. (в ред. ФЗ №139 от 02.12.2000г.) предусматривает один вид эксперимента для излечения больного – терапевтический эксперимент.
Слайд 8Правомерным медицинский эксперимент делает соблюдение следующих условий:
Научная обоснованность применение методов и
Социально полезная цель эксперимента;
Излечение, облегчение состояния больного;
Соразмерность благоприятного исхода с риском причинения тяжких последствий;
Гласность эксперимента;
Полная информация экспериментируемого об условиях проведения эксперимента;
Запрещения эксперимента на людях, болезнь которых не имеет связи с целью опыта;
Запрещение эксперимента на психически больных, заключенных, больных в терминальной стадии, новорожденных, беременных женщина.
Слайд 9Эксперименты на человеке по характеру, по целям и степени тяжести для
Научные эксперименты на больных и здоровых людях;
Научные испытания новых иммунобиологических средств с целью выявления иммуногенности и реактогенности для человека;
Научные испытания новых лечебных препаратов для выявления их эффективности и возможного побочного действия;
Новаторские метода диагностики, активной терапии, хирургических вмешательств, применяемых в практической работе врача;
Исследования с использованием различных методик, которые не показаны данному больному (т.н. «контрольные группы») и которые проводятся с целью установления новых научных факторов.
Слайд 10Биомедицинские эксперименты включают исследования, направленные, прежде всего, на расширение научной базы
В биомедицинских исследованиях используются различные формы и методы. Исследования, задачей которых является оценка безопасности, эффективности или полезности воздействия, включают изучение различных видов лечения.
Слайд 11
Права испытуемых. Этико-юридические аспекты биомедицинских экспериментов с участием человека.
Проблема биомедицинских исследований
Если раньше акцент при проведении исследований на человеке делался на неизбежности риска для субъекта эксперимента, а, следовательно, обязанность корректного экспериментатора заключался в снижении этого риска, то в конце XX - начале XXI века всё чаще начинает приниматься во внимание и возможная польза для участника эксперимента, прежде всего с точки зрения доступности самого современного (но, возможно, не досягаемого из-за дороговизны) лечения, доступа к препарату, отсутствующему в аптечной сети.
Теперь этика эксперимента должна включать не только защиту прав особо уязвимых контингентов (детей, беременных и кормящих матерей, лиц с ограниченными умственными способностями, военнослужащих), но и оценку справедливого и равного доступа к открывающимся в результате такого исследования возможностям терапии (например, испытанию препаратов для лечения ВИЧ/СПИДа).
Слайд 12Последние десятилетия привнесли в практику биомедицинских исследований увеличение числа непосредственных сторон-участников.
Такое регулирование было предложено и сегодня осуществляется под эгидой Всемирной Медицинской Ассоциации (ВМА), созданной в 1947 г. и объединяющей национальные врачебные ассоциации более 60 государств, разрабатывающая его принципы, нормы и механизмы.
Слайд 13Документы, регламентирующие этические нормы проведения биомедицинских исследований с участием человека
Проблемой
Слайд 14Документы, регламентирующие этические нормы проведения биомедицинских исследований с участием человека
Этика эксперимента
Одной из структур, действующей в рамках Совета Европы, является Руководящий комитет по биоэтике, который разрабатывает документы, впоследствии утверждаемые Парламентской ассамблеей и Комитетом министров Совета Европы. Юридическим документом, регулирующим биомедицинские исследования, является Конвенция Совета Европы о защите прав и достоинств человека в связи с использованием достижений биологии и медицины, Конвенция о правах человека и биомедицине, принятая в Овьедо (Испания) в 1997 г. Ради краткости ее часто называют Конвенцией о биоэтике.
Этот документ обязателен для исполнения всеми членами этой организации (в том числе и Россией) после его ратификации. В нём имеется норма, запрещающая проведение исследований на человеческих эмбрионах (а дополнительный протокол 1998г. запрещает клонирование человека)
Слайд 15Самый последний документ, появившийся в этой области – Дополнительный протокол к
Общие принципы проведения биомедицинских исследований таковы:
- интересы и благополучие испытуемого должны превалировать над исключительными интересами общества или науки;
- подтверждается принцип свободы исследования, но при условии, что оно проводится в соответствии с положениями настоящего протокола и других правовых норм, направленных на защиту человеческого существа.
Далее, исследование может проводиться только в том случае:
- если нет сравнимых по эффективности альтернатив;
- выгоды для испытуемого должны превышать риск, которому он подвергается;
- если же участие в исследовании вообще не несёт прямой выгоды испытуемому (так называемые не терапевтические исследования), то риск не должен превышать некоторого уровня, определяемого как приемлемый.
Слайд 16Протокол содержит весьма жёсткие правовые нормы по защите здоровья, прав и
Прежде всего - это необходимость этической экспертизы каждого исследовательского проекта, коль скоро намечаемое исследование будет проводиться с участием людей в качестве испытуемых.
Второе принципиальное требование – необходимость обязательного информирования испытуемого о целях и смысле исследования, о риске, которому он будет подвергаться, о гарантиях его безопасности и о возмещении возможного ущерба, вызванного участием в исследовании и получения добровольного согласия испытуемого
Слайд 17Что касается отечественного законодательства в данной области, то здесь, прежде всего,
В то же время статья содержит и одну чересчур жёсткую норму, согласно которой дети до 15 лет могут участвовать в испытаниях новых лекарственных препаратов, методов и т.п. только по жизненным показаниям. В реальности, конечно, эта " норма постоянно нарушается, да иного и быть не может - в противном случае какой - бы то ни было прогресс в области профилактики, диагностики и лечения детей был бы просто невозможен. В то же время статья содержит и одну чересчур жёсткую норму, согласно которой дети до 15 лет могут участвовать в испытаниях новых лекарственных препаратов, методов и т.п. только по жизненным показаниям. В реальности, конечно, эта норма постоянно нарушается, да иного и быть не может - в противном случае какой бы то ни было прогресс в области профилактики, диагностики и лечения детей был бы просто невозможен.
Слайд 18Кроме того, ст. 29 "Основ законодательства РФ об охране здоровья граждан"
Далее существует норма, содержащаяся в ст. 5 Закона "О психиатрической помощи и гарантиях прав граждан при её оказании« №3185-1 от 02.07.92г. (в ред. ФЗ №122 от 22.08.2004г.), в которой провозглашается право лица, страдающего психическим расстройством, давать согласие или отказываться от участия в исследованиях (но, между прочим, ничего не говорится о необходимости при проведении исследований получать такое согласие, т.е. реально обеспечивать это право).
Слайд 19Проведение биомедицинских исследований сегодня фактически стало целой индустрией, в которой пересекаются,
Слайд 20Информированное согласие
Основополагающим документом, определяющим этические принципы проведения биомедицинских исследований с
Слайд 21Информированное согласие
Говоря об ИС, хотелось бы обсудить несколько особенно важных аспектов:
какие основные моменты должна отражать форма ИС;
каковы требования, предъявляемые к тексту;
когда и как получать ИС;
какие действия следует предпринять при внесении изменений или поправок в тексте ИС, возникающих в ходе исследования;
каковы требования к ИС для пациентов, относящихся к особо уязвимому контингенту (дети, беременные, военнослужащие, лица с когнитивными нарушениями, пожилые и т.д.).
Слайд 22Правильно составленное ИС должно содержать в себе следующие разделы:
положение о том,
цели клинического испытания;
виды лечения (включая плацебо) и вероятность случайного распределения пациентов между различными видами лечения;
описание процедур исследования;
обязанности пациентов, участвующих в испытании;
предсказуемый риск, возможные неудобства;
ожидаемая польза;
альтернативные методы лечения (преимущества и недостатки);
компенсации за ущерб здоровью;
условия оплаты участникам за участие в исследовании (если предусмотрено);
возможные расходы субъекта в ходе исследования;
положение о добровольности участия в исследовании;
возможность отказа от участия в исследовании в любое время без неблагоприятных последствий;
конфиденциальность информации и гарантия того, что имена участников исследования не будут указаны при публикации результатов исследования;
возможность проведения проверок (при соблюдении конфиденциальности) представителями официальных инстанций;
имена и телефоны контактных лиц;
ожидаемая продолжительность участия в исследовании;
приблизительное (планируемое) количество участников исследования;
предупреждение о том, является ли участие в исследовании препятствием для участия в других программах.
Слайд 23Информированное согласие
Процесс получения ИС достаточно сложен, проблемы возникают даже у опытных
Слайд 24Информированное согласие
Особое внимание хотелось бы обратить на получение ИС у пациентов,
Имеет свои особенности и получение ИС у неизлечимых (например, онкологических) больных. Такие пациенты более подвержены принуждению или неоправданному стимулированию, а риск при исследованиях на них более чем минимальный.
В некоторых случаях можно включать пациента в исследование и без ИС (например, в реанимационной практике у больных, находящихся в бессознательном состоянии, доставленных в клинику без сопровождения родственников).
Слайд 25Этические проблемы экспериментов на беременных женщинах
Исследования на беременных женщинах должны проводиться
Цели исследования и условия его проведения иногда представляют большую сложность для проведения этической экспертизы ввиду наличия "конфликта интересов" между участниками исследования (беременная женщина и плод) и между участниками исследования и их ближайшими родственниками. В этом случае необходимо обратить внимание на следующие моменты:
направлено ли исследование непосредственно на улучшение здоровья женщины;
определена ли степень риска для плода;
требуется ли согласие отца на проведение исследования.
Слайд 26Этические проблемы экспериментов на беременных женщинах
Требуются согласия матери и отца
цель исследования - это помощь здоровью матери;
личность отца не установлена или не подтверждена;
беременность является результатом изнасилования.
Слайд 27Юридические аспекты
Кроме этических норм, при проведении клинических исследований
Хельсинская декларация (2000 г.);
Конституция РФ;
«Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. №5481-1 (в ред. ФЗ №139 от 02 декабря 2000 г.);
Федеральный Закон от 22 июня 1998 г. №86-ФЗ "О лекарственных средствах" (с изменениями от 2 января 2000 г.; 30 декабря 2001 г.), ст. 40 ч.7 п.2;
Слайд 28 Так в статье 40 ч.7 закона "О лекарственных
несовершеннолетних, не имеющих родителей;
беременных, за исключением случаев, если проводятся клинические исследования лекарственных средств, предназначенных для беременных, когда необходимая информация может быть получена только при исследованиях лекарственных средств на беременных и когда полностью исключён риск нанесения вреда беременной и плоду;
военнослужащих;
отбывающих наказание в местах лишения свободы, а также находящихся под стражей в следственных изоляторах.
Слайд 29Этические проблемы экспериментов на душевнобольных
При проведении исследований с привлечением лиц с
Желание освободиться из специализированного лечебного учреждения может заставить человека, особенно, если он помещен на лечение принудительно, участвовать в исследовании, чтобы показаться "рациональным" и желающим "сотрудничать" с теми, кто принимает решение об его освобождении. При исследованиях, направленных на изучение эмоционально чувствительных тем, важно охранять частную жизнь всех субъектов и конфиденциальность собираемой информации. Многие пациенты не хотят, чтобы разглашался сам факт их обращения к врачу или помещения в специализированное лечебное учреждение.
Слайд 30Этические проблемы экспериментов на душевнобольных
Исследования с привлечением субъектов с психическими нарушениями
• они представляют собой единственную подходящую для исследования группу населения;
• целью исследования является вопрос, непосредственно касающийся именно этой группы населения;
• проведение исследования влечёт за собой не более чем минимальный риск.
• исследование, влекущее за собой более чем минимальный риск, может быть приемлемо только в том случае, если целью исследования является терапия конкретных субъектов и возможный риск соизмерим с ожидаемой пользой.
Слайд 31Этические проблемы экспериментов на детях
Педиатры, чаще всего, вынуждены использовать в своей
Вместе с тем, иногда невозможно получить необходимую информацию на основании результатов исследований на старших возрастных группах и отсутствие научно-исследовательской работы в педиатрии подвергает больных детей ещё большему риску. И напротив, многие болезни взрослых начинаются в детском возрасте, поэтому изучение заболеваний маленьких детей и даже антенатальные исследования могут определить стратегию профилактики болезней (например, таких, как диабет или гипертония), что может иметь большое значение для здоровья общества в целом.
Научная ценность получаемых в ходе клинических исследований результатов должна быть уравновешена соблюдением этических норм, направленных на защиту каждого участника испытания. Таким образом, очевидно, что, прогресс в лечении детей не может быть достигнут без проведения исследований именно на данной возрастной группе, а результаты могут иметь большое значение, в том числе и для взрослых пациентов.
Слайд 32 Клиническое исследование на детях может рассматриваться как этически приемлемое если:
необходимые данные не могут быть получены на взрослых пациентах:
исследование рационально спланировано с учётом минимизации дискомфорта и инвазивных процедур;
исследование направлено на получение важных результатов, направленных на совершенствование диагностики и лечения или способствующих обобщению и систематизации данных о детских заболеваниях;
исследование базируется на основании результатов исследований на лабораторных животных и взрослых пациентах, углублённом знании истории проблемы таким образом, что ожидаемые результаты лишь подтвердят его обоснованность;
ожидаемая польза от исследования превышает потенциальный риск, а потенциальный риск является минимальным, т.е. не большим, чем при выполнении обычных лечебных и диагностических процедур при данной патологии;
исследователь обладает достаточной информацией о "предсказуемости" любых возможных неблагоприятных последствий исследования;
испытуемым и их законным представителям предоставлена вся информация, необходимая для получения их осознанного и добровольного согласия.
Слайд 33ЮРИДИЧЕСКИЕ АСПЕКТЫ
Кроме этических существуют юридические нормы, регулирующие порядок проведения
В настоящее время в России правовой основой для проведения клинических исследований с участием детей являются следующие документы:
Конституция РФ;
«Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. №5481-1 (в ред. ФЗ №139 от 02 декабря 2000 г.);
Федеральный Закон №86-ФЗ "О лекарственных средствах" от 22 июня 1998 г. (в ред. от 30.12.2001г.)
Слайд 34Этические проблемы экспериментов на детях
При исследованиях на детях важнейшими
защита здоровья и прав детей при проведении исследований;
оценка научной и клинической обоснованности исследования и важности предполагаемых результатов.
Клинические исследования на детях можно инициировать лишь в тех случаях, когда необходимые данные невозможно получить на пациентах других возрастных групп. Исследования новых методов терапии должны проводиться только на тех группах пациентов, для которых эти методы разрабатываются
Слайд 35Этические проблемы экспериментов на детях
Не следует привлекать к клиническим исследованиям детей,
Пациенты должны участвовать в принятии решения соразмерно своему развитию и предоставлять своё согласие всегда, когда это допустимо. Родители и врачи не должны исключать детей и подростков из процесса принятия решения без уважительных на то причин. Доктрина информированного согласия напоминает нам об уважении прав личности на полную и точную информацию, позволяющую осуществить своё право принятия решения.
Слайд 36Этические проблемы экспериментов на детях
ВМА (1964) гласит, что "... согласие ребёнка
Слайд 37Этические проблемы экспериментов на детях
В некоторых случаях несовершеннолетние-подростки, имеют право самостоятельно
"независимые" несовершеннолетние (материально независимы и/или не живут дома; состоят в браке; беременные или сами являющиеся родителями; объявленные независимыми в судебном порядке);
"зрелые" несовершеннолетние или нуждающиеся в лечении по поводу "взрослых" болезней (передающихся половым путём, лекарственной или алкогольной зависимости и т.п.).
Разумеется, что доктрина "информированного согласия" может иметь лишь ограниченное применение в педиатрии. Только пациенты с адекватной способностью принимать решения и законными полномочиями могут давать своё информированное согласие.
Слайд 38Этические проблемы экспериментов на детях
В процессе получения информированного
соответствующие развитию сведения для понимания природы его состояния;
рассказ о том, чего он может ожидать от диагностического или лечебного вмешательства;
оценка понимания ситуации пациентом и факторов, влияющих на его ответ (в том числе, не было ли оказано неподобающего давления для получения согласия на проведение диагностического или лечебного вмешательства);
просьбу к пациенту выразить готовность принять предлагаемые меры.
По мере взросления дети должны становиться основными партнерами врача в принятии решения, принимая ответственность от родителей. Получение согласия ребёнка - это интерактивный процесс, при котором стороны делятся информацией, оценивают её и принимают совместное решение. Это ни в коем случае не должно превратиться в ещё один бюрократический механизм в виде обязательной "формы согласия".
Слайд 39Рекомендации
Освещение различных сторон рассматриваемого вопроса позволяет сделать следующие выводы:
В качестве объектов
испытатели, для большинства из которых участие в эксперименте — обыкновенная работа.
Опасность участия в опытах сведена к минимуму, так как допускаются к испытаниям только
абсолютно здоровые люди.
К настоящему времени сформировались два главных права «подопытного» — добровольность
и возможность отказаться от участия в эксперименте в любой момент без объяснения причин.
На восстановление здоровья, как правило, дается столько же времени, сколько занял опыт, под
пристальным контролем врачей, на усиленном питании, иногда — в санатории.
Беременная женщина может быть субъектом исследования только тогда, когда цель
исследования отвечает потребностям здоровья матери и плода, а риск для их здоровья при
этом минимален.
Запрещено привлекать к испытаниям психически неполноценных людей без их согласия, но не
разработан механизм получения такого согласия, т.е. реально это право не обеспечено.
Клинические исследования на детях можно инициировать лишь в тех случаях, когда
необходимые данные невозможно получить на пациентах других возрастных групп. Набор
пациентов при проведении исследования основывается на добровольном согласии пациента
и/или его родителей или опекунов.
Слайд 40Литература
Введение в биоэтику./ Под ред. Б.Г. Юдина, П.Д. Тищенко. М., 1998
Кубарь
«Основы законодательства РФ об охране здоровья граждан»/22.07.93. №5481-1 (в ред. ФЗ №139 от 02.12.2000г.)
Приказ МЗ Рф «О порядке принятия решения о проведении клинических испытаний лекарственных средств»./24.03.2000, №103
Силуянова И.В. Биоэтика в России: ценности и законы. – М., 2001
Сторожанов Г.И., Малышева Е.А. Этические комитеты: их роль в проведении клинических исследований// Медицинское право и этика. 2002, №4
Тищенко П.Д. Биоэтика. – Этика: Энциклопедический словарь. – М., 2001
Кэмпбелл А. Джилетт, Джонс Г. Медицинская этика. Под ред. Ю.М. Лопухина, Б.Г. Юдина. – М.,2005
Щамов И.А. Биомедицинская этика. – М., 2005
Леонтьев О.В. Медицинская помощь: права пациента. – Сиб. «Невский проспект», 2002
Уильямс Джон Р. Руководство по медицинской этике. Русское издание под ред. Ю.М. Лопухина, Б.Г. Юдина, Л.А. Михайлова. – М., 2006
Глыбочко П.В., Жданов Г.Г., Хижняк Д,Г. Правовые аспекты медицины. – Саратов, 2006
Слайд 41ТЕСТОВЫЕ ЗАДАНИЯ
1.Какой из перечисленных законодательных актов, не регулирует эксперименты с
а) «Женевская Декларация Всемирной Медицинской Ассоциации».
б) «Международный Кодекс Медицинской Этики».
в) «Конвенция о защите прав и достоинства человека в связи с применением достижений биологии и медицины:
г) «Конвенция о правах человека и биомедицине».
д) «Закон о защите прав потребителей».
е)«Хельсинская Декларация»
2.Какие существуют правила, необходимые для проведения биомедицннских экспериментов с участием человека?
1) уважение к личности
2) правило конфиденциальности
3) достижение пользы
4) справедливость
3. Конвенция о правах человека и биомедицине" (1997 г.) при использовании достижений биологии и медицины обязуется защищать и гарантировать все, кроме:
а) уважения достоинства человека
б) защиту индивидуальности каждого человеческого существа
в) уважение целостности и неприкосновенности личности
г) соблюдение прав человека и основных свобод
д)обеспечения экономической выгоды и материального интереса
4. Вмешательство в сферу здоровья человека может осуществляться:
а)на основании свободного, осознанного и информированного согласия больного
б) на основании медицинских показаний
в) на основании редкости картины заболевания и его познавательной ценности
г) на основании требования родственников
д) на основании извлечения финансовой выгоды
Слайд 42ТЕСТОВЫЕ ЗАДАНИЯ
5. К лицам, не способным дать информированное согласие, относятся все,
а) несовершеннолетних; б) лиц с умственной неполноценностью; в) лиц с тяжелыми формами заболеваний, блокирующими сознание; г) лиц женского пола; д) граждан с иностранным подданством.
6. Какие существуют правила, необходимые для проведения биомедицинских экспериментов с участием человека?
а) уважение к личности;
б) правило конфиденциальности;
в) достижение пользы;
г) справедливость;
д) информированное согласие.
7. При проведении любого вмешательства в сферу здоровья, включая вмешательство с исследовательскими целями должно соблюдаться все, кроме:
а) законы РФ;
б) международное законодательство;
в) профессиональные биомедицинские этические стандарты;
г) моральные представления пациента;
д) нормы библейской морали;
е) общечеловеческие ценности;
ж) корпоративные профессиональные интересы;
з) экономические интересы исследователя.
Слайд 43Ситуационные задачи
Задача№1
С позиций биоэтики не этичными считают биомедицинские эксперименты на детях,
Задача№2
Больная М.,15 лет, была доставлена из пионерского лагеря машиной «скорой помощи» в приемное отделение районной больницы с диагнозом «острый энтероколит». Больна в течение четырех дней. В приемном отделении был установлен диагноз «аппендикулярный абсцесс», и девочка была оперирована в срочном порядке. Согласие девочки на операцию было получено. Прибывший через 3 часа отец девочки подал жалобу на действия дежурного хирурга, так как операция была выполнена без согласия родителей лица, не достигшего совершеннолетнего возраста. Справедливы ли претензии отца девочки?
Задача№3
В детскую городскую больницу родителями был доставлен 7-летний ребенок с диагнозом «анемия». Требовалось срочное переливание крови. Родители от этой процедуры отказались, сославшись на то, что это им не позволяют религиозные убеждения. Врачи не стали делать данную процедуру. Ребенок умер от того, что ему своевременно не перелили кровь. Подлежит ли ответственности медицинский персонал?
Слайд 45Ключ к задачам
1. Да, если исследование в данной области провести на
2. Нет, так как в соответствии со ст. 32 «Основ законодательства РФ об охране здоровья граждан» лица, достигшие возраста 15 лет имеют право самостоятельно принимать решение о согласии или отказе от лечения.
3. Нет. Действия медперсонала соответствуют ст. 34 «Основ законодательства РФ об охране здоровья граждан».