- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Қанның биохимиясы презентация
Содержание
- 1. Қанның биохимиясы
- 2. Мақсатты: - қанның физико-қасиеттерін, олардың
- 3. Қанның биохимиясы.Міндеттері. Қан-сүйық тін.Ол әртүр лі жасушалардың
- 4. Сонымен қатар: газдарды тасымалдау / О2
- 5. -термореттеу осмотикалық / қан тамырларын да осмотикалық
- 6. Қан-сүйық тін. Ол жасушалардан \ формалық
- 7. Қанның биохимиясы Физико-химиялық қасиеттері.
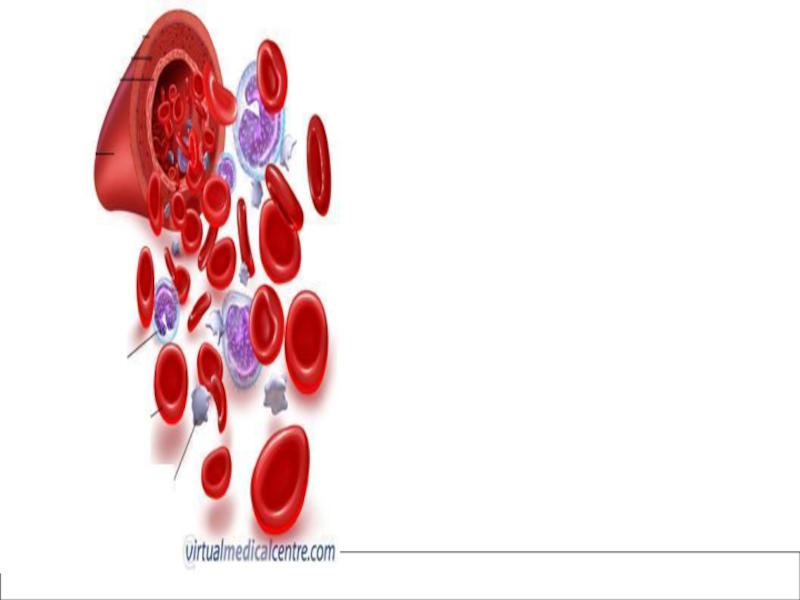
- 8. Қанның жасушалары
- 9. НЕЙТРОФИЛДЕР Фагоцитоз арқылы адам ағзасын микроорганизм
- 10. БАЗОФИЛДЕР Аллергиялық реакцияларға , қан үйюна қатысады.
- 11. ЭОЗИНОФИЛДЕР Аллергиялық реакцияларға қатысады \гистаминның синтезі\. Жасушаны
- 12. МОНОЦИТТЕР Құрамында лизосомальды ферменттер бар \ гидролаза
- 13. ЛИМФОЦИТТЕР Иммуноглобулиндерді синтездей ді \ энергияның қайнар көзі – гликолиз \
- 14. Эритроциттер
- 19. Гематокриты мөлшерді эритроциттердін көлемімен көрсетеді. Гематокрит ерлерде
- 21. Қанның сары суы –фибриногенсіз плазма.
- 22. КАННЫН ФИЗИКО-ХИМИЯЛЫК КОНСТАНТАЛАРЫ.
- 23. Қанның рН Ацидоз ---- N 7,35-7,45 -----
- 24. Гемоглобинды буферлы жүйе 75% ННв02 –
- 25. Бикарбонатты буфер Н2СО3
- 26. Фосфатты буфер Н2РО4 -
- 27. Эритроциттердің биохимиясы Барлық жасушалрдын 36-48
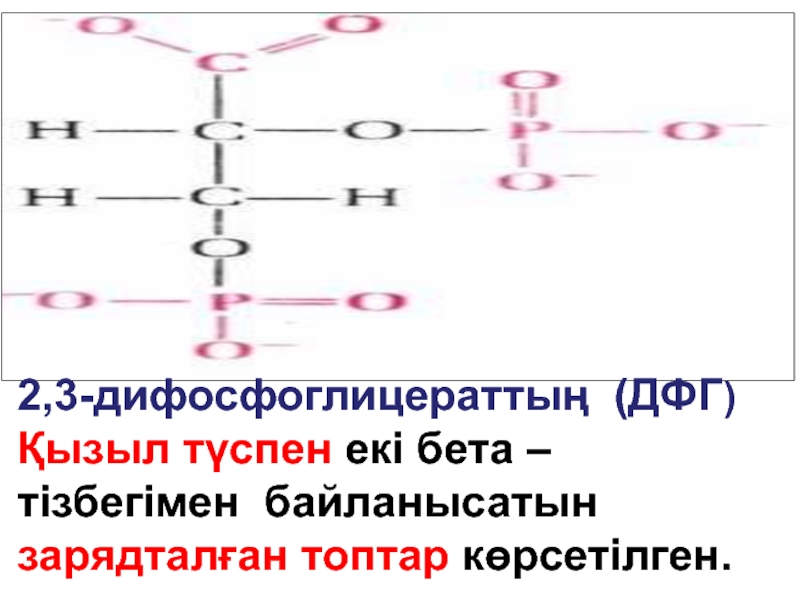
- 28. Эритроциттерде заттар алмасуының ерекшеліктері. Анаэробті гликолиз жоғары .Ол- энергияның және 2,3-дифосфоглицераттың қайнар көзі.
- 29. 2,3-дифосфоглицераттың (ДФГ) Қызыл түспен екі бета – тізбегімен байланысатын зарядталған топтар көрсетілген.
- 30. ДФГ- ң (қызыл түс) Нв- нің орта лық, ішкі бөлігінде орналасуы.
- 31. 2,3-дифосфоглицерат Нв аллостериялық эффекторы, О2-ң
- 32. Эритроциттер Эритроциттер -қанның формалық элементтері.
- 33. Эрит, биол,мәні: Тіндерді О2 қамтамасыз ету
- 34. Эритроциттер метаболизмнің ерекшеліктері.
- 35. Эритроциттер Эритроциттердің негізгі ақуызы - Нв
- 36. Эритроциттерде әртүрлі міндеттер атқаратын ақуыздар бар-
- 37. Нв эритроциттердің негізгі ақуызы. Прост.топ.-
- 38. Гемоглобин / Нв / Ақуыздар ішіненең ең
- 39. Гемоглобин
- 41. Темірдің координациялық байланыстары
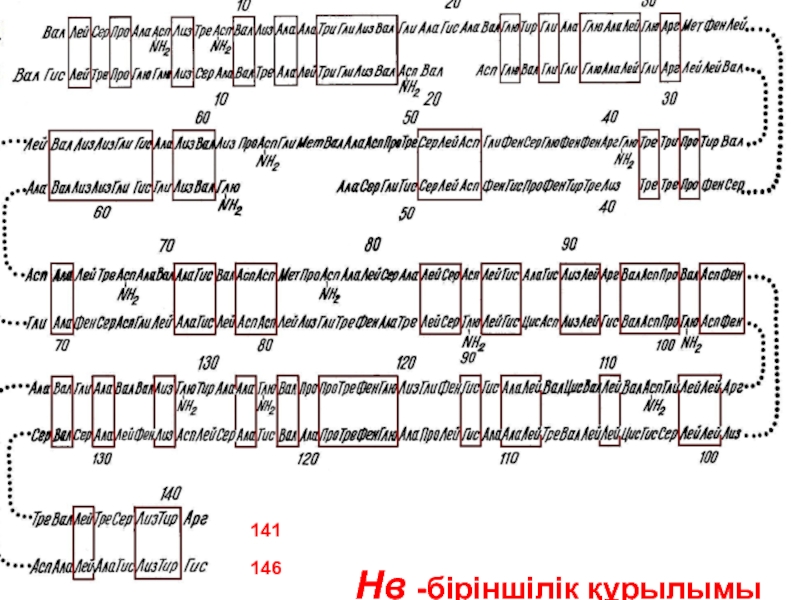
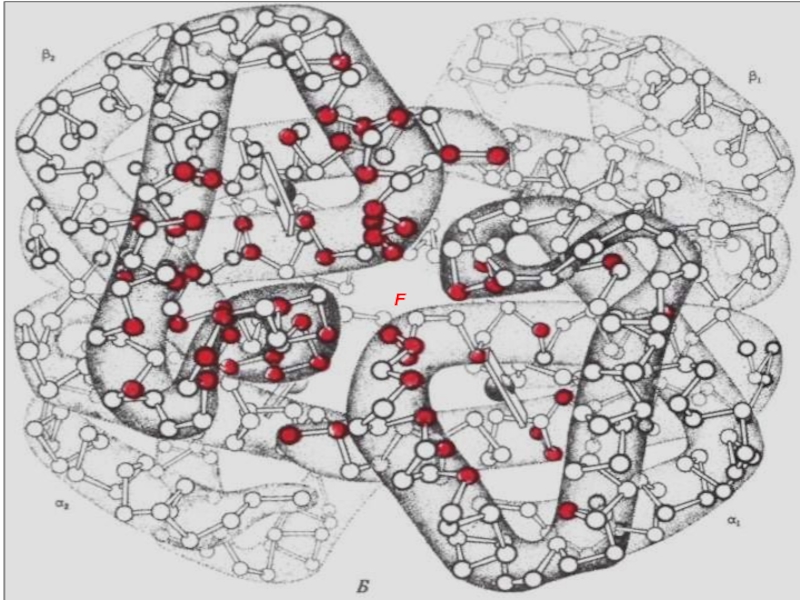
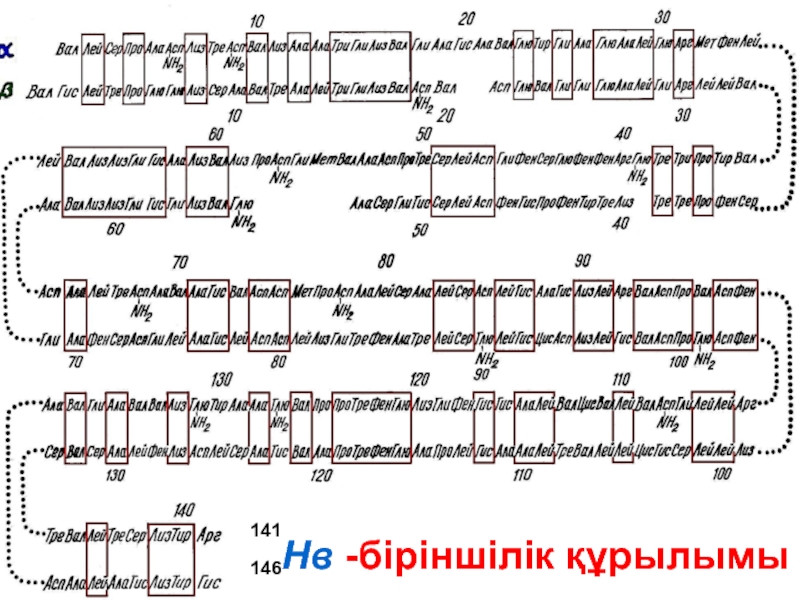
- 42. Нв -біріншілік құрылымы 141 146
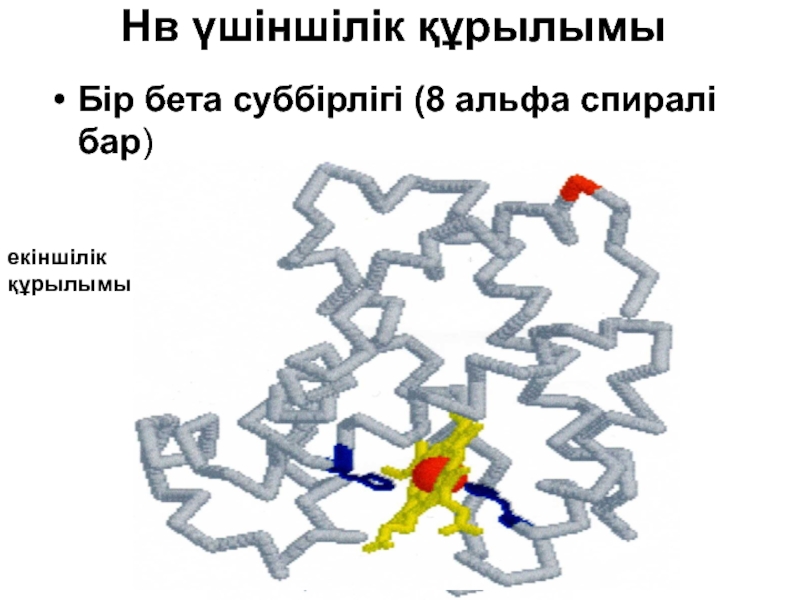
- 43. Нв үшіншілік құрылымы Бір бета суббірлігі (8 альфа спиралі бар) екіншілік құрылымы
- 44. Үшіншілік құрылым Тұрақтандыратың байланыстар: Сутегті; Ионды; Гидрофобты қарым-қатынастар; Ковалентті көлденен байланыстар.
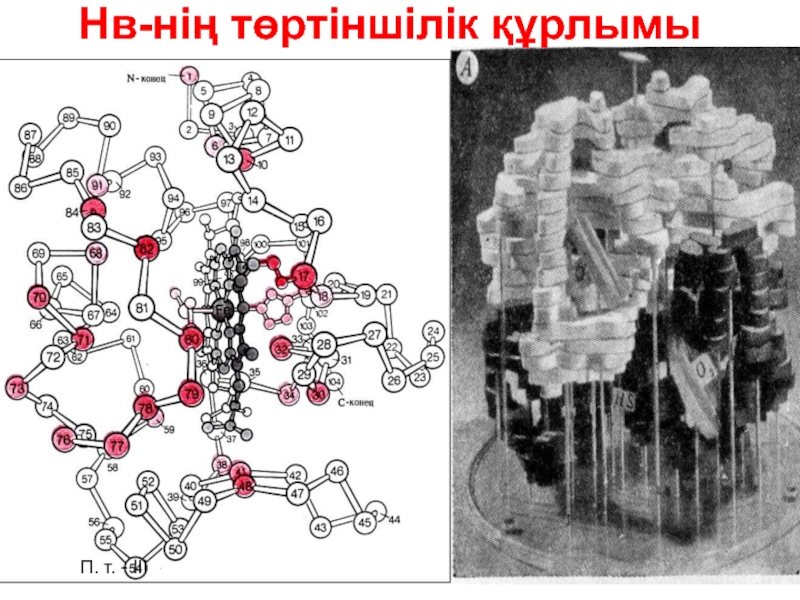
- 45. Нв-нің төртіншілік құрлымы П. т. - ІІІ
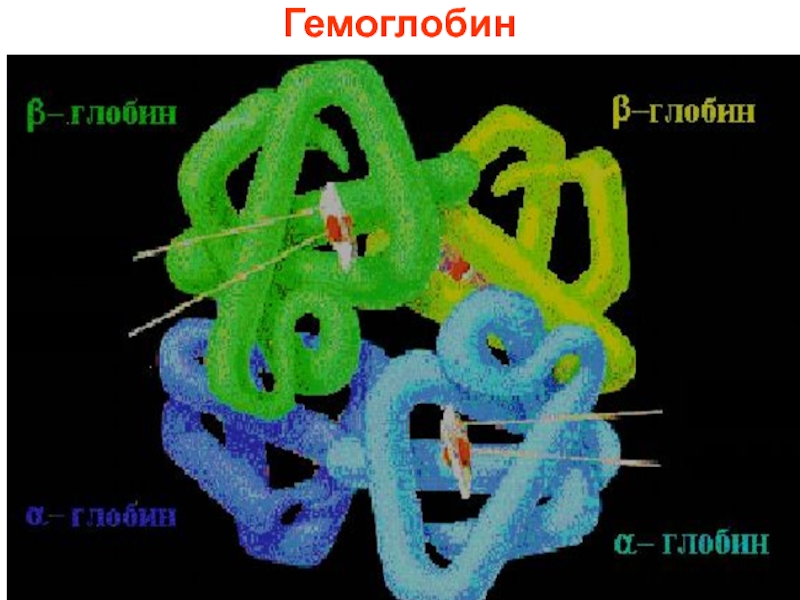
- 46. Гемоглобин
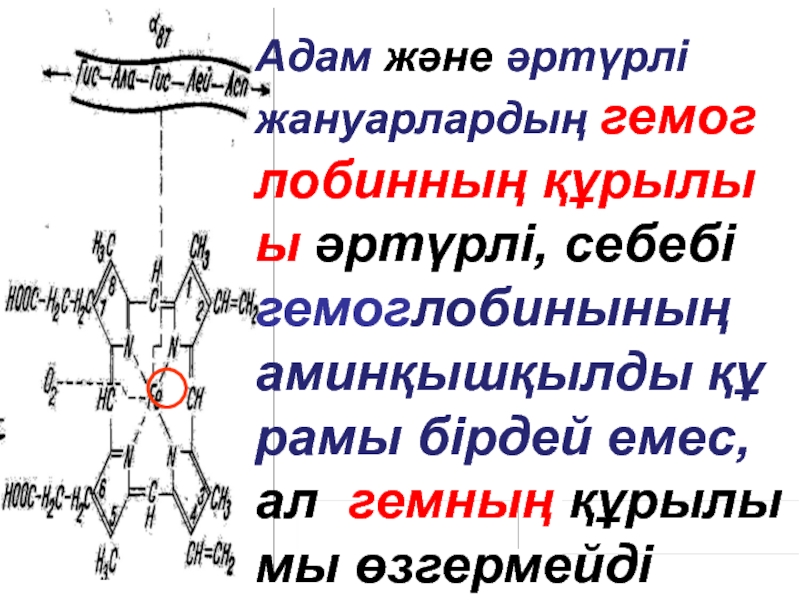
- 47. . Адам және әртүрлі жануарлардың
- 48. Гем , ортасында Fe2+ ион орна ласқан.
- 49. Эмбриональді жағдайдан ересек жағдайға дейін адамның эритроциттерінде
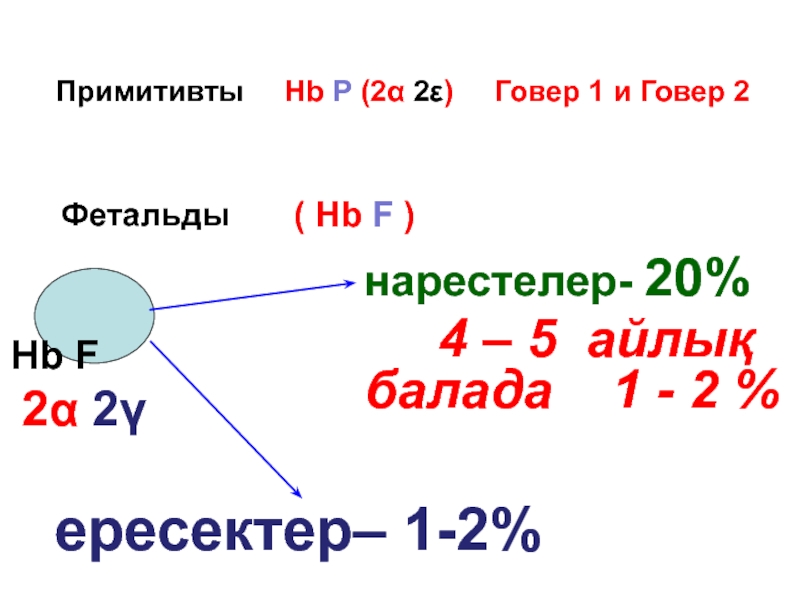
- 50. Примитивты гемоглобин (НвР) Эмбрионның эритроциттерінде негізінен
- 51. Примитивты Hb P
- 52. Фетальды гемоглобин ( F) Эмбрионда- 9
- 53. Ересектердің гемоглобины(А)
- 54. Ересектердің гемоглобины (Нв А) Гемоглобинның Нв А
- 55. НвА мен салыстырғанда НвF оттекке туыстығы жоғары,
- 56. Адам қанында 300-ден артық , мутация нәтижесінде
- 57. F
- 58. Гемоглобин аурулары- гемоглобизноздар. Олар екіге бөлінеді: гемоглобинопатиялар талассемиялар
- 59. Гемоглобинопатиялар: қалыпты гемоглобиннің біріншілік полипептидтік
- 60. Гемоглобиноз Темір жетіспеуілік анемиялары: -темір жетіспеуші лігінен гем синте зінің бұзылуы;
- 61. Мутация нәтижесінде түзілетін аномальды / патологиялық
- 62. - АМҚ алмасуы Glu 16 Lis
- 63. Гемоглобинде кездесетін мутациялар Әсіресе мутациялар
- 64. - АМҚ алмасуы Lys Гемоглобиннің β-тізбегіндегі мутациялар
- 65. Нв -біріншілік құрылымы 141 146
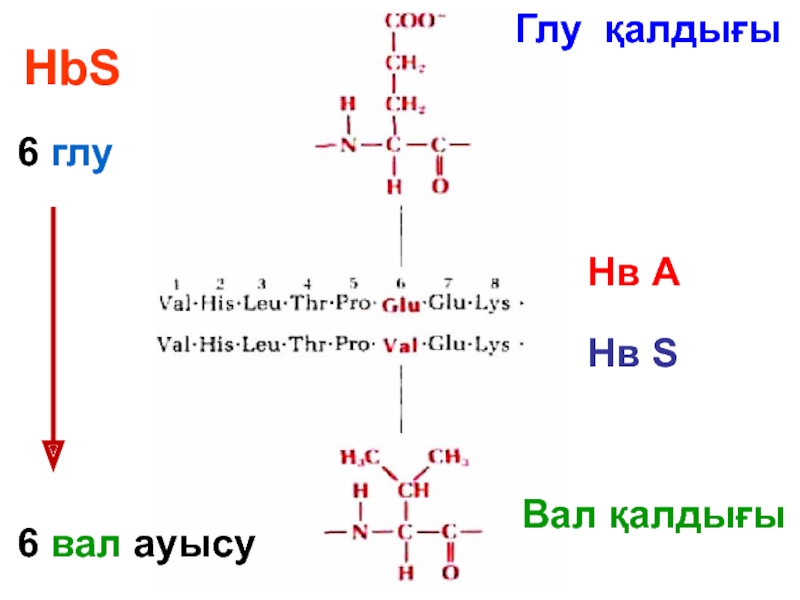
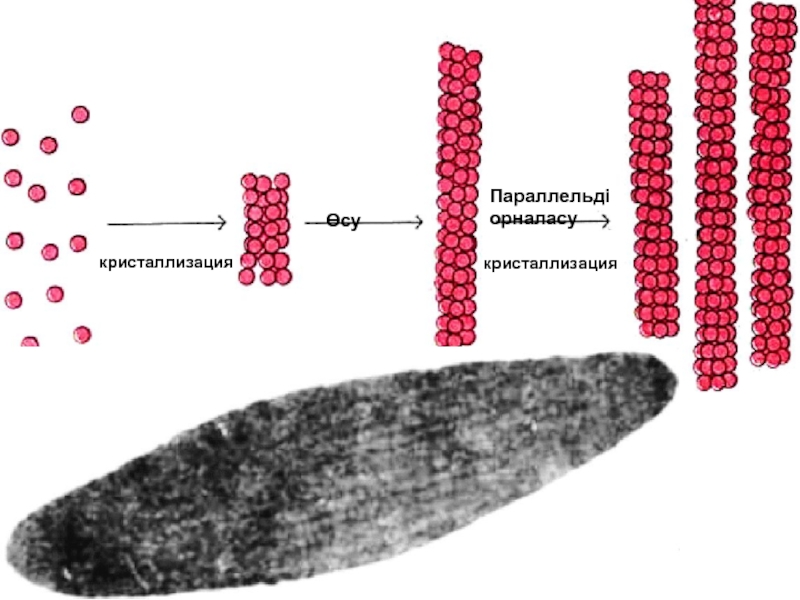
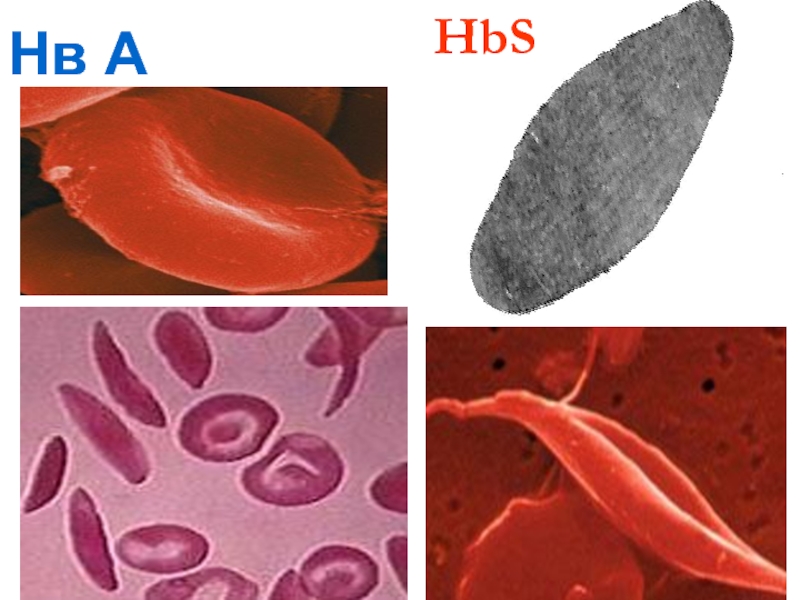
- 66. HbS 6 глу
- 67. Нв S Нәтижесінде Нв-нен оттек
- 68. кристаллизация Өсу Параллельді орналасу кристаллизация
- 69. Нв А HbS
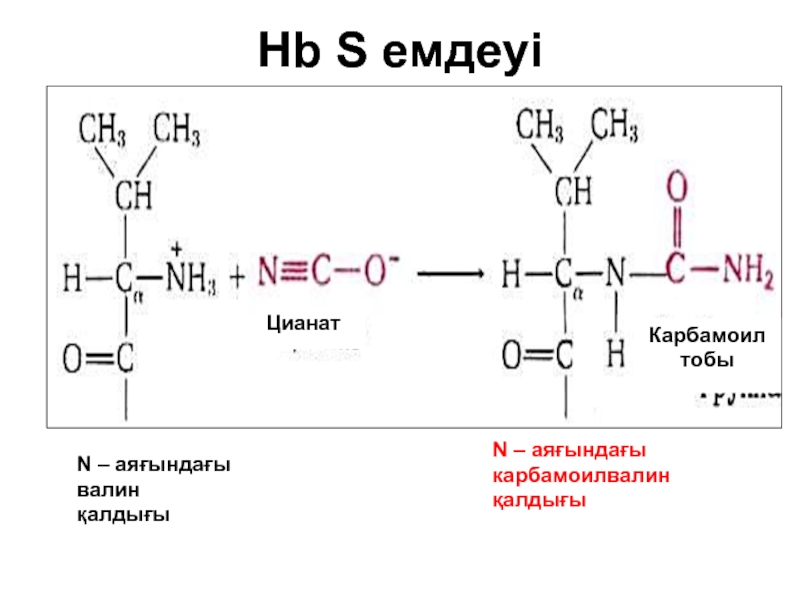
- 72. Hb S емдеуі
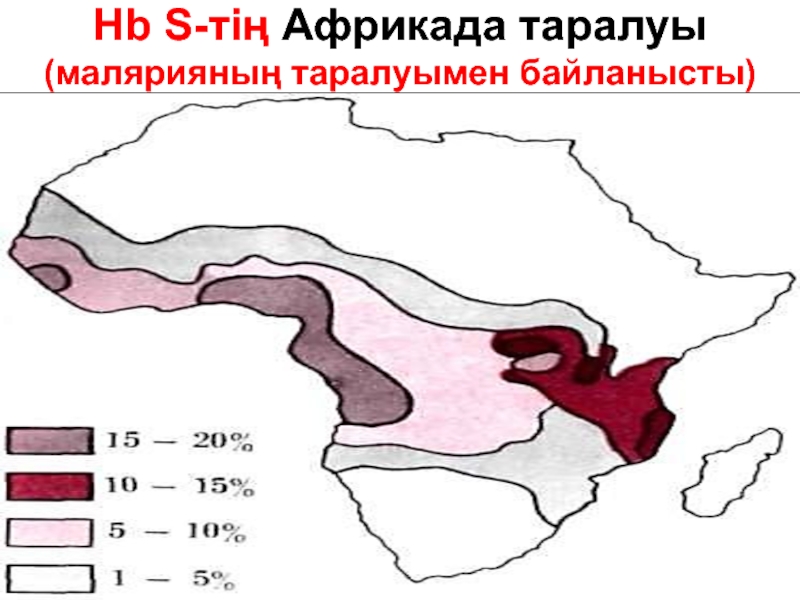
- 73. Hb S-тің Африкада таралуы (малярияның таралуымен байланысты)
- 74. Гемоглобин О2, СО2, СО байланысканда түзіледі: оксигемоглобин
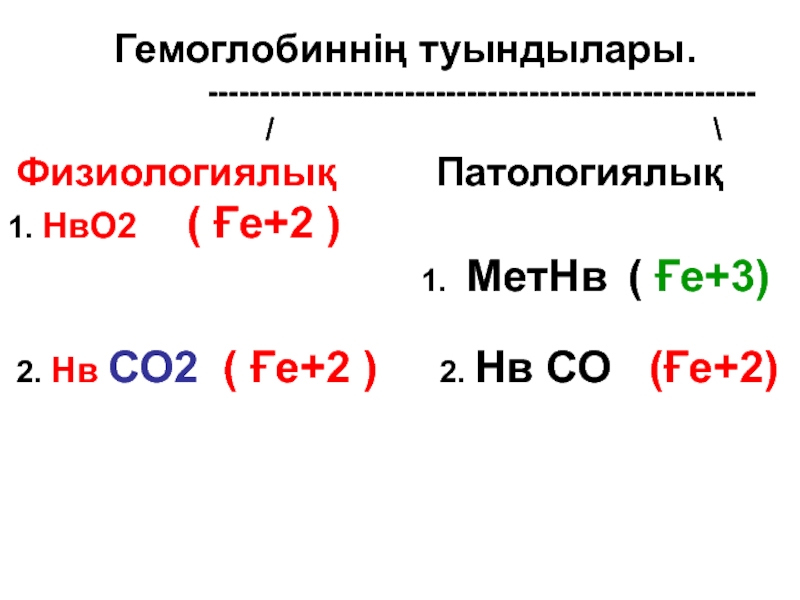
- 75. Гемоглобиннің туындылары.
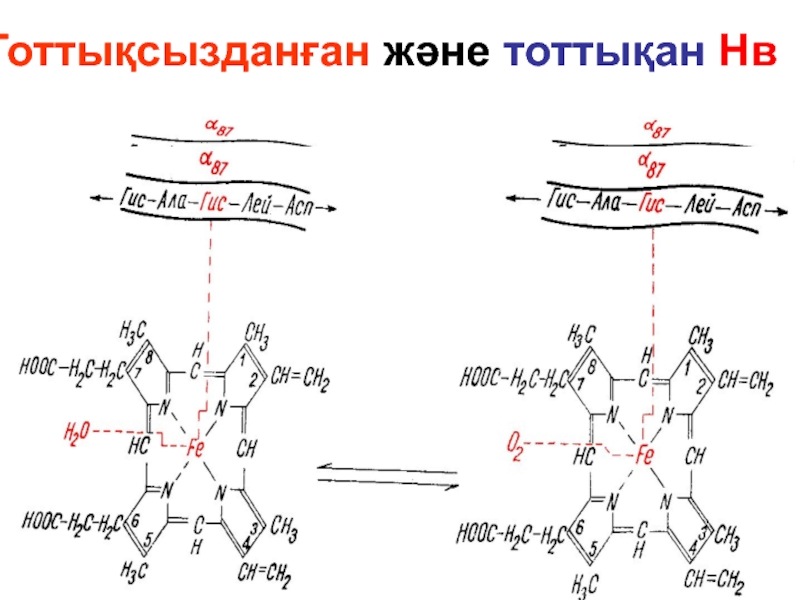
- 76. Тоттықсызданған және тоттықан Нв
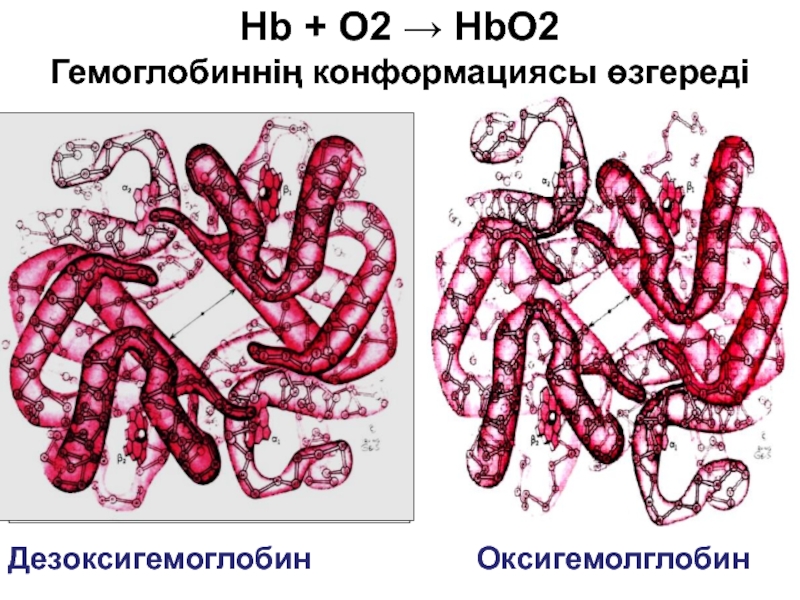
- 77. Дезоксигемоглобин Оксигемолглобин Hb + O2 → HbO2 Гемоглобиннің конформациясы өзгереді
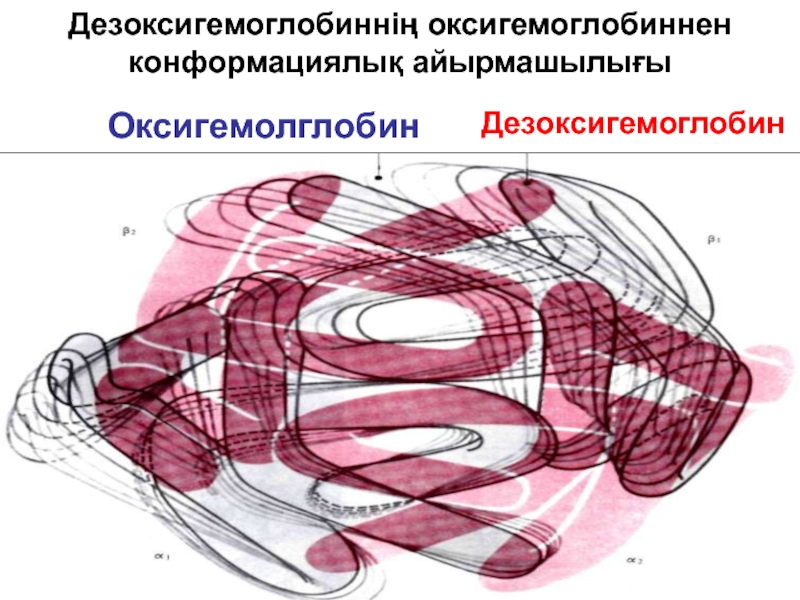
- 78. Дезоксигемоглобиннің оксигемоглобиннен конформациялық айырмашылығы Оксигемолглобин Дезоксигемоглобин
- 79. СО2 – әрбір 4 полипептидтік
- 81. Карбоксигемоглобин О2 салыстырғанда
- 82. Нв
- 83. Анемия Гемоглобин гема токрит
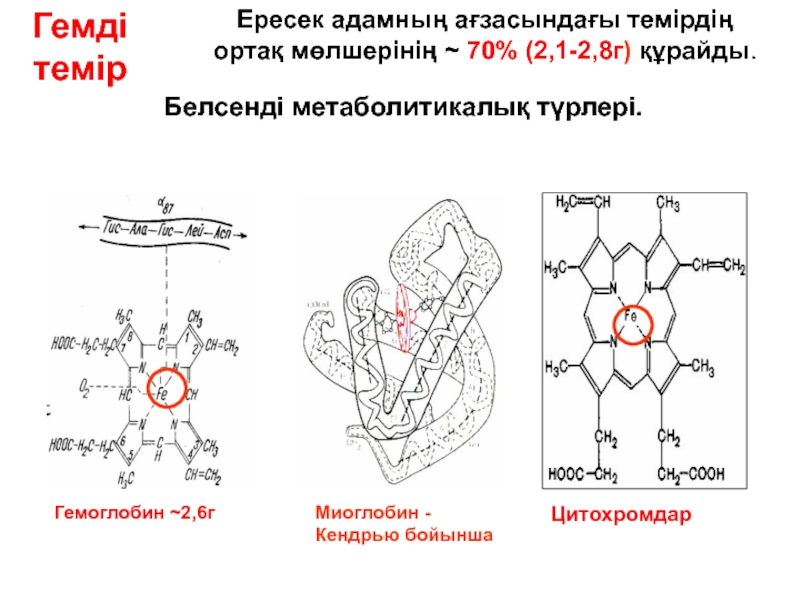
- 84. Қан арқылы гемоглобинмен О2 және СО2 тасымалдануы
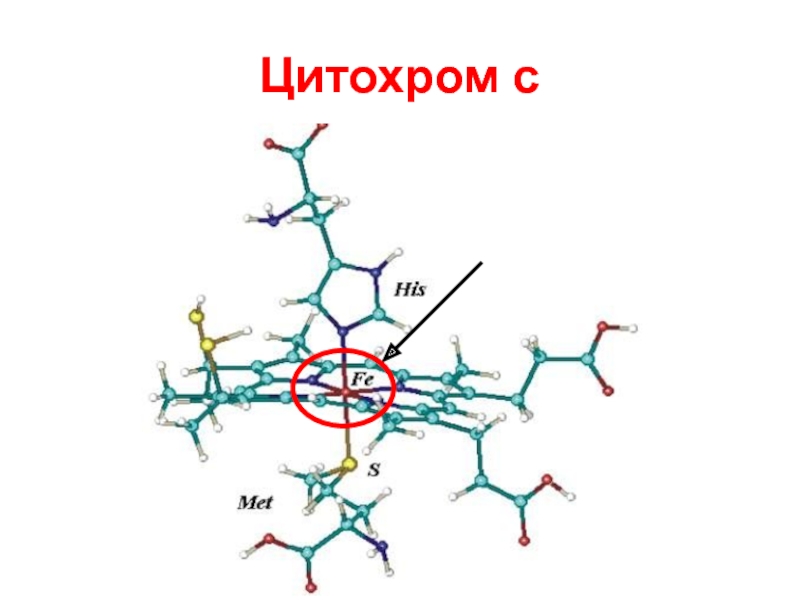
- 85. Окпеде оттегінің парциальді қысымы 90-100 с.б,мм,
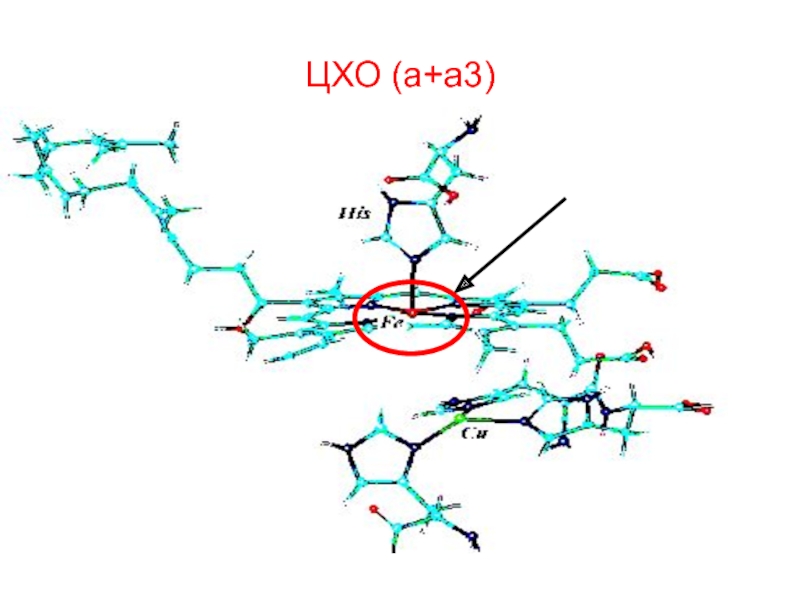
- 86. Гемоглобинге О2 қосылған да оның
- 87. рН-тың гемоглобиннің оттегімен қанығу қисығына әсері
- 88. Тіндер капилярында оттегінің парциальді қысымы 25-40 с.б,мм,
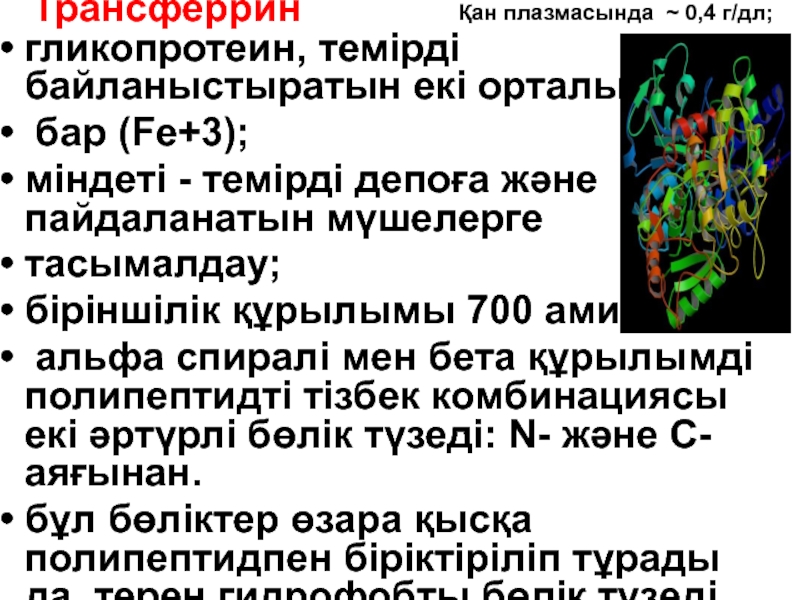
- 89. Бордың эффектісі. Перифериялық тіндерде рН мәні
- 90. Эритроциттерде
- 91. KHbO2 KHb + O2 CO2 (тіндерде) плазма
- 92. Қалыпты жағдайда Нв аз мөлшері
- 93. Метгемоглобин Нв
- 94. Қалыпты жағдайда
- 95. Туа біткен метгемоглобинемия Метгемоглобинредук тазаның
- 96. Мет Нв түзілуінің себебтері:
- 97. О2 белсенды турлеры супероксидты анион
- 98. О2 белсенды турлеры өте белсенді заттар. Нуклеин
- 99. О2 белсенды турлерінің түзілу жолдары : бір
- 100. О2 токсикалық түрлерінін түзілуі Гемоглобинның
- 101. Hb(Fe++) + O2 MetHb(Fe+++) + O2-
- 102. Супероксидті анион электронның акцеп торы
- 103. H2О2 супероксидті анион мен
- 104. Гидроксильді радикал супероксидті анионом
- 105. О2 белсенді турлерінің закымдаушы асері әсіресе
- 106. Липидтердің пероксидты тотығуы липидтердін
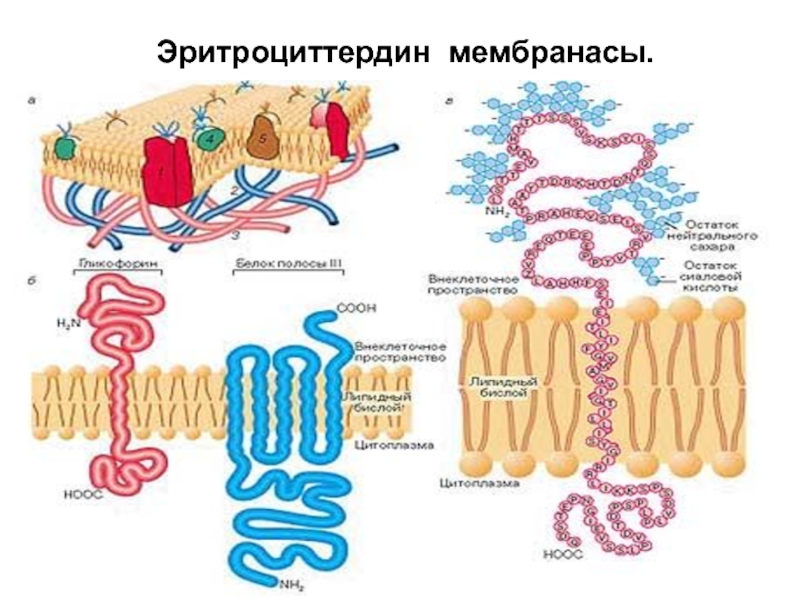
- 107. Эритроциттердин мембранасы.
- 108. Сондықтан мембраналардын курылымымен миндеттері бузылып эритроциттердін гемолизі дамиді.
- 109. Антиоксиданті жүйе О2 белсенді турлерінің әсерлерін арнаы антиоксиданты жүйе тежейді.
- 110. Оның ферменттері: -супероксиддисмутаза -каталаза
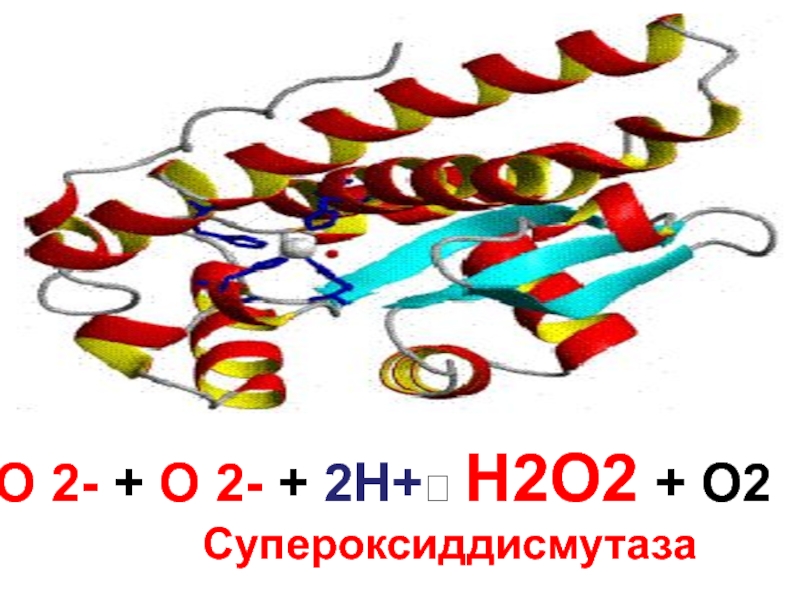
- 111. О 2- + О 2- + 2Н+?
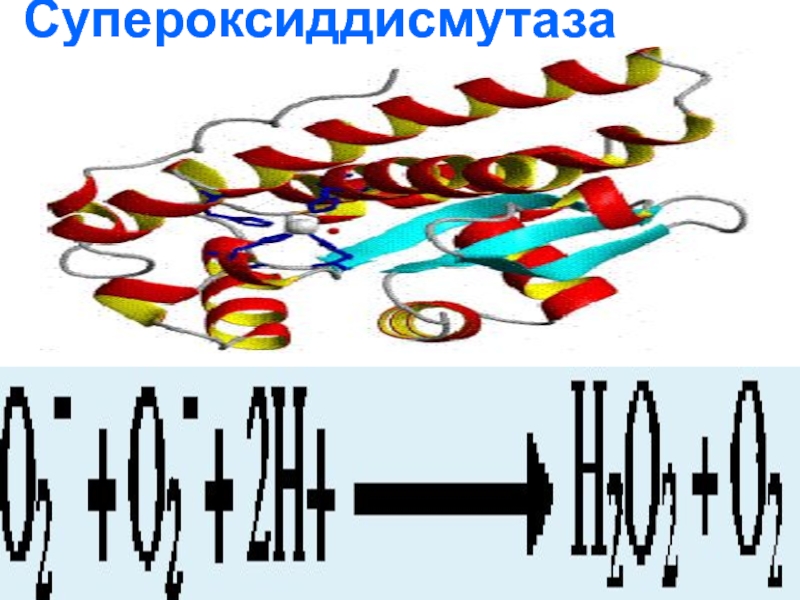
- 112. Супероксиддисмутаза
- 113. Эритроциттерде белс. жоғары
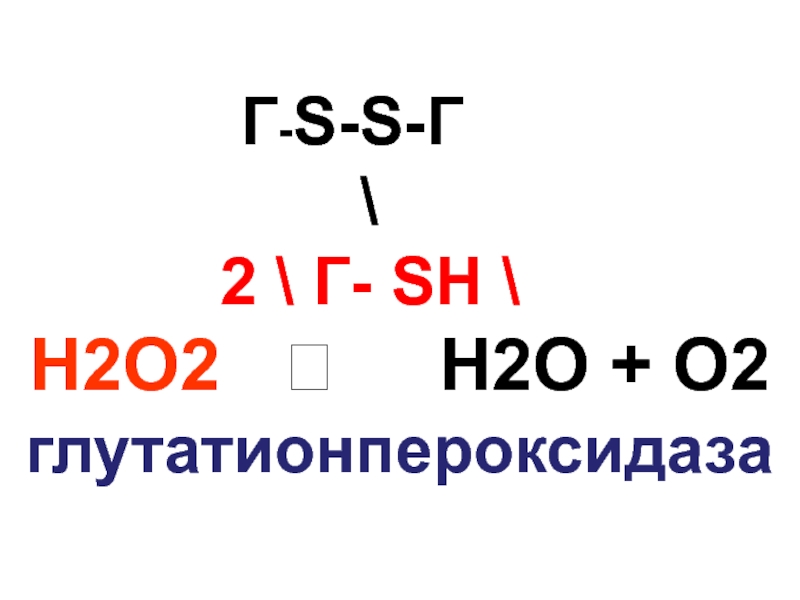
- 114. Г-S-S-Г \ 2 \ Г- SН
- 115. Глутатионредуктаза Г-S-S-Г глутатионредуктаза әсерімен 2 \ Г- SН \ аусады
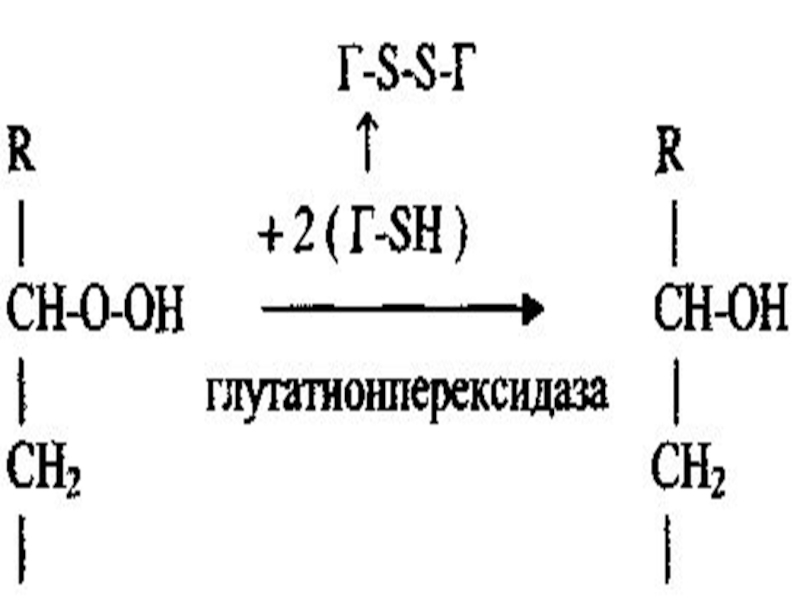
- 117. Сонымен қатар глутатионпероксидаза липидтердің гидроперекистерін тотықсыздандырады.
- 119. Витамин Е Антиоксиданты әсер көрсетеді.Себебі
- 120. ТЕМІРДІҢ АЛМАСУЫ
- 121. Темірдің ағзадағы орыны Ағзада жалпы салмағы 3-6г:
- 122. Агзада 3 - 6г:
- 123. Гемді темір Ересек адамның ағзасындағы темірдің
- 124. Цитохром с
- 125. ЦХО (а+а3)
- 126. Каталаза пероксидаза, және тб.
- 127. Гемдік емес темір ~ 0,3-1,2 г: Тасымалдаушы
- 128. Трансферрин гликопротеин, темірді байланыстыратын екі орталығы
- 129. Ферритин. (аппоферритин+ Fe+3 ) темірге
- 130. Ферритин Ақузды қабықшасында қуыс пен сыртқы ортаны
- 131. Ферритин каналдары Ферритиннің ядросын сыртқы ортамен екі
- 132. Гемосидерин темірдің оксидінен тұратын ақуыз комплексі, 25%
- 133. Теміржетіспеушілік анемиясы (ТЖА): бүкіл жер шарында ең
- 134. Қанның ұюы. Процеске плазма, тромбоциттер, тіндердің
- 135. Фактор І – фибриноген. Фактор ІІ –
- 136. Факторы свертывания крови Факторы участвующие в
- 137. Тромбоциттердің факторлары Фактор -1 проакцелерин. Фактор –
- 138. Фибриннің пайда болу механизмі. Протромбин
- 139. Фибринолиз ( тромбтардың ыдырауы).
- 140. Қан ұюға қарсы жүйелер.
- 141. Қанның ұюын тежейтін заттар ( антикоагулянттар).
- 142. Витамин К – факторлар ІІ, VІІ,
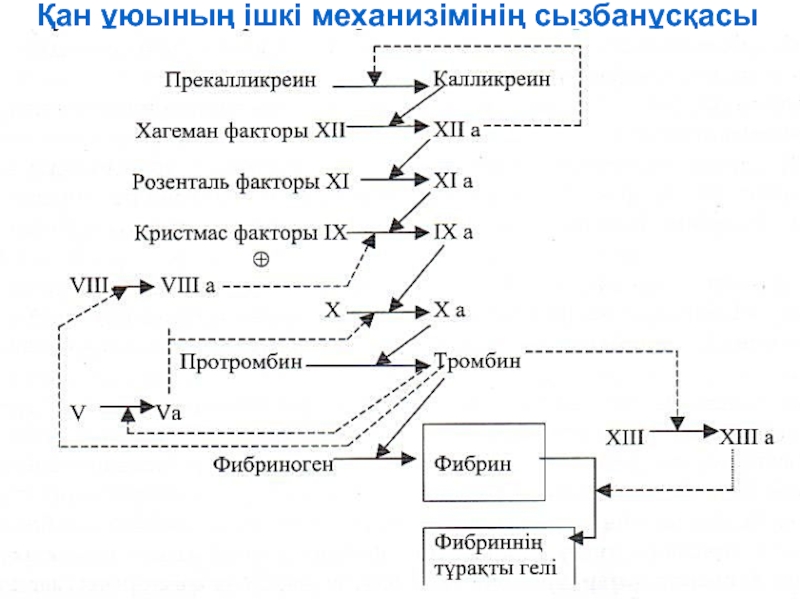
- 143. Қан ұюының ішкі механизімінің сызбанұсқасы
- 144. Ұлы Отан соғысы жылдарында көп теген жарақаттан
- 145. 1942 жылы қысқа уақыт аралығында атақты
- 146. Викасол (менадион, ағылш. menadione) – полициклдық аромати
- 147. Викасол К дәр. Синтети калық суда
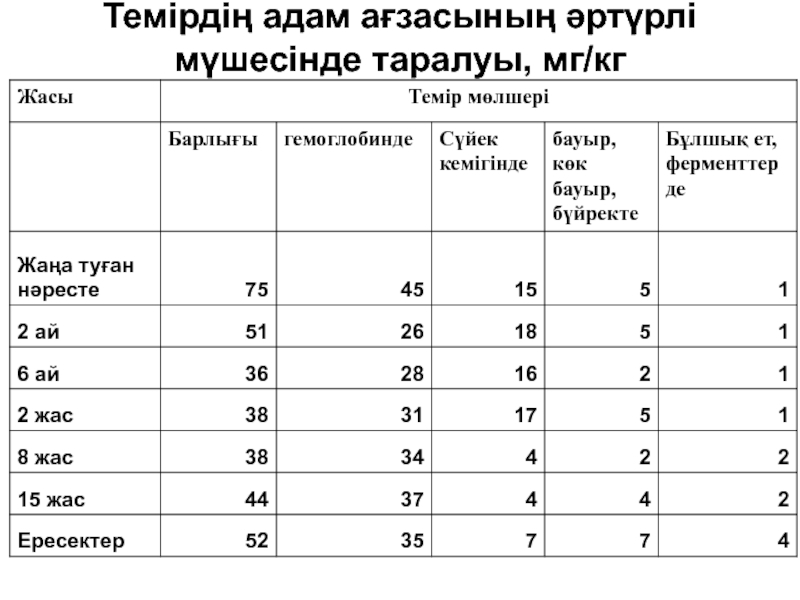
- 150. Викасол қазіргі уақыттада кеңінен қолданылады
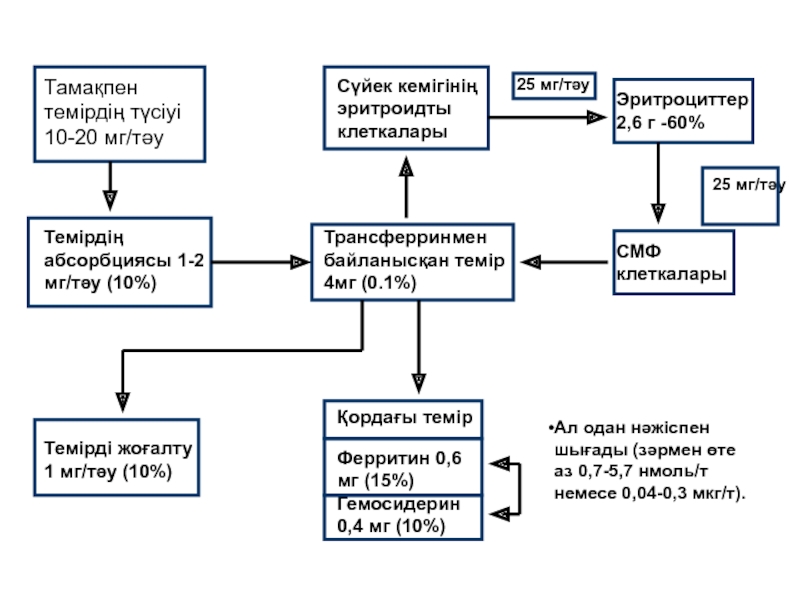
- 151. Гемофилия – гемор рагиялық ауру. Қан
- 152. Гемофилиялар. Гемофилия А -
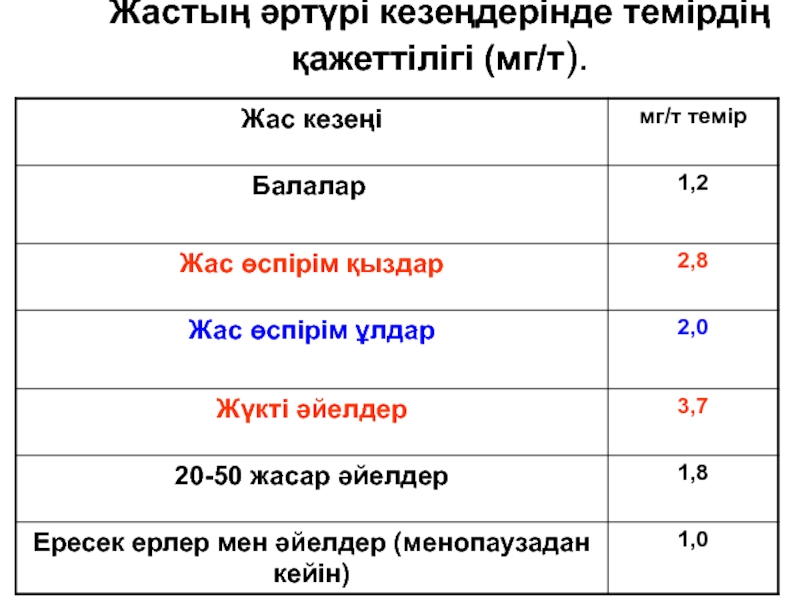
- 153. Гемофилия А
- 154. Классикалық мысал – цесаревич Алексей
- 157. Гемофилия А (80-85%) –
- 158. Бұл аурудың зардаптары Касвинов М.К. «Двадцать
- 161. Ағзадағы заттар алмасуының жағдайін қанның
- 167. Кининдер Физиологиялық мәні Кининдердің патологиялық процестің дамуына қатысуы Кининдердің фармакологиялық әсерлері
- 171. *
- 175. Пигментті алмасудың көрсеткіштері 1. Билирубин
- 176. Су-түзді алмасудың көрсеткіштері:
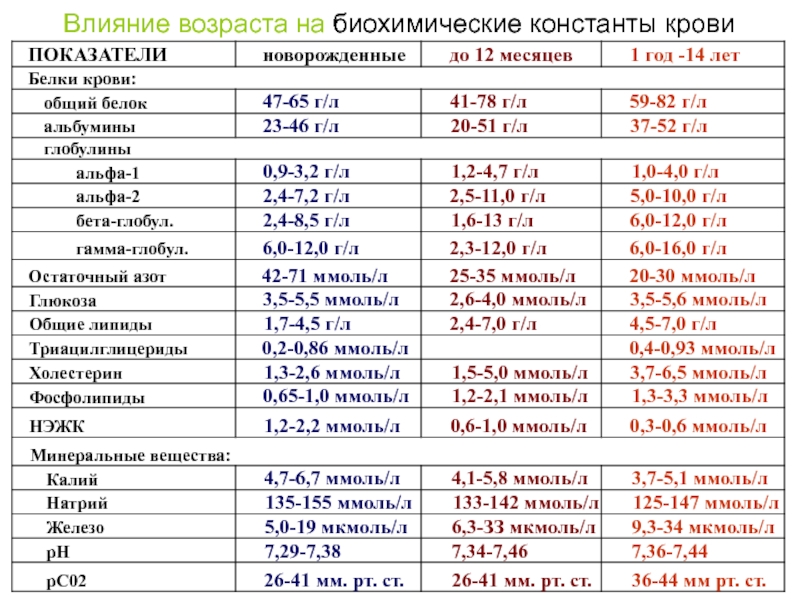
- 177. Влияние возраста на биохимические константы крови
- 178. Гормондар және олардың метаболиттері
- 179. Қанның биохимиялық анализінің негізгі көрсеткіштері: Жалпы
- 180. Диспротеинемические пробы
- 181. Өткір фазалардың ақуыздары С- реактивті ақуыз
- 182. Қан және т.б. биохимиялық сарапта Масы нәтіжесі
- 183. Қанның сараптамасы Гематологиялық анализатор
- 184. WBC – лейкоциты LYM – лимфоциты
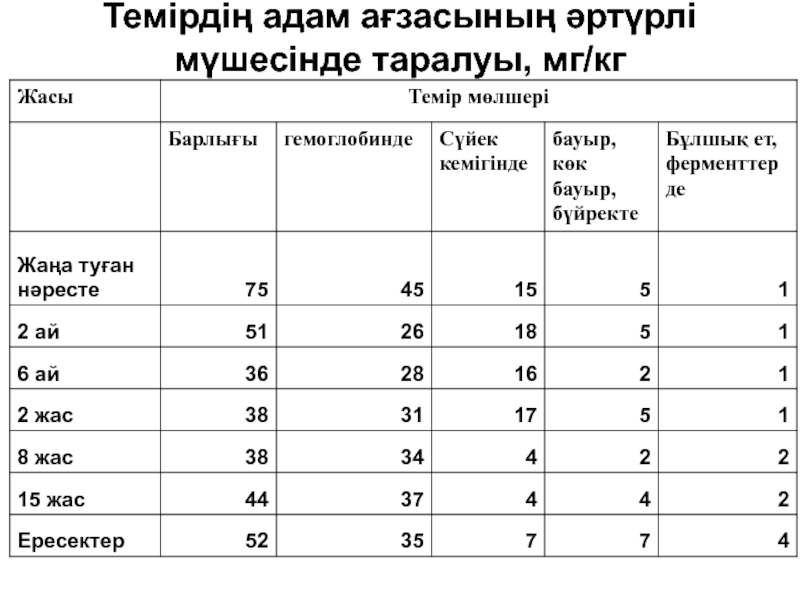
- 185. Темірдің адам ағзасының әртүрлі мүшесінде таралуы, мг/кг
- 186. Темірдің абсорбциясы, сіңірілуі, тасымалдалдануы мен сақталуы. аспен
- 187. Тамақпен темірдің түсіуі 10-20 мг/тәу Сүйек кемігінің
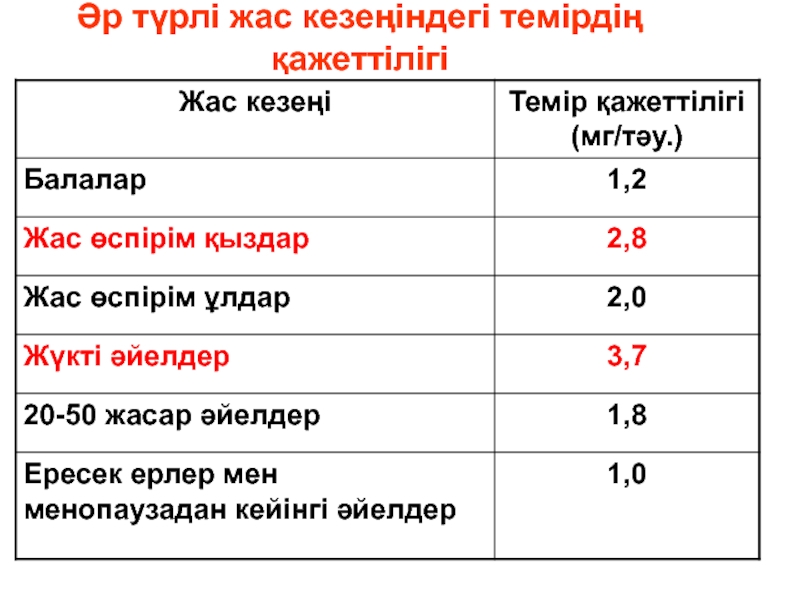
- 188. Жастың әртүрі кезеңдерінде темірдің қажеттілігі (мг/т).
- 189. Трансферинмен темірді байланыстыру: темірдің ионың байланыстыратын аминоқ.
- 190. Жаңа туған нәрестелер мен емшектегі балардағы теміржетіспеушілік
- 191. Темірдің адам ағзасының әртүрлі мүшесінде таралуы, мг/кг
- 192. Әр түрлі жас кезеңіндегі темірдің қажеттілігі
- 193. ТЖА-ның клиникалық көріністері бозару; жүректің қағуы; құлақтағы
- 194. КЕРІ БАЙЛАНЫС Қанның міндеттерің атаныз. Қанның физиологиялық
Слайд 1ҚАННЫҢ БИОХИМИЯСЫ
Жоспары:
-биол. міндеттері
-құрамы, жасушалары, физико-химиялық қасиеттері
-эритроциттердің биохимиясы
-гемоглобинның құрылысы, құрылымдары
, туындылары
-оттектің белсенді
-антиоксиданты жүйе
-қанның үйы, гемофилия
Слайд 2 Мақсатты: - қанның физико-қасиеттерін, олардың сапа
лық, сандық өзгерістерінің
- аурудың диагностикасы, ем
деудің нәтіжесін бағалау , ау
рудың алдың алу үшін кли
никада қанның биохимия
лық зертеунің мәнін түсіну.
Слайд 3Қанның биохимиясы.Міндеттері.
Қан-сүйық тін.Ол әртүр
лі жасушалардың био
процестерін
біріктхимиялық іреді.Себебі мүше
лер мен тіндердің ара
сында
ды тасымалдайды.
Слайд 4 Сонымен қатар:
газдарды тасымалдау / О2 өкпеден тіндерге, СО2 тіндер
тыныс алу
қорғау / антиденелер, лейкоциттердің фагоцитарлы міндетті /
көректену
реттеу
Слайд 5-термореттеу
осмотикалық / қан тамырларын
да осмотикалық қысымды қамта
масыз етеді \
- детоксикалық
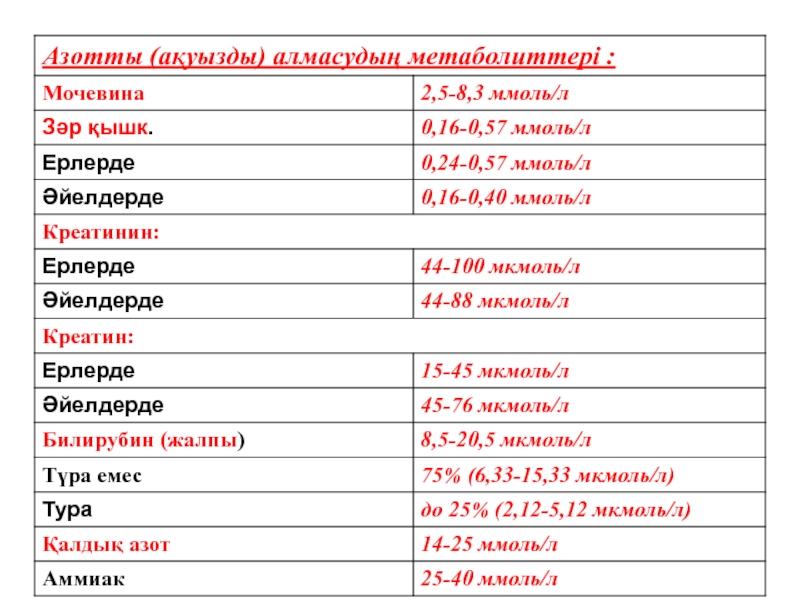
-бүйрекке заттар алмасуының сонғы өнімдерін тасымалдайды / мочевина, зәр қышқылы, билирубин, креатинин және т.б.
Слайд 6Қан-сүйық тін.
Ол жасушалардан
\ формалық элементер \ және жасушадан тыс суйықтықтан
\ плазмадан \ турады. Ересек адамның ағзасында қанның жалпы мөлшері ерлерде 4,9-5,2 л., әелдерде 3,8-4,5 л
Слайд 7Қанның биохимиясы
Физико-химиялық қасиеттері.
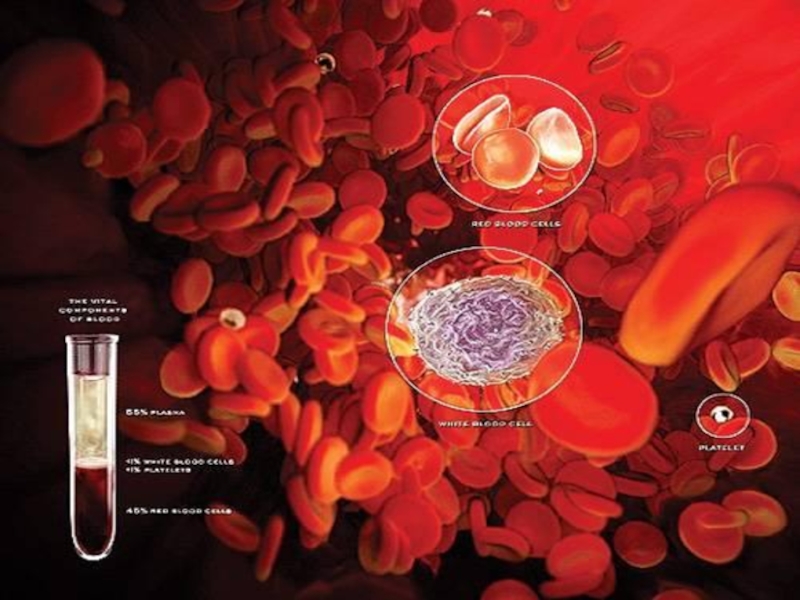
Қан
Плазма(55 %) Формалық
(Формалық элементтер
элементсіз қан ) эритроциттер - 44%
Су - 90 % АМҚ,ақуыздар, лейкоциттер
көмір.,түздар- тромбоциттер - 1 % 10 %
Слайд 9НЕЙТРОФИЛДЕР
Фагоцитоз арқылы адам ағзасын микроорганизм
дер мен вирустардың әсерінен сақтайды.Энер
Слайд 10БАЗОФИЛДЕР
Аллергиялық реакцияларға , қан үйюна қатысады.
Нейтралды майлардың ыдырауна қатысады.
Энергияның қайнар көзі
Слайд 11ЭОЗИНОФИЛДЕР
Аллергиялық реакцияларға қатысады \гистаминның синтезі\.
Жасушаны микроорганизмдер
ден сақтайды \ миелопероксида
за,
. Тромбтарды ыдыратады
\ тромболизин \.
.Энергияның қайнар көзі-гликолиз
Слайд 12МОНОЦИТТЕР
Құрамында лизосомальды ферменттер бар \ гидролаза лар \.
Макрофагтар. Микробтар, вирустарды
Энергияның қайнар көзі тотығу фосфорлану,
Слайд 17 Гематокрит
Формды
гематокрит деп аталады
\центрифугированиядан кейин\.
Слайд 19Гематокриты мөлшерді эритроциттердін көлемімен көрсетеді.
Гематокрит ерлерде 0,41- 0,53 %,
Әйелерде—0,36—0,46 %.
Нәрестелерде шамасымен 20 % жоғары,ал кішкентай балаларда —10% төмен үлкен кісімен салыстырғанда.
Слайд 21Қанның сары суы –фибриногенсіз плазма.
Қанның осмотикалық қысымы :
7,7-8,1 атм.
Тығыздығы : 1,05-1,060
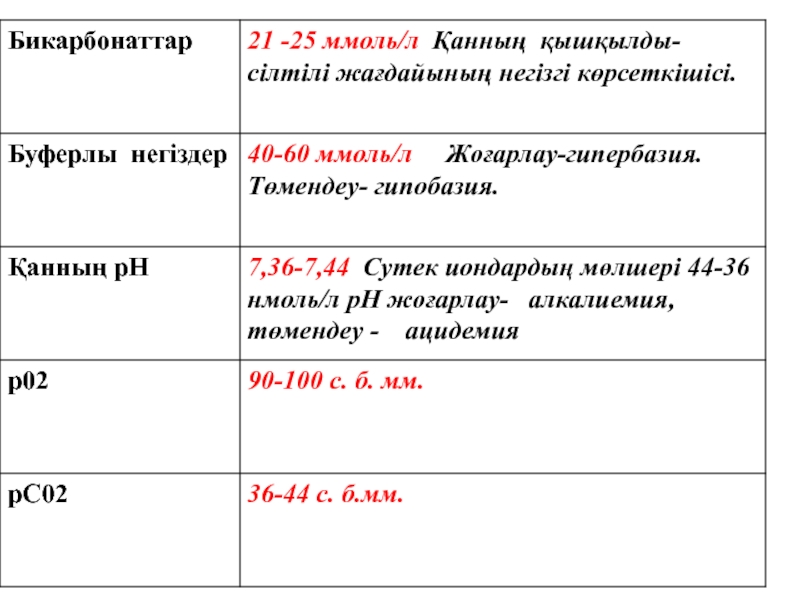
Слайд 23Қанның рН Ацидоз ---- N 7,35-7,45 ----- Алкалоз Н+↑
Слайд 25Бикарбонатты буфер Н2СО3 Н+ +НСО3- Протонның доноры
Слайд 26Фосфатты буфер Н2РО4 -
Слайд 27Эритроциттердің биохимиясы
Барлық жасушалрдын 36-48 % құрайды.
1 мм 3, 4-5
Өмір сүру ұзақтығы 110-120 күн.
Күн сайын 2-10” эритроцит ыдырап, соншалықты эритроцит синтезделеді.
Ядро болмайды, сондықтан ақуыздың синтезі жүрмейді
1 сағатта қандағы барлық эритроцитерде- 0,7г глюкоза беретін энергияны пайдаланады.
Эритроциттерде глюкозаның 90 % гликолиз жолымен, ал 10 % пентозофосфаттық жолмен ыдырайды.
Слайд 28Эритроциттерде заттар алмасуының ерекшеліктері.
Анаэробті гликолиз жоғары .Ол- энергияның және 2,3-дифосфоглицераттың қайнар
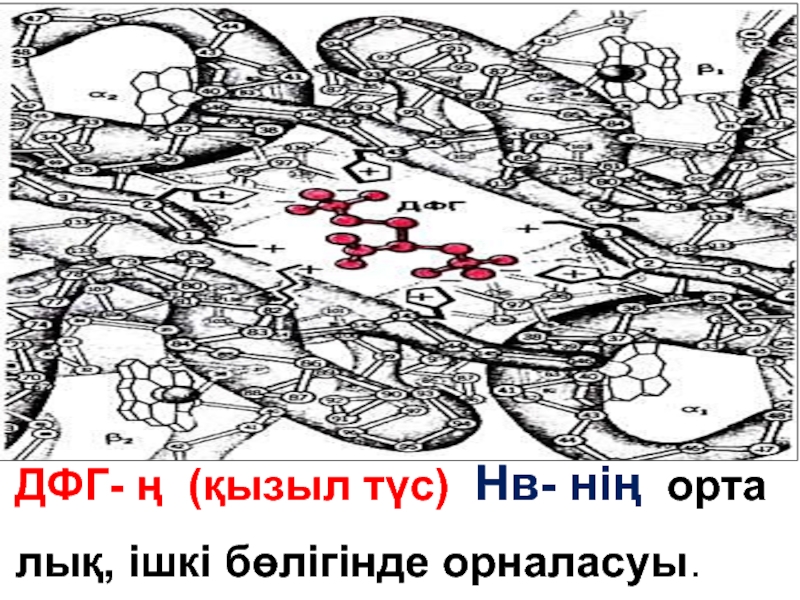
Слайд 292,3-дифосфоглицераттың (ДФГ) Қызыл түспен екі бета – тізбегімен байланысатын зарядталған топтар
Слайд 312,3-дифосфоглицерат Нв аллостериялық эффекторы,
О2-ң гемоглобинге туыс тытығың реттейді .
Слайд 32Эритроциттер
Эритроциттер -қанның формалық элементтері.
Ерлерде 4,0-5,6 x 10
Әйелерде 3,7-5 х 10 12 /л
Эритроциттердің жоғарлау эритроцитоз ал,
төмендеу \ гемоглобинмен бірге \ - анемия деп аталады.
Слайд 33
Эрит, биол,мәні:
Тіндерді О2 қамтамасыз ету және СО2 тасымалдауына қатысу
Антигеннды
Гомеостаздың тұрақтылығың қамтамасыз етеді.
Қорғау
Слайд 34 Эритроциттер метаболизмнің ерекшеліктері. Эритроциттерде митохондриялар мен ядро жоқ. Сондықтан глюкоза
Слайд 35Эритроциттер
Эритроциттердің негізгі ақуызы - Нв (95%).
Тыныс алу процессіне қатысады.
Өкпеден оттекті тіндерге тасымалдайды;
Тіндерден көмір қышқыл газын өкпеге тасымалдайды.
Слайд 36 Эритроциттерде әртүрлі міндеттер атқаратын ақуыздар бар- ферм. -метгемоглобинредуктаза супероксиддисмутаза глутатионпероксидаза глутатионредуктаза
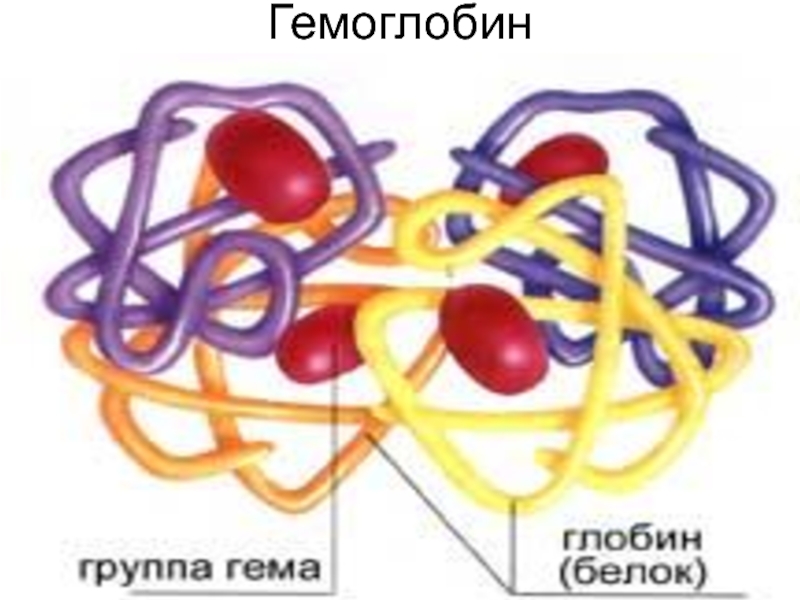
Слайд 37 Нв эритроциттердің негізгі ақуызы. Прост.топ.- гем,ақұызы-глобин Нв (гем + глобин ) Ғе+2/+3 Хромопротеид. Плазмада
Слайд 38Гемоглобин / Нв /
Ақуыздар ішіненең ең алғашқы гемоглобиннің аминқышқылдық құрамымен құрылымы
~ 340 000 000 Нв--ң молекуласы болады
Слайд 44 Үшіншілік құрылым
Тұрақтандыратың байланыстар:
Сутегті;
Ионды;
Гидрофобты қарым-қатынастар;
Ковалентті көлденен байланыстар.
Слайд 47.
Адам және әртүрлі жануарлардың гемог
лобинның құрылы
ы әртүрлі, себебі гемоглобинының аминқышқылды құ
рамы
мы өзгермейді
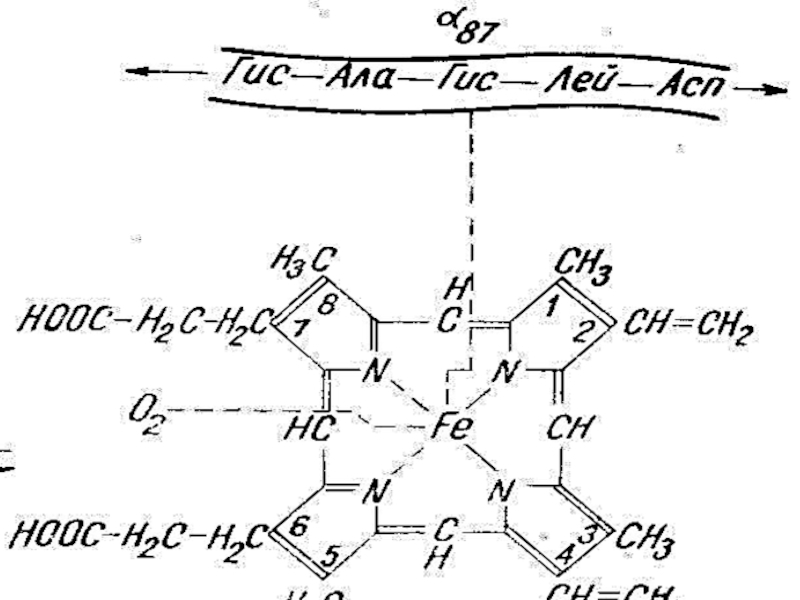
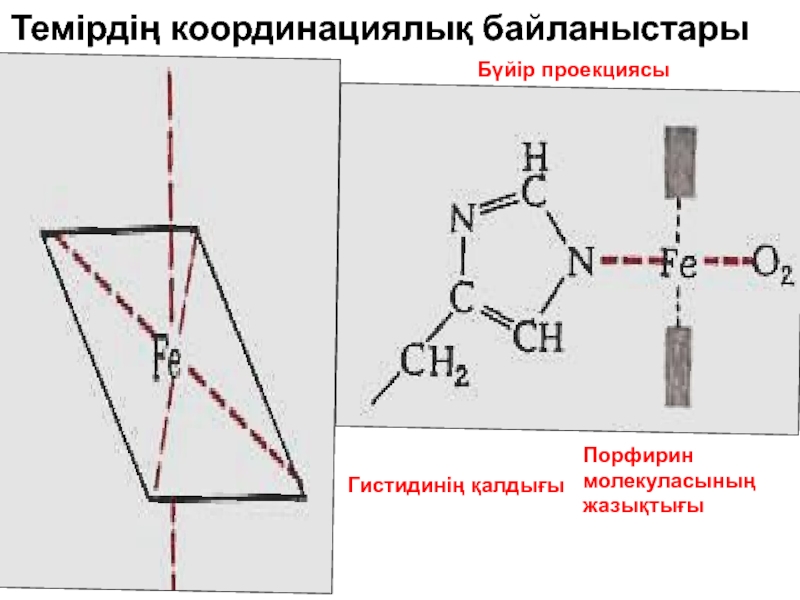
Слайд 48Гем , ортасында Fe2+ ион орна
ласқан. Fe2+ О2 байлаНыса ды
локты бөлігінің құрылымы әртүрлі. Осымен байланысты
эмбриональді жағдайдан ере
сек жағдайға дейін адам Нв бірнеше түрлелері болады.
Слайд 49Эмбриональді жағдайдан ересек жағдайға дейін адамның эритроциттерінде Нв әртүрлері болады :
примитивті (Нb P) 7 – 12 негізінен апталарда
фетальді (НbF)
ересектердің (HbA, HbA2, HbA3). Олардың айырмашылығы- субірлік құрамы және оттекке туыстығы әртүрлі
Слайд 50Примитивты гемоглобин (НвР)
Эмбрионның эритроциттерінде
негізінен 7 – 12 апталарда болады,
сонынан фетальды
аусады.
Слайд 51
Примитивты Hb P (2α 2ε) Говер 1
Фетальды ( Hb F )
Hb F
2α 2γ
нарестелер- 20%
4 – 5 айлық балада 1 - 2 %
ересектер– 1-2%
Слайд 52Фетальды гемоглобин ( F)
Эмбрионда-
9 – 13 аптадан кейін негізгі Нв.
13 –аптадан кейін
Нв А жоғарлайды .
Туар алдында
Нв F 20 %, ал 80 % Нв А.
4 – 5 айлық балада
Нв F 1 - 2 %.
Слайд 54Ересектердің гемоглобины (Нв А)
Гемоглобинның Нв А фракциялары:
гемоглобин A1
гемоглобин A2 (2α 2 δ ) 2-3%
гемоглобин A3 ( 2α 2γ)
~ 1%
Слайд 55НвА мен салыстырғанда НвF оттекке туыстығы жоғары, себебі HbF
2,3-дифосфоглицератка туыстығы төмен. Сондықтан ұрық үшін оттектің қайнар көзі- анасының окси
гемоглобины (HbO2)
Слайд 56Адам қанында 300-ден артық , мутация нәтижесінде пайда болған Нв
ған. Глобин синтезіне қатыс
ты геннің мутациясы – гемоглобинопатияларға әкеледі
Слайд 59 Гемоглобинопатиялар:
қалыпты гемоглобиннің біріншілік полипептидтік тізбегінің аминқышқыл ды құрамы өзгереді
талассемия:
Слайд 61Мутация нәтижесінде түзілетін аномальды
/ патологиялық / Нв-дер : Hb
Hb C,Нв Е , Нв М және т. б. төменде көрсетілген.
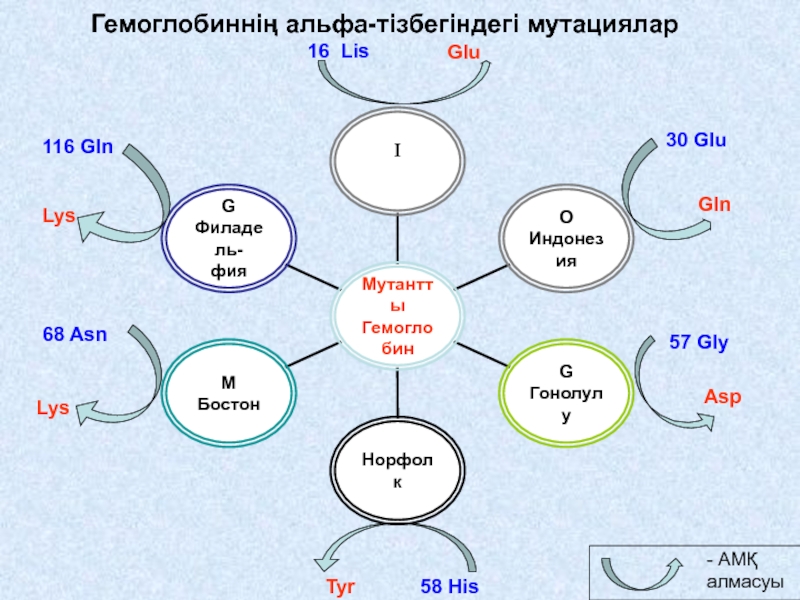
Слайд 62
- АМҚ алмасуы
Glu
16 Lis
30 Glu
Gln
116 Gln
Lys
68 Asn
Lys
57 Gly
Asp
58 His
Tyr
Гемоглобиннің альфа-тізбегіндегі
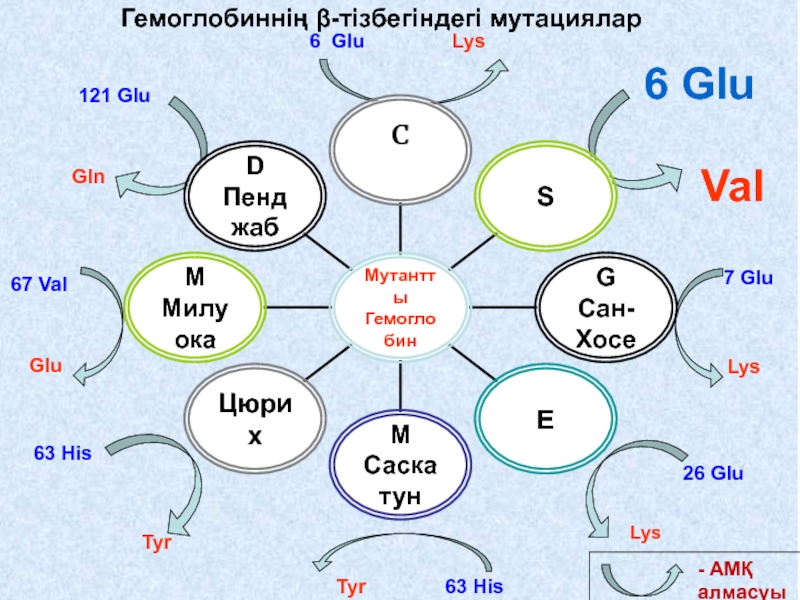
Слайд 63Гемоглобинде кездесетін мутациялар
Әсіресе мутациялар
β-полипептидті
тізбегінде жиірек
кезігеді.
Мыс. Нв S
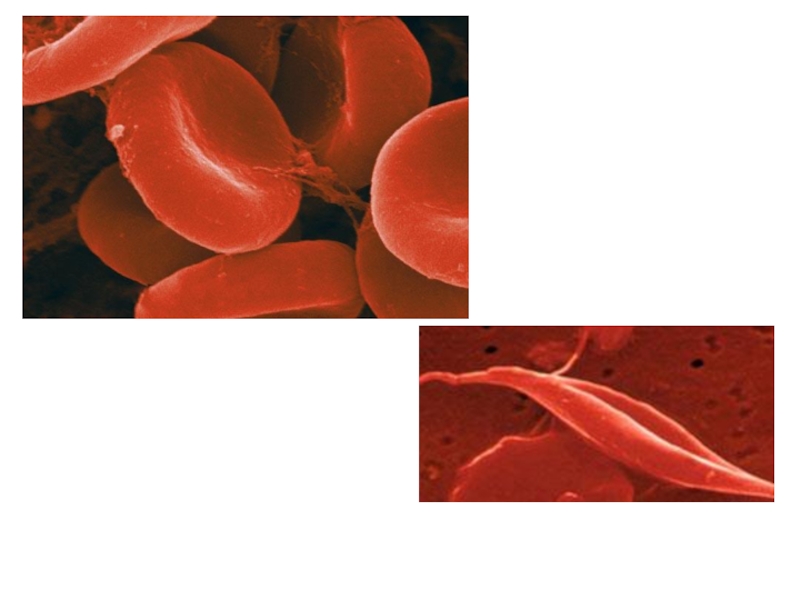
Слайд 67Нв S
Нәтижесінде Нв-нен оттек бөлінген сон ол нашар еритің
Слайд 74Гемоглобин О2, СО2, СО байланысканда түзіледі:
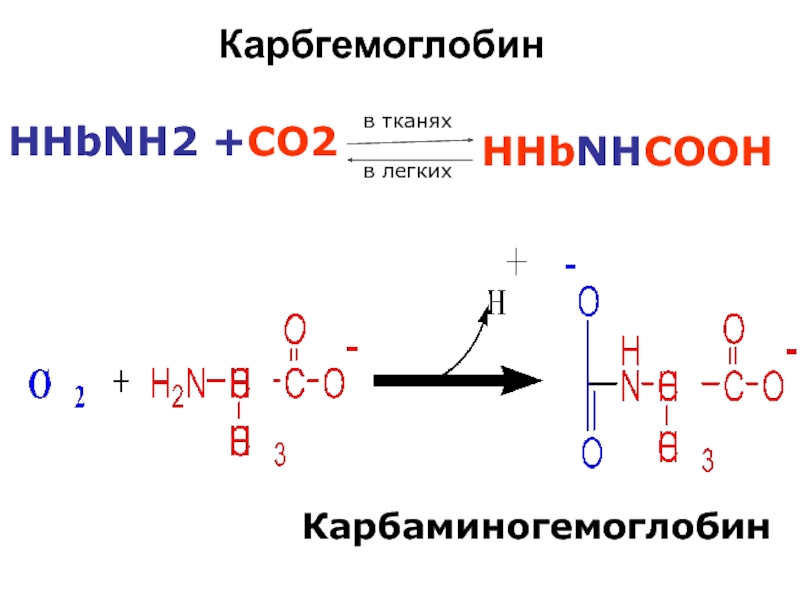
оксигемоглобин (ННbО2)
тотықсызданған (ННb)
карбгемоглобин (ННbСО2)
карбоксигемоглобин (ННbСО) - О2 салыстыр
ғанда Нв туыстығы өте жоғары \ 200 есе \
Слайд 75 Гемоглобиннің туындылары.
/ \
Физиологиялық Патологиялық 1. НвО2 ( Ғе+2 )
1. МетНв ( Ғе+3)
2. Нв СО2 ( Ғе+2 ) 2. Нв СО (Ғе+2)
Слайд 78Дезоксигемоглобиннің оксигемоглобиннен конформациялық айырмашылығы
Оксигемолглобин
Дезоксигемоглобин
Слайд 79 СО2 – әрбір 4 полипептидтік тізбектердің соңғы альфа -
Карбгемоглобин
Слайд 81Карбоксигемоглобин
О2 салыстырғанда
ННbСО Нв -ге
туыстығы
\ 200 есе \
салдары:
гипоксия
Слайд 82
Нв 120—165 г/л
Әйелдерде 120—150
Жүктілікте 110- г/л.
Ерлерде 130—160 г/л
Міндеттері. Негізгі.
О2 и СО2 тасымалдау,
гемоглобинды буфер және т.б
Слайд 83Анемия
Гемоглобин гема токрит мөлше рінің төмендеу.
Слайд 84Қан арқылы гемоглобинмен О2 және СО2 тасымалдануы
НвA1- 2α 2β полипептидті
төрт гем. Бір гем О2 бір молекуласың байланыстырады. Процес төрт факторға тәуелді.
О2 –н парциальды қысымы
на , рН мәніне
2,3-дифосфоглицераттың және СО2 мөлшеріне
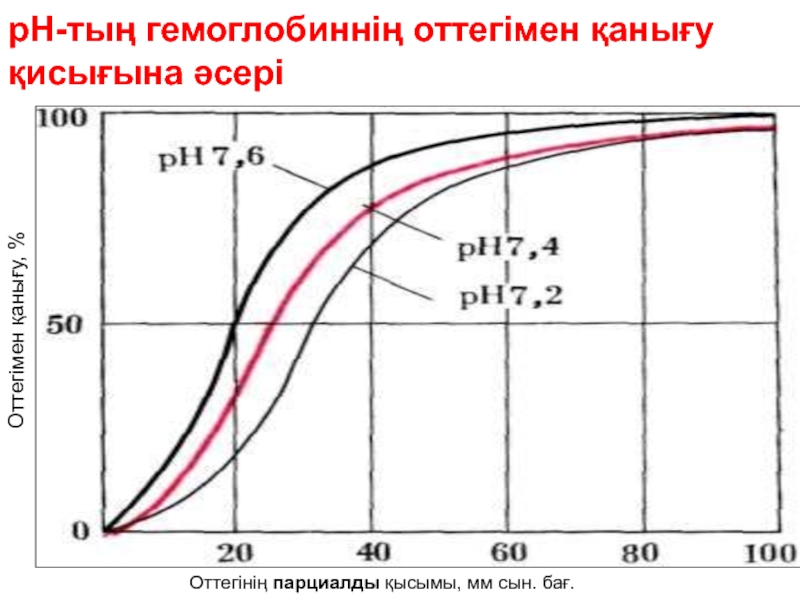
Слайд 85Окпеде оттегінің парциальді қысымы 90-100 с.б,мм, рН-7,6
Нв оттегімен максимальді
Слайд 86 Гемоглобинге О2 қосылған
да оның кеністік конформа
циясы өзгереді. Дезоксиге
бинге әртүрлі кеністік конфор
мация тән, яғни оның төртін
шілік құрылымы өзгереді. Бұл Нв- ның О2 қанығуын сигмоидті қисық көрсетеді.
Слайд 88Тіндер капилярында оттегінің парциальді қысымы 25-40 с.б,мм, рН 7,2-7,3 НвО2 диссо
циаяға
тек тіндерге беріледі.
Нв оттегімен қанығуы /65% /
Слайд 89Бордың эффектісі.
Перифериялық тіндерде рН мәні төмен, СО2 мөлшері жоғары. Осымен
мендейді. Өкепеде СО2 мөл
шері төмен және рН мәні жоғары. Сондықтан Нв-ң О2 –ге туыстығы жоғарылайды
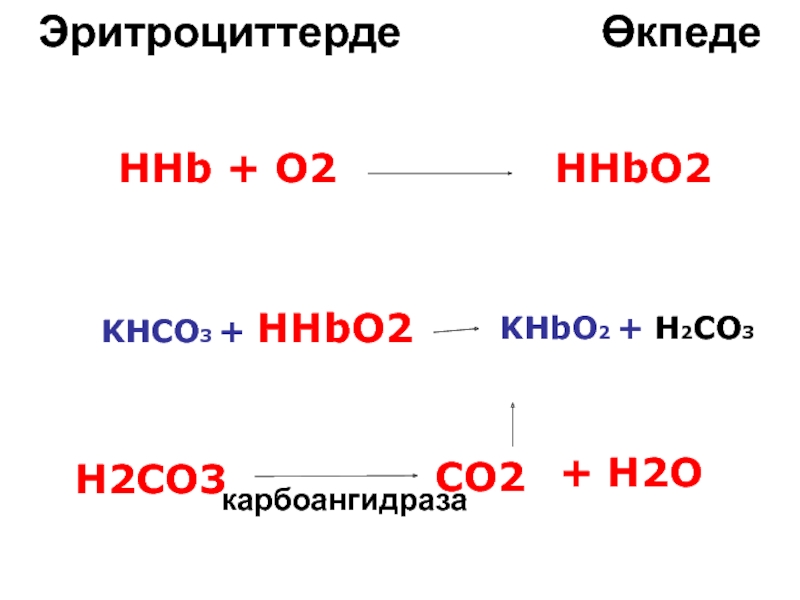
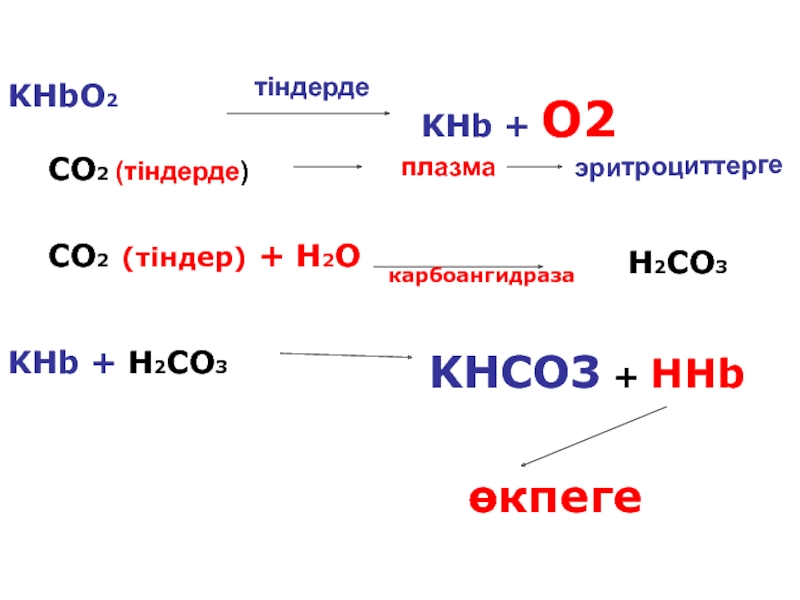
Слайд 91KHbO2
KHb + O2
CO2 (тіндерде)
плазма
CO2 (тіндер) + H2O
H2CO3
карбоангидраза
KHb + H2CO3
KHCO3
өкпеге
тіндерде
эритроциттерге
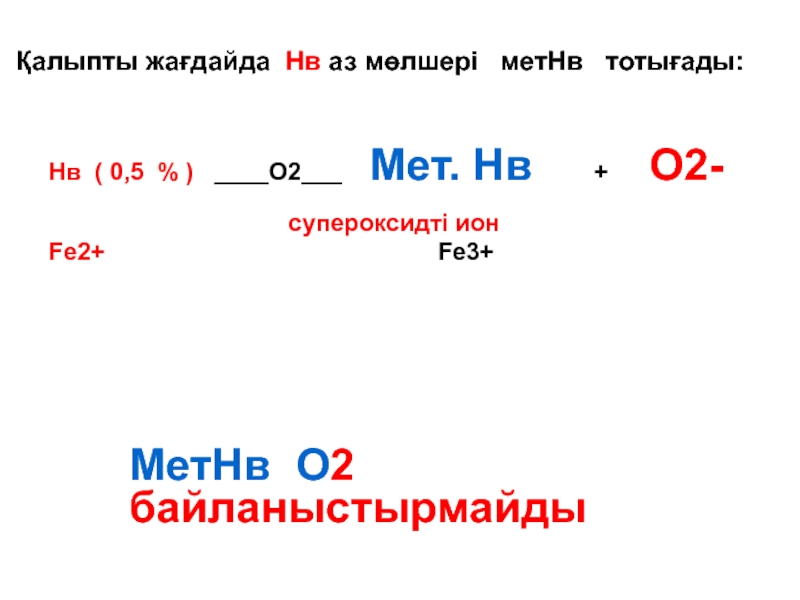
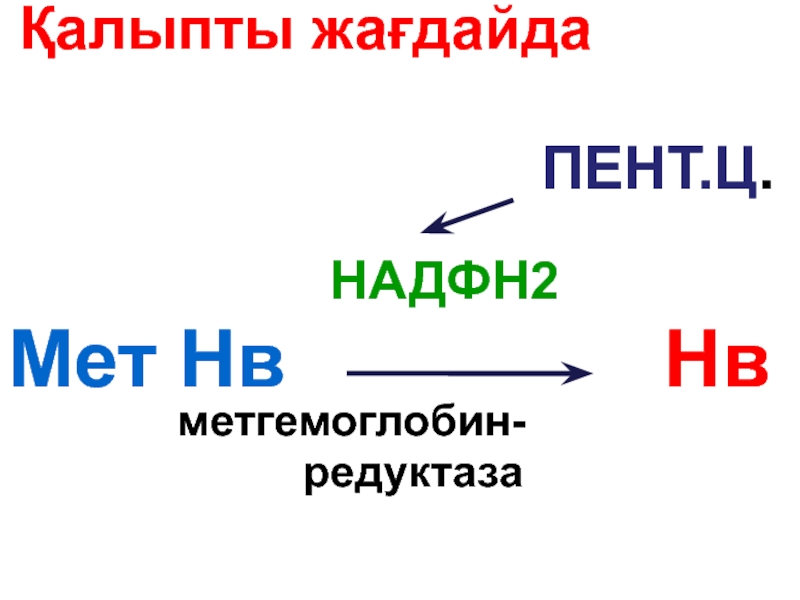
Слайд 92 Қалыпты жағдайда Нв аз мөлшері метНв тотығады:
Нв
Fe2+ Fe3+
МетНв О2 байланыстырмайды
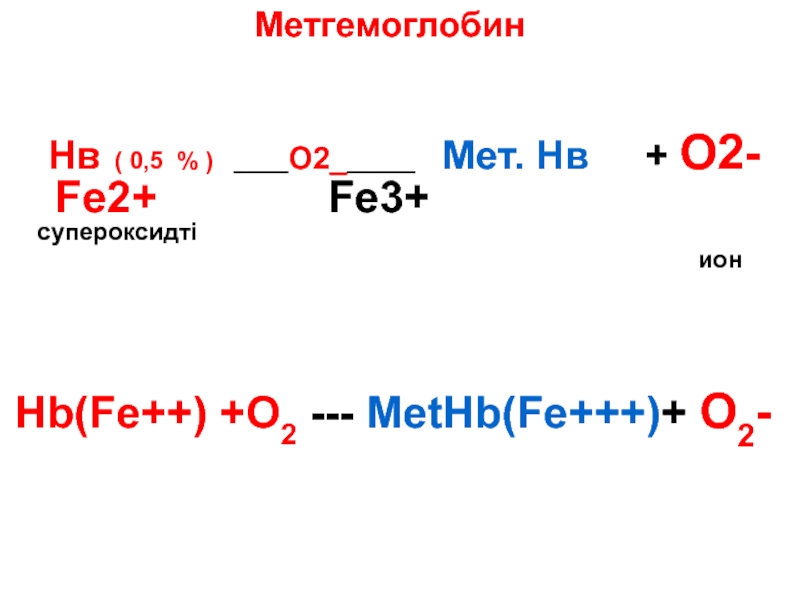
Слайд 93Метгемоглобин
Нв ( 0,5 % ) ____О2______ Мет. Нв
ион
Hb(Fe++) +O2 --- MetHb(Fe+++)+ O2-
Слайд 95Туа біткен метгемоглобинемия
Метгемоглобинредук
тазаның
туа біткен жетіспшілігі метгемоглобинемияға әкеледі.
Салдары: гипоксия.
Слайд 96Мет Нв түзілуінің себебтері:
Ағзаға тотықтандырушылардың
бертолет тұзы
нитраттар
нитриттар
анилин
нитробензол және т.б.
АТФ- синтетазды реакцияның тө
мендеу / АДФ жетіспеушілігінен)
Слайд 97О2 белсенды турлеры
супероксидты анион (О2-)
сутегтің асқың тотығы Н2О2
синглетті оттегі ( ''О2- ) -негізгі закымдаушы фактор
Слайд 98О2 белсенды турлеры өте
белсенді заттар. Нуклеин кышкылдар, акуыздар әсіресе липидтер
лар болып табылады.
Слайд 99О2 белсенды турлерінің түзілу жолдары :
бір қатар заттардың оның ішінде дәрілердің
әртүрлі оксидазалармен катализденетің реакциялар.
Слайд 100О2 токсикалық түрлерінін түзілуі
Гемоглобинның \ Нв\ метгемоглобинге
\ МетНв\ тотығуы супероксидты анионның (О2-) түзілуіне әкеледі
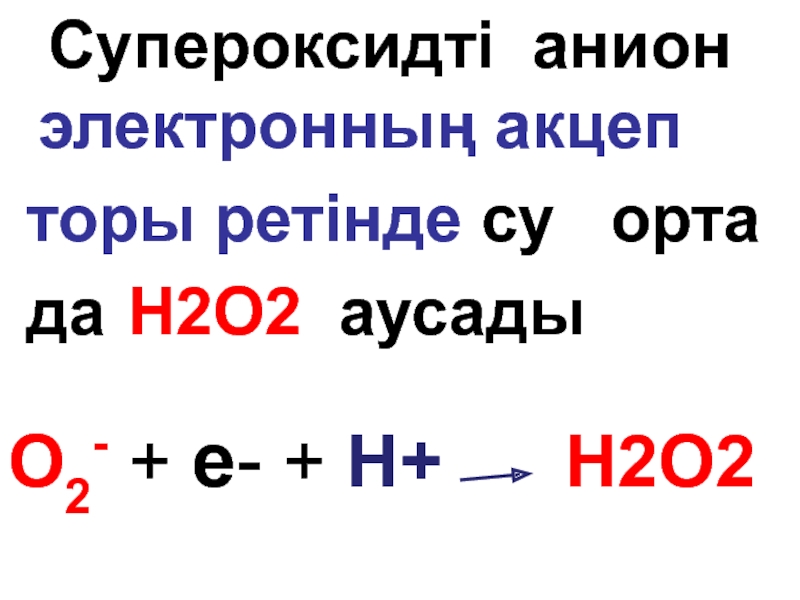
Слайд 102 Супероксидті анион электронның акцеп
торы ретінде су орта
да
O2- + е- + Н+ H2О2
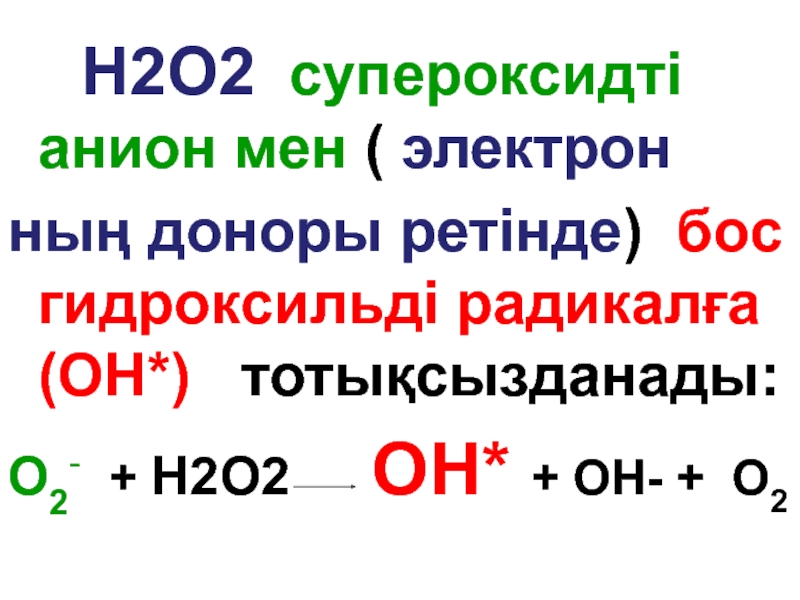
Слайд 103
H2О2 супероксидті анион мен ( электрон
ның доноры ретінде) бос
O2- + H2O2 ОН* + ОН- + О2
Слайд 104 Гидроксильді радикал супероксидті
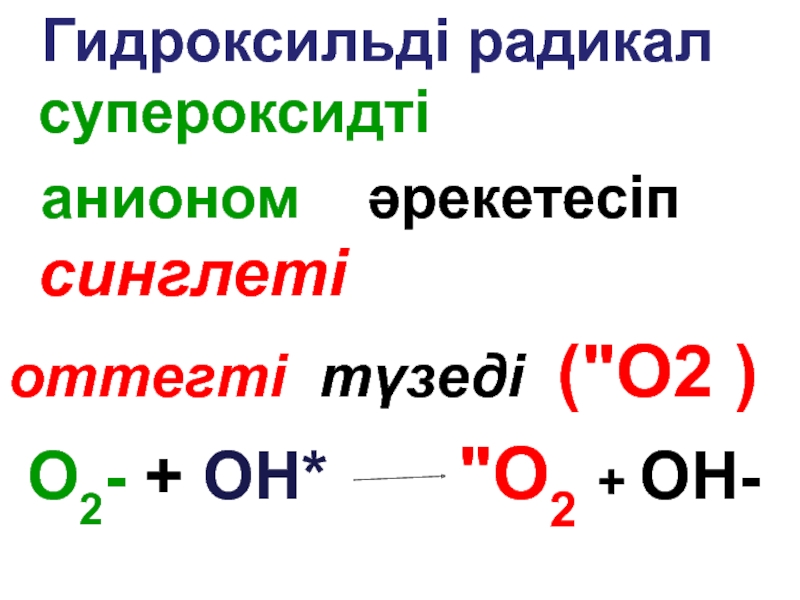
анионом әрекетесіп синглеті
оттегті түзеді
O2- + ОН* "О2 + ОН-
Слайд 105О2 белсенді турлерінің закымдаушы асері
әсіресе липидтерге бағы
талған. Нәтижесінде канық
паган май
пероксидтері түзіледі. Олар тұрақсыз, арығарай ыдырап альдегидтерді түзеді.
Слайд 106 Липидтердің пероксидты тотығуы липидтердін гидрофобтыгың томенде
теді,
Слайд 110
Оның ферменттері:
-супероксиддисмутаза
-каталаза
-глутатионпероксидаза
-глутатионредуктаза
/ НАДФН2 /
Слайд 116
НАДФН2
Г-S-S-Г ? 2
глутатионредуктаза
НАДФН2 қайнар көзі : пентозды цикл
\ глюкозо-6- фосфатдегидрогеназа /
Слайд 119Витамин Е
Антиоксиданты әсер көрсетеді.Себебі элек
трондардың доноры ретінде май
дардың пероксидты реакцияларың тежейді.
Слайд 121Темірдің ағзадағы орыны
Ағзада жалпы салмағы 3-6г:
гемдік темір:
гемоглобиннің құрамында
миоглобиннің құрамында
ферменттер (цитохромдар, пероксидаза,
Слайд 122 Агзада 3 - 6г:
Гемды емес темир
трансферрин;
ферритин;
ферменты:
аконитаза,
рибонуклеотид-
редуктаза и др..
Миоглобин
Нв ~2,6г
Цитохромы и
[(FeО∙ОН)8 (FeО∙ОРО3Н2)]
Гемді темір
Слайд 123
Гемді темір
Ересек адамның ағзасындағы темірдің ортақ мөлшерінің ~ 70% (2,1-2,8г) құрайды.
Белсенді метаболитикалық түрлері.
Слайд 127Гемдік емес темір ~ 0,3-1,2 г:
Тасымалдаушы түрі – трансферин;
(Fe ~ 1г)
Резервті
(Fe ~ 0,6г)
Гемдік емес ферменттер – аконитаза (Кребс циклі), рибонуклеотидредуктаза (ДНК) және т.б.
Слайд 128Трансферрин
гликопротеин, темірді байланыстыратын екі орталығы
бар (Fe+3);
міндеті - темірді депоға және
тасымалдау;
біріншілік құрылымы 700 аминқ.
альфа спиралі мен бета құрылымді полипептидті тізбек комбинациясы екі әртүрлі бөлік түзеді: N- және C- аяғынан.
бұл бөліктер өзара қысқа полипептидпен біріктіріліп тұрады да, терең гидрофобты бөлік түзеді.
Қан плазмасында ~ 0,4 г/дл;
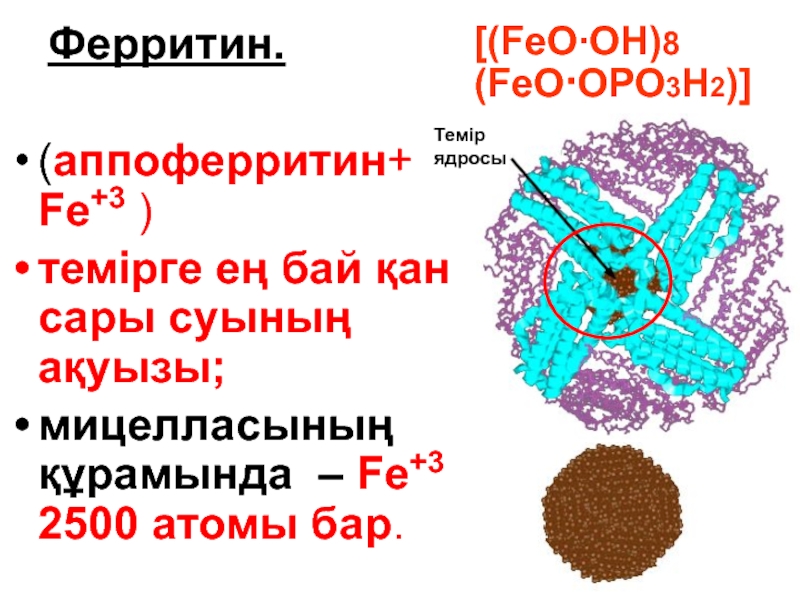
Слайд 129 Ферритин.
(аппоферритин+ Fe+3 )
темірге ең бай қан сары суының ақуызы;
мицелласының
Темір ядросы
[(FeО∙ОН)8 (FeО∙ОРО3Н2)]
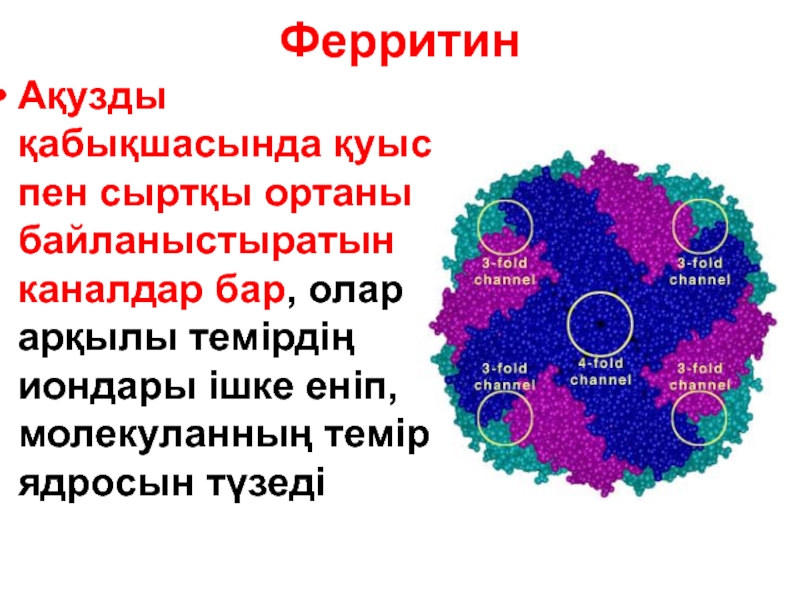
Слайд 130Ферритин
Ақузды қабықшасында қуыс пен сыртқы ортаны байланыстыратын каналдар бар, олар арқылы
Слайд 131Ферритин каналдары
Ферритиннің ядросын сыртқы ортамен екі полярлы емес (үш-қабаттасқан мономер) және
Полярлы емес канал арқылы темір Fe+2 ядроға өткізіледі немесе шығарыладыды
Полярлы канал арқылы электрон тасымалдауы жүреді (ядродағы темірді Fe+3-тен Fe+2-ге айландыру үшін)
Слайд 132Гемосидерин
темірдің оксидінен тұратын ақуыз комплексі, 25% нуклеотидпен көмірсулардан тұрады,
қою сары түсті
гемоглобиннің ыдырауының және ферритиннің денатурациясымен депротеинизациясының нәтижесінде түзіліп, ішектен тоқтаусыз сіңірілсе жинақталады;
темірдің ағзадағы сақталу түрінің бірі;
суда ерімейді, қолдануға тез бейімделе алмайды;
ол бауыр, көкбауыр макрофагтарында сүйек кемігінде кездеседі.
Слайд 133Теміржетіспеушілік анемиясы (ТЖА):
бүкіл жер шарында ең көп таралған ауру;
барлық жас топтарында,
бүкіл жер бетінде 500 млн жуық адамда кездеседі (Provan D. et al., 2000);
жер шарының әртүрлі аймақтарында темір жетіспеушілігі ~ у 20-50% адамдарда;
шамалап алғанда әрбір 8-ші әйелде (18-30 жасар) – темір жетіспеушілігі байқалады (Saloojee H. et al., 2001).
Слайд 134Қанның ұюы.
Процеске плазма, тромбоциттер, тіндердің белгілі заттары қатынасады (қан ұюының
Қан плазмасының факторлары:
Слайд 135Фактор І – фибриноген. Фактор ІІ – протромбин
ФакторІІІ –
Фактор ІV – кальций иондары ( Са 2+).
Фактор V – проакцелерин.
Фактор VІІ – проконвертин.
Фактор VІІІ – антигемофильді глобулин А (туа біткен жетіспеушілігінде гемофилия А дамиды - 87-94 %).
ФакторІХ – антигемофильді глобулин В (т.б.ж.-гемофилия В, 6 – 13% ).
ФакторХ – Прауер – Стюарттың факторы.
ФакторХІ – Розенталь факторы (т.б.ж.- гемофилия С, 1 – 2 % ).
ФакторХІІ – Хагеман факторы.
ФакторХІІІ – фибринді тұрақтандырады
( трансглутаминазаның белсенді емес түрі ).
Слайд 136Факторы свертывания крови
Факторы участвующие в свертывании крови имеют свои тривиальные
фактор I - фибриноген
факторII -протромбин
фактор III – тромбопластин
фактор IV - ионы Са++
фактор V - проакцеленин
фактор VII - проконвертин
фактор VIII - антигемолитический фактор
фактор IX - фактор Кристмана
фактор X - фактор Стюарта
фактор XI - предшественник тромбопластина плазмы
фактор ХII - фактор Хагемана
фактор ХIII - предшественник трансглутаминазы.
Слайд 137Тромбоциттердің факторлары
Фактор -1 проакцелерин.
Фактор – 3.
Фактор – 8 тромбостенин
Қан ұюдың белокты
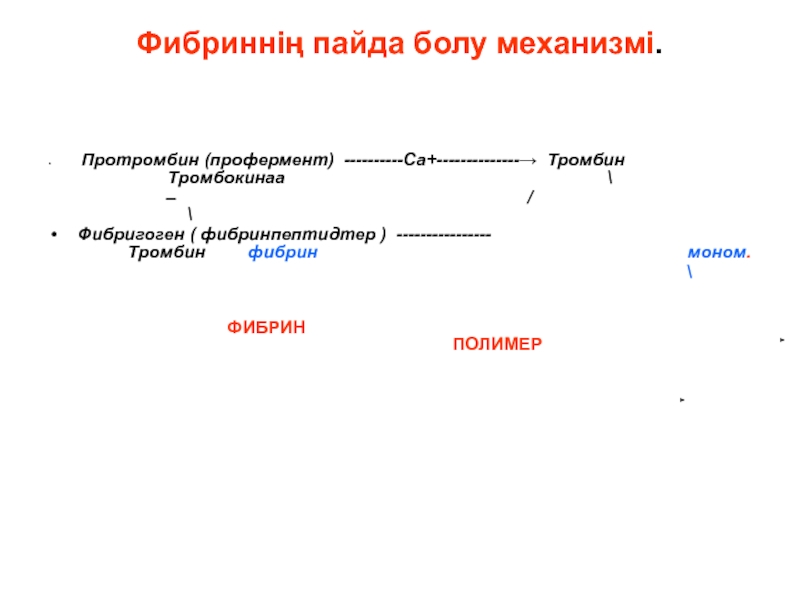
Слайд 138Фибриннің пайда болу механизмі.
Протромбин (профермент) ----------Са+--------------→ Тромбин Тромбокинаа \
/
Фибригоген ( фибринпептидтер ) ---------------- Тромбин фибрин моном.
\
ФИБРИН ПОЛИМЕР
Слайд 139 Фибринолиз ( тромбтардың ыдырауы).
/
Плазминоген ------------------------------→ плазмин
(профермент) Қанның және тіндер- (фермент)
дің активаторлары
Фибрин ------→ фибриннің ыдырауының
Плазмин өнімдері
Тромбин мен плазминнің жүйелерінің арасында тепе – теңдік бұзылғанда тромбтың пайда болуы күшееді немесе геморагиялық жағдайлар байқалады.
( Геморагия – қан ұюының төмендеуі).
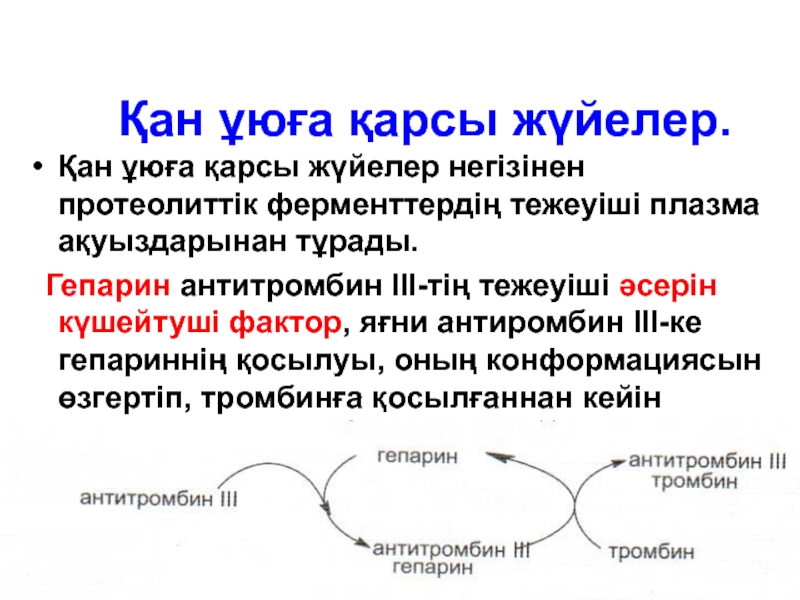
Слайд 140Қан ұюға қарсы жүйелер.
Қан ұюға қарсы жүйелер негізінен протеолиттік ферменттердің тежеуіші
Гепарин антитромбин ІІІ-тің тежеуіші әсерін күшейтуші фактор, яғни антиромбин ІІІ-ке гепариннің қосылуы, оның конформациясын өзгертіп, тромбинға қосылғаннан кейін гепарин қайтадан бөлініп шығып, антиромбин ІІІ-тің басқа молекуласына қосылды.
Слайд 141Қанның ұюын тежейтін заттар
( антикоагулянттар).
1.Антитромбин ( 6 түрі белгілі ).
2. Антитромбопластиндер.
3. Фибринолитикалық жүйе.
4. Витамин К антивитаминдері (дикумарол, неодикумарол және т.б.)
Слайд 142
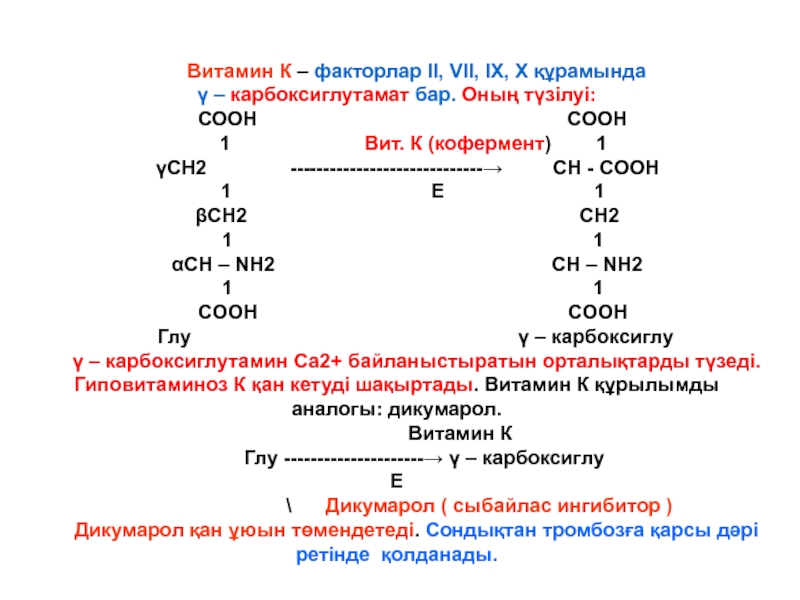
Витамин К – факторлар ІІ, VІІ, ІХ, Х құрамында
γ –
СООН COOH
1 Вит. К (кофермент) 1
γСН2 -----------------------------→ CH - COOH
1 Е 1
βСН2 CH2
1 1
αСН – NH2 CH – NH2
1 1
COOH COOH
Глу γ – карбоксиглу
γ – карбоксиглутамин Са2+ байланыстыратын орталықтарды түзеді. Гиповитаминоз К қан кетуді шақыртады. Витамин К құрылымды аналогы: дикумарол.
Витамин К
Глу ---------------------→ γ – карбоксиглу
Е
\ Дикумарол ( сыбайлас ингибитор )
Дикумарол қан ұюын төмендетеді. Сондықтан тромбозға қарсы дәрі ретінде қолданады.
Слайд 144Ұлы Отан соғысы жылдарында көп
теген жарақаттан
ған жауынгерлер
қан кетуден қаза тапты,сондықтан
жоғарылататын препарат
ты дереу синтездеу қажет
тілігі туындады.
Слайд 1451942 жылы қысқа уақыт
аралығында атақты биохимик, академик Палладин А.В викасолдын
дың өмірі сақталып қалды
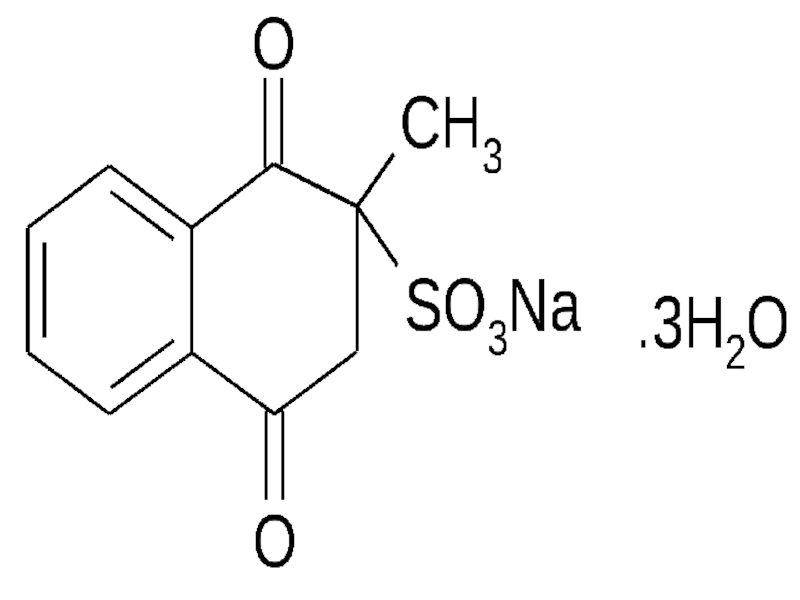
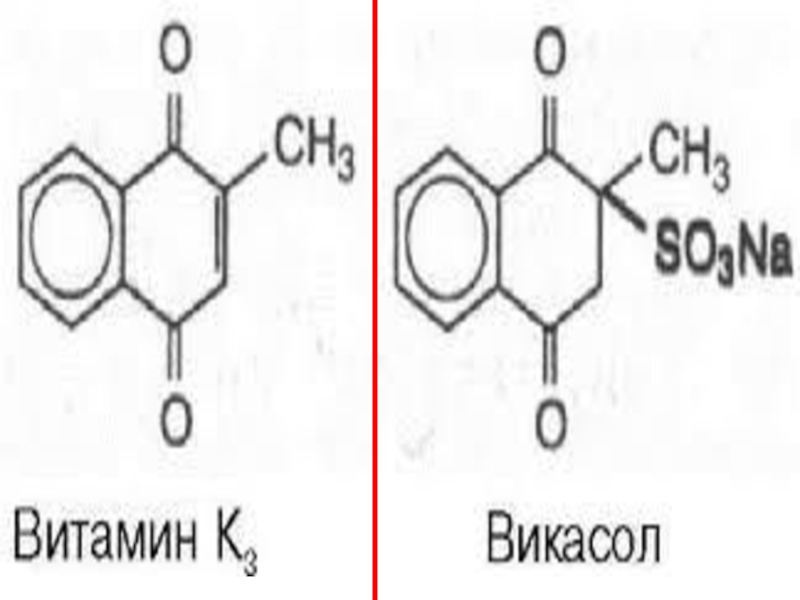
Слайд 146Викасол (менадион, ағылш. menadione) – полициклдық аромати
калық кетон, 1,4-нафто
хинонның туындысы. Ақ
Слайд 147Викасол К дәр. Синтети
калық суда еритін анало
логы (спиртта ерімейді) Дәрілік
Слайд 151Гемофилия – гемор
рагиялық ауру. Қан үюына қатысатың плазмамалық
торардың туа біткен жетіспеушілігі.
Слайд 152Гемофилиялар.
Гемофилия А - 10/100000 Фактор VIII жетіспеушілігі.
Қанның биохимиялық зертеунің
Слайд 153 Гемофилия А
(80-85%) – VIII фактордың туа
.
Слайд 154 Классикалық мысал – цесаревич
Алексей (Ресей патша
сы Николай ІІ-нің
Слайд 157 Гемофилия А (80-85%) – VIII фактордың туа біткен
Классикалық мысал - цесаревич Алексей (Ресей патшасы Николай ІІ-нің баласы) гемофилия А (генетикалық ауруына) шалдыққаны белгілі.
Қанның биохимиялық зертеунің
Слайд 158Бұл аурудың зардаптары
Касвинов М.К. «Двадцать
три ступени вниз»
деген кітабында нақты
Слайд 161 Ағзадағы заттар алмасуының жағдайін қанның химиялық құрамы және оның
ді. Сондықтан аурудың диаг
ностикасы, емдеудің нәтіжесін бағалау және аурудың алдың алу үшін қанның биохимиялық зертеун клиникада кең қолданады.
Слайд 167Кининдер
Физиологиялық мәні
Кининдердің патологиялық процестің дамуына қатысуы
Кининдердің фармакологиялық әсерлері
Слайд 175Пигментті алмасудың көрсеткіштері
1. Билирубин және оның фракциялар.
2. Уропорфириндер.
3.
Слайд 176Су-түзді алмасудың көрсеткіштері:
1. натрий
2. калий
4. магний
6. темір
7. фосфор
8. мышьяк, қорғасын, сынап.
Слайд 179 Қанның биохимиялық анализінің негізгі көрсеткіштері:
Жалпы белок
Билирубин
Креатинин;
КФК (креатинофосфокиназа), ЛДГ
Липаза
Зәр қышқылы
мочевина
Холестерин; үшацилглицеридтер
трансаминазалар
Жалпы белок және оның фракциялары
Қалдық азот
индикан
Глюкоза, темір, калий,кальций,натрий,магний,фосфор.
Слайд 181Өткір фазалардың ақуыздары
С- реактивті ақуыз
Церулоплазмин
α2-макроглобулин
α1-антитрипсин
Тропонин J
α-фетопротеин
Слайд 182Қан және т.б. биохимиялық сарапта
Масы нәтіжесі бойынша дәрігер келесі сұрақтарға жауап
1.Қан және зәрдің сараптамасы бойынша қандай өзгерістер байқалады?
2.Қандай алмасу процестер бұзылған?
3.Қандай патологиялық жағдайларда бул бұзылыстардың дамуы мүмкін ?
4.Бұзылыстардың механизмі қандай ?
Слайд 184WBC – лейкоциты
LYM – лимфоциты
MID – моноциты/эозинофилы
GRA – гранулоциты
LY% – % лимфоцитов
MI% – % моноцитов/эозинофилов
GR% – % гранулоцитов
RBC – эритроциты
HGB – гемоглобин
HCT – гематокрит
MCV – средний объём эритроцитов
MCH – среднее содержание гемоглобина в эритроците
MCHC – средняя концентрация гемоглобина в эритроцитах
RDWc – широта распределения популяции эритроцитов
PLT – тромбоциты
PCT – тромбокрит
MPV – средний объём тромбоцитов
PDWc – широта распределения популяции тромбоцитов
Слайд 186Темірдің абсорбциясы, сіңірілуі, тасымалдалдануы мен сақталуы.
аспен түскен темір Fe+3 асказан сөлінің
он екі елі ішекте темір Fe+2 ферритиннен қан сарысуына сіңірілу үшін босатылады;
Қан плазмасында Fe+2 трансферринмен байланысып, біразы бауырда ферритин құрамында қорда сақталу үшін жеткізіледі; қалғаны темір қажет ететін мүшелерге жеткізіледі.
Слайд 187Тамақпен темірдің түсіуі 10-20 мг/тәу
Сүйек кемігінің эритроидты клеткалары
25 мг/тәу
Эритроциттер 2,6 г
25 мг/тәу
СМФ клеткалары
Трансферринмен байланысқан темір 4мг (0.1%)
Темірдің абсорбциясы 1-2 мг/тәу (10%)
Темірді жоғалту 1 мг/тәу (10%)
Қордағы темір
Ферритин 0,6 мг (15%)
Гемосидерин 0,4 мг (10%)
Ал одан нәжіспен шығады (зәрмен өте аз 0,7-5,7 нмоль/т немесе 0,04-0,3 мкг/т).
Слайд 189Трансферинмен темірді байланыстыру:
темірдің ионың байланыстыратын аминоқ. әр бөлікте бірдей: екі тир,
темірді байланыстыру үшін соған қоса анион керек, әдетте бұл кар бонат (CO32-) болып табылады;
екі тир және асп 3- заряды темір ионының 3+ зарядың тепе-теңдікке әкеледі;
анион заряды белоктың тұстас оң зарядымен тепе-теңдікке келеді – трансферринде бұл бүйір тізбегімен N- сонының альфа спиралінің аргининінің оң заряды;
Слайд 190Жаңа туған нәрестелер мен емшектегі балардағы теміржетіспеушілік анемиясының себебі
анасының теміржетіспеушілік анемиясына
шала туған
көпурукты жүктілік
төмен салмақ \туғанда\
инфекциялар
сінірілудін бұзылысы
дурыс емес тамақтану түрі және т.б.
Слайд 193ТЖА-ның клиникалық көріністері
бозару;
жүректің қағуы;
құлақтағы шу;
бас ауруы;
әлсіздік;
дәм сезудің бұзылуы (бор, әк жеуге
тілдің ашуы;
диспепсия;
терінің құрғақтығы;
тырнақтың өзгеруі;
шаш түсу;
Ауыз бұрыштарының жарылуы.
невротическикалық реакциялар, неврастения,
Бұлшық еттің еңбекке қабілеті, жалпы физикалық күш түсіруге шыдымдылығы төмендеу
Миокардтың зат алмасуының бұзылуы
периферияда қан айналымының бұзылуы





























































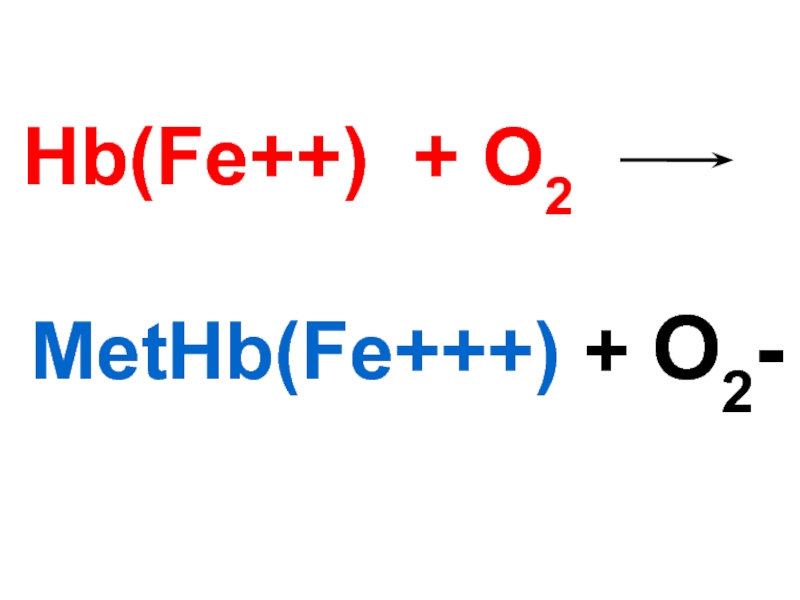












![Агзада 3 - 6г:Гемды емес темиртрансферрин;ферритин;ферменты: аконитаза, рибонуклеотид- редуктаза и др..МиоглобинНв ~2,6гЦитохромы и др. [(FeО∙ОН)8 (FeО∙ОРО3Н2)]Гемді темір](/img/tmb/5/487130/7b5afaf167b1de67170350f6a510bd28-800x.jpg)