- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Надлежащая практика дистрибуции презентация
Содержание
- 1. Надлежащая практика дистрибуции
- 2. ЗАДАЧИ ДИСТРИБУЦИИ Гарантировать обеспечение
- 3. GDP – GOOD DISTRIBUTION PRACTICE ДИСТРИБЬЮЦИЯ - неотъемлемая часть системы обеспечения качества ЛС
- 4. НОРМАТИВНЫЕ ДОКУМЕНТЫ
- 5. ТРЕБОВАНИЯ GDP Руководство 42-01-2002
- 6. ПРИНЦИПЫ GDP ЗАРЕГИСТРИРОВАННЫЕ ЛС ПРЕДУПРЕЖДЕНИЕ
- 7. ПРИНЦИПЫ GDP ОБОРОТНОСТЬ ЗАПАСОВ СОЗДАНИЕ
- 8. ПЕРСОНАЛ
- 9. ДОКУМЕНТАЦИЯ ПИСЬМЕННЫЕ МЕТОДИКИ: получение и проверка
- 10. ВЫПОЛНЕНИЯ РАБОТ В СООТВЕТСТВИИ С
- 11. ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ Пригодны и соответствуют по
- 12. ОРГАНИЗАЦИЯ ХРАНЕНИЯ: ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ
- 13. ПОСТАВКИ ЗАКАЗЧИКАМ
- 14. ПОСТАВКИ ЗАКАЗЧИКАМ ОБЩИЕ ПРАВИЛА ТРАНСПОРТИРОВАНИЯ: Не утрачена
- 15. ВОЗВРАТЫ ЛС, НЕ ИМЕЮЩИЕ ДЕФЕКТОВ Отдельное хранение
- 16. ЧТО ТАКОЕ «ОТЗЫВ»? ИЗЪЯТИЕ ИЗ ОБРАЩЕНИЯ (С
- 17. ПРИЧИНЫ ОТЗЫВА
- 18. ПРИНЦИП ОТЗЫВА У ПРОИЗВОДИТЕЛЯ / ДИСТРИБЬЮТОРА
- 19. ПЛАН ДЕЙСТВИЙ В КРИТИЧЕСКИХ СИТУАЦИЯХ (СРОЧНЫЙ ОТЗЫВ):
- 20. ОТВЕТСТВЕННОЕ ЛИЦО
- 21. ПРОТОКОЛ ОТЗЫВА В полном соответствии с СРМ
- 22. НОРМАТИВНЫЕ ДОКУМЕНТЫ Приказ МЗ от
- 23. САМОИНСПЕКЦИИ Самоконтроль Коррегирующие действия Совершенствование системы обеспечения качества дистрибьютора/производителя
- 24. СЕРТИФИКАЦИЯ дистрибьюторов на соответствие требованиям GDP в
- 25. КРИТЕРИИ СЕРТИФИКАЦИИ Соответствие материально-технической базы, технических
- 26. ПРОЦЕДУРА СЕРТИФИКАЦИИ ОФОРМЛЕНИЕ И ВЫДАЧА
- 27. СЕРТИФИКАТ № Срок действия до ______________
- 28. Актуальные вопросы внедрения GDP в Украине
- 29. СПАСИБО ЗА ВНИМАНИЕ! НАДЛЕЖАЩАЯ ПРАКТИКА ДИСТРИБУЦИИ
Слайд 1НАДЛЕЖАЩАЯ ПРАКТИКА ДИСТРИБУЦИИ
КАФЕДРА УПРАВЛЕНИЯ И ЭКОНОМИКИ ФАРМАЦИИ
GDP – GOOD DISTRIBUTION PRACTICE
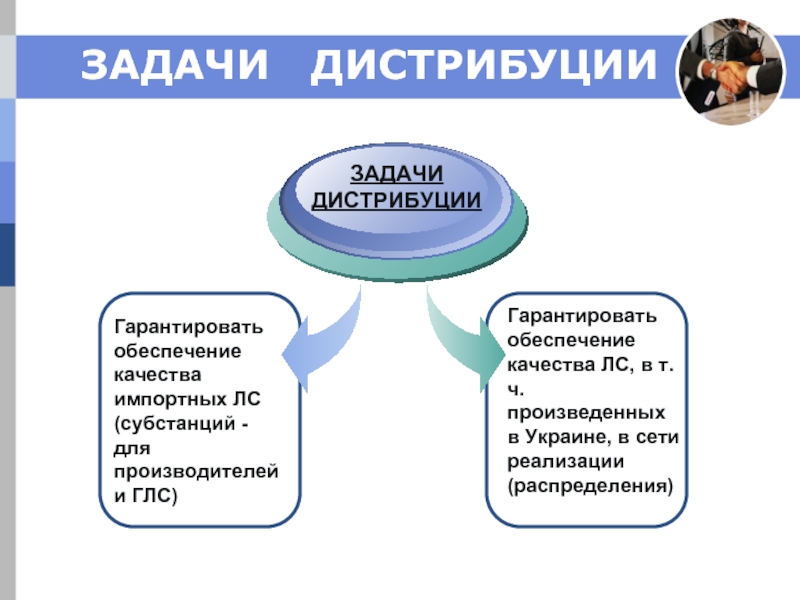
Слайд 2ЗАДАЧИ ДИСТРИБУЦИИ
Гарантировать обеспечение качества импортных ЛС (субстанций - для производителей
ЗАДАЧИ ДИСТРИБУЦИИ
Гарантировать обеспечение качества ЛС, в т.ч. произведенных в Украине, в сети реализации (распределения)
Слайд 3GDP – GOOD DISTRIBUTION PRACTICE
ДИСТРИБЬЮЦИЯ
- неотъемлемая часть системы обеспечения качества
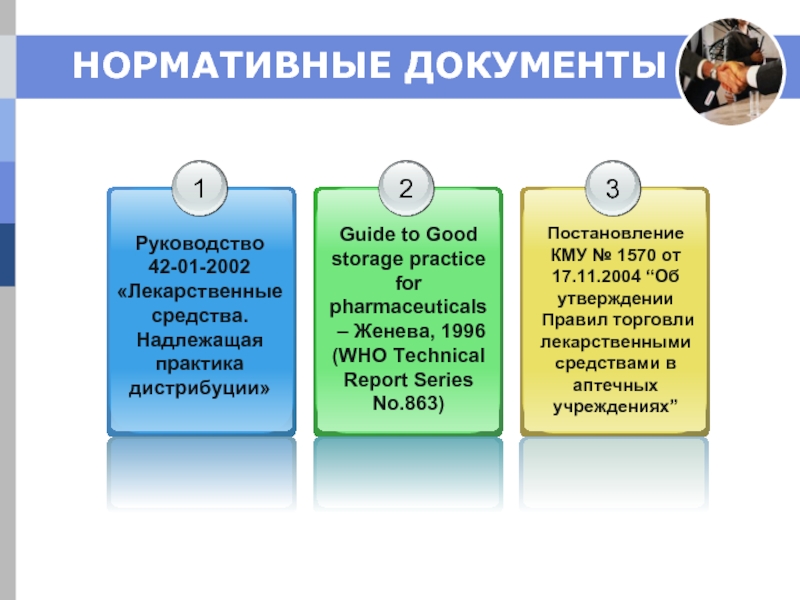
Слайд 5ТРЕБОВАНИЯ GDP
Руководство 42-01-2002
ПОСТАВКИ ПОТРЕБИТЕЛЯМ
ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ
(ПОЛУЧЕНИЕ, ХРАНЕНИЕ)
ДОКУМЕНТАЦИЯ
ПЕРСОНАЛ
ОСНОВНЫЕ ПОЛОЖЕНИЯ
САМОИНСПЕКЦИЯ
ВОЗВРАТЫ
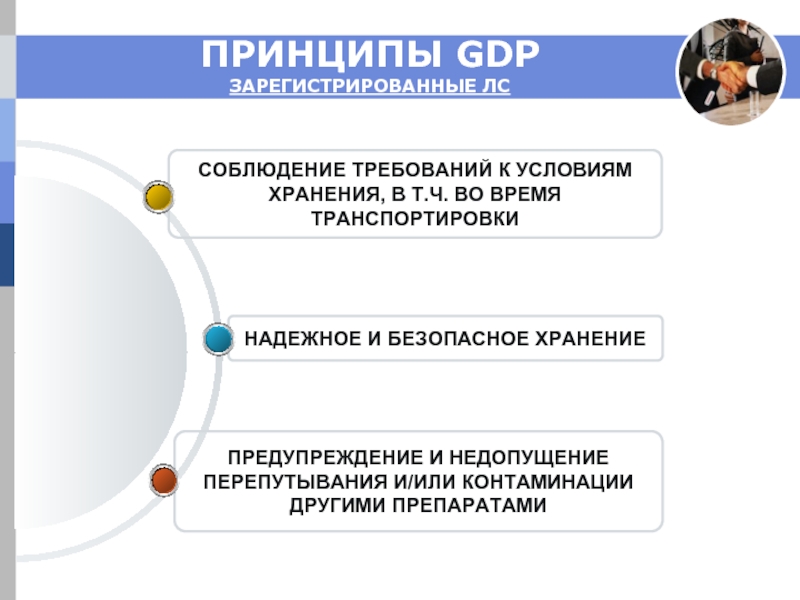
Слайд 6ПРИНЦИПЫ GDP
ЗАРЕГИСТРИРОВАННЫЕ ЛС
ПРЕДУПРЕЖДЕНИЕ И НЕДОПУЩЕНИЕ
ПЕРЕПУТЫВАНИЯ И/ИЛИ КОНТАМИНАЦИИ
ДРУГИМИ ПРЕПАРАТАМИ
НАДЕЖНОЕ И БЕЗОПАСНОЕ
СОБЛЮДЕНИЕ ТРЕБОВАНИЙ К УСЛОВИЯМ
ХРАНЕНИЯ, В Т.Ч. ВО ВРЕМЯ
ТРАНСПОРТИРОВКИ
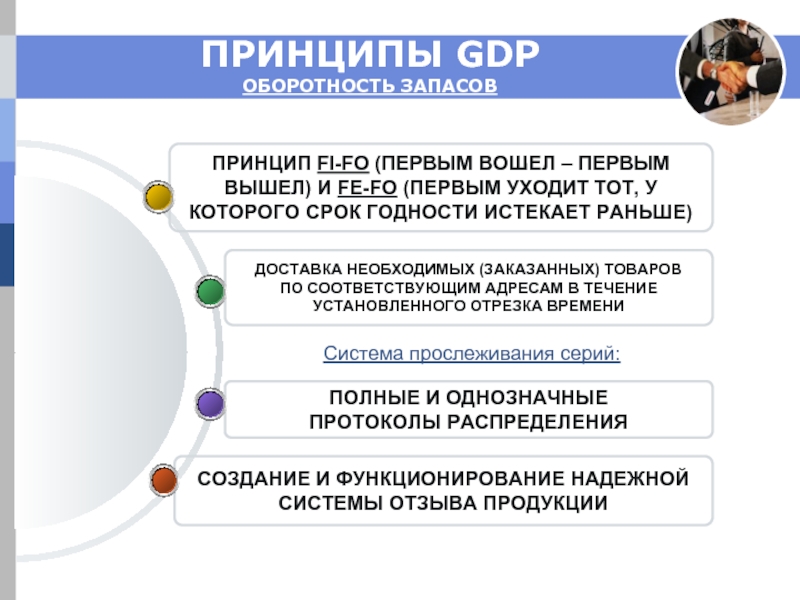
Слайд 7ПРИНЦИПЫ GDP
ОБОРОТНОСТЬ ЗАПАСОВ
СОЗДАНИЕ И ФУНКЦИОНИРОВАНИЕ НАДЕЖНОЙ
СИСТЕМЫ ОТЗЫВА ПРОДУКЦИИ
ПОЛНЫЕ И ОДНОЗНАЧНЫЕ
ПРОТОКОЛЫ
ДОСТАВКА НЕОБХОДИМЫХ (ЗАКАЗАННЫХ) ТОВАРОВ
ПО СООТВЕТСТВУЮЩИМ АДРЕСАМ В ТЕЧЕНИЕ
УСТАНОВЛЕННОГО ОТРЕЗКА ВРЕМЕНИ
ПРИНЦИП FI-FO (ПЕРВЫМ ВОШЕЛ – ПЕРВЫМ
ВЫШЕЛ) И FE-FO (ПЕРВЫМ УХОДИТ ТОТ, У
КОТОРОГО СРОК ГОДНОСТИ ИСТЕКАЕТ РАНЬШЕ)
Система прослеживания серий:
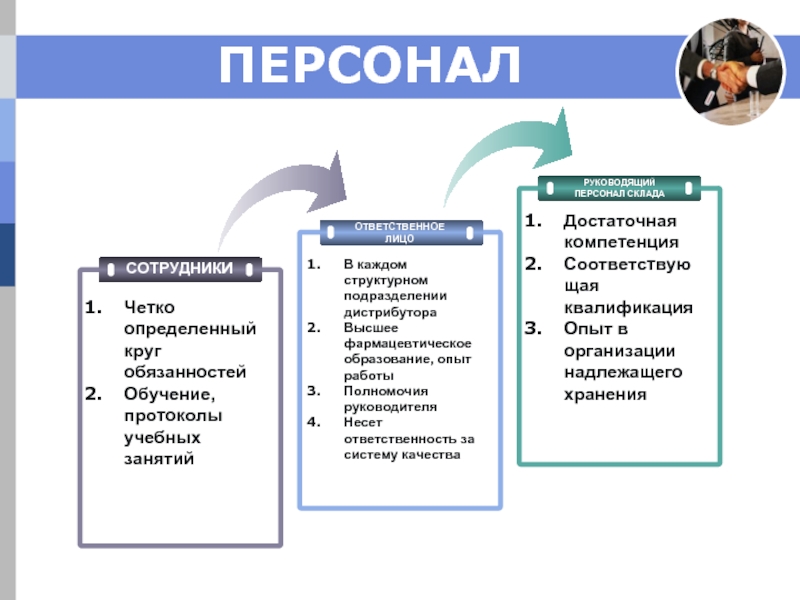
Слайд 8ПЕРСОНАЛ
ОТВЕТСТВЕННОЕ
ЛИЦО
РУКОВОДЯЩИЙ
ПЕРСОНАЛ СКЛАДА
В каждом структурном подразделении дистрибутора
Высшее фармацевтическое образование, опыт работы
Полномочия руководителя
Несет
Достаточная компетенция
Соответствующая квалификация
Опыт в организации надлежащего хранения
Слайд 9ДОКУМЕНТАЦИЯ
ПИСЬМЕННЫЕ МЕТОДИКИ:
получение и проверка
обслуживание складских помещений
контроля и регистрации условий хранения
обращения с
карантинная,
возвращенная,
фальсификаты;
требующая специальных условий и правил хранения.
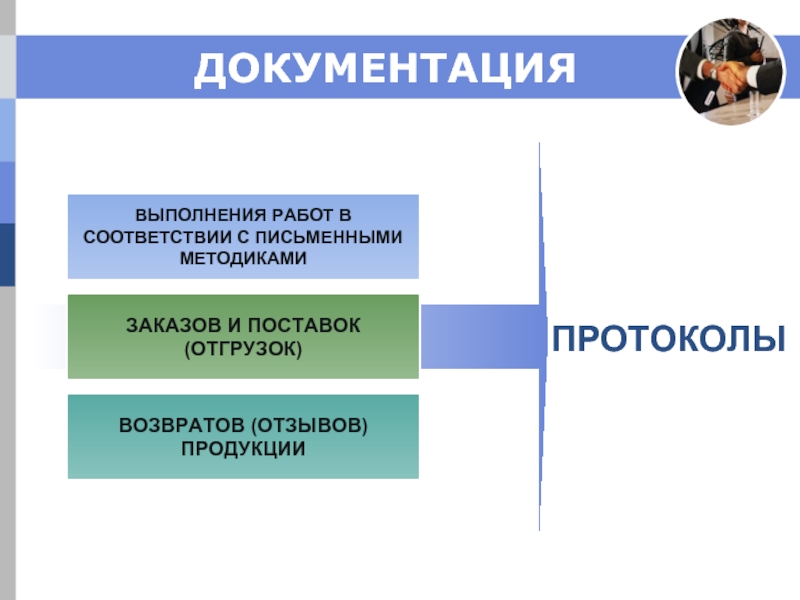
Слайд 10
ВЫПОЛНЕНИЯ РАБОТ В
СООТВЕТСТВИИ С ПИСЬМЕННЫМИ
МЕТОДИКАМИ
ЗАКАЗОВ И ПОСТАВОК
(ОТГРУЗОК)
ВОЗВРАТОВ (ОТЗЫВОВ)
ПРОДУКЦИИ
ПРОТОКОЛЫ
ДОКУМЕНТАЦИЯ
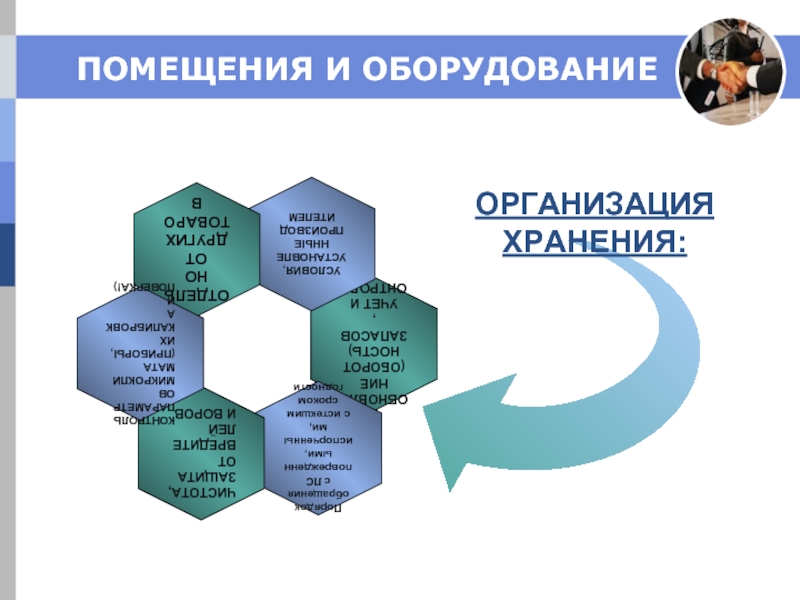
Слайд 11ПОМЕЩЕНИЯ И ОБОРУДОВАНИЕ
Пригодны и соответствуют по размерам объемам хранящейся продукции.
Получение:
Защита от
Карантин: Проверка поставки на соответствие заказа, отсутствие повреждений.
Немедленная идентификация и передача (размещение) в зону хранения.
Письменное (!) разрешение на реализацию.
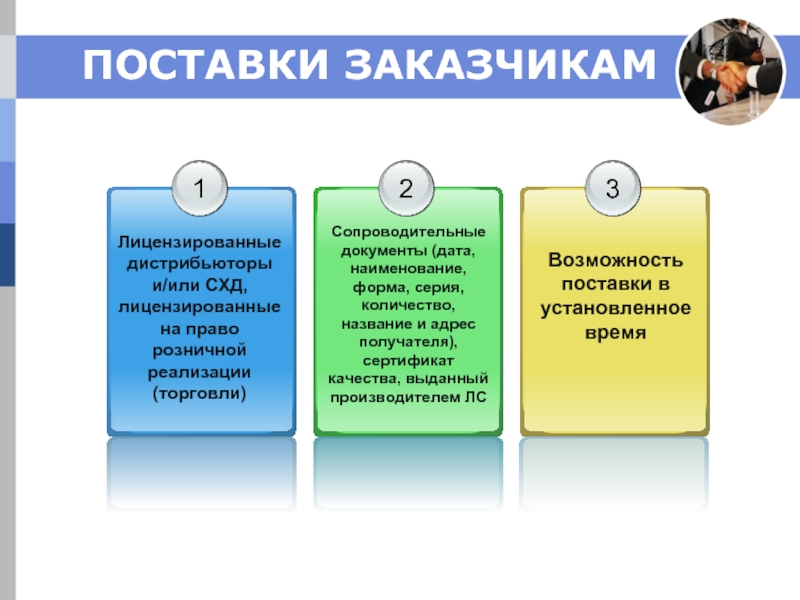
Слайд 14ПОСТАВКИ ЗАКАЗЧИКАМ
ОБЩИЕ ПРАВИЛА ТРАНСПОРТИРОВАНИЯ:
Не утрачена возможность идентификации
Недопущение перекрестной контаминации
Предупредительные меры от
Защита от воздействия факторов внешней среды (температура, свет, влажность и т.п.), микроорганизмов или паразитов
Специально оборудованные технические средства для транспортирования в условиях контролируемой температуры (МИБП, инсулины и т.п.)
Слайд 15ВОЗВРАТЫ
ЛС, НЕ ИМЕЮЩИЕ ДЕФЕКТОВ
Отдельное хранение (карантин) до момента получения разрешения на
Официальное разрешение на возвращение в запас, разрешенный к реализации, после получения положительных выводов о:
Упаковка не нарушена
Известно, что условия хранения были соблюдены
Приемлемый срок годности
Результатах лабораторных исследований, проведенных в установленном порядке
Протоколы возвратов хранят вместе с разрешением УЛ.
Размещение возвращенных в реализуемый запас по правилам соблюдения его оборотности
Слайд 16ЧТО ТАКОЕ «ОТЗЫВ»?
ИЗЪЯТИЕ ИЗ ОБРАЩЕНИЯ (С РЫНКА) КОНКРЕТНОЙ ИЛИ ВСЕХ СЕРИЙ
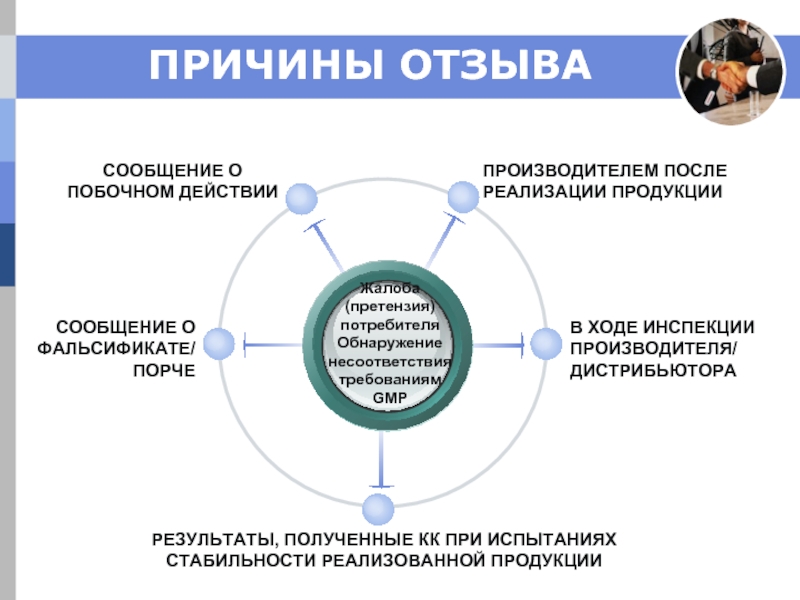
Слайд 17ПРИЧИНЫ ОТЗЫВА
Жалоба
(претензия) потребителя
Обнаружение несоответствия требованиям
GMP
ПРОИЗВОДИТЕЛЕМ ПОСЛЕ РЕАЛИЗАЦИИ ПРОДУКЦИИ
СООБЩЕНИЕ О
В ХОДЕ ИНСПЕКЦИИ ПРОИЗВОДИТЕЛЯ/
ДИСТРИБЬЮТОРА
СООБЩЕНИЕ О ФАЛЬСИФИКАТЕ/
ПОРЧЕ
РЕЗУЛЬТАТЫ, ПОЛУЧЕННЫЕ КК ПРИ ИСПЫТАНИЯХ СТАБИЛЬНОСТИ РЕАЛИЗОВАННОЙ ПРОДУКЦИИ
Слайд 18ПРИНЦИП ОТЗЫВА
У ПРОИЗВОДИТЕЛЯ / ДИСТРИБЬЮТОРА
должна быть создана
система быстрого и
отзыва продукции из сети реализации
отзыв в критических ситуациях
Слайд 19ПЛАН ДЕЙСТВИЙ
В КРИТИЧЕСКИХ СИТУАЦИЯХ (СРОЧНЫЙ ОТЗЫВ):
Наличие письменного плана действий для срочных
Назначено ответственное лицо
Все действия запротоколированы
Уведомление государственных органов
Обеспечение эффективности плана отзыва (Методики и Протоколы)
Уведомление всех партнеров и заказчиков
Содержание сообщения:
Требование о немедленном изъятии из всех запасов
Обеспечение изолированного хранения до принятия решения
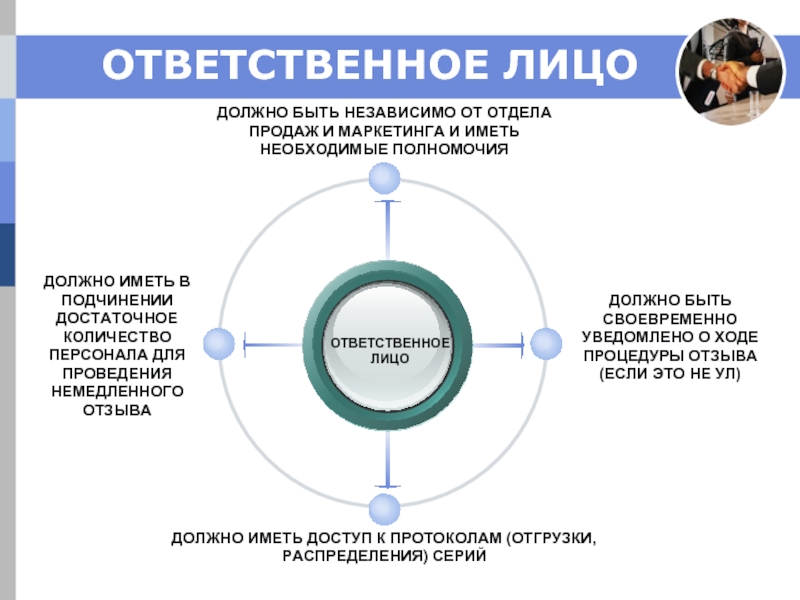
Слайд 20ОТВЕТСТВЕННОЕ ЛИЦО
ОТВЕТСТВЕННОЕ
ЛИЦО
ДОЛЖНО БЫТЬ НЕЗАВИСИМО ОТ ОТДЕЛА ПРОДАЖ И МАРКЕТИНГА И
ДОЛЖНО БЫТЬ СВОЕВРЕМЕННО УВЕДОМЛЕНО О ХОДЕ ПРОЦЕДУРЫ ОТЗЫВА (ЕСЛИ ЭТО НЕ УЛ)
ДОЛЖНО ИМЕТЬ В ПОДЧИНЕНИИ ДОСТАТОЧНОЕ КОЛИЧЕСТВО ПЕРСОНАЛА ДЛЯ ПРОВЕДЕНИЯ НЕМЕДЛЕННОГО ОТЗЫВА
ДОЛЖНО ИМЕТЬ ДОСТУП К ПРОТОКОЛАМ (ОТГРУЗКИ, РАСПРЕДЕЛЕНИЯ) СЕРИЙ
Слайд 21ПРОТОКОЛ ОТЗЫВА
В полном соответствии с СРМ с объяснением причин отклонений от
Баланс количеств отгруженной и возвращенной продукции
Заключительный отзыв о ходе отзыва
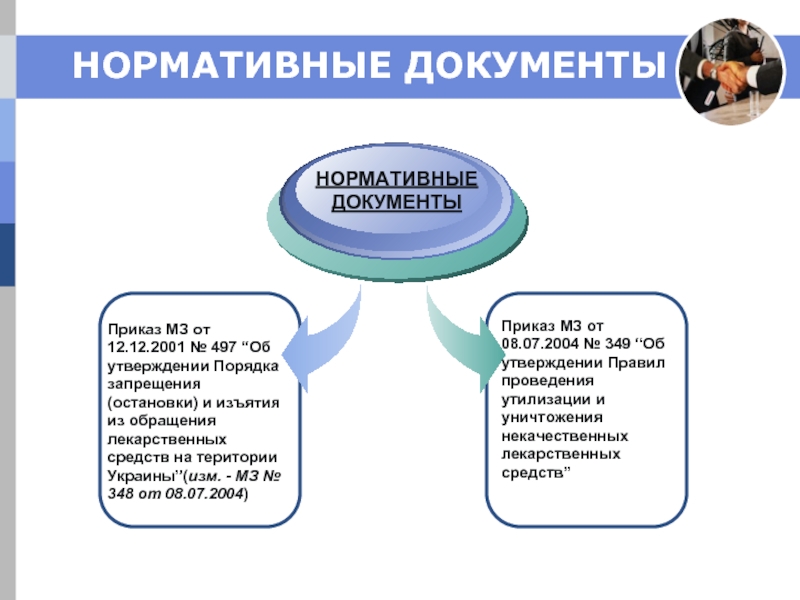
Слайд 22НОРМАТИВНЫЕ ДОКУМЕНТЫ
Приказ МЗ от 12.12.2001 № 497 “Об утверждении Порядка запрещения
НОРМАТИВНЫЕ ДОКУМЕНТЫ
Приказ МЗ от 08.07.2004 № 349 “Об утверждении Правил проведения утилизации и уничтожения некачественных лекарственных средств”
Слайд 23САМОИНСПЕКЦИИ
Самоконтроль
Коррегирующие действия
Совершенствование системы обеспечения качества дистрибьютора/производителя
Слайд 24СЕРТИФИКАЦИЯ
дистрибьюторов на соответствие требованиям GDP в Украине
Порядок проведения сертификации Утвержден приказом
В соответствии с постановлением КМУ № 1419 от 28.10.2004
Поэтапное внедрение международных стандартов
Добровольно – до 01.01.2009 р.
Бесплатно
Определены: Критерии, Процедура и Сроки
Слайд 25КРИТЕРИИ СЕРТИФИКАЦИИ
Соответствие материально-технической базы, технических средств и системы обеспечения качества ЛС
Постоянное наличие оборотных запасов в ассортименте ЛС, в частности внесенных в перечни основных (жизненно необходимых) ЛС, и обязательного минимального ассортимента ЛС для аптек.
Своевременная поставка на заказ аптечного или лечебного учреждения – 2 суток.
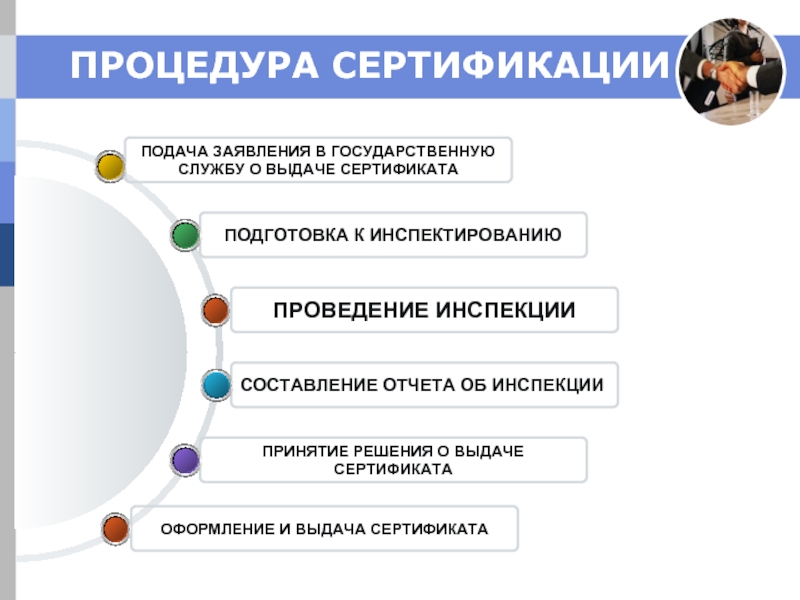
Слайд 26ПРОЦЕДУРА СЕРТИФИКАЦИИ
ОФОРМЛЕНИЕ И ВЫДАЧА СЕРТИФИКАТА
ПРИНЯТИЕ РЕШЕНИЯ О ВЫДАЧЕ
СЕРТИФИКАТА
СОСТАВЛЕНИЕ ОТЧЕТА ОБ
ПОДГОТОВКА К ИНСПЕКТИРОВАНИЮ
ПОДАЧА ЗАЯВЛЕНИЯ В ГОСУДАРСТВЕННУЮ
СЛУЖБУ О ВЫДАЧЕ СЕРТИФИКАТА
ПРОВЕДЕНИЕ ИНСПЕКЦИИ
Слайд 27СЕРТИФИКАТ №
Срок действия до ______________
Этот сертификат свидетельствует, что система обеспечения
название фирмы – владелец лицензии
____________________________________________________________________
адрес структурного подразделения
Лицензия серии ___________ № ___________ от ____________,
по результатам инспекции, проведенной с _________ по _________ года, признаны такими, что соответствуют правилам
НАДЛЕЖАЩЕЙ ПРАКТИКИ ДИСТРИБУЦИИ
Согласно Руководству 42-01-2002
“Лекарственные средства. Надлежащая практика дистрибуции”
Которое соответствует правилам GDP ЕС и рекомендациям PIC/S, учитывает рекомендации Всемирной организаии здравоохранения относительно правил хранения (GSP), торговли и дистрибуции (GTDP) лекарственных средств
Предприятие систематически инспектируется на соответствие требованиям НПД
Слайд 28Актуальные вопросы внедрения GDP
в Украине
Из Распоряжения КМУ от 10.09.2008 г.
плану заходів щодо удосконалення державного контролю за обігом
лікарських засобів і виробів медичного призначення»:
П. 16. Розробити і затвердити стандарти забезпечення якості
лікарських засобів, гармонізовані з директивами ЄС, зокрема щодо належної виробничої практики, належної дистриб'юторської практики, належної лабораторної практики, належної клінічної практики.
МОЗ – до 10.10.2008 р.
П. 17 Розробити механізм введення в обіг лікарських засобів, передбачений постановою Кабінету Міністрів України від 28 жовтня 2004 р. N 1419 ..., зокрема забезпечити внесення відповідних змін до ліцензійних умов на право провадження господарської діяльності з виробництва лікарських засобів, їх оптової та роздрібної торгівлі. МОЗ, Держкомпідприємництво – до 01.01.2009