та запобігання процесів горіння
Лекція 26
Запобігання виникнення горіння засобами, що розбавлюють
та інгібують
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Запобігання виникнення горіння засобами, що розбавлюють та інгібують презентация
Содержание
- 1. Запобігання виникнення горіння засобами, що розбавлюють та інгібують
- 2. План лекції. 1. Механізм припинення горіння розбавленням.
- 3. 1. МЕХАНІЗМ ПРИПИНЕННЯ ГОРІННЯ РОЗБАВЛЕННЯ Одним із
- 4. Отже, при введені НГ в зону горіння
- 5. Розріджувач, потрапляючи в зону горіння, нагріва-ється за
- 6. Переваги газового пожежогасіння: мінімальний збиток при впливі
- 7. Недоліки об'ємного гасіння негорючими газами: сумарна витрата
- 8. 2. МЕХАНІЗМ ПРИПИНЕННЯ ГОРІННЯ ІНГІБІЮВАННЯМ Зниження тепловиділення
- 9. Взаємодія між ГР і Ок відбувається за
- 10. Швидкість ланцюгової реакції: Wл.р = Wініц +
- 12. Інгібітори горіння – речовини, які легко вступають
- 13. 2.1. Гасіння хладонами Хладони - склади на
- 14. При введені хладонів в зону горіння відбувається
- 15. Хладони використовуються для протипожежного захисту особливо важливих
- 16. 2.2. Гасіння вогнегасними порошками Вогнегасні порошки -
- 17. Вогнегасна дія порошків загального призначення обумовлена: інгібіюванням
- 18. Вогнегасна дія порошків загального призначення обумовлена інгібіюванням
- 19. Переваги застосування вогнегасних порошків: висока вогнегасна ефективність;
- 20. 3. ФЛЕГМАТИЗАЦІЯ ГОРЮЧИХ СУМІШЕЙ РОЗРІДЖУВАЧАМИ Запобігання утворення
- 21. Зміна КМПП залежно від вмісту розріджувача в горючій суміші
- 22. Флегматизуюча концентрація - найменша концентрація негорючого газу
- 23. Коефіцієнти формули визначення вогнегасної концентрації флегматизатора
- 24. Концентрація окисника стане менше, ніж критич-не значення
- 25. Значення флегматизуючих концентрацій для хладонів значно нижче,
- 26. ЗАВДАННЯ НА САМОПІДГОТОВКУ: 1. Підготуватися до
Слайд 2План лекції.
1. Механізм припинення горіння розбавленням.
2. Механізм припинення горіння інгібіюванням.
3.
Флегматизація горючих сумішей розріджувачами.
Слайд 31. МЕХАНІЗМ ПРИПИНЕННЯ ГОРІННЯ РОЗБАВЛЕННЯ
Одним із прийомів припинення горіння є розбавлення
горючої суміші негорючими розріджувачами.
При цьому відбувається зниження q(+) в зоні горіння за рахунок зменшення концентрацій компонентів горючої суміші.
При введенні негорючих газів (НГ) в зону горіння крім зниження концентрації компонентів горючої суміші, відбувається також втрата частини тепла на нагрівання самих розріджувачів від То до Тгор.
Кількість енергії, що витрачається на нагрів НГ:
Qнагр=Vнг ρнг cp нг (Tгор-To)
При цьому відбувається зниження q(+) в зоні горіння за рахунок зменшення концентрацій компонентів горючої суміші.
При введенні негорючих газів (НГ) в зону горіння крім зниження концентрації компонентів горючої суміші, відбувається також втрата частини тепла на нагрівання самих розріджувачів від То до Тгор.
Кількість енергії, що витрачається на нагрів НГ:
Qнагр=Vнг ρнг cp нг (Tгор-To)
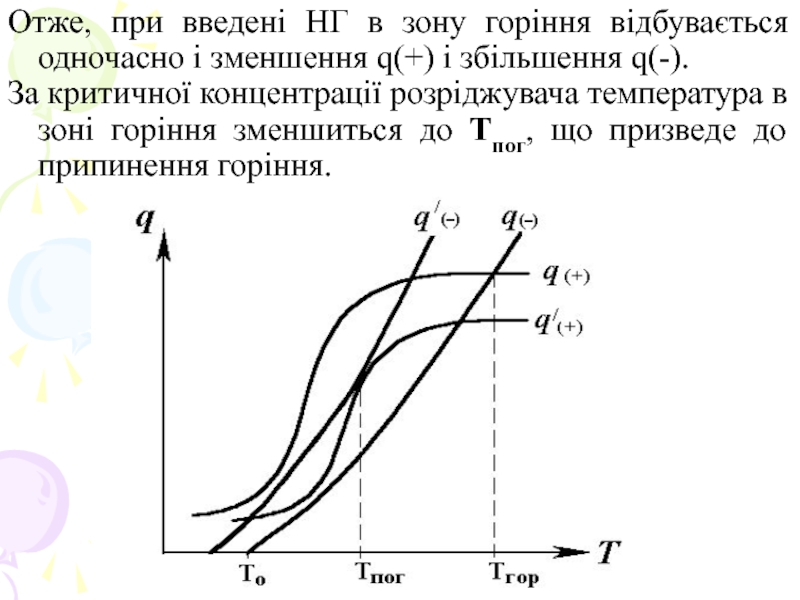
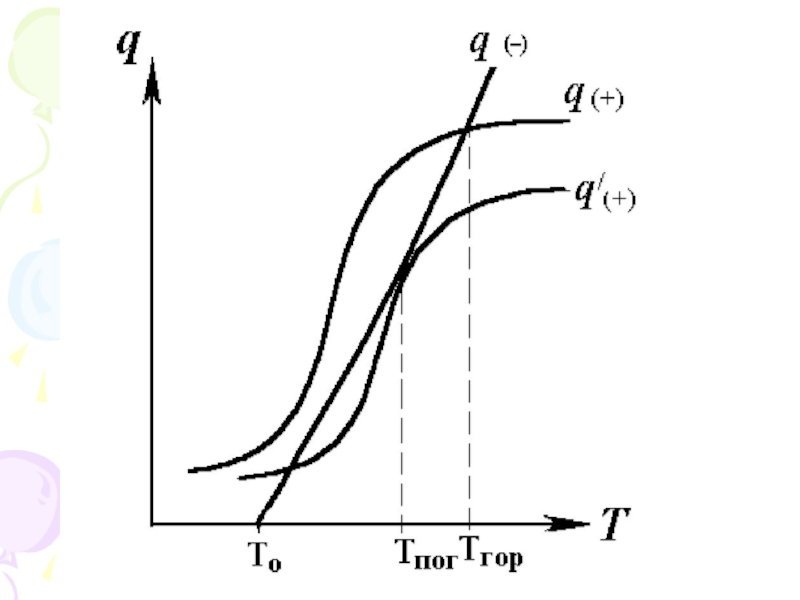
Слайд 4Отже, при введені НГ в зону горіння відбувається одночасно і зменшення
q(+) і збільшення q(-).
За критичної концентрації розріджувача температура в зоні горіння зменшиться до Тпог, що призведе до припинення горіння.
За критичної концентрації розріджувача температура в зоні горіння зменшиться до Тпог, що призведе до припинення горіння.
Слайд 5Розріджувач, потрапляючи в зону горіння, нагріва-ється за рахунок власної теплоємності ср
і потрапляє нагрітим в підготовчу зону фронту полум'я. Чим більший коефіцієнт теплопровідності λ розріджувача, тим скоріше відбувається відвід тепла від зони реакції в підготовчу зону до свіжої суміші, внаслідок чого температура в підготовчій зоні зростає. При цьому швидкість поширення горіння і Тгор підвищуються, що обумовлює зниження вогнегасної дії розріджувача.
Комплексним параметром, що характеризує вогнегасну ефективність розріджувачів, є показник ефективності Nef:
Чим більший розмір молекули негорючого газу, тим більша його вогнегасна ефективність.
Комплексним параметром, що характеризує вогнегасну ефективність розріджувачів, є показник ефективності Nef:
Чим більший розмір молекули негорючого газу, тим більша його вогнегасна ефективність.
Слайд 6Переваги газового пожежогасіння:
мінімальний збиток при впливі на матеріали і обладнання, що
захищаються;
оперативність при використанні;
можливість тривалої експлуатації в автоматичному режимі;
знижені вимоги до профілактики при обслу-говуванні автоматичних систем пожежогасіння;
універсальність застосування (можна використовувати при гасінні пожеж класу В, С, Е, А1 в початковій стадії розвитку і А2).
Особливо ефективне при захисті музейних цінностей, архівів, бібліотек, обчислювальних центрів та інших об'єктів, де пріоритетною задачею є збереження матеріальних цінностей.
оперативність при використанні;
можливість тривалої експлуатації в автоматичному режимі;
знижені вимоги до профілактики при обслу-говуванні автоматичних систем пожежогасіння;
універсальність застосування (можна використовувати при гасінні пожеж класу В, С, Е, А1 в початковій стадії розвитку і А2).
Особливо ефективне при захисті музейних цінностей, архівів, бібліотек, обчислювальних центрів та інших об'єктів, де пріоритетною задачею є збереження матеріальних цінностей.
Слайд 7Недоліки об'ємного гасіння негорючими газами:
сумарна витрата газу становить приблизно двократний об'єм
приміщення;
для гасіння потрібна велика кількість балонів, отже, великі витрати на їх обслуговування (можуть застосовуватися скраплені гази);
вогнегасна концентрація в 3-5 разів вища, ніж небезпечні для людей концентрації, тому необхідна сигналізація і витяжна вентиляція.
Не рекомендується застосовувати газове пожежегасіння при гасінні пожеж волокнистих, сипучих і пористих матеріалів , а також при гасінні пожеж класу Д.
для гасіння потрібна велика кількість балонів, отже, великі витрати на їх обслуговування (можуть застосовуватися скраплені гази);
вогнегасна концентрація в 3-5 разів вища, ніж небезпечні для людей концентрації, тому необхідна сигналізація і витяжна вентиляція.
Не рекомендується застосовувати газове пожежегасіння при гасінні пожеж волокнистих, сипучих і пористих матеріалів , а також при гасінні пожеж класу Д.
Слайд 82. МЕХАНІЗМ ПРИПИНЕННЯ ГОРІННЯ ІНГІБІЮВАННЯМ
Зниження тепловиділення q(+) в зоні горіння можна
досягти за рахунок збільшення енергії активації Еакт горючої суміші.
Збільшення енергії активації Еакт відбувається при додаванні в систему спеціальних речовин - інгібіторів.
Збільшення енергії активації Еакт відбувається при додаванні в систему спеціальних речовин - інгібіторів.
Слайд 9Взаємодія між ГР і Ок відбувається за ланцюговим механізмом через стадію
утворення активних центрів полум'я (АЦП – атоми, молекули чи радикали, які мають енергію більше, ніж Еакт системи).
Реакції горіння вуглеводнів носять розгалужений ланцюговий характер, при цьому концентрація АЦП різко збільшується, швидкість реакції зростає, що сприяє поширенню горіння.
АЦП можуть гинути (гублять свою енергію і стають неактивними) при взаємодії один з одним або з молекулою інгібітору. У цьому випадку відбудеться обрив ланцюга і зниження швидкості ланцюгової реакції.
Реакції горіння вуглеводнів носять розгалужений ланцюговий характер, при цьому концентрація АЦП різко збільшується, швидкість реакції зростає, що сприяє поширенню горіння.
АЦП можуть гинути (гублять свою енергію і стають неактивними) при взаємодії один з одним або з молекулою інгібітору. У цьому випадку відбудеться обрив ланцюга і зниження швидкості ланцюгової реакції.
Слайд 10Швидкість ланцюгової реакції:
Wл.р = Wініц + Wрозг – Wобр. ланц.
Якщо Wобр.ланц
стане більшою швидкості утворення АЦП Wрозг., сумарна швидкість Wл.р. почне зменшуватися. При зменшенні швидкості реакції Wл.р знижується q(+) , а отже температура в зоні горіння стане менше Тпог.
Збільшити Wобр.ланц можна за рахунок введення в систему інгібіторів.
Вогнегасна концентрація інгібіторів дуже мала (біля 2-3%), отже концентрації компонентів ГС і теплофізичні параметри суміші при цьому не змінюються, тому інтенсивність тепловіддачі q(-) залишається незмінною.
Збільшити Wобр.ланц можна за рахунок введення в систему інгібіторів.
Вогнегасна концентрація інгібіторів дуже мала (біля 2-3%), отже концентрації компонентів ГС і теплофізичні параметри суміші при цьому не змінюються, тому інтенсивність тепловіддачі q(-) залишається незмінною.
Слайд 12Інгібітори горіння – речовини, які легко вступають у взаємодію з активними
центрами полум'я і при цьому утворюють нереакційноздатні або малоактивні продукти з високим значенням Еакт, при цьому через декілька актів хімічного перетворення інгібітори повністю чи частково відновлюються і вступають у повторну взаємодію з АЦП.
До інгібіторів горіння відносять:
- хладони;
- вогнегасні порошки загального призначення;
- аерозолеутворюючі скдади.
До інгібіторів горіння відносять:
- хладони;
- вогнегасні порошки загального призначення;
- аерозолеутворюючі скдади.
Слайд 132.1. Гасіння хладонами
Хладони - склади на основі галоїдпохідних насичених вуглеводнів, в
яких атоми водню заміщені повністю або частково атомами галоїдів.
Вогнегасна ефективність хладонів підвищується при заміщенні в них атома водню на атом галоїду у ряду: F ≤ Cl << Br < I
При введенні F в молекулу інгібітору підвищується його стабільність, зменшуються горючість, токсичність хладонів.
Найбільш ефективними і зручними для застосування є бром-, фтор- похідні метану і етану.
Вогнегасна ефективність хладонів підвищується при заміщенні в них атома водню на атом галоїду у ряду: F ≤ Cl << Br < I
При введенні F в молекулу інгібітору підвищується його стабільність, зменшуються горючість, токсичність хладонів.
Найбільш ефективними і зручними для застосування є бром-, фтор- похідні метану і етану.
Слайд 14При введені хладонів в зону горіння відбувається вилучення АЦП за рахунок
зв’язування їх з молекулами галоїдвуглеводнів :
С2F4Вr2 + Н∙ = НВr + С2F4Вr*
С2F4Вr* + Н∙ = HBr + С2F4*
HBr + Н∙ = H2 + Br*
HBr + OH∙ = H2O + Br*
Br* + H∙ = HBr
Інгібірування обумовлено загибеллю активних радикалів Н∙ і ОН∙, при цьому виникають негорючі продукти (H2O, HBr), або малоактивні атомами галоїдів або їх похідні (Br*, С2F4*).
С2F4Вr2 + Н∙ = НВr + С2F4Вr*
С2F4Вr* + Н∙ = HBr + С2F4*
HBr + Н∙ = H2 + Br*
HBr + OH∙ = H2O + Br*
Br* + H∙ = HBr
Інгібірування обумовлено загибеллю активних радикалів Н∙ і ОН∙, при цьому виникають негорючі продукти (H2O, HBr), або малоактивні атомами галоїдів або їх похідні (Br*, С2F4*).
Слайд 15Хладони використовуються для протипожежного захисту особливо важливих об’єктів.
Використання хладонів не
ефективне при гасінні гетерогенного горіння, пористих матеріалів, що містять в своєму складі кисень, а також металів.
Хладонами можна не тільки швидко гасити пожежу, але і ефективно попереджати можливість вибуху.
Недоліки застосування хладонів:
- за високих температур можливо самоспалахування із виділенням галогенів і галогеноводню;
хладони мають токсичний вплив, особливо продукти їх термічного розкладання і продукти горіння;
хладони руйнують озоновий шар Землі (приблизно в 10 раз сильніше, чим інші газоподібні вогнегасні засоби).
Хладонами можна не тільки швидко гасити пожежу, але і ефективно попереджати можливість вибуху.
Недоліки застосування хладонів:
- за високих температур можливо самоспалахування із виділенням галогенів і галогеноводню;
хладони мають токсичний вплив, особливо продукти їх термічного розкладання і продукти горіння;
хладони руйнують озоновий шар Землі (приблизно в 10 раз сильніше, чим інші газоподібні вогнегасні засоби).
Слайд 162.2. Гасіння вогнегасними порошками
Вогнегасні порошки - тонко подрібнені мінеральні солі з
добавками, які перешкоджають злежуваємості і грудкуванню, поліпшують текучість.
Вогнегасні порошки поділяють на:
загального призначення (ПСБ, Пірант-А, ПФ, ПХ, П2-АП) призначені для гасіння пожеж класів А, В, С, і Е (домінуючий вплив – інгібірування);
спеціального призначення (ПС, ПГС-М, РС, МГС) призначені для гасіння пожеж класу Д, а також тліючих пожеж підкласу А1 (домінуючий вплив – ізоляція компонентів горючої суміші газонепроникною плівкою, яка утворюється при розплавленні порошку).
Вогнегасні порошки поділяють на:
загального призначення (ПСБ, Пірант-А, ПФ, ПХ, П2-АП) призначені для гасіння пожеж класів А, В, С, і Е (домінуючий вплив – інгібірування);
спеціального призначення (ПС, ПГС-М, РС, МГС) призначені для гасіння пожеж класу Д, а також тліючих пожеж підкласу А1 (домінуючий вплив – ізоляція компонентів горючої суміші газонепроникною плівкою, яка утворюється при розплавленні порошку).
Слайд 17Вогнегасна дія порошків загального призначення обумовлена:
інгібіюванням хімічних реакцій в полум'ї, яке
може здійснюватися як в газовій фазі (гомогенне інгібірування), так і на поверхні часток порошку (гетерогенне інгібірування);
охолоджування зони горіння за рахунок нагрівання і розкладання твердих часток порошку
розбавлення зони полум'я продуктами розкладання порошку
екранування порошком потоку променистої енергії, що поступає від полум'я до поверхні горючої речовини;
ізоляція поверхні ГР при гасінні вуглецю і металів плівкою, яка перешкоджає проникненню в зону горіння компонентів горючої суміші.
охолоджування зони горіння за рахунок нагрівання і розкладання твердих часток порошку
розбавлення зони полум'я продуктами розкладання порошку
екранування порошком потоку променистої енергії, що поступає від полум'я до поверхні горючої речовини;
ізоляція поверхні ГР при гасінні вуглецю і металів плівкою, яка перешкоджає проникненню в зону горіння компонентів горючої суміші.
Слайд 18Вогнегасна дія порошків загального призначення обумовлена інгібіюванням реакцій окислення в полум'ї.
Залежно від дисперсності порошку домінує гомогенне чи гетерогенне інгібіювання.
Гомогенне інгібірування
МеCl → Ме + Cl
Ме + ОН* + П → МеОН + П,
МеОН +ОН* → Н2О + МеО
МеОН +Н* → Н2О + Ме
Гетерогенне інгібірування
адсорбція → рекомбінація → десорбція.
А* + П → АП адсорбція
АП + А* → АПА адсорбція
АПА → ААП рекомбінація
ААП → АА + П десорбція
Гомогенне інгібірування
МеCl → Ме + Cl
Ме + ОН* + П → МеОН + П,
МеОН +ОН* → Н2О + МеО
МеОН +Н* → Н2О + Ме
Гетерогенне інгібірування
адсорбція → рекомбінація → десорбція.
А* + П → АП адсорбція
АП + А* → АПА адсорбція
АПА → ААП рекомбінація
ААП → АА + П десорбція
Слайд 19Переваги застосування вогнегасних порошків:
висока вогнегасна ефективність;
універсальність (можливо застосовувати для гасіння пожеж
всіх класів);
можливість застосування за від’ємних температур.
Недоліки порошкового пожежогасіння:
схильність до зволоження,
злежування і грудкування, при цьому втрачається здатність порошків транспортуватися і погіршується утворення вогнегасної хмари,
необхідність спеціальних пристроїв, що розпилюють порошок в зоні горіння у вигляді дисперсної хмари.
можливість застосування за від’ємних температур.
Недоліки порошкового пожежогасіння:
схильність до зволоження,
злежування і грудкування, при цьому втрачається здатність порошків транспортуватися і погіршується утворення вогнегасної хмари,
необхідність спеціальних пристроїв, що розпилюють порошок в зоні горіння у вигляді дисперсної хмари.
Слайд 203. ФЛЕГМАТИЗАЦІЯ ГОРЮЧИХ СУМІШЕЙ РОЗРІДЖУВАЧАМИ
Запобігання утворення горючого середовища в закритому газовому
просторі за допомогою газів-розріджувачів називається флегматизацією.
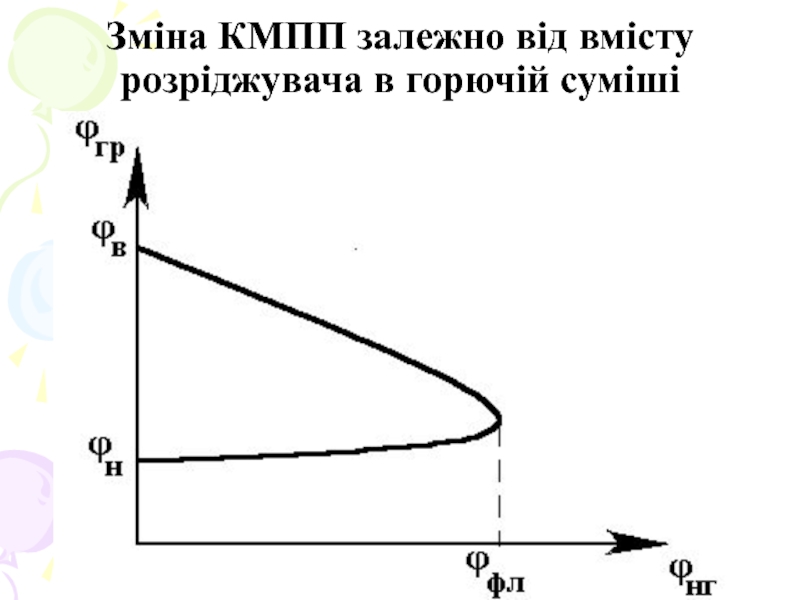
При введенні в газоповітряну суміш негорючих газів область займання звужується - нижня межа зростає, а верхня знижується. При деякій критичній кількості флегматизатора верхня і нижня межі сходяться, створюючи точку флегматизації, яка відповідає флегматизуючій концентрації.
При введенні в газоповітряну суміш негорючих газів область займання звужується - нижня межа зростає, а верхня знижується. При деякій критичній кількості флегматизатора верхня і нижня межі сходяться, створюючи точку флегматизації, яка відповідає флегматизуючій концентрації.
Слайд 22Флегматизуюча концентрація - найменша концентрація негорючого газу в горючій суміші, при
якій суміш стає нездатною до горіння при будь-якому співвідношенні горючої речовини й окисника.
Найбільш поширеними газами-флегматизаторами є СО2, Н2О, N2.
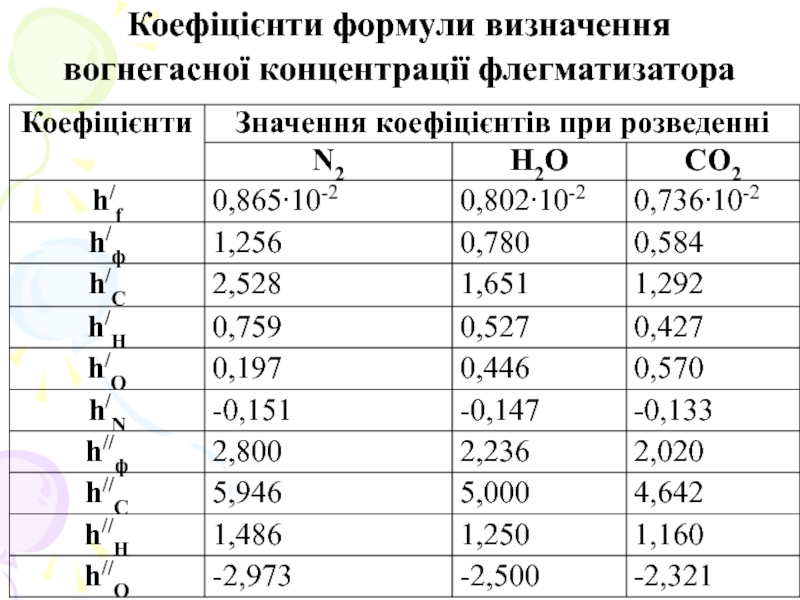
де hf , hф/, hф// - коефіцієнти, що характеризують вид негорючого газу;
hj, Нf -теплофізичні показники горючої речовини;
mj - число атомів j-го типу в горючій речовині.
Найбільш поширеними газами-флегматизаторами є СО2, Н2О, N2.
де hf , hф/, hф// - коефіцієнти, що характеризують вид негорючого газу;
hj, Нf -теплофізичні показники горючої речовини;
mj - число атомів j-го типу в горючій речовині.
Слайд 24Концентрація окисника стане менше, ніж критич-не значення – мінімальна вибухонебезпечна концентрація
кисню:
Для забезпечення гарантованих умов пожежовибухобезпеки розраховують безпечну концентрацію кисню за формулою:
Для забезпечення гарантованих умов пожежовибухобезпеки розраховують безпечну концентрацію кисню за формулою:
Слайд 25Значення флегматизуючих концентрацій для хладонів значно нижче, ніж при використанні інертних
розріджувачів. Флегматизуючу концентрацію хладонів розраховують за формулою
βСО – стехіометричний коефіцієнт в реакції горіння речовини до СО та Н2О;
hf=2,58∙10–2; hС=2,373; hН=2,757; hО= -0,522; hN= -0,494
γ – емпіричний параметр для кожного хладону.
βСО – стехіометричний коефіцієнт в реакції горіння речовини до СО та Н2О;
hf=2,58∙10–2; hС=2,373; hН=2,757; hО= -0,522; hN= -0,494
γ – емпіричний параметр для кожного хладону.
Слайд 26ЗАВДАННЯ НА САМОПІДГОТОВКУ:
1. Підготуватися до виконання лабораторної роботи
2. Вивчити матеріал
по посібниках:
И.М. Абдурагимов, В.Ю. Говоров, В.Е. Макаров. Фізико-хімічні основи розвитку і гасіння пожеж. С. 149-152; 199-208; 158-172.
И.М. Абдурагимов, В.Ю. Говоров, В.Е. Макаров. Фізико-хімічні основи розвитку і гасіння пожеж. С. 149-152; 199-208; 158-172.